板栗采后优势致腐真菌的分离、鉴定及植物精油对其控制效果
张曦晨,李萌,杨书珍,彭丽桃,冯柏如,杨菁菁
1.华中农业大学食品科学技术学院,武汉 430070;2.广州粒上皇食品有限公司,广州 510600
板栗(Castanea mollissimaBlume)是壳斗科栗属坚果类植物,在我国大部分地区均有栽培,是我国重要的经济树种,其种植面积和产量均居世界首位[1]。板栗果实甘甜味美,营养丰富,素有“干果之王”的美誉[2]。但与其他坚果相比,板栗的淀粉含量和水分含量较高,采后呼吸作用旺盛,对贮藏环境的温湿度很敏感,在采后贮运过程中常因管理不当遭受病原菌的侵染而腐烂变质[3]。据统计,我国每年因贮藏不当而造成的板栗果实腐烂变质导致的损失占总产量的20%~30%,而在南方的一些板栗产区,由于采收期高温、高湿的环境,严重时板栗腐烂率可达50%,给板栗产业带来了极大的损失[4]。
板栗的采后病害通常是由于多种病原菌的共同侵染所致,发病症状多且杂,目前尚未有统一的系统分类。根据病斑的表观颜色不同,板栗采后病害可分为黑腐、褐腐和红腐;根据病果的湿润程度不同,可分为干腐和湿腐;根据病原菌的侵染途径不同,可分为外腐和内腐[5]。此外,板栗采后病原真菌的种类和数量受其产地和品种的影响大[6],给板栗采后病害的防治带来了极大的困难[7]。因此,明确板栗采后优势致腐真菌,进一步针对性地控制板栗采后病害,对于有效减少板栗采后损失具有重要意义。
植物精油是一种植物源次生代谢产物[8],通常具有优异的抑菌活性,不仅对沙门氏菌、大肠杆菌、金黄色葡萄球菌等细菌具有显著的抑制效果[9],同时对青霉菌、根霉菌和链格孢菌等病原真菌引起的果实采后病害也表现出良好的控制作用[10]。据统计,在目前已经发现的3 000 多种植物精油中,约有1 340种具有较强的抑菌活性,是开发新型果蔬采后天然抑菌剂的优势资源[11]。然而,由于大多数植物精油的成分复杂,极易受植物的种类、品种、生长部位和产地的影响,致使其生物活性稳定性差,给植物精油在食品防腐保鲜领域的应用带来一定的困难[12]。因此,近年来人们对植物精油单组分的抗菌活性进行了广泛研究,并发现了一些具有强烈抗菌活性的植物精油单组分,如柠檬醛[13]、香叶醇[14]、丁香酚[15]和肉桂醛[15]等对采后果蔬具有良好的抑菌防腐效果。目前有关植物精油单组分控制板栗采后病害的研究相对较少。因此,本研究从不同来源的发病板栗中分离并鉴定板栗采后优势致腐真菌,并分析植物精油单组分对优势致腐真菌的抑制活性,在此基础上研究了活性精油单组分香芹酚对板栗采后病害的控制作用,旨在为进一步研发适合板栗采后防腐保鲜的天然防腐保鲜剂提供参考。
1 材料与方法
1.1 材 料
试验所用板栗采自湖北省黄冈市罗田县凤山镇栗子坳工业园区,品种包括“大红袍”“羊毛栗”和“红光油栗”;试验中所有真菌的培养均使用马铃薯琼脂葡萄糖(potato dextrose agar,PDA)培养基;PCR 扩增试剂盒购自天一辉远生物科技有限公司;紫苏醛(90%)、肉桂醛(98%)、柠檬醛(97%)、叶醛(98%)、丁香酚(99%)、芳樟醇(98%)、橙花醇(97%)均购自上海阿拉丁生化科技有限公司;麝香草酚(99%)、香芹酚(99%)、香茅醇(95%)均购自上海麦克林生化科技有限公司;试验中其他试剂均为分析纯,购自国药集团化学试剂有限公司。
1.2 病原菌的分离与纯化
板栗致腐菌的分离与纯化采用组织分离法[16]进行,具体的操作步骤:将常温贮藏2 周后的板栗病果用刀片剥去外壳,分别从果壳和果仁的病健交界处挑取组织,将组织小块在75%乙醇中浸泡消毒10 s,经无菌水清洗3次后,接种至PDA 培养基,26 ℃恒温培养24 h 后,挑取生长在菌落边缘的幼嫩菌丝体转接至新的培养基上,在同等条件下继续培养,重复之前的分离操作3~5 次,直至获得纯菌落,根据其菌落与菌丝的形态特征进行初步归类和编号,并保存菌种。
1.3 致病性测定
采用菌饼接种法[17]对病原菌的致病性进行测定。将病原真菌接种于PDA 培养基上,26 ℃下培养4 d后,于菌落边缘取菌饼(直径8 mm)待用。板栗经过清水浮选,剔除浮起的病虫害果后,选择大小均一,表面无机械损伤的罗田板栗,用0.4%的NaClO溶液进行表面消毒后,采用造伤接种法,用刀片在果实腰部割开一个方形小孔,露出内种皮,将菌饼反贴至造伤部位。每种病原菌分别接种15 颗板栗,以反贴无菌PDA 培养基至造伤部位的板栗作对照,于室温下放置7 d 后剥去外壳,观察果仁的发病情况。按照公式(1)和公式(2)分别统计致病率和病情指数,并在病斑处再次分离病原菌,获得菌株应与原接种菌株一致。板栗病害病情分级标准[18]:0 级,果实不感病,未出现病斑;1级,有病斑但不扩散;2级,0 mm<病斑直径≤5 mm;3 级,5 mm<病斑直径≤10 mm;4级,病斑直径>10 mm。

1.4 病原菌鉴定
1)形态学鉴定。将通过致病性实验所得到的优势致腐真菌于26 ℃下培养3 d,根据其菌落形态、色泽、生长速度和气生菌丝的疏密程度,以及观察光学显微镜下的菌丝形态、菌丝隔膜及孢子形态等特征,对病原菌进行初步的形态学鉴定。
2)分子生物学鉴定。采用CATB 法[19]提取菌株基因组DNA,使用EF22T/EF3 和T22-R/T1-F、EF1-986R/EF1-728F 和ITS1/ITS4 两组引物(表1)[20-23]分别对病原菌菌株进行PCR 扩增(15 μL 2×PCR Mix,1 μL DNA,1 μL10 mmol/L Forward primer 与1 μL10 mmol/L Reverse primer,12 μL ddH2O),95 ℃预变性5 min,95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,共35 次循环。72 ℃修复延伸5 min。PCR 产物用1%琼脂糖凝胶进行电泳检测(20 min,120 V)后,由天一辉远生物科技(武汉)有限公司进行测序,将获得的序列与从NCBI中下载的菌株序列进行比对,经人工校正后使用软件MEGA 7.0,采用邻接法构建系统发育树。

表1 用于分子鉴定的基因位点与引物序列Table 1 Gene locus and primer sequences used to molecular identification
1.5 植物精油单组分的抑菌活性评价
参考Ambrico 等[24]的滤纸片扩散法并稍作修改。将病原真菌在PDA 培养基上于26 ℃培养3 d后,于菌落边缘处取菌饼,反贴于PDA 培养基的中央。将不同体积的植物精油单组分滴加至直径为20 mm、已灭菌的圆形滤纸片上,迅速密封培养皿,26 ℃恒温培养3 d,每隔24 h 测定1 次菌落直径,并按照公式(3)计算菌丝生长抑制率,以滴加等量蒸馏水的平板作对照。以精油单组分的浓度为横坐标,以菌丝生长抑制率为纵坐标,制作毒力回归方程并计算相应的EC50和EC90。

1.6 香芹酚对病原菌菌落生长和菌丝生物量的影响
菌落生长的测定采用生长速率法[25]进行。将病原菌菌丝转接至PDA 培养基上于26 ℃培养3 d 后,于菌落边缘处取菌饼,反贴于PDA 培养基的中央。将不同体积的香芹酚(使其最终体积分数分别达到0、5、10、15、20、25、30 μL/L)滴加至直径为20 mm、已灭菌的圆形滤纸片上,迅速将其粘贴至培养皿内盖中心位置,迅速用封口膜将培养皿紧密封口;每个处理设置3个重复,26 ℃恒温培养5 d,定期观察菌落形态,并用十字交叉法测量菌落直径。
菌丝生物量的测定采用文献[25]的方法进行。将病原菌菌丝转接至PDB 培养基中26 ℃、120 r/min恒温振荡培养24 h,无菌过滤收集菌丝,称取1.0 g的幼嫩湿重菌丝接种于100 mL 的PDB 培养基中,加入一定体积的香芹酚,使其最终体积分数分别达到12.5、25、50、100、200 μL/L。每个处理设置3 个重复,26 ℃、120 r/min 振荡培养48 h,菌丝过滤后用蒸馏水冲洗2次,冷冻干燥60 h,记录菌丝干质量。
1.7 香芹酚熏蒸处理对板栗采后病害的控制效果
将板栗进行清水浮选,挑除已腐烂和发芽的果实后,再挑选外壳色泽一致,大小均一且无机械损伤的果实待用。病原菌的接种方法与本文“1.3”方法一致。香芹酚处理采用熏蒸法,将已接种病原菌的板栗置于带盖保鲜盒内,滴加一定量的香芹酚于滤纸片上,贴于保鲜盒内侧,使盒内香芹酚体积分数为80 μL/L,以加入等量蒸馏水熏蒸空白对照,以上每组处理设置3 个重复,每个重复3 颗果实,密闭熏蒸16 h,熏蒸结束后打开盒盖通风30 min,用扎孔保鲜膜封口,室温下放置7 d 后,按照与本文“1.3”的方法测定板栗的发病率与病情指数。
2 结果与分析
2.1 板栗采后病害病原菌的分离纯化结果
从150 颗不同来源的板栗腐烂果实中分离获得共464 株病原菌,根据菌落在PDA 培养基上的生长形态大致分为23类,经过初步的致病性测定,获得了5 株具有较强的致病性的病原真菌,编号依次为BL-3、BL-8、BL-18、BL-20 和BL-22,在分离纯化过程中分别检出36、30、39、49和33株。
2.2 板栗采后病害优势病原菌的致病性
根据柯赫氏法则,将前期筛选得到的5株病原菌菌株回接至健康的板栗果实上,室温放置7 d 后将板栗外壳剥去,观察到部分板栗种仁表面产生了明显的黑灰色病斑,少数种仁表面还有白色或粉红色的菌苔覆盖,而对照组果实则没有发病。对病果发病组织中的病原菌再次分离纯化培养,其生长特性与菌落、菌丝形态等均与原菌株一致。由表2可知,BL-8 和BL-18 的致病率和病情指数均为最高,致病率分别为100% 和93.33%,病情指数分别为68.33 和63.33,说明其致病性最强,而BL-20 的致病性最弱,其致病率和病情指数均为最低。
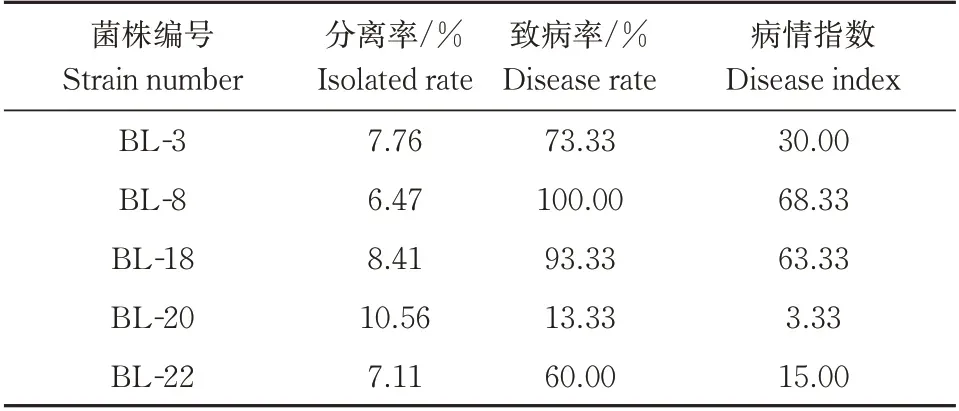
表2 板栗采后病原真菌的致病性Table 2 Pathogenicity assay of isolated fungal strains on chestnut
2.3 板栗采后病害优势病原菌的显微形态特征
根据菌落特征、菌丝形态和孢子形态等对菌株BL-3、BL-8、BL-18、BL-20、BL-22 进行初步的形态学鉴定,其菌落特征与显微结构如图1所示。

图1 5种优势病原菌的菌落形态(A)、菌丝形态(B)与孢子形态(C)观察Fig.1 Colony morphology(A),mycelial morphology(B)and spore characteristics(C)of five pathogenic fungal strains
BL-3:菌落呈边缘整齐的圆形,初为白色,培养2~3 d 后逐渐转为淡粉色,最后渐变为淡黄色,气生菌丝呈白色棉絮状,生长速度中等。菌丝有分支与隔膜,宽度约为3.20~5.30 μm,在PDA 培养基上可产生大量小型分生孢子,有单细胞和多细胞2 种,呈椭圆或长条形,长5.10~18.75 μm,宽1.89~2.50 μm,依据上述特征并结合菌种鉴定手册初步鉴定为镰孢菌属(Fusariumsp.)。
BL-8:菌落呈边缘整齐的圆形,初为白色,培养2~3 d 后逐渐转为浅粉色,最后呈玫红色,气生菌丝旺盛,呈白色绒毛状,生长速度较快。菌丝有分支与隔膜,宽度约为6.46~7.85 μm。由于在PDA 培养基上未观察到分生孢子,依据上述特征并结合文献[26]认为其与镰孢菌属(Fusariumsp.)的形态特征相似,需要进一步通过分子生物学鉴定明确其种类。
BL-18:菌落边缘不整齐,初为白色,培养2~3 d后逐渐转为灰绿色,最后颜色加深至灰黑色,气生菌丝旺盛,呈白色棉絮状,生长速度较快。菌丝多为无隔膜菌丝,菌丝宽度约为2.46~4.72 μm。由于在PDA 培养基上未观察到分生孢子,依据上述形态特征并结合文献[27],认为其与新壳梭孢属(Neofusicoccumsp.)的形态特征相似,需要进一步通过分子生物学鉴定明确其种类。
BL-20:菌落呈边缘整齐的圆形,匍匐生长,始终为浅白色,无气生菌丝,生长速度缓慢。营养菌丝有少量分支与隔膜,宽度约为7.10~9.50 μm,在PDA培养基上观察到呈长串状生长的分生孢子,以菌丝节孢的方式产孢,单个的分生孢子呈方形、长筒型或圆形,长3.92~6.65 μm,宽2.46~3.60 μm,依据上述特征并结合菌种鉴定手册初步鉴定为地霉属(Geotrichumsp.)。
BL-22:菌落初始为灰白色,培养约3 d 后,逐渐转变为黑褐色,表面密生小颗粒孢子团,气生菌丝不发达,生长速度中等。菌丝有分支与隔膜,宽度约为6.35~9.24 μm,可观察到球形孢子囊,内含大量圆形或椭圆形的孢囊孢子,孢子长0.90~1.57 μm,宽1.10~1.24 μm。依据上述形态特征,结合菌种鉴定手册初步鉴定为毛霉属(Mucorsp.)。
2.4 板栗采后病害优势病原菌的分子生物学鉴定
对菌株BL-8 的EF-1α和β-tubulin片段、BL-18的EF-1α和ITS片段进行扩增,菌株BL-8 分别获得676 bp 和1 260 bp 的片段,菌株BL-18 分别获得282 bp 和577 bp 的片段。在NCBI 数据库中进行同源性比对,下载同源性较高的菌株序列,与菌株BL-8 和BL-18 的相应序列构建双基因联合系统发育树。系统进化分析发现菌株BL-8与分离自玉米的F.asiaticum聚为同一分支(图2),其EF-1α和β-tubulin核苷酸序列与F. asiaticum菌株HBQHD529 的匹配度分别达到了99.85%和99.84%。菌株BL-18 与分离自芒果、草莓、蓝莓和柳树的N. parvum聚为同一分支(图3),其EF-1α和ITS核苷酸序列与N. parvum菌株WTS24 的匹配度分别达到了98.89%和100%。因此,菌株BL-8鉴定为Fusarium asiaticum,菌株BL-18鉴定为Neofusicoccum parvum。

图2 基于菌株BL-8的EF-1α和β-tubulin基因序列构建的NJ系统发育树Fig.2 Phylogenetic tree constructed through NJ method based on combined EF-1α and β-tubulin gene sequences
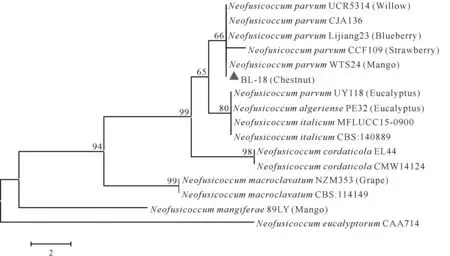
图3 基于菌株BL-18的EF-1α和ITS基因序列构建的NJ系统发育树Fig.3 Phylogenetic tree constructed through NJ method based on combined EF-1α and ITS gene sequences
2.5 植物精油单组分对板栗优势致腐菌的抑制作用
采用菌饼法测定了香芹酚、丁香酚、麝香草酚、紫苏醛、肉桂醛、叶醛、柠檬醛、芳樟醇、香茅醇和橙花醇等10种常见的植物精油单组分对板栗采后优势致腐菌的抑制作用,结果如表3 所示,大多数精油单组分对菌株BL-8 和BL-18 表现出了一定的抑菌活性。香芹酚、丁香酚、麝香草酚、紫苏醛、肉桂醛、叶醛、柠檬醛以及芳樟醇均对菌株BL-8 表现出显著的抑制作用,其EC50值和EC90值均低于100 μL/L。其中,香芹酚的抑菌效果最强,对菌株BL-8 的EC50和EC90分别为5.696 和24.431 μL/L。而香芹酚、麝香草酚、紫苏醛、叶醛等精油单组分对菌株BL-18 表现出明显的抑制效果,其EC50值和EC90值均低于100 μL/L,同样是香芹酚拥有最强的抑菌活性,其EC50和EC90分别仅达到2.561和11.768 μL/L。

表3 10种植物精油单组分对板栗优势致腐菌BL-8和BL-18抑制作用Table 3 Inhibitory effects of 10 essential oil components on the dominant pathogenic fungus of postharvest chestnut μL/L
2.6 香芹酚对板栗优势致腐菌菌丝生长的影响
进一步采用菌饼法和菌丝干重法分析香芹酚对板栗采后优势致腐菌菌株BL-8 和BL-18 生长的影响,结果如图4、图5 所示。由图4A、B 可知,经香芹酚处理的菌株BL-8的菌落直径显著低于对照菌的菌落直径;香芹酚对菌株BL-8 的菌落生长表现出显著的抑制作用,且这种抑制作用呈明显的浓度效应,当香芹酚的体积分数为30 μL/L 时,菌株BL-8 的菌落生长被完全抑制。香芹酚处理对菌株BL-18 菌落生长的抑制作用规律与菌株BL-8 相似,当香芹酚的体积分数达到25 μL/L 时,菌株BL-18的菌落生长被完全抑制。由图5 可以看出,经香芹酚处理的菌株BL-8 和BL-18,其菌丝干质量显著下降,并且随着香芹酚体积分数的增高,菌丝干质量呈逐渐下降的趋势。可见,香芹酚对板栗采后优势致腐菌菌株BL-8和BL-18的生长表现出显著的抑制作用。

图4 香芹酚处理后菌株BL-8(A)和BL-18(B)的菌落生长情况Fig.4 Inhibition of carvacrol on colony growth of strain BL-8(A)and BL-18(B)

图5 香芹酚处理下菌株BL-8和BL-18菌丝的干质量Fig.5 Inhibition of carvacrol on mycelial biomass of strain BL-8 and BL-18
2.7 香芹酚熏蒸对板栗采后病害的控制效果
香芹酚对板栗采后病害的防治效果如图6所示。接种菌株BL-8 和BL-18 的对照组果实感病症状明显(图6A、C),病情指数分别为94.45 和100(图6B、D)。而经过香芹酚熏蒸处理的板栗果实,发病症状和病情指数显著低于对照组果实(图6A);并且在0~80 μL/L 的体积分数范围内,随着香芹酚浓度的上升,板栗果实的病情指数显著降低,当香芹酚的浓度达80 μL/L时,接种菌株BL-8 和BL-18的板栗果实的病情指数分别骤降至19.45和36.11,采后病害抑制率分别达到了79.4%和63.89%。可见,香芹酚熏蒸处理对板栗果实采后病害具有明显的防治效果。
3 讨 论
由病原真菌侵染引起的板栗病害是造成板栗采后腐烂的重要原因之一,我国板栗种植产区的分布十分广泛,病原菌的种类及其侵染特性都存在着较大的地域差异性。王海霞等[5]对来自北京市产区的板栗进行了病原菌的分离鉴定,其研究结果表明镰孢菌属和壳梭孢属的致腐菌具有潜伏侵染的致病特性。梁丽松等[28]从湖北、湖南、安徽的等8 个主要板栗产区的6 个产区板栗中都分离出了镰孢菌属的病原菌,分布地域十分广泛。菌株BL-18则是林木和果树中的常见病原菌,可直接侵染果实导致采后柑橘、柠檬、苹果和芒果的腐烂,也可在果树的枝干和根中潜伏,造成枝干枯萎、树根死亡[28-29]。本研究发现菌株BL-8和菌株BL-18在板栗采后病害的发病过程中起重要作用,是2 种主要的致腐菌,此结果与前人研究基本一致[30]。在病原菌鉴定过程中,菌株BL-8 和菌株BL-18 均未在PDA 培养基上观察到分生孢子,这与单柳颖[31]和袁志林等[32]的研究发现一致,这2种霉菌在营养丰富的PDA培养基中均无法产生有性或无性繁殖结构,需要在绿豆汤培养基等特殊培养基中培养,并通过近紫外线照射诱导产孢。此外,本研究还在板栗病果中分离出了毛霉属(Mucorsp.)和地霉属(Geotrichumsp.),但其致病性并不强。吴小芹等[33]从江苏“九家种”板栗病果中分离出了镰刀属、壳梭孢属和毛霉属,其中毛霉属的分离率最高。李琳玲等[34]认为束丝菌属和曲霉属是湖北罗田板栗病害的重要致腐菌。结合以往的研究来看,从同一批的发病板栗中可以分离出多种病原菌,而同一种病原菌也可以从不同产地、不同病症的板栗中分离到。Turchetti 等[35]认为,从同一批板栗中分离出的多种真菌并不都在板栗腐烂过程中起主要作用,由于菌种之间存在竞争关系,直接导致板栗病害的可能只有少数几种优势菌。因此,鉴于板栗复杂的发病规律,既需要全面系统地研究明确各种病原菌的种类与分布,也需要深入精确地研究病原菌的侵染机制与防控措施。
在果蔬采后防腐保鲜的领域,香芹酚也展现出了良好的发展前景。前人研究发现,香芹酚作为牛至精油的主要成分,对青霉菌、曲霉菌、根霉菌等多种果蔬采后腐败真菌均有抑制作用。Wu 等[36]报道了百里香精油对由链格孢菌引起的圣女果采后病害有良好的体外抑菌活性和病害控制效果,而百里香精油中的主要活性成分正是香芹酚。候辉宇等[37]发现香芹酚对链格孢菌和尖孢镰孢菌的MIC 值均低于500 mg/L。此外,添加了香芹酚的可食性涂膜能有效减轻草莓的腐烂症状,延长草莓的货架期[38]。本研究通过测定香芹酚、丁香酚、麝香草酚、紫苏醛、肉桂醛、叶醛、柠檬醛、芳樟醇、香茅醇和橙花醇等10种植物精油单组分对板栗采后病害病原真菌的抑制作用,发现香芹酚对板栗优势致腐菌的抑制效果最为显著,将香芹酚以熏蒸的方式处理板栗,能有效控制板栗病害的发生。综上所述,结合本研究的结果,作为一种天然植物源抑菌剂,香芹酚对板栗优势致腐菌所表现出的显著抑制作用,以及对板栗采后病害的良好控制效果,使其在板栗采后真菌性病害的防治工作中具备了潜在的应用价值。

