屈螺酮炔雌醇片(Ⅱ)联合营养干预对肥胖型PCOS内分泌及代谢的影响
石丽云 叶喜阳 程彦君,* 曾丽丹
1.深圳市人民医院妇科 (广东 深圳 518020)
2.深圳市人民医院营养科 (广东 深圳 518020)
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是一种生殖内分泌代谢性疾病,关系到女性生殖、代谢和心理健康。2018年以循证医学为基础的PCOS国际新指南明确提出,对于非生育需求的PCOS患者,推荐心理指导、生活方式干预并结合针对高雄激素和月经不调的一线药物COC进行综合管理[1]。本研究通过在屈螺酮炔雌醇片Ⅱ治疗基础上对肥胖型PCOS进行营养干预,为患者的治疗提供参考。
1 资料与方法
1.1 研究对象选取2018年3月至2020年3月至深圳市人民医院妇科内分泌门诊和营养科就诊的肥胖型PCOS为研究对象,按照治疗方法不同随机分为对照组与观察组,每组50例。观察组年龄19~35岁,平均年龄(23.4±1.5)岁,病程7个月~8年,平均病程(3.4±0.3)年;实验组年龄21~36岁,平均年龄(24.7±1.6)岁,病程9月~7年,平均病程(4.2±0.7)年。两组患者基本资料比较,具有可比性,差异无统计学意义(P>0.05)。
诊断及纳入标准:根据欧洲人类生殖和胚胎学协会(ESHRE)与美国生殖医学协(ASRM)联合制订的2018国际PCOS指南作为诊断PCOS标准,评判标准依据我国《中国成人超重和肥胖症预防与控制指南》:BMI>24kg/m2,或者腰围(waist circumference,WC)≥80cm为超重或肥胖,两者相结合诊断为肥胖型PCOS。
排除标准:有药物慎用情况、禁忌证或曾对所受药物任何一成分过敏者;入选前3个月接受过激素类药物或者促排卵治疗;有严重心肝肾功能异常或其他内科疾病者;有严重家族遗传病或相关精神疾病史者;其他可能引起高雄激素的疾病(如有内分泌功能的肿瘤、Cushing综合征以及先天性肾上腺皮质增生症等疾病)。
1.2 研究方法两组患者均在月经周期第1天开始服用屈螺酮炔雌醇片(Ⅱ)(优思悦)治疗[Bayer WeimarGmbH und Co.KG(德国),批准文号H20140972],采用24+4给药方式,即先服用24片粉色活性片(每片含3mg屈螺酮+20μg炔雌醇),后服用4片白色无活性,每天1次,每次1片,28d为1个周期,不间断循环服药,连续服用4个周期。
观察组在服用药物同时进入我院营养科体重控制门诊进行营养干预,由营养科医生进行健康指导,并对所有患者采用标准方案进行营养干预,使其掌握营养干预工具和各阶段食物选择方案。全部营养干预时间为4周,分为三个阶段,依次为启动期、过度期与维持期。每日总摄入热卡控制在1200~2200K之间,前2个月为启动期,采取标准化饮食干预,每日选择低糖负载食物,并搭配代餐营养棒与多种矿物质及维生素等补充剂(均由浙江诺特营养中心提供),并搭配脂肪分解测试试纸。营养医师通过电话或微信方式了解患者每日具体饮食情况、尿酮测试结果与体重等参数,及时处理患者问题;过渡期逐渐减少营养棒的量及添加主食水果,时间4周;维持期共4周,以我国膳食宝塔为原则选择食物。干预期间妇科医师和营养师定时沟通,指导患者改善饮食和生活方式。
对照组在服用药物同时仅由医师进行一次一对一的系统咨询,嘱改善饮食和坚持适当运动,采用低脂肪、低碳水化合物、低热量及高纤维素饮食。两组均治疗4个月。
1.3 观察指标所有患者治疗前后月经期第2~4天(闭经者可不限制时间)采集空腹静脉血,检测血清性激素水平,包括促卵泡刺激素(FSH)、促黄体生成激素(LH)、睾酮(T)、游离睾酮指数(FAI)等,并测量空腹血糖(FPG)、血脂和空腹胰岛素水平(FINS),评估计算出胰岛素抵抗指数(HOMA-IR),各项激素水平检测采用免疫化学发光法测定。同时在用药前后对患者进行物理指标测量,包括腰围、臀围、身高、体重,计算出腰臀比和体重指数(BMI)和腰臀比。
1.4 统计学方法采用SPSS 20.0软件进行统计分析,计量资料采用(±s)表示,用t检验,计数资料则用χ2检验,P<0.05显示差异具有统计学意义。
2 结 果
2.1 两组患者治疗前后性激素比较两组患者治疗前后相比,LH、LH/FSH、T、FAI均有显著性降低,具有统计学意义(P<0.05),FSH治疗前后相比,差异则无统计学意义(P>0.05),见表1。
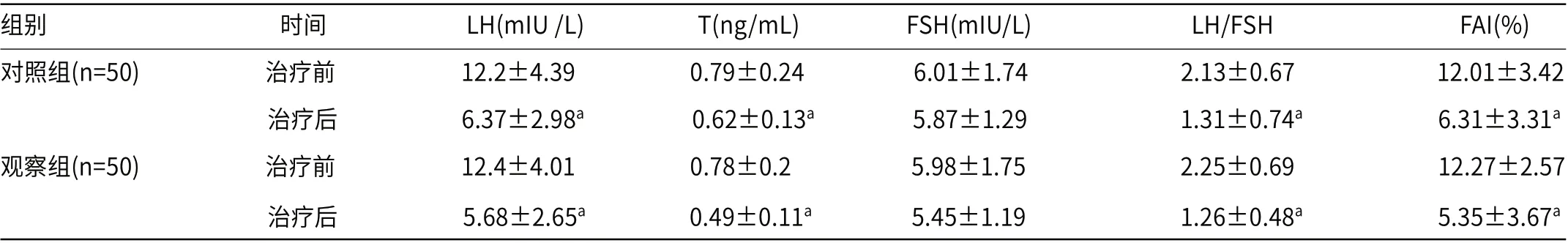
表1 两组患者治疗前后性激素水平比较
2.2 两组患者治疗前后糖脂代谢指标比较两组患者治疗前后,观察组FBG、FINS、Homa-IR、TG、T-CHO指标差异有统计学意义(P<0.05),与对照组相比治疗后的结果,差异也有统计学意义。而对照组以上各指标治疗前后则无统计学意义(P>0.05),见表2。

表2 两组患者治疗前后糖脂代谢指标比较
2.3 两组患者治疗前后物理测量各指标比较观察组治疗前后相比较,体重、腰围、腰臀比与BMI差异均有统计学意义(P<0.05),与对照组治疗后相比较,差异也有统计学意义(P<0.05);而对照组治疗前后上述指标差异则无统计学意义(P>0.05),见表3。
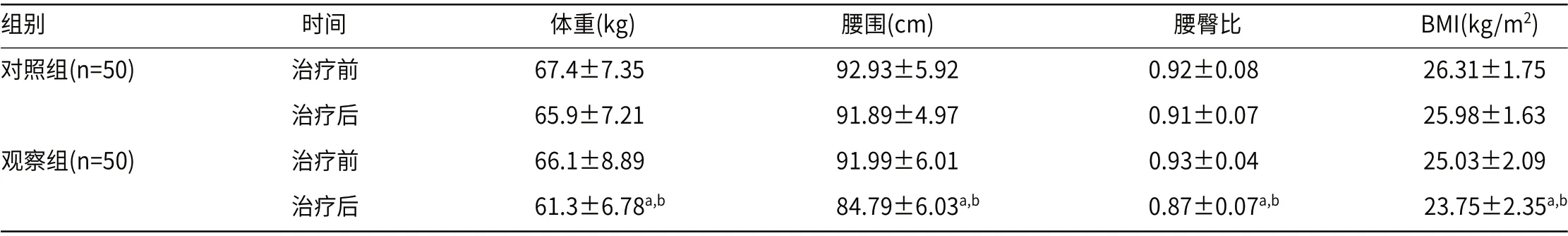
表3 两组治疗前后物理测量指标比较
3 讨 论
多囊卵巢综合征临床表现主要为不规律的月经、高雄激素、排卵功能障碍、不孕和肥胖等,严重危害女性健康。世界育龄期女性中发病率为6%~20%,中国育龄期女性5.1%~7.2%,占无排卵性不孕的75%[1-3]。PCOS除了给患者带来近期的临床影响外,还会产生一系列远期的健康危害,包括妊娠并发症、胰岛素抵抗、代谢综合征、2型糖尿病等,增加了心血管疾病及子宫内膜癌的发病风险,故需要长期综合管理。
目前国际PCOS循证医学指南提出,PCOS治疗以症状为导向,即与月经异常、高雄激素或排卵障碍、不孕等症状有关。复方口服避孕药是PCOS抗高雄激素及调整月经的一线药物,可增加性激素结合球蛋白,降低游离睾酮。结合雌激素作用、代谢影响、副作用、成本和可行性,推荐最低有效雌激素剂量[1]。研究表明,屈螺酮炔雌醇片(Ⅱ)本身不具有雄激素效应,且抗雄激素作用强,有助于改善代谢紊乱问题,还能减少雄激素分泌并降低其活性,从而控制高雄激素血症[4-5],故可作为更优一线治疗药物。本研究中显示,观察组和对照组经过4个周期以上治疗后,雄激素水平、LH及LH/FSH均显著下降,说明屈螺酮炔雌醇片(Ⅱ)可起到较好的抗高雄激素效果。
临床统计发现接近1/2的PCOS患者伴有肥胖问题[6],约20%的患者有胰岛素抵抗[7]。肥胖与PCOS两者之间的发生发展互为因果,其机制为:一方面,PCOS患者的胰岛素抵抗导致脂代谢异常,同时胰岛素抵抗引起的高胰岛素血症又促进患者食欲导致肥胖;另一方面,肥胖又能降低胰岛素的敏感性,加剧胰岛素抵抗和血脂代谢紊乱情况,加重了PCOS功能紊乱,增加了2型糖尿病、心血管事件的风险。故对于无生育要求的PCOS患者,除了采取抗高雄激素及调整月经的一线治疗药物外,采用科学有效的减重方案是治疗肥胖型PCOS的重要治疗手段。
PCOS治疗除了以症状为导向外,减少肥胖、胰岛素抵抗、代谢综合征的相关风险也是目标之一,故心理健康指导和生活方式干预也应作为PCOS患者的基础治疗。有循证医学[8]支持PCOS患者积极调整生活方式可预防超重与肥胖,从而改善远期生命质量,即使PCOS患者就诊时体重正常,但因其有远期体重增加的风险,故同样需要生活方式的指导干预。Brennan等[9]综述了PCOS患者进行有效生活方式干预来管理体重的研究,建议PCOS患者进行规律的自我监测,将生活方式干预和心理健康指导相结合,制定出临床可行性强且经济有效的方案,而正常体重的PCOS患者则可采取相对低强度的干预措施以维持正常体重及预防体重增加。生活方式干预主要包括饮食干预和运动指导。Lin等[10]综述了PCOS患者饮食习惯和运动情况,发现PCOS患者在运动方面和健康女性相比并无显著差异,但因PCOS患者饮食呈高热量特点,摄入过多饱和脂肪酸并缺乏膳食纤维。热量限制是PCOS饮食干预的关键因素,不仅对于生育管理,也有助于预防长期代谢并发症产生[6]。Bykowska-Derda[11]研究也表明PCOS女性饮食质量评分和营养知识要低于健康对照组,专业的饮食教育可能改善饮食行为。
对于肥胖型PCOS患者,饮食干预显得尤为重要。本研究在药物治疗基础上通过两种方式进行的饮食干预对比可见,标准化营养干预方案优于单纯营养咨询,经过短期严格标准化营养干预后,肥胖型PCOS患者的物理测量指标和糖脂代谢指标均较单纯饮食咨询组改善显著,但停止标准化营养干预后患者是否能长期坚持优化饮食结构,仍需要进行更长时间的追踪随访。

