纳米银、金溶胶的电化学合成及其基本胶体性质
——物理化学综合实验设计
马继臻,丁思雨,田亚冬,马厚义,张进涛
山东大学化学与化工学院,济南 250100
金属纳米材料作为一类非常重要的功能材料,由于其特殊的表界面特点表现出了与块体材料显著不同的物理化学性质,在催化、生物标识、导电浆料、电池储能等现代科学技术领域具有广泛的应用潜力[1,2]。纳米金属溶胶分散粒子的尺寸、大小通常在1-100 nm之间,具有胶体的基本物理化学性质,是一种重要的胶体分散体系。特别是,随着纳米金属溶胶合成方法的丰富,各种各样的纳米金属溶胶被合成出来,并应用到催化等不同领域。与传统的化学方法和机械合成相比,电化学方法制备纳米材料的优点是设备简单、操作方便、易于控制、反应条件温和、产物污染少等,是一种非常有前途的制备与组装纳米粒子的好方法[3]。例如,可选择性地调节和控制电位或电流大小、实施电位或电流阶跃、外加交流微扰信号等,为制备粒径和形状可控的纳米微粒提供了一种方便可行的实验方法。
电化学和胶体分散体系作为大学本科物理化学基础知识的两个重要部分,为学习电化学知识与胶体体系的基础理论提供重要保障[4,5]。但是,课堂的讲授与学习缺乏直观的手段与方法让学生加深相关基础知识的理解和基本反应过程的认识。因此,为了激发学生的求知欲、创新思维、动手能力,加深对电化学反应过程与胶体体系的认识与思考,设计纳米银、金溶胶的电化学合成与基本胶体性质表征的综合化学实验具有重要的意义。电化学还原合成纳米金属溶胶是功能纳米材料合成的重要基础方法之一,其基本原理清晰、设备简单、现象直观,能够实时观测电极反应过程和金属溶胶的形成过程,并结合基本的光谱方法进一步理解胶体的基本性质和电化学合成机理。该综合实验包括纳米银、金溶胶的电化学合成、溶胶基本光学性质表征和电化学还原过程初探三部分。实验设备简单、易于操作,且每部分都可以作为独立的基础化学实验进行,可以作为化学专业本科学生的必修综合实验课程,也可以作为与化学相关的材料科学、生物医学专业本科生的选修实验,提供多维度的实验技能训练,从而培养学生理论联系实际的能力,激发学生从事科学研究的热情。
1 实验目的
(1)学习和掌握纳米金属溶胶的电化学合成方法和基本原理;
(2)了解表面活性剂(或聚合物)在纳米金属粒子形成过程中所起的作用;
(3)掌握溶胶的基本性质,阐明纳米银、金粒子特征吸收峰的起源;
(4)初步掌握基本的循环伏安测试方法,加深纳米金属粒子电化学合成过程的理解;
(5)培养学生的基础知识综合运用能力和实验技巧。
2 实验原理
2.1 纳米银、金溶胶电化学合成的基本原理
当电流通过“电极/溶液”界面时,电极表面就会发生相应的电化学反应,同时伴随着电解液中与电极反应直接相关的传质过程。与溶液中的氧化还原化学反应相比,电化学氧化与还原反应是异相反应过程,具有如下的三个重要特征:
(1)分区反应。电化学氧化与还原反应分别在阳极和阴极进行,反应中涉及到电子通过电极和外电路的传递。
(2)界面反应。氧化与还原反应均发生在“电极/溶液”的荷电界面上。
(3)特殊的异相催化反应。“电极/溶液”界面附近的电场对电极反应有显著的活化作用,在一定范围内调整电极电位可以改变电极反应的活化能,从而影响电化学反应的速率。
根据物理化学电化学的基础理论,当电解池的外加电压逐渐增大时,阳极电势随之逐渐升高,同时阴极电势逐渐降低。只要电极电势达到对应离子的析出电势,则电解反应即开始发生。阴极上发生的是还原反应,即金属离子还原成金属或氢离子还原为氢气;在阳极发生的是氧化反应。析出电势越低的离子,越易在阳极上放出电子而氧化[4]。因此,在阳极电势逐渐升高的过程中,不同离子依照析出电势由低到高的顺序先后放电进行氧化反应。如果阳极材料是铂等惰性金属,则电解时的阳极反应通常是溶液中的离子放电,如负离子氢氧根氧化成为氧气(阳极反应)。根据以上分析,金属离子在低于可逆电位下发生还原并形成新相是理所当然的事情,这是在导电材料表面制备金属镀层的理论依据。
实际上,金属离子的阴极还原过程相当复杂。受电极极化的影响,金属的实际析出电位往往低于其平衡还原电位,同时涉及到电极表面电沉积和形成分散的纳米粒子两个彼此竞争的过程[6,7]。大多数情况下,没有额外因素影响时电沉积过程占据明显优势。倘若在电解液中加入适当的表面活性剂作为金属纳米团簇的稳定剂,用来提升纳米粒子的形成速率,同时降低电沉积的速率,这样就可以利用金属离子的电化学还原反应直接制备金属纳米离子(阴极反应):
阳极反应4OH-→ O2+ 4e-
阴极反应Mn++ne-+稳定剂→ Mcoll
以上反应式中,Mn+代表电解液中的金属离子;稳定剂代表季氨盐、聚乙烯吡咯烷酮等表面活性剂或聚合物分子,作为纳米金属团簇的稳定剂;Mcoll表示由稳定剂包裹的较为稳定的纳米金属胶体粒子。
由此可见,在外加电场的作用下,金属离子(Mn+)迁移到阴极区域,在阴极表面放电,并与稳定剂(如季铵盐)结合形成吸附原子。然后,吸附原子逐渐聚集形成金属团簇,在稳定剂的保护下形成纳米金属胶体粒子分散到溶液中[8]。纳米金属粒子的大小可以通过改变外加电位或外加电流调节还原速率来选择性控制。一般情况下,阴极电流密度越大,所制备的纳米粒子的粒径就越小。同时,电化学方法合成金属纳米粒子的过程中,选取合适的纳米粒子稳定剂非常关键。由于季铵盐的保护效果不够理想,金属纳米粒子时常团聚沉积在反应器的底部(如图1所示)。本实验中选取对银、金等金属具有更强亲和力的水溶性高分子聚乙烯吡咯烷酮(PVP)代替季铵盐类阳离子表面活性剂作为纳米粒子的稳定剂,形成的纳米金属胶粒优先吸附金属阳离子而带正电荷,随后吸附溶液中的阴离子(如硝酸根离子、氯离子),整个胶团呈电中性[7]。同时,以旋转电极代替静止的阴极,借助于旋转离心力作用将形成的金属粒子分散到溶液中,从而协助解决阴极附近金属离子浓差极化的影响以及纳米离子团聚的问题。以PVP为稳定剂的金属纳米粒子电化学合成方法具有操作更为简单、适用范围更广、更易于控制粒子的大小和粒度分布的优点。
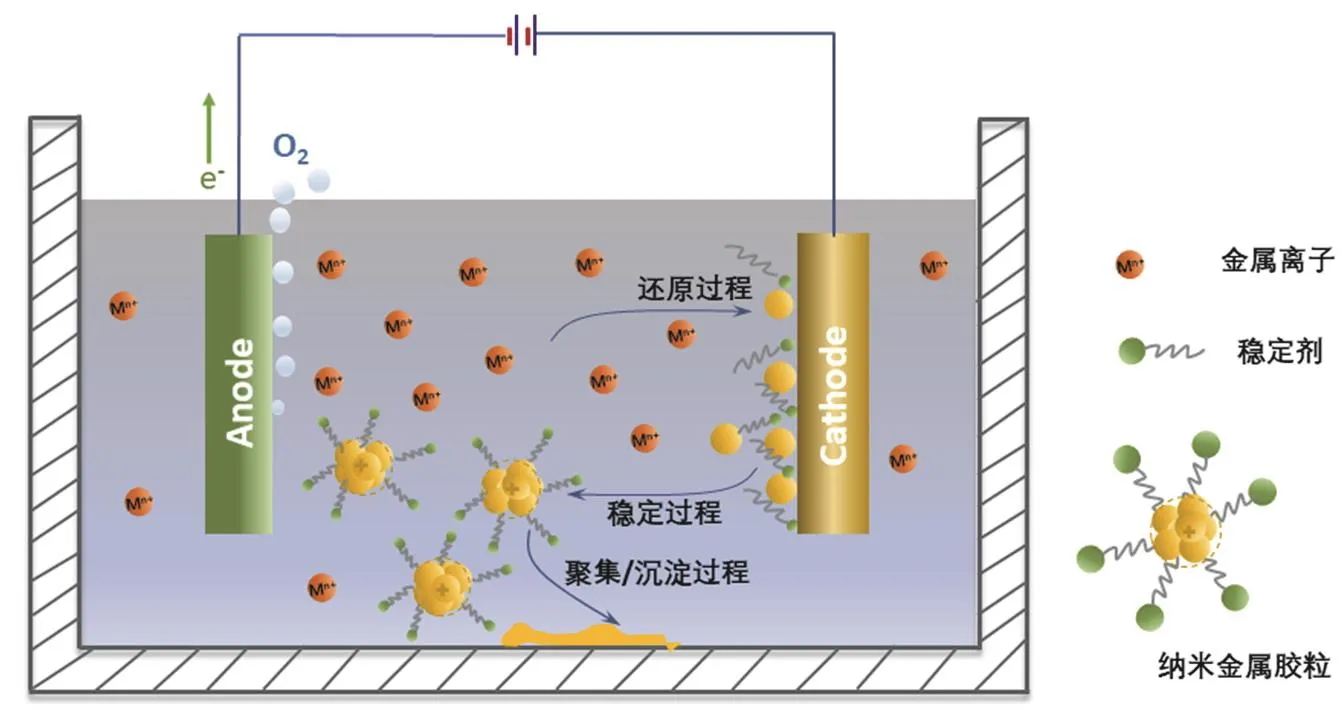
图1 在阴极附近,金属离子电化学还原形成纳米金属胶体粒子的示意图
2.2 紫外-可见吸收光谱特征吸收峰的物理意义
在光的作用下,纳米尺寸的金属粒子内部自由电子随着光电场周期的振荡也将会在粒子内部做协同的周期运动。在某一波长的光的激发下,粒子表面电荷分布随着电场周期进行规律性的变化,即产生粒子的表面等离子体共振,其共振频率与粒子中电子密度、粒子大小和粒子形状等密切相关。当粒子较小时,粒子可被近似认为处于同相位均匀电场中,表现为简单的偶极子共振模式;而当粒子较大时,因粒子中处于不同位置的电子所承受的激发光的相位有所差异,即外电场在整个粒子上分布不再均匀,此时可表现出高级模式的等离子体,如四极子或八极子共振模式。由于各种物质的内部结构不同,分子的能级千差万别,各种能级之间的间隔也互不相同,这就决定了它们对不同波长的光线的选择吸收。
Lambert-Beer定律是光吸收的基本定律,也是分光光度分析法的理论依据和基础[9]。如果改变某一吸收物质的入射光的波长,并记录该物质在每一波长处的吸光度(A),然后以波长为横坐标、以吸光度为纵坐标作图,如此获得的谱图就称为该物质的吸收光谱或吸收曲线。某物质的吸收光谱反映了它在不同的光谱区域内吸收能力的分布情况,这可以从波形、波峰的强度及其数目分辨出来,为研究物质的内部结构提供了重要的信息。在紫外-可见吸收光谱中,纳米粒子吸收峰的位置是由粒径大小决定的,而粒径的分布情况则可用吸收峰的宽窄来表征。通常纳米粒子越小,其紫外吸收峰就越易发生蓝移(波长变小);粒径分布越不均匀,其吸收峰就越宽。紫外-可见分光光度法定量分析的依据是Lambert-Beer定律,在一定波长处被测定物质的吸光度与它的浓度呈线性关系。因此,通过测定溶液对一定波长入射光的吸光度,即可求出该物质在溶液中的浓度或含量。一般紫外-可见分光光度计只能提供190-850 nm范围的单色光。
3 实验部分
3.1 实验仪器
旋转圆盘电极(中国天津市兰力科化学电子高技术有限公司,型号LKXZ-1,也可用转速可控的机械搅拌器改装而成,如图2所示)、紫外-可见分光光度计(上海舜宇恒平科学仪器有限公司,UV2800)、电化学工作站(上海辰华,CHI610)、直流稳压电源(调节电流和电压)、电流表(量程:1 μA-1 A)、旋转铂电极(截面直径2 mm)、铂对电极、两端连接鳄鱼夹的导线多根。
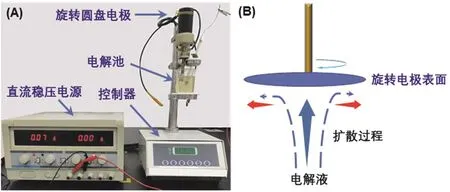
图2 反应装置照片(A)以及旋转电极表面金属离子扩散-还原过程示意图(B)
3.2 试剂
聚乙烯吡咯烷酮(PVPK30或PVPK17、PVPK90)、硝酸钾(KNO3)、硝酸银(AgNO3)、氯金酸(HAuCl4)。试剂均购自国药集团化学试剂有限公司,分析纯。
4 实验步骤
4.1 溶液配制
配制0.010 mol·L-1的AgNO3水溶液。称取0.42 g硝酸银,利用容量瓶配制0.010 mol·L-1的AgNO3水溶液250 mL,放入棕色瓶中保存。配制电解液时,每次取25 mL。
配制0.010 mol·L-1的HAuCl4水溶液。取0.85 g氯金酸配制0.010 mol·L-1的HAuCl4水溶液250 mL。配制电解液时,每次取5 mL。
配制1 mol·L-1的KNO3溶液100 mL。称取10.11 g硝酸银,利用容量瓶配制1 mol·L-1的KNO3溶液100 mL。配制电解液时,每次取5 mL。
配制电化学合成纳米银溶胶的电解液。依次移取25 mL 0.010 mol·L-1的AgNO3水溶液,5 mL 1 mol·L-1的KNO3溶液混合均匀,称取1 g PVPK30 (PVPK17或PVPK90)溶解在该电解液中,然后定容至50 mL。
配制电化学合成纳米金溶胶的电解液。依次移取5 mL 0.010 mol·L-1的HAuCl4水溶液,5 mL 1 mol·L-1的KNO3溶液混合均匀,称取1 g PVPK30 (PVPK17或PVPK90)溶解在该电解液中,然后定容至50 mL。
4.2 纳米银、金溶胶的电化学合成
室温下,向含有银离子的50 mL电解液中放入旋转圆盘电极作为阴极,铂片作为阳极,控制阴极转速在1000 r·min-1,调节稳压电源对反应体系施加100 mA的阴极电流,分别电解5 min、10 min、20 min,记录电解液的颜色随电解时间的变化。以同样的方法,电解合成纳米金溶胶的电解液,观察反应过程中溶液颜色变化以及电极表面特征等实验现象。
根据实验计划和时间安排,可以启发学生设计实验考查不同转速(500、1000、1500、2000 r·min-1)、不同聚合物或表面活性剂(十二烷基苯磺酸钠,SDBS)等的影响规律。
4.3 紫外-可见吸收光谱的测量
软件运行:打开电脑以及分光光度计。直接点击图标,然后从菜单栏,文件-打开,找到相关标线打开。(另一种方法,从我的电脑-紫外-找到标线打开)点击connection,机器自检,待自检结束,点击“OK”(注:若实验前机器处于打开状态时不会出现自检)。
调零:在两个通道放入装有蒸馏水的比色皿(注:放入比色皿后一定要把盖关闭),把光标放在系统基线校准即可。
测样:用选择好的比色皿进行测试,首先用测量样品冲洗比色皿两到三次,然后倒入样品(注意:拿比色皿时,不要碰到光滑面,用手指捏住毛面即可;倒液体时,尽量不要溢出比色皿;如有溢出,用擦镜纸擦干,确定没有水珠和痕迹后再放入通道中,以免影响吸光度),再将比色皿放入测试通道中,选择200-800 nm的光谱范围,点击测量即可。
数据存储:测样结束后,在菜单栏中选择“数据存储”,选择“CSV”格式,将数据存至D盘,建立个人文件夹。
4.4 银电沉积和剥离过程的伏安曲线的测定
循环伏安曲线通常由电化学工作站测试完成。循环伏安法(cyclic voltammetry,简称CV法)是指在电极上施加一个扫描速率恒定的线性扫描电压信号,当达到所设定的回扫电位时,再反向回扫至设定的终止电位。将等腰三角形的脉冲电压(三角波)施加到工作电极上,并记录电极上所得到的电流响应信号与所施加电压的关系,即可得到电流-电压曲线,此即为循环伏安曲线。
本实验中,利用玻璃碳圆盘电极作为工作电极,铂片作为对电极,银丝为参比电极的三电极体系,通过电化学工作站控制,测定循环伏安曲线。具体步骤和参数设定:(1)选择开路电位测试测定,时间为400 s,等待稳定后获得开路电位OCP;(2)选择循环伏安曲线方法,在参数设计页面设定起始电位为OCP,扫描电势区间为-0.3 - 0.3 V (vs. Ag/AgCl),扫描速度为50 mV·s-1,次数为6,然后电脑收集记录伏安曲线。分析伏安曲线的ia、φa、ic、φc等参数,解析银离子在固体电极上电沉积和氧化剥离过程的规律。
5 实验结果与讨论
室温下,电解液中放入旋转圆盘电极作为阴极,铂片作为阳极,控制阴极转速在1000 r·min-1,调节稳压电源对反应体系施加100 mA的阴极电流进行电解。随着电解的进行,观察到溶液发生明显的颜色变化,由无色透明溶液变为浅黄色。当电解时间由5 min延长至20 min时,溶液由浅黄色逐渐变为黄色(图3)。图3C为利用紫外-可见分光光度计测定的吸收光谱光谱。位于420 nm处的吸收峰是银纳米粒子典型的吸收峰,且随着电解时间的延长,峰强度逐渐增强。根据Lambert-Beer定律,在一定波长处被测定物质的吸光度与它的浓度呈线性关系。因此,随着电解时间的延长,溶液中银纳米粒子的浓度逐渐增大。三个电解时间下的吸收峰出峰位置没有明显偏移,即没有明显的大颗粒沉淀形成,形成的粒径较均匀。电解后溶液可以稳定保存数周,不发生聚集沉淀。这些结果表明,在PVP的协助下,以旋转圆盘电极作为阴极,通过电化学还原可以直接合成银纳米粒子溶胶溶液。
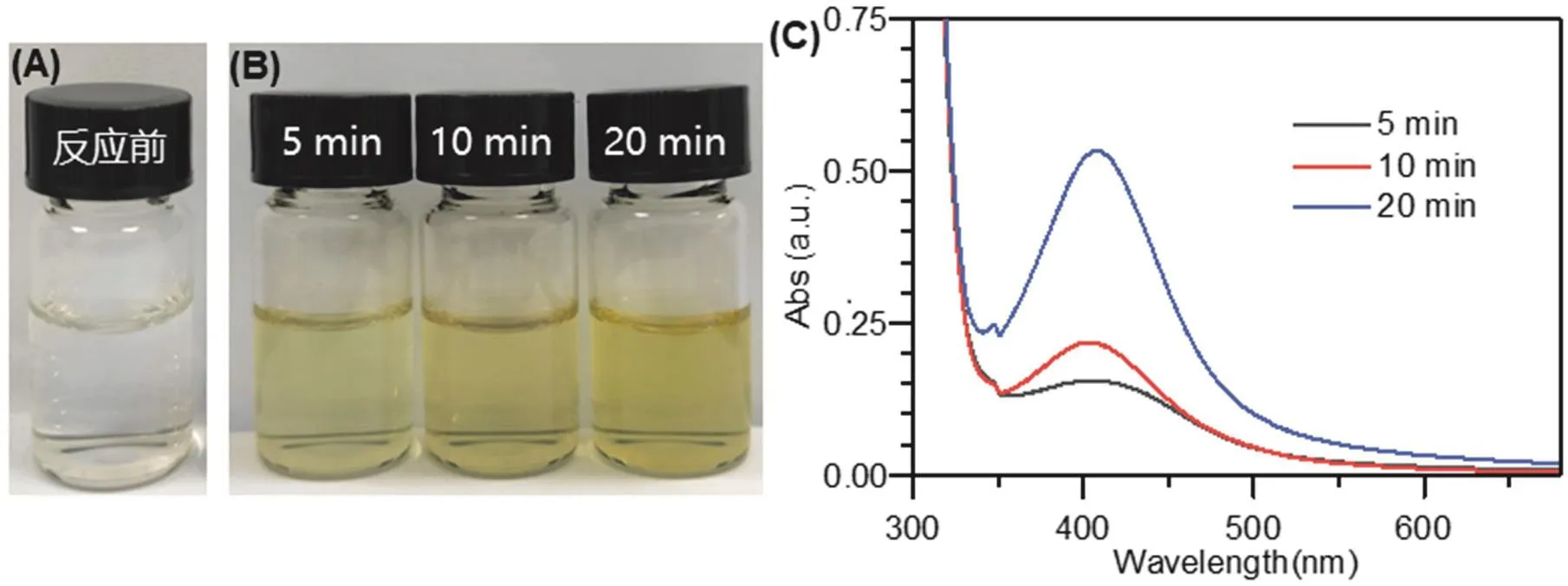
图3 含硝酸银电解液在电解前(A)、后(B)溶液的照片及电解不同时间溶液的紫外-可见吸收光谱(C)
运用同样的方法,电解含有氯金酸的电解液时,观察到浅黄色的氯金酸溶液逐渐变为浅玫瑰红色,再变为暗红色(图4)。利用紫外-可见分光光度计分析,在540 nm的吸收峰为纳米金的典型吸收峰,表明纳米金溶胶的形成。如图4所示,纳米银与纳米金溶液显示了明显不同的颜色,在紫外-可见光谱中的吸收峰位置也有明显的差异。在光的作用下,纳米尺寸的金属粒子表面电荷分布随着光电场周期进行规律性变化表面产生等离子体共振,是紫外-可见光谱中的吸收峰的起源。由于各种物质的内部结构不同,分子的能级千差万别,各种能级之间的间隔也互不相同,这就决定了它们对不同波长的光线的选择吸收。因此,不同金属纳米粒子的吸收峰位置不同。当一束激光穿过纳米银、金溶液时,在垂直于入射光的方向上可以观察到明亮的光路,即丁达尔效应,体现了典型的溶胶性质。

图4 电化学合成银、金胶体溶液的紫外-可见吸收光谱及其数码照片(插图)
循环伏安曲线是电化学研究中最常用的方法之一。如图5所示,循环伏安曲线包括两个分支:当电位由开路电位向阴极方向扫描,电活性物种将在电极上发生还原反应,产生还原波(O + ne-= R);那么后半部分电位反转向阳极方向扫描时,则还原产物又会重新在电极上被氧化,产生氧化波(R =O + ne-)。在一次完整的三角波电位扫描过程中,可完成一个还原和氧化过程的循环。对于近似可逆的氧化-还原过程,峰电流可表示为:ip= 2.69 × 105× n3/2v1/2D1/2Sc。
其中:ip为峰电流(A,安培);n为电子转移数;D为扩散系数(cm2·s-1);v为电压扫描速度(V·s-1);S为电极面积(cm2);c为被测物质浓度(mol·L-1)。
随电极电势逐渐降低,溶液中银离子被还原为金属银,并在固体电极表面发生电沉积,形成银的电沉积层,在伏安曲线上产生阴极还原峰。当外加三角波电压逐渐升高时,银将发生氧化生成银离子,从电极表面剥离,在伏安曲线上给出氧化峰。在一次完整的扫描过程中,银的电沉积和剥离过程将产生一对氧化还原峰。如图5所示,在未添加聚合物PVP的电解液中,循环伏安曲线显示一对具有较好可逆性氧化与还原峰,φa,φc分别位于0.055,-0.16 V。但是,当电解液中添加聚合物PVP后,银的氧化峰电流(ia)明显减小。同时,峰电位间有更大的差异,表明氧化还原可逆性变差。

图5 含硝酸银电解液添加PVP前后的循环伏安曲线
根据胶体溶液的基本性质,聚合物添加剂对溶胶纳米粒子的形成和稳定性起着非常关键的作用。水溶性PVP分子对金银等金属离子具有较强的配位作用,并容易吸附在金属表面形成包覆层。电化学方法合成银纳米粒子时,在电解液中添加一定量的可溶性聚合物PVP后,聚合物与银离子可能通过配位离解平衡形成络合离子,从而控制了溶液中游离银离子的浓度,从而抑制银离子在电极上的还原沉积速度,其还原电流也有所减小。在电解液中添加PVP后,除了电极表面银离子的还原沉积外,在PVP的包覆作用下,部分银离子被还原分散到溶液中形成纳米银胶体粒子。在阳极扫描时,只有部分沉积在电极表面的银被氧化剥离。因此,其氧化电流明显减小。这些结果表明,在电解液中添加聚合物PVP是抑制银在电极表面沉积形成银纳米粒子的重要原因。其次,旋转电极产生的离心力可将电极附近形成的金属纳米粒子及时分散到溶液中去,从而抑制金属粒子的聚集沉淀,对于纳米粒子的分散和形成也起到协助作用。
6 注意事项
1)配制1 mol·L-1的硝酸钾时,由于溶解过程较长,可以借助超声波分散;同时,随着的PVP分子量的增大,不易溶解,同样借助超声波分散。
2)因硝酸银溶液易变质,硝酸银溶液应现配现用,且避光保存。溶解配制过程中避免超声处理。
7 思考题
1)为什么在电解液中加入大量硝酸钾?其作用是什么?
2)加入PVP的作用是什么?
3)尝试说明纳米银、金溶胶紫外-可见光谱特征吸收峰的起源。
8 结语
本文结合物理化学电化学和胶体分散体系物理化学基础知识的学习,设计了一个综合化学实验。利用电化学还原的方法直接合成纳米银、金溶胶,运用紫外-可见光谱分析合成的纳米金属溶胶的吸收光谱特征,对比分析不同合成参数的影响规律,并运用电化学循环伏安法分析电沉积过程与纳米金属粒子的形成机理。本物理化学实验综合运用电化学理论与胶体体系性质等相关的基础知识,实验可分组进行,总时长大约6小时。同时,实验的模块化设计分为电化学纳米金属溶胶的合成与性质表征、溶胶的电化学合成与形成机理初探两个模块可分别独立进行,也可启发建议学生自行设计实验方案考查不同反应参数(如改变旋转电极转速、采用十二烷基苯磺酸钠等不同表面活性剂)的影响规律及其他纳米金属溶胶(如钯)的电化学合成,从而有效培养学生的综合化学实验能力,并激发学生的科研热情。

