碳布负载氢氧化镍电极材料的合成及其电容性能分析
——推荐一个综合化学实验
张琳,要红昌,李朝辉,李中军
郑州大学化学学院,郑州 450001
随着二氧化碳等温室气体的大量排放,气候变化已经成为人类面临的全球性重要问题。为此,我国积极参与全球倡导的低碳减排活动,大力发展绿色、洁净的可再生能源,并提出了2030年实现碳达峰和碳中和的工作目标[1]。由于太阳能、风能等新能源具有不可持续性或地域性等限制,因此近年来对二次电池、电容器等能量转换与存储装置的发展也提出了更高的要求。超级电容器是一种新型的储能器件,与二次电池相比具有充放电速度快、循环寿命长、安全性高等显著特点,因而引起了人们的广泛关注和研究。电极材料是影响超级电容器性能的关键因素。在众多电极材料中,氢氧化镍具有理论比容量高、价格低廉、来源丰富及环境友好等特点,被认为是一种非常有潜力的超级电容器电极材料[2]。然而,Ni(OH)2导电率低的缺点严重限制了其实际性能。研究表明,在导电性良好的碳布基底上制备Ni(OH)2薄膜可以有效解决这一问题[3]。目前,制备薄膜的方法主要包括水热法、电化学沉积法和化学浴沉积法(Chemical Bath Deposition,CBD)等。其中,CBD法反应条件温和、设备简单、成膜速度快,已成为制备Ni(OH)2、ZnO、CdS、CdTe和CuInSe等薄膜的一种首选方法。将这一研究成果引入到实验教学中,不仅可以丰富化学实验教学内容,而且有助于学生了解科技前沿发展。
此外,在基础理论研究方面,科研工作者已经对超级电容器的储能机理进行了深入的研究,并且建立了相对完善的电容性能评价方法[3]。电化学理论是大学本科化学基础知识的重要部分。这部分内容理论性强,课堂学习很难激发学生的学习兴趣。为了加深学生对电化学基础知识的理解,掌握现代电化学分析方法,笔者设计了碳布负载Ni(OH)2薄膜的制备与电容性质评价这个综合性应用化学实验,内容包括三部分,即CBD法在碳布基底上制备Ni(OH)2薄膜、材料的形貌结构表征以及电容分析。该实验设备简单、易于操作,可以作为化学和材料科学专业本科学生的综合实验课程,有助于培养学生的化学应用能力,激发学生从事科学研究的热情。
1 实验目的
(1)了解CBD法的合成方法和成膜机理;
(2)了解X射线衍射仪的基本操作,掌握物相结构分析方法;
(3)了解扫描电镜的测试操作,掌握形貌分析方法;
(4)了解循环伏安法、直流充放电法的基本原理和实验操作方法;
(5)掌握电容性能的分析方法。
2 实验原理
2.1 CBD法成膜机理
CBD法是将基底浸入含有金属离子、配合剂和阴离子的前驱溶液中,常压、常温下制备薄膜的一种液相化学方法。CBD法制备Ni(OH)2薄膜涉及的化学反应如下所示[4]:
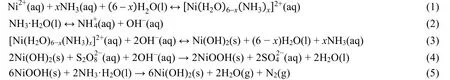
首先,Ni2+与氨分子和溶剂水分子很容易结合形成配合物离子[Ni(H2O)6-x(NH3)x]2+,该反应如(1)所示,它的平衡常数为Ks{[Ni(H2O)6-x(NH3)x]2+}。然后,随着反应(2)的进行,氨水解离产生的OH-浓度不断增加,开始发生反应(3)。反应(3)的平衡常数K3= 1/Ks{[Ni(H2O)6-x(NH3)x]2+}·Ksp(Ni(OH)2),该反应的反应商Q = cx(NH3)/c{[Ni(H2O)6-x(NH3)x]2+}·c2(OH-),在一定温度下,当Q < K3(即△rGm< 0)时,[Ni(H2O)6-x(NH3)x]2+和OH-离子将结合形成Ni(OH)2晶核。在过硫酸钾的存在下,少量Ni(OH)2被部分氧化成NiOOH,如(4)所示,并以[4Ni(OH)2·NiOOH]的形式存在。随后,NiOOH还可发生反应(5),被氨水重新还原为Ni(OH)2。形成的大量Ni(OH)2晶核紧密附着在碳布衬底上,并逐渐长大、相互连接形成薄膜。实验发现由于氧化剂过硫酸钾的存在,更容易在基底上沉积Ni(OH)2薄膜,这可能与NiOOH的形成有关。
式(3)所示的化学反应在溶液中(同质形核)和衬底表面(异质形核)同时进行。目前关于CBD法的成膜机理通常有两种观点。第一种是“离子-离子”模型,薄膜由溶液中的[Ni(H2O)6-x(NH3)x]2+和OH-在衬底表面直接反应形成。第二种是“胶粒-胶粒”模型,溶液中通过同质形核形成的颗粒,吸附到衬底表面形成薄膜。在实际过程中,两种反应方式可能同时存在并相互作用。哪一种机制占主要地位则是由异质形核和同质形核的程度来决定的。关键影响因素主要有溶液的过饱和度、衬底的催化能力、反应温度和溶液pH等。
2.2 超级电容器的工作原理[5]
按照储能机理,超级电容器通常分为双电层电容器和赝电容电容器两种类型。双电层电容器按照亥姆赫兹(Helmholtz)双电层模型储存电荷,如图1(a)所示,电解液离子通过静电作用在电极材料表面发生吸附、脱附,从而实现快速充放电。多孔碳材料是最常用的双电层电容器的电极材料。
金属氧化物或氢氧化物属于赝电容电极材料。赝电容超级电容器是依据电极表面或近表面发生快速可逆的氧化还原反应来实现充放电。其储能原理如图1(b)所示,充电时电解液离子(如H+、OH-)在外加电场的驱动下,由溶液中扩散到电极/溶液界面,然后通过界面的氧化还原反应进入到氧化物电极的体相。放电时氧化还原反应逆向进行,电解液离子重新迁移至溶液中,同时所存储的电荷通过外电路释放出来。该充放电过程不同于双电层超级电容器单纯的物理吸脱附过程,它存在氧化还原反应,因此具有更高的比容量和能量密度。
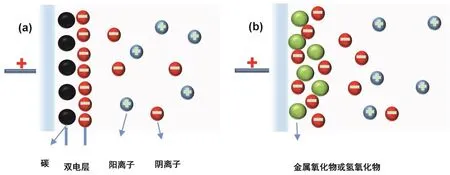
图1 超级电容器的储能机理
2.3 循环伏安法(Cyclic voltammetry,CV) [6]
CV测试是一种常用的电化学方法,该法控制电极电势以三角波形反复扫描,得到电流-电势曲线。在扫描的某些电位区间会出现波峰,表明在该电位区间进行着某些电化学反应或表面吸附。根据CV曲线的形状可以判断电极材料储能的类型以及可逆程度。对于完全可逆的电极表面过程,CV曲线上氧化电位(EPa)和还原电位(EPc)值相等,即EPa- EPc= ΔEP= 0,峰电位与扫描速度(v)无关,峰电流与v的一次方成正比,且氧化电流(IPa)和还原电流(IPc)相等,即IPa/IPc=1;对于电极反应不完全可逆(比如准可逆或不可逆),其ΔEP≠ 0,IPa/IPc≠ 1,差别程度由电极反应的可逆性决定。
CV法还可以用于分析电极材料的电荷储存动力学。在不同的v下进行扫描,得到不同的IP。二者之间有如下的关系:

其中,a和b为可变参数。如果b的值为0.5,电极材料表现为电池属性,即为扩散控制过程;如果b的值在0.5-1范围内,电极材料表现为电池和赝电容共同属性;如果b的值≥ 1,电极材料表现为赝电容属性,即为电容控制过程。通过Origin软件对公式(6)中的logIP和logν进行线性拟合即可得出b(斜率)的值。
此外,可以根据CV曲线围成的面积大小计算比电容。计算公式如下:

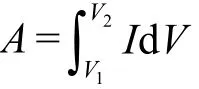
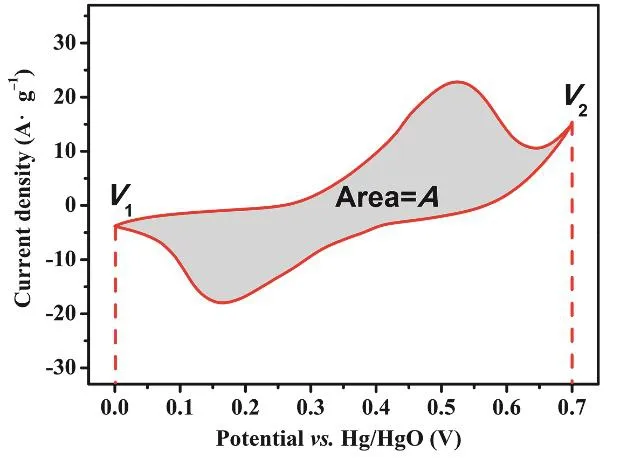
图2 循环伏安曲线
2.4 恒流充放电法(Galvanostatic charge and discharge,GCD) [7]
GCD法又叫计时电位法,在恒流条件下对被测电极进行充放电,记录电位随时间的变化曲线,进而研究电极的充放电性能。恒流充放电测试是评价超级电容器比容量最常用的方法之一。在实验中设定不同的电流密度,根据恒流放电曲线数据,可以计算出不同电流密度下的比电容。具体公式如下:

Cs,I,Δt,ΔV分别代表比电容(F·g-1),恒定的放电电流(A),放电时间(s)和放电电位窗口(V)。
3 实验部分
3.1 实验仪器
磁力搅拌器、分析天平、真空干燥箱、电化学工作站(上海辰华仪器有限公司,型号CHI660C)、X射线衍射仪(荷兰帕纳科,型号X’Pert PRO MPD)、扫描电子显微镜(英国蔡司,型号Zeiss Sigma 500),铂电极夹,饱和甘汞电极,铂电极。
3.2 实验试剂
氢氧化钾(KOH)、氨水(NH3·H2O)、硝酸镍(Ni(NO3)2·6H2O)、过硫酸钾(K2S2O8)、无水乙醇(C2H5OH),上述试剂均购自国药集团化学试剂有限公司,分析纯。碳布购自环宇电源股份有限公司。
4 实验步骤
4.1 碳布预处理
首先,将碳布浸泡在丙酮和乙醇的混合溶液中15 min除去表面附着的油污。干燥后,将碳布置于1 : 1硫酸溶液(H2SO4与H2O体积比)浸泡1 h。然后,用去离子水洗涤直至中性。最后,预处理的碳布在60 °C条件下真空干燥2 h。
4.2 Ni(OH)2薄膜的合成
称取7.27 g硝酸镍、1.35 g过硫酸钾,将其加入45 mL去离子水中,搅拌10 min。将预处理好的2 × 2 cm2的碳布放入上述溶液中,继续搅拌20 min,使溶液完全浸透碳布。随后,加入5 mL的氨水溶液,在不断搅拌条件下反应一定时间(设置为5、10、60 min)。反应结束后,用去离子水和无水乙醇将碳布洗净,在60 °C真空干燥箱中烘干2 h。
4.3 X射线衍射(XRD)
XRD利用X射线在晶体中的衍射现象获得衍射图谱,通过图谱信息确定材料的物相以及晶体结构。晶体都具有自身特有的化学组成和晶体结构,对X射线的衍射会产生各自特有的衍射花样。粉末衍射标准委员会收集了大量晶体的标准衍射数据,编制成X射线粉末衍射数据卡片(JCPDS卡片)。通过将测得物质粉末的衍射数据与标准JCPDS卡进行对照,可以得到被测物质的化学组成以及相关的各种晶体学数据。晶体物质的衍射面间距d和衍射线相对强度I/I1是晶体结构的特征反映。d与晶胞大小及形状有关,I/I1与晶胞中所含质点的种类、数目以及在晶胞中的位置有关。XRD测试样品的制备方法:取一定量的待测样品粉末放入特制玻璃片的槽内并刮平,然后将玻璃片放入仪器进行测试。实验测试时,使用铜靶作为辐射源,波长为0.15418 nm,扫描范围为5°-80°,扫描速率为5° min-1。
4.4 扫描电子显微镜(SEM)
SEM是观察样品微观形貌最直观的手段之一。利用电子束与被测样品表面的相互作用,它将产生的电子信息收集、转换得到反映样品表面形貌的SEM图。SEM测试样品的制备方法:首先取少量待测样品涂到导电胶带上,然后对样品进行喷金处理。
4.5 电容性能测试
电容测试采用三电极体系。工作电极(Working Electrode,WE)指被研究的电极。对电极(Counter Electrode,CE)与工作电极构成串联回路,通常使用铂或者碳电极作为对电极。参比电极(Reference Electrode,RE)是测量电极电势时用作参照的电极,常用的有饱和甘汞电极(SCE)等。在本实验中,生长有Ni(OH)2的碳布作为工作电极,饱和甘汞电极为参比电极,面积为2.5 × 2.5 cm2的铂片为对电极,电解液为6 mol·L-1KOH溶液。采用上海辰华CHI 660E电化学工作站在室温条件下进行CV和GCD曲线测试。
4.5.1 CV法
打开工作站控制界面,选择Cyclic Voltammetry,输入参数:低电位-0.2 V;高电位0.6 V;起始电位可以是-0.2 - 0.6 V之间任意值,一般选择-0.2 V;其他参数可以使用默认值。以30 mV·s-1的扫描速度在电位-0.2 - 0.60 V区间循环扫描,记录循环伏安曲线,观察峰电位和峰电流,判断电极活性。利用公式(7)计算比电容值。
在保证电极具有足够的活性情况下,改变扫描速度分别为5、10、15、20、30 mV·s-1,得到电位区间-0.2 - 0.60 V内的CV图,记录各扫描速率下IPa和IPc。根据公式(6)进行拟合,计算b值,判断电极储能机理。
叠加各扫描速度下的CV曲线,观察扫描速度对电极反应(峰电流和峰电位)的影响,根据所得数据判断电极反应的可逆性。
4.5.2 GCD法
打开工作站控制界面,选择计时电位法(Chronopotentiometry),输入参数:阳极电流和阴极电流相同,可设置为2、4、10、20、40 mA;最低电位0 V;最高电位0.5 V;段数7;其他参数可以使用默认值,记录直流充放电曲线,按公式(8)计算比电容。
5 实验结果与讨论
5.1 XRD分析
测定氢氧化镍薄膜的XRD图谱,如图3所示。与标准卡片(JCPDS No. 22-0444)进行对照,发现所得氢氧化镍为α-Ni(OH)2,其中,位于12.5°,33.5°,59.7°的衍射峰分别归属于α-Ni(OH)2的(001),(110)和(300)晶面。而25.8°和43.5°这两个衍射峰是碳材料的特征峰,属于碳布基底。
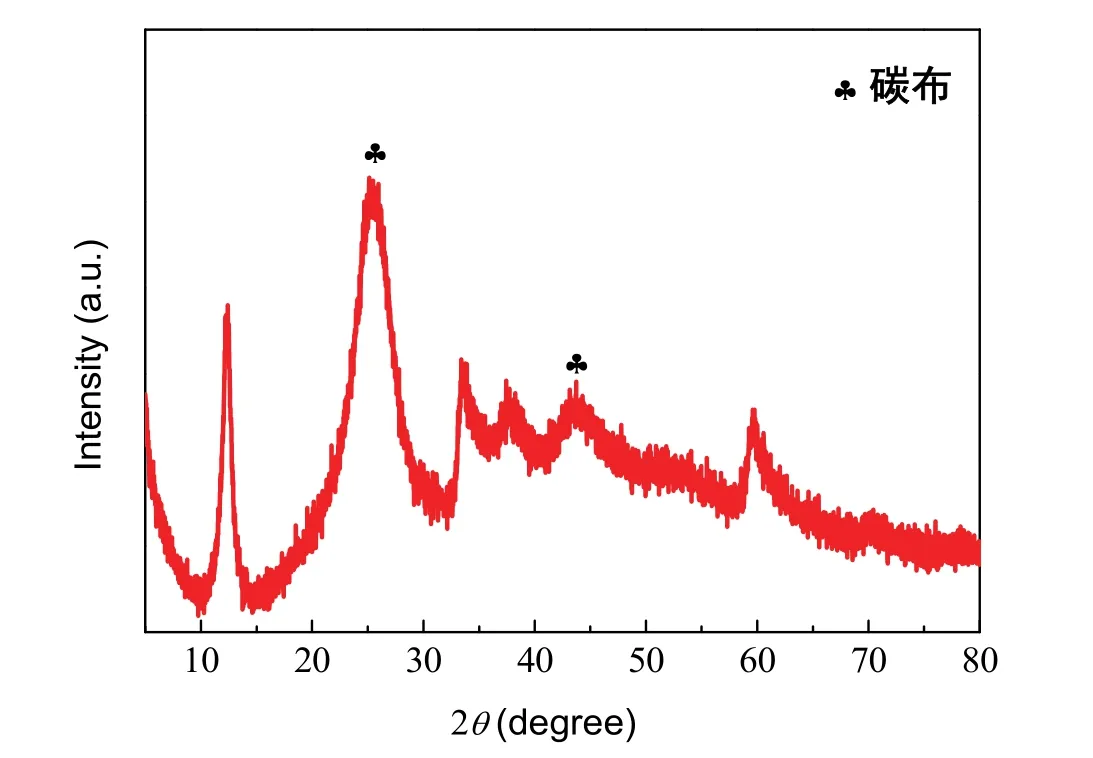
图3 样品的XRD图谱
5.2 形貌分析
为探讨沉积时间对Ni(OH)2薄膜形貌的影响,将样品在扫描电镜下观察,得到不同放大倍数的SEM图。图4为沉积时间5、10、60 min条件下制备的样品的SEM图。对比低倍SEM图(a,b,c),可以发现当沉积时间为5 min和10 min时,大部分Ni(OH)2均匀覆盖在碳纤维表面。但随着沉积时间的延长,Ni(OH)2发生了严重的堆积。从高倍SEM图中(d,e,f),可以清晰地观察到Ni(OH)2的微观结构。不同沉积时间下制备的Ni(OH)2均呈现纳米片状,且这些纳米片相互连接构成多孔结构。当沉积时间为5 min时,生成的纳米片细小且排列致密。当沉积时间为10 min时,纳米片逐渐长大、均匀分布在碳纤维表面,形成大量中孔结构。适宜的中孔结构能够为离子的快速传输提供大量通道,有利于氧化还原反应的充分进行。但当沉积时间延长至60 min时,纳米片发生聚集、形成大量的花状团簇堆积在薄膜上,这将阻碍电解质离子渗透到材料内部,从而导致材料的有效比表面积下降。

图4 不同沉积时间条件下制备样品的SEM图
5.3 电容性能分析
5.3.1 CV分析
在不同的扫描速度下测试样品的CV曲线,分析电极的可逆性、比电容和储能机理。如图5(a)所示,在30 mV·s-1的扫描速度下,碳布基底的CV曲线是平坦的,说明它对总电容的贡献可以忽略不计。对于沉积时间为10 min得到的样品,在它的CV曲线中可以观察到一对氧化还原峰,峰的位置为0. 36 V和0.12 V,对应于Ni2+/Ni3+的可逆法拉第氧化还原反应:

随着扫描速度的增加,氧化峰和还原峰分别向正方向和负方向移动,说明电极材料的不可逆性,这是由于电极材料的极化引起的。根据峰电流与扫描速度的关系曲线(图5(b)),拟合得到阳极峰和阴极峰的b值分别为0.57和0.50,说明氢氧化镍的电极反应以扩散过程为控制步骤。利用CV技术进一步分析不同沉积时间下所得样品的电容性质。如图5(c)所示,沉积时间为10 min时所得样品的CV曲线具有最大的面积,表明其比电容最大。根据公式(7)对CV的面积进行积分,进一步计算其比电容。在30 mV·s-1扫描速度下,三种不同沉积时间(5,10,60 min)下所得样品的比电容分别是543,584和401 F·g-1。
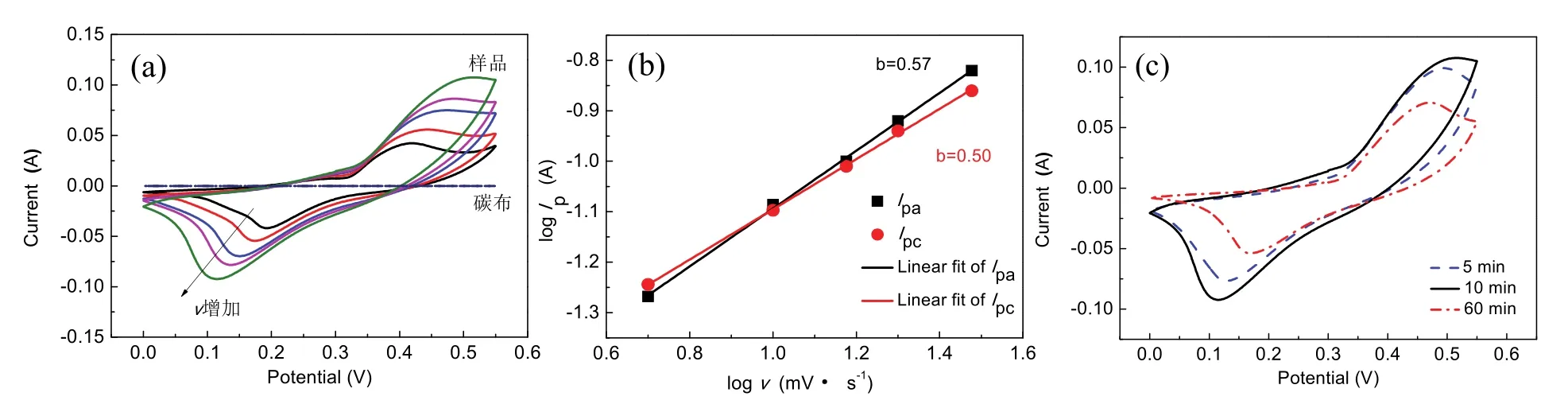
图5 (a)沉积时间10 min制得的样品在不同扫描速度下以及碳布在5 mV·s-1的CV曲线,(b)沉积时间10 min所得样品峰电流与扫描速度之间的关系曲线,(c)不同沉积时间下制备的三种样品在30 mV·s-1扫描速度下的CV曲线
5.3.2 GCD分析
将沉积时间为10 min条件下制备的样品在电流密度为1、2、5、10、20 A·g-1的恒电流下进行充放电测试,得到的GCD曲线如图6(a)所示。曲线在0.35 V处明显的电压平台证明了法拉第氧化还原行为。随着电流密度的增加,由于电解质中的OH-受扩散时间的限制,只有电极外部的材料参与氧化还原反应,所以放电时间逐渐变短。根据公式(8)计算样品在不同电流密度下的比电容。当电流密度从1 A·g-1增加到20 A·g-1时,样品的比电容分别为1268,1145,981,810,606 F·g-1。测试不同沉积时间下所得样品的GCD曲线,比较其比电容大小。如图6(b)所示,当沉积时间为10 min时,所得电极拥有最长的放电时间,表明其比电容最大。具体的比电容数值可根据公式(8)计算,三种沉积时间(5,10,60 min)下所得样品在1 A·g-1下的比电容分别为1200、1268、931 F·g-1,在20 A·g-1下的比电容分别为560、606、403 F·g-1。对比发现,沉积时间为10 min时制备的样品在各个电流密度下拥有最大的比电容。这归因于该样品均匀的中孔结构,它不仅能提供较多的活性位点,还能为离子的快速传输提供有效的通道。
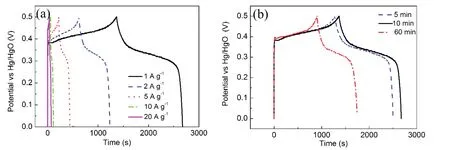
图6 (a)沉积时间为10 min时制得的样品在不同电流密度下的直流充放电曲线;(b)不同沉积时间下制备的样品在1 A·g-1电流密度下的直流充放电曲线
6 思考题
1)在Ni(OH)2制备中,氨水量对反应物的结构将会有什么影响?
2)过硫酸钾在合成氢氧化镍过程中的作用?
3)氢氧化镍的储能机理是什么?它与双电层电容材料的电化学性质有何区别?
7 结语
本文结合电化学和化学平衡基础知识,设计了一个综合化学实验。该实验可分为两个模块进行,一个为碳布负载氢氧化镍薄膜电极的制备和结构表征,另一个为电化学测试与分析,对电极材料的电容性能和储能机理进行评价。两个模块可分别独立进行,在实验过程中也可以启发学生设计平行实验,以考查不同反应参数对材料性质的影响规律。这一实验体系设计完备,能够有效地引导学生掌握“材料的制备-结构表征-性能研究”的系统性科学研究方法,培养学生的综合化学应用能力。

