“元素化学实验”中的热致变色现象(二)
——部分Cr(III)化合物的热致变色现象及其变色机理探讨
阮婵姿,许振玲,潘蕊,张春艳,吕银云,翁玉华,董志强,任艳平
厦门大学化学化工学院,化学国家级实验教学示范中心(厦门大学),福建 厦门 361005
前文[1]介绍了常见Co(II)化合物的热致变色现象及其影响因素以及热致变色机理探讨的有关内容。Cr3+有3个成单的d电子,吸收部分可见光可以发生d-d跃迁,所以Cr(III)化合物都显有颜色。那么,常见Cr(III)化合物是否具有热致变色现象?其热致变色的机理又是什么?在学生完成有关元素化学实验的基础上,我们继续通过简单的试管演示实验一起认识常见Cr(III)化合物的热致变色现象,分析和探讨其热致变色机理。通过演示实验创设“问题情境”,以实例引导学生学习和掌握科学研究的思维方法,如面对新问题,如何提出自己的设想,怎样设计实验方案验证自己的设想;又如何根据实验现象推断出结论,以肯定或否定自己的设想。培养学生“于无疑处生疑、于是疑处质疑”的能力。
常见Cr(III)的固体化合物有CrCl3·6H2O,KCr(SO4)2·12H2O和Cr(NO3)3·6H2O等。这些化合物的溶液是否具有热致变色现象?首先我们一起通过演示实验认识CrCl3·6H2O溶液颜色变化及其热致变色情况。
1 CrCl3 ·6 H2 O固体现配溶液颜色变化、热致变色现象及其影响因素
文献[2]报道CrCl3·6H2O固体中Cr(III)以[Cr(H2O)4Cl2]Cl·2H2O型体存在,而其溶液中Cr(III)以何种型体存在呢?从图1可以看出,用CrCl3·6H2O固体现配的0.05 mol·L-1CrCl3溶液A1是绿色的,可见吸收光谱测定结果表明,其绿色溶液A1中Cr(III)主要以[Cr(H2O)4Cl2]+型体存在,这与文献[2,3]报道结果一致。从图1也可以看出,[Cr(H2O)4Cl2]+绿色溶液A1不稳定,即[Cr(H2O)4Cl2]+中的Cl-会被溶液中的H2O慢慢取代而生成绿色[Cr(H2O)5Cl]2+和蓝色[Cr(H2O)6]3+(溶液颜色如C1)混合物而使溶液B1显现墨绿色(绿色和蓝色的混合色)。可见吸收光谱实验结果证实,[Cr(H2O)4Cl2]+绿色溶液A1在室温下放置7天后就会完全变成[Cr(H2O)6]3+蓝色溶液C1(放置18小时溶液B1的颜色与放置7天以上时间溶液C1颜色的对比)。将蓝色溶液C1加热,溶液颜色很快变为墨绿色B1至绿色A1。总的来说,[Cr(H2O)6]3+蓝色溶液C1具有热致变色现象,但其热致变色的可逆性较差。

图1 CrCl3·6H2O固体现配溶液的颜色变化及其热致变色实验流程
加热有利于水合离子[Cr(H2O)6]3+中的配位H2O被Cl-取代,即式(1)中平衡向右移动,形成[Cr(H2O)5Cl]2+或[Cr(H2O)4Cl2]+而使体系显现绿色[2,3]。在含有适量Cl-的[Cr(H2O)6]3+体系中,由于加热更有利于形成[Cr(H2O)5Cl]2+或[Cr(H2O)4Cl2]+,抑制了Cr(III)的水解,所以,体系中没有形成羟基桥联多核Cr(III)配合物[2]。

图1中,用CrCl3·6H2O固体现配的溶液颜色变化及其热致变色机理启发大家一起思考:如果要保持CrCl3·6H2O固体现配的绿色溶液A1颜色不变,即如何阻止其溶液中H2O渐渐取代[Cr(H2O)4Cl2]+中的Cl-而形成[Cr(H2O)6]3+蓝色溶液C1?从式(1)可以看出,除加热保温以保持该平衡向右移动而保持绿色溶液A1颜色不变外,提高Cl-浓度也可以促使该平衡向右移动,如图1所示,在[Cr(H2O)4Cl2]+绿色溶液A1中加入适量6 mol·L-1HCl,既提高了Cl-浓度,同时也抑制了Cr(III)的水解。所以,绿色[Cr(H2O)4Cl2]+溶液D1放置12天后变为绿色溶液E1,可见吸收光谱测定结果表明,绿色溶液E1中Cr(III)主要以[Cr(H2O)5Cl]+型体存在。上述实验结果表明,要保持[Cr(H2O)4Cl2]+稳定,还要提高Cl-浓度以阻止溶液中H2O进一步取代[Cr(H2O)4Cl2]+中的Cl-而依次形成[Cr(H2O)5Cl]+和[Cr(H2O)6]3+。
2 KCr(SO4 )2 ·12 H2 O溶液的热致变色现象及其影响因素
KCr(SO4)2·12H2O固体现配溶液颜色变化及其热致变色现象与CrCl3·6H2O固体现配溶液颜色变化及热致变色现象是否一样?再来观察图2所示的演示实验过程,并透过颜色变化来分析和探讨其变色机理。
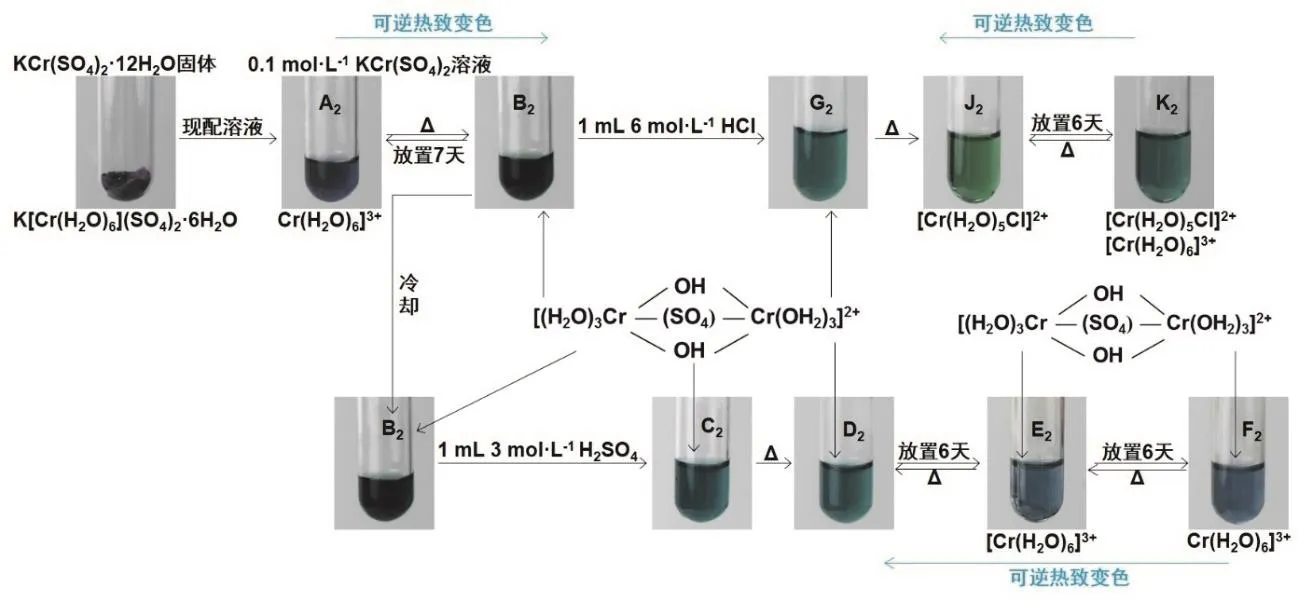
图2 KCr(SO4)2·12H2O溶液的热致变色实验流程
比较图1和图2,与图1中CrCl3·6H2O固体现配溶液不同的是,图2中,用KCr(SO4)2·12H2O固体现配的溶液A2是蓝色的。可见吸收光谱实验结果证明蓝色溶液A2中Cr(III)完全以[Cr(H2O)6]3+型体稳定存在,这与文献[2]报道的“KCr(SO4)2·12H2O固体中Cr(III)以K[Cr(H2O)6](SO4)2·6H2O型体存在,由KCr(SO4)2·12H2O配制的溶液中Cr(III)以[Cr(H2O)6]3+型体存在”说法一致。
图2中蓝色溶液A2是否具有热致变色现象?如图2所示的演示实验过程,将[Cr(H2O)6]3+蓝色溶液A2加热后变为墨绿色溶液B2,当将墨绿色溶液B2冷却,即室温放置一段时间后又变回蓝色溶液A2,说明Cr(III)以[Cr(H2O)6]3+型体存在的K[Cr(H2O)6](SO4)2·6H2O溶液具有可逆热致变色现象。这一实验现象着实使不少学生感到意外和好奇,不禁发问,这墨绿色溶液B2中Cr(III)以何种型体存在?
从图1可以看到,新配制的CrCl3溶液中Cr(III)以[Cr(H2O)5Cl]2+或[Cr(H2O)4Cl2]+型体存在而显绿色,即含有Cl-的[Cr(H2O)6]3+体系能够发生热致变色现象,是由于该体系中形成了[Cr(H2O)5Cl]2+或[Cr(H2O)4Cl2]+而显绿色。而图2中,Cr(III)完全以[Cr(H2O)6]3+型体存在的K[Cr(H2O)6](SO4)2·6H2O溶液中没有Cl-,为什么[Cr(H2O)6]3+蓝色溶液A2在加热条件下会变为墨绿色溶液B2?
文献[2]报道在加热条件下,在Cr(III)完全以[Cr(H2O)6]3+型体存在的K[Cr(H2O)6](SO4)2·6H2O溶液中存在着如式(2),式(3)和式(4)所示的一系列平衡反应,即加热促进了[Cr(H2O)6]3+的水解反应发生,并形成一系列羟基水合Cr(III)配离子[Cr(OH)(H2O)5]2+或[Cr(OH)2(H2O)4]+等,同时也促使了SO42-进入[Cr(H2O)6]3+内界取代部分H2O与Cr(III)直接键合配位形成系列绿色的六水合-μ-硫酸根-二羟基铬(III)离子、四水合硫酸根-μ-硫酸根-二羟基铬(III)离子等[2]。
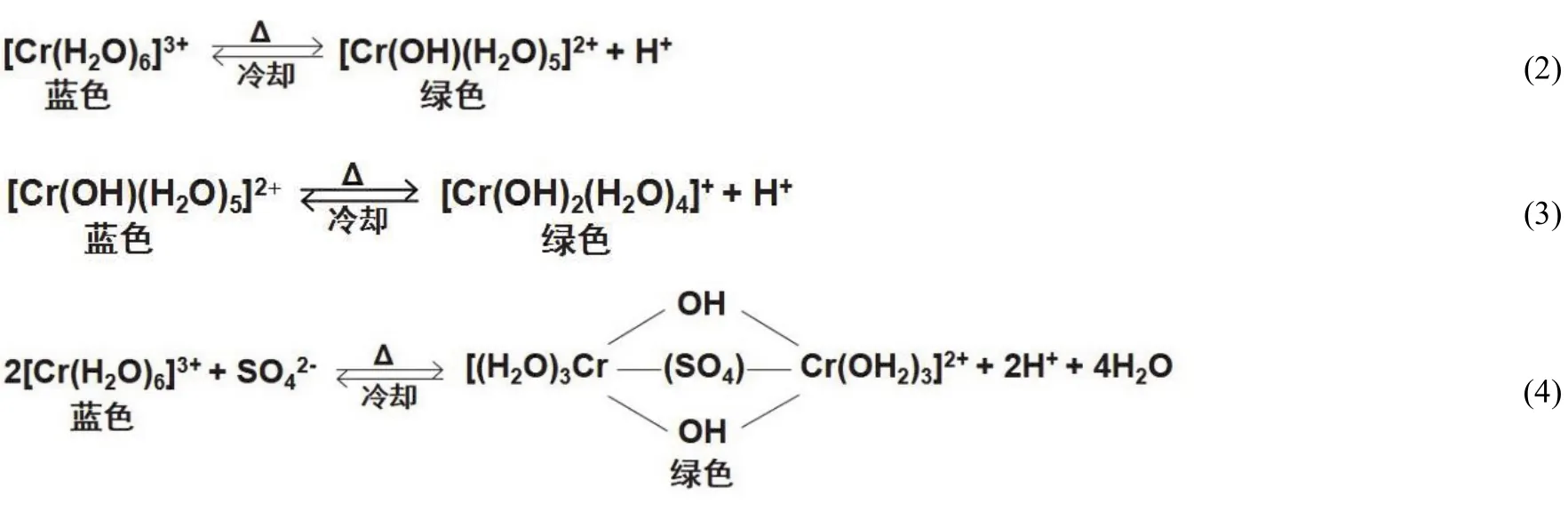
图2所示的K[Cr(H2O)6](SO4)2·6H2O溶液具有热致变色现象,很显然是由于作 为配位体进入[Cr(H2O)6]3+内界取代部分H2O与Cr(III)直接键合配位形成羟基、硫酸根合铬(III)双核配离子而呈现绿色。当加热时,上述反应式(2),式(3)和式(4)中的平衡向右进行的速度较快,绿色(B2)出现快;而其逆向反应进行较慢,需要放置一段时间,绿色溶液B2才能完全变为蓝色溶液A2[2]。
对于K[Cr(H2O)6](SO4)2·6H2O溶液的热致变色性质讨论至此,学生还有疑问,如何证明进入[Cr(H2O)6]3+内界参与了Cr(III)的配位形成了如反应平衡(4)所示的桥联双核Cr(III)配合物?消除学生质疑的最好方法不是争辩,还是通过实验事实来说明。
如果K[Cr(H2O)6](SO4)2·6H2O溶液的热致变色机理如上所述,那么,将加热得到的绿色溶液B2冷却后,加入1 mL 3 mol·L-1H2SO4,对式(4)平衡来说,同时增大H+和浓度,由于H+和相向作用,所以对平衡没有影响,溶液颜色由深(B2)变浅(C2)是由于加H2SO4稀释所致,可见吸收光谱测定结果表明,加适量H2SO4前(B2)后(C2)以及加H2SO4后再加热的体系(D2)所存在的物种是一样的。如图2所示,加入H2SO4后并加热的溶液D2室温放置6天后变成蓝色溶液E2,再继续放置6天后溶液F2颜色与溶液E2颜色基本相同,说明溶液E2与溶液F2中所存在的主要物种基本相同。实际上,图2中,在绿色溶液B2中加入H2SO4的实验结果只能说明进入[Cr(H2O)6]3+内界参与了Cr(III)的配位,但至于是否生成文献[2]报道的式(4)中所示结构的绿色配合物,目前的演示实验结果还难以证实,启发学生进一步分析、研究。
如果在图2中的墨绿色溶液B2中加入1 mL 6 mol·L-1HCl (得溶液G2)并加热得到绿色溶液J2,即溶液中HCl离解的H+促使式(4)平衡向左移动的同时,Cl-取代[Cr(H2O)6]3+中H2O配位而使溶液J2显绿色,可见吸收光谱实验结果证明绿色溶液J2中Cr(III)主要以[Cr(H2O)5Cl]2+型体存在。[Cr(H2O)5Cl]2+绿色溶液J2热致变色现象与图1所示的热致变色现象一致。上述实验结果进一步说明了K[Cr(H2O)6](SO4)2·6H2O溶液与CrCl3·6H2O溶液的热致变色机理不同。
3 Cr(NO3 )3 ·6 H2 O溶液的热致变色现象及其影响因素
文献[2]报道Cr(NO3)3·6H2O固体中的Cr(III)以[Cr(H2O)6](NO3)3型体存在,[Cr(H2O)6](NO3)3溶液是否具有热致变色现象?继续观察图3所示的演示实验结果。
从图3可以看出,[Cr(H2O)6](NO3)3溶液A3的热致变色现象与K[Cr(H2O)6](SO4)2·6H2O溶液A2的热致变色现象非常相似。那么,它们的热致变色机理是否一样?
在探讨[Cr(H2O)6](NO3)3溶液A3的热致变色机理前,我们先来从理论上分析若在图3的绿色溶液B3中加入1 mL 2 mol·L-1HNO3后的两种可能情况,即:1)如果热致变色只是由于加热促使该体系中[Cr(H2O)6]3+水解而形成羟基桥联多核Cr(III)配合物,在热致变色溶液B3中加入1 mL 2 mol·L-1HNO3,溶液中HNO3离解出的H+抑制水解反应的进行,B3溶液颜色应由绿色变为蓝色(C3);2)如果热致变色是由于加热促使该体系中[Cr(H2O)6]3+水解以及参与配位而形成羟基、桥联的多核Cr(III)配合物而显绿色,那么,加入1 mL 2 mol·L-1HNO3,如同H+和对式(4)所示反应平衡的影响一样,由于H+和相向作用对热致变色平衡没有影响,溶液仍显绿色。实验事实会怎样呢?继续观察演示实验,我们发现图3所示的演示实验结果与上述1)的分析结果相吻合,说明[Cr(H2O)6](NO3)3溶液的热致变色性质与无关,这与文献[4]报道的“配位能力弱,形成桥联的多核Cr(III)配合物的几率不到1%”说法一致。
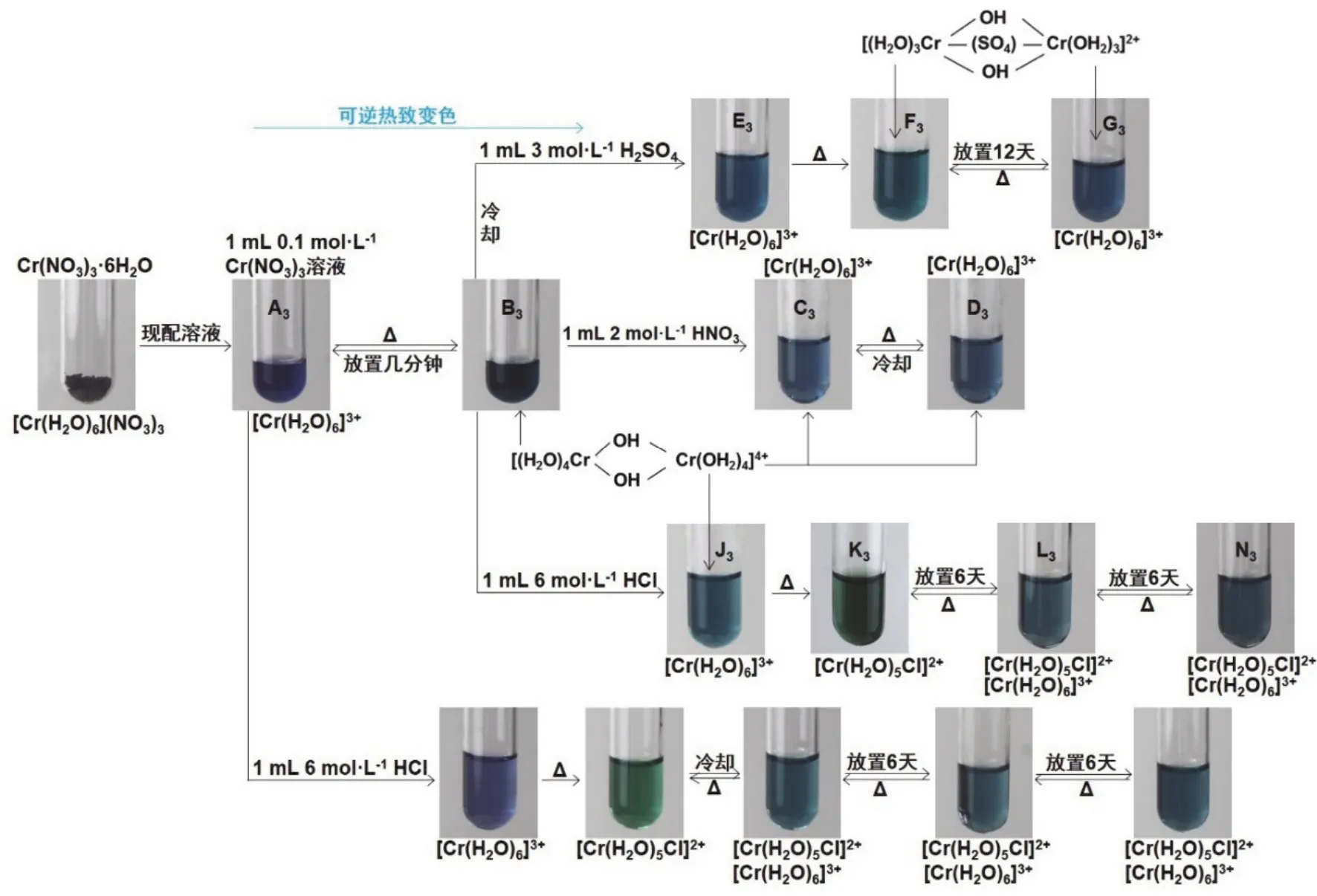
图3 Cr(NO3)3·6H2O溶液的热致变色实验流程
如图3所示,在[Cr(H2O)6](NO3)3溶液A3热致变绿的溶液B3中加入1 mL 3 mol·L-1H2SO4冷却后,溶液颜色由绿色(B3)变为蓝色(E3) (与加入1 mL 2 mol·L-1HNO3的情况一样),加热蓝色溶液E3后变为绿色溶液F3,可见吸收光谱实验测定结果表明,绿色溶液F3中Cr(III)存在的型体与[Cr(H2O)6](NO3)3溶液A3热致变绿色溶液B3中Cr(III)存在的型体不同(图3),这些实验事实进一步说明了[Cr(H2O)6](NO3)3溶液与K[Cr(H2O)6](SO4)2·6H2O溶液的热致变色现象相同,而其热致变色机理不完全相同。根据上述实验结果比较分析,[Cr(H2O)6](NO3)3溶液的热致变色现象与式(5)平衡有关,即
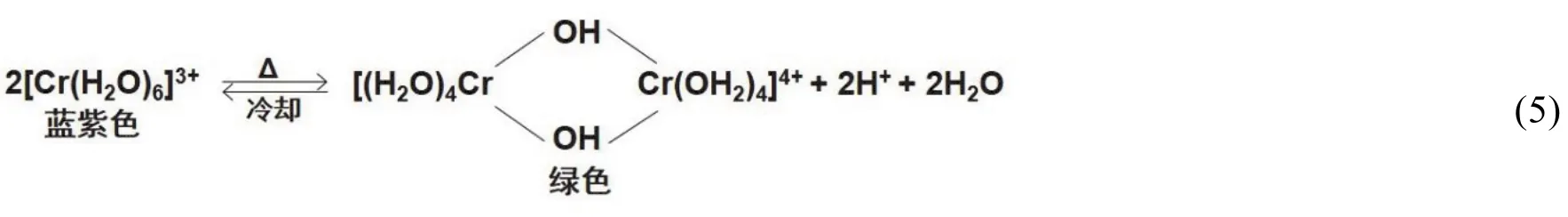
综上所述,[Cr(H2O)6](NO3)3溶液具有热致变色性质,是由于加热导致其溶液中[Cr(H2O)6]3+水解而形成羟基桥联多核Cr(III)配合物,这与文献[5]报道[Cr(H2O)6]3+水解得到的羟合离子以及羟桥聚合离子呈现不同程度的绿色相吻合。
从图3所示的演示实验结果也可以看出,无论是在[Cr(H2O)6](NO3)3蓝色溶液A3还是在其热致变墨绿色溶液B3中加入1 mL 6 mol·L-1HCl,都不同程度地抑制了[Cr(H2O)6]3+的水解,如G3溶液中Cr(III)主要以[Cr(H2O)6]3+型体存在,而G3溶液显绿色是因为体系中还存在一定量的如式(5)所示平衡的墨绿色Cr(III)羟桥聚合离子以及所加1 mL 6 mol·L-1HCl稀释而致。上述所加1 mL 6 mol·L-1HCl体系其热致变色现象与CrCl3·6H2O溶液的热致变色情况基本相同。进一步说明了Cl-对[Cr(H2O)6]3+溶液热致变色性质的影响。
比较图1,图2和图3,可以看出,不管是[Cr(H2O)6](NO3)3溶液还是K[Cr(H2O)6](SO4)2·6H2O溶液,加入适量盐酸后,其体系的热致变色情况与CrCl3·6H2O溶液的热致变色情况基本一致。
图1-3的演示实验结果及其对应反应平衡式(1),式(2)和式(5)告诉我们,[Cr(H2O)6]3+溶液的热致变色机理与其体系中所存在的阴离子(Cl-,,NO3-)种类和浓度有关。
为便于读者有效了解上述图1,图2和图3中各溶液的颜色及其对应可见吸收光谱情况,笔者把文中图1,图2和图3中各溶液对应的可见吸收光谱图以二维码形式给出(图1),方便读者通过手机扫码查看。同时,也为了让读者有效了解用K[Cr(H2O)6](SO4)2·6H2O固体现配溶液加热后体系中Cr(III)主要存在型体及其对应颜色,笔者也将用Cr2(SO4)3·6H2O固体现配溶液的可见吸收光谱图一并列入上述二维码的后台文件中。
4 Cr-EDTA配合物溶液的热致变色情况
进一步分析上述实验结果,能够发生热致变色现象的体系都是因为加热使化学平衡发生移动而形成新的物种而呈现不同的颜色。浓度、温度只有对配位能力相当的配体,如H2O,Cl-,SCN-等小分子配体形成的配合物的配位化学平衡体系有影响。由此可以想象,相比于小分子配体Cr(III)的配合物,配位数为6的Cr-EDTA配合物溶液是不会发生热致变色作用的,如图4所示演示实验流程。
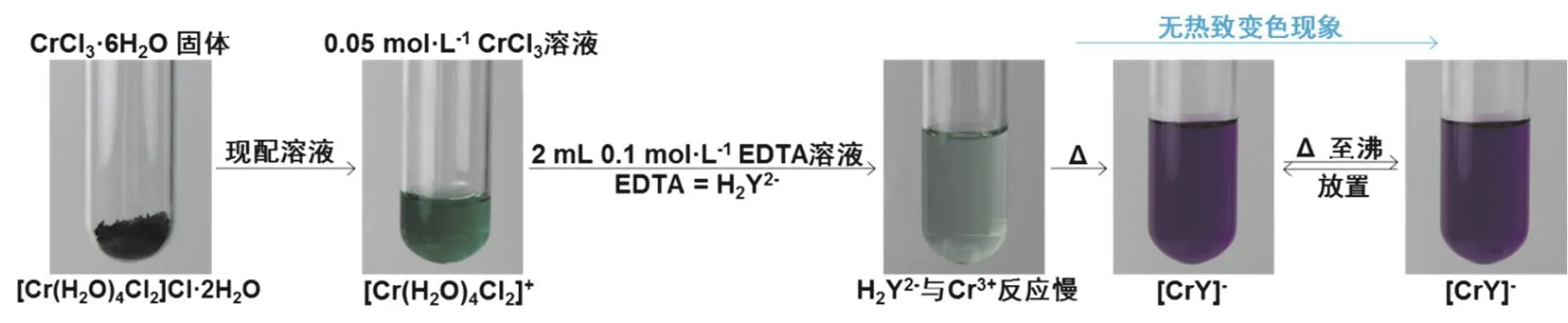
图4 Cr-EDTA溶液的热致变色情况
由于Cr-EDTA配合物具有螯合网状结构很稳定,并且由于空间位阻作用,所以,即使加热,H2O等小分子配体既“撼动”不了EDTA的配位作用,也难于取代EDTA与Cr(III)的配位,也不能“见缝插针”参与Cr-EDTA中Cr(III)的配位。所以,不能形成组成不同、配位数不同或结构不同的Cr(III)配合物而变色。也就是说,从热力学角度,配合物结构相对不稳定或亚稳定的体系,可能发生热致变色现象;从动力学的角度,能够快速发生配体交换反应的体系,可能发生热致变色现象。
除了上述常见Cr(III)化合物具有热致变色现象外,一些Cu(II)化合物和配合物等也具有热致变色特性。鉴于本文篇幅所限,有关Cu(II)化合物和配合物等的热致变色实验实施结果与讨论内容见后续报道。
5 结语
在学生完成元素化学实验的基础上,进一步通过上述简单的试管演示实验和以问题为导向的师生相互讨论,引导学生直观认识了一些Cr(III)化合物的热致变色性质及其热致变色机理。进一步培养学生学会用理论知识解释实验现象的能力和用所学理论知识指导实验的能力。

