饲料添加怀山药对鲤生长、肠屏障及肠道菌群的影响
李 衡 曹 慧 杨国坤,2 常绪路,2 张艳敏,2 张建新,2 胡文攀 朱振祥 李克克 孟晓林,2*
(1.河南师范大学水产学院,新乡453007;2.河南省水产动物养殖工程技术研究中心,新乡453007;3.河南金百合生物科技股份有限公司,安阳456150)
随着科技的进步,高密度、集约化养殖模式在提升经济效益的同时,也引发了抗生素滥用及鱼病频发等诸多问题[1]。虽然药物在预防和治疗水生动物疾病方面具有显著效果,但长期或过量使用会破坏机体免疫力,增强病原菌耐药性,增加机体药物残留[2]。2020年7月1日,中华人民共和国农业农村部第149号令已明确禁止在饲料中添加抗生素。因此,寻找抗生素替代物已成为大家关注的焦点。
中草药富含蛋白质、多糖、生物碱、氨基酸、皂苷、维生素、有机酸等多种生物活性物质,具有纯天然、毒副作用小和药食同源的优点,可发挥增强免疫力、促进生长、抑菌杀菌、保肝利胆等作用。在现代鱼类养殖中,中草药已作为替代抗生素的新型饲料添加剂被广泛使用[3]。“怀山药”产自河南焦作,又名薯蓣(DioscoreaoppositeThunb.),为薯蓣科(Dioscoreaceae)薯蓣属(Dioscorea)植物。目前,山药在畜禽动物中的应用研究已十分广泛,如在断奶仔猪、肉鸡等动物上的研究发现,山药籽实具有提高采食量、降低饲料系数、提高机体免疫力的功效[4-5]。在水产动物上的研究表明,山药饲喂黄河鲤可显著提高其肌肉中必需氨基酸的含量,以及血清中白蛋白和球蛋白含量[6]。此外,山药可重构小鼠肠道菌群组成,增加短链脂肪酸的含量,保护肠道屏障[7]。
鲤(CyprinuscarpioL.)是我国重要的淡水经济养殖鱼类,根据《2020中国渔业统计年鉴》报道,我国鲤养殖量在2019年达288.53万t,占全国淡水养殖产量的9.57%[8],但目前怀山药在鲤免疫及肠道微生态方面的研究还鲜有报道。因此,本研究旨在探究怀山药籽实作为饲料添加剂对鲤免疫及肠道菌群的调控机理,以初步明确其作为添加剂在水产养殖中应用的可行性,为山药在水产领域的开发与应用提供参考。
1 材料与方法
1.1 试验设计及试验饲料
试验用鲤购自新乡市延津县渔场,暂养于河南师范大学水产养殖基地。以商品饲粮(购自河南某农牧科技有限公司)暂养2周,选择健康状况良好的180尾鲤[(75.25±1.45) g],随机分为3组,每组3个重复。试验进行8周,每天08:30、11:30、14:30、17:30投喂4次,记录食物摄入和死亡数量,每2周调整1次投饲量。水质控制指标:溶解氧含量>6 mg/L,氨态氮含量<0.01 mg/L,水温(25±1) ℃,光照周期12L∶12D。
试验用怀山药籽实产自河南省武陟县,经超微粉碎过60目筛,60 ℃烘干制成怀山药粉。采用单因素试验设计,分别在基础饲粮中添加0(对照组)、1%(LCY组)和2%(HCY组)的怀山药粉。其他饲粮原材料粉碎过筛(60目),按配方比重混匀,用饲料颗粒机制成粒径2.5 mm的颗粒饲料,晾干后于-20 ℃保存备用。基础饲粮组成及营养水平见表1。
1.2 生长性能指标测定
每天记录试验鱼的死亡率及投喂量,计算增重率(WGR)、特定生长率(SGR)、饲料系数(FCR)。
增重率(%)=100×(末体重-初体重)/初体重;
特定生长率(%/d)=100×(ln末体重-
ln初体重)/饲喂天数;
饲料系数=每个重复饲料总消耗量/
(末体重+死亡鱼重-初体重)。
表1 基础饲粮组成及营养水平(风干基础)

Table 1 Composition and nutrient levels of the basal diet (air-dry basis) %
1.3 肠道酶活性测定
每桶随机取3尾鱼,每组9尾,冰上分离出全肠于2 mL无菌无酶离心管中,液氮速冻后-80 ℃超低温冰箱保存。样品匀浆后,测定丙二醛(MDA)含量及超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和溶菌酶(LZM)活性,试剂盒均购自南京建成生物工程研究所。
1.4 中肠组织形态学观察
每桶随机取3尾鱼,每尾分离出2份中肠组织样品。磷酸盐缓冲液(PBS)冲洗后,一份使用10%福尔马林溶液固定,用于苏木精-伊红(HE)染色。另一份样品用2.5%戊二醛溶液固定,用于扫描电子显微镜观察。
HE染色:固定后的中肠组织样品,梯度乙醇脱水24 h后,用石蜡包埋切片机将蜡块切成4 μm厚,染色后在光学显微镜下分别放大100、200和400倍,观察肠道肌层厚度和肠绒毛高度。
扫描电子显微镜:将固定好的样品在30%、50%、70%、80%、90%和100%的梯度乙醇中脱水15 min。随后在叔丁醇中浸泡15 min,4 ℃下冷冻。在扫描电子显微镜(JEOL,日本)下观察。
1.5 基因相对表达量测定
每桶随机取3尾鱼,每组9尾,分离中肠组织于1.5 mL无菌无酶离心管中,放入液氮速冻后-80 ℃超低温冰箱保存。样品提取RNA后使用TaKaRa PrimeScript RT reagent Kit (TaKaRa,大连)试剂盒进行反转录。以cDNA作为模板,18S rRNA基因作为内参。荧光定量PCR反应体系:5 μL SYBR®Premix Ex TaqTM(TaKaRa,大连),0.3 μL正向引物(10 μmol/L),0.3 μL反向引物(10 μmol/L),1.0 μL cDNA模板,3.4 μL无菌水。扩增程序为:95 ℃ 30 s; 95 ℃ 5 s,60 ℃ 20 s,共40个循环,每样品设3个平行(RocheLightCycler®480,瑞士)。荧光定量PCR引物由上海生物工程股份有限公司合成,引物序列见表2,基因的相对表达量采用2-ΔΔCt法计算。

表2 实时荧光定量PCR引物序列
1.6 肠道菌群测序分析
每桶选取12尾鱼,酒精棉擦拭鱼体表,在超净工作台下用灭菌的剪刀从鲤泻泄殖孔处剪开,将取出的肠道用一次性培养皿盛放。用PBS洗外肠道,镊子夹除肠系膜、脂肪等物质后,用无菌钳轻轻挤压中肠,小心地取肠内容物,2个样品混合为1个样品,共6个样品,于液氮中速冻,-80 ℃保存备用。肠内容物一部分用于微生物基因组DNA提取,另一部分用于肠内容物短链脂肪酸含量测定。使用基因组DNA提取试剂盒(QIAamp,德国)提取肠内容物样品基因组DNA。使用NanoDrop 2000测量DNA浓度,并通过琼脂糖电泳检测DNA完整性。所得合格的总DNA样品用于16S rRNA的高通量测序。用条形码引物V338F (5’-ACTCCTACGGGAGAGGCAGCA-3’)和V806R (5’-ATGCAGGGACTACHVGGGTWTCTAAT-3’)扩增16S rRNA基因的V3~V4区。从1%琼脂糖凝胶中提取扩增子,通过AxyPrep DNA凝胶提取试剂盒(Axygen, 美国)纯化,并根据制造商的规程使用QuantiFluorTM-ST(Promega, 美国)进行定量。将纯化的扩增子通过Illumina Miseq PE 300进行配对末端测序。
使用FLASH(Version 1.2.11)对测序得到的PE reads进行组装,并使用QIIME(V.1.9.1)进行分析。通过使用与UPARSE(Version 7.1,http://drive5.com/uparse/)的97%相似性截止值,对可操作分类单元(OTU)进行了聚类,并使用UCHIME鉴定并去除了嵌合序列。通过RDP分类器算法(http://rdp.cme.msu.edu/)针对Silva(SSU123)16S rRNA数据库,按照70%的置信度阈值分析每个16S rRNA基因序列的分类。根据物种注释,标记每个样本中对应于每个分类级别的序列数。基于OTU,进行了Shannon、Simpson等多样性指数的分析,比较各组间肠道微生物的多样性和丰富度,统计样品的α多样性。
1.7 肠内容物短链脂肪酸含量测定
称取1.6中所取的新鲜肠道内容物样品2 g,以1.0∶2.5(w/v)的比例添加超纯水并混合研磨2 min,12 000 r/min离心30 min。将上清液移入新的2 mL离心管,调上清pH至2~3,0.45 μm过滤制得样品液。短链脂肪酸含量采用气相色谱仪(Agilent Technologies 7890B,美国)测定,测定条件为:流速8 mL/min;进样量1.0 μL;机器入口温度保持在240 ℃。
1.8 数据分析
试验数据均用平均值±标准差表示,用软件SPSS 20.0对数据进行one-way ANOVA单因素方差分析和Duncan氏法多重比较检验,P<0.05表示差异显著,P<0.01表示差异极显著。利用http://www.i-sanger.com美吉测序平台对高通量测序结果进行生物信息学分析。
2 结果与分析
2.1 怀山药对鲤生长性能的影响
由表3可知,与对照组相比,各试验组增重率、特定生长率、饲料系数及存活率无显著差异(P>0.05)。但随着怀山药添加量增加,增重率和特定生长率有所升高,饲料系数有一定程度的降低。
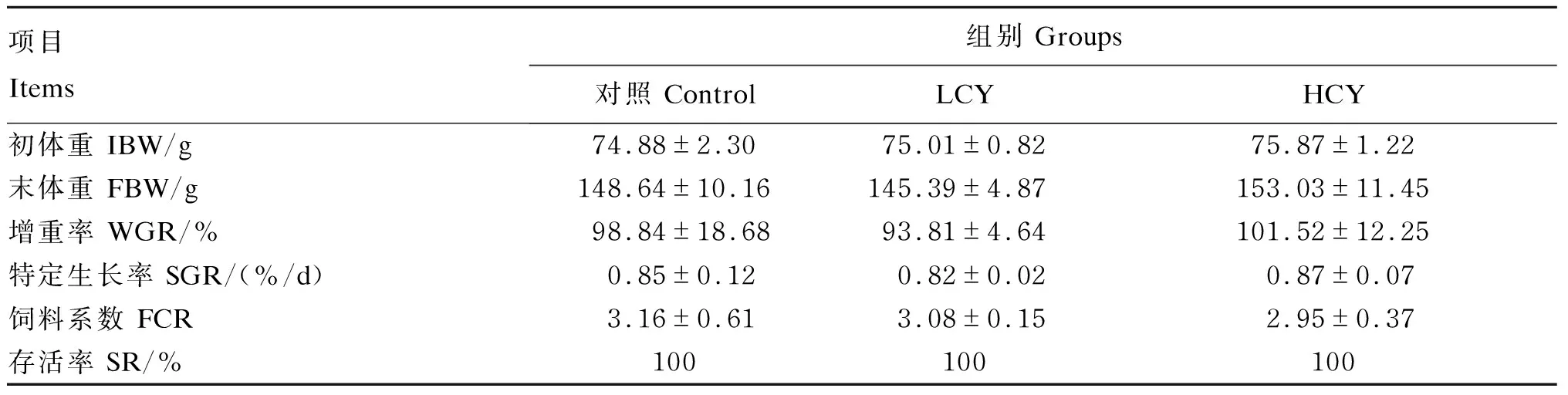
表3 怀山药对鲤生长性能的影响
2.2 怀山药对鲤肠道酶活性的影响
由表4可知,与对照组相比,LCY和HCY组肠道超氧化物歧化酶、过氧化氢酶、溶菌酶活性均显著升高(P<0.05),但MDA含量在各组间无显著差异(P>0.05)。
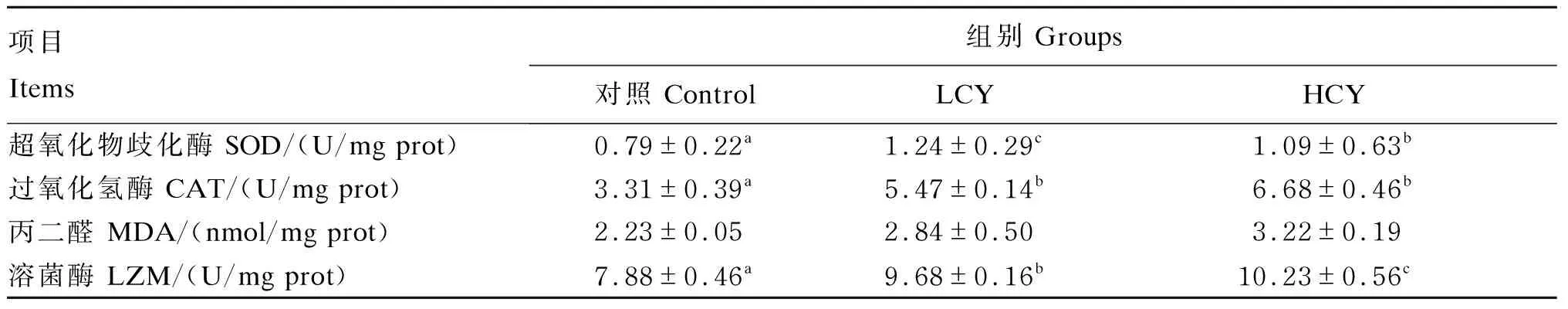
表4 怀山药对鲤肠道酶活性的影响
2.3 怀山药对鲤肠道组织形态的影响
HE切片结果显示,与对照组相比,添加怀山药后鲤肠微绒毛密度增大,微绒毛结构更完整,杯状细胞数量增加(图1-A、图1-B)。扫描电镜结果显示,试验组肠道黏膜褶皱数量与对照组相比显著增多(P<0.05),且在HCY组尤为明显(图1-C)。此外,与对照组相比,LCY组肠绒毛高度显著增加(P<0.05),而试验组肠道肌层厚度与对照组相比无显著差异(P>0.05)(图2)。
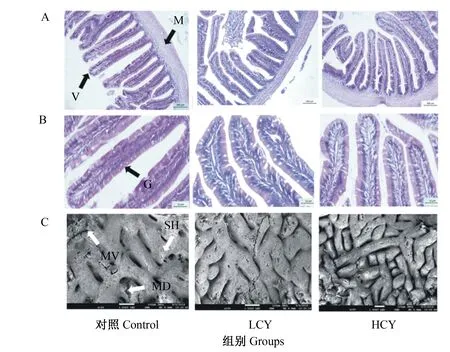
A:HE染色100倍;B:HE染色400倍;C:肠黏膜组织扫描电镜150倍。MD:机械损伤;MV:微绒毛;SH:分泌孔;V:肠绒毛;M:基层;G:杯状细胞。
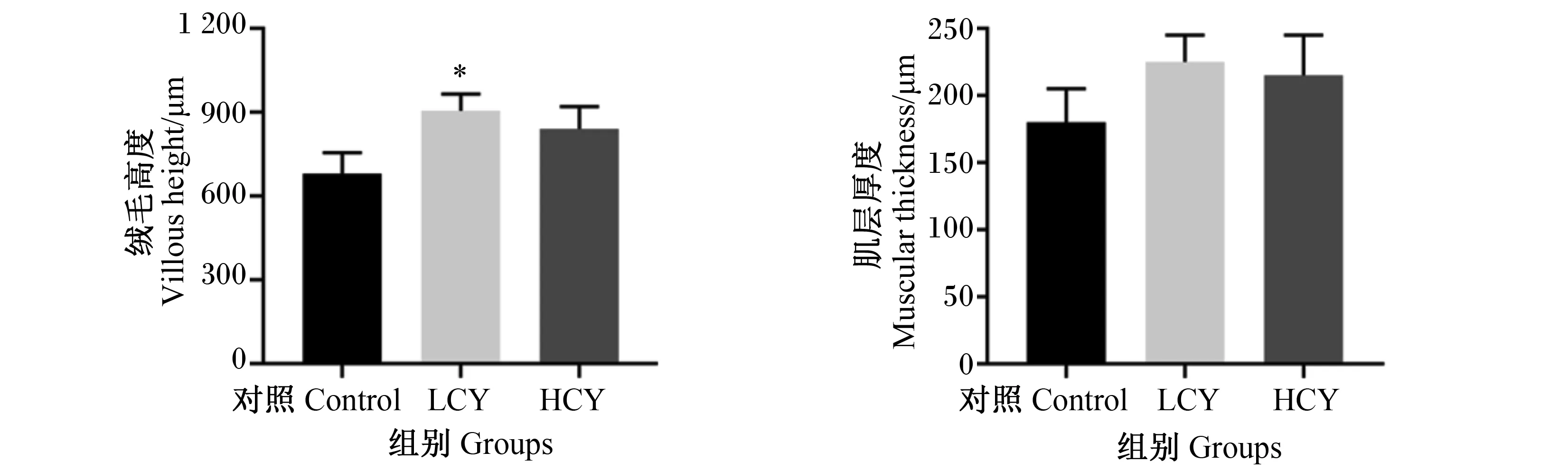
数据柱形标注*表示与对照组相比差异显著(P<0.05),**表示与对照组相比差异极显著(P<0.01)。下图同。
2.4 怀山药对鲤肠道免疫相关基因相对表达量的影响
由图3可知,与对照组相比,LCY组中肠道白细胞介素-10(IL-10)和紧密连接蛋白-1(ZO-1)基因相对表达量显著升高(P<0.05),白细胞介素-1β(IL-1β)、转化生长因子-β(TGF-β)、Toll样受体4(TLR4)和闭合蛋白(Occludin)基因相对表达量极显著升高(P<0.01)。在HCY组中,仅有IL-10基因相对表达量与对照组相比显著升高(P<0.05),其余基因表达量与对照组相比有升高趋势,但差异均不显著(P>0.05)。
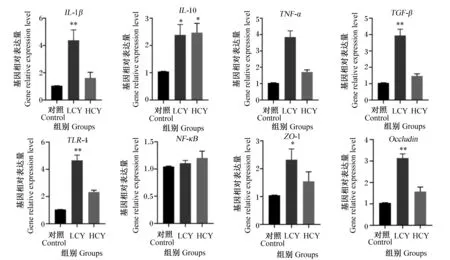
IL-1β:白细胞介素-1β interleukin-1β;IL-10:白细胞介素-10 interleukin-10;TNF-α:肿瘤坏死因子-α tumor necrosis factor-α;TGF-β:转化生长因子-β transforming growth factor-β;TLR4:Toll样受体4 Toll-like receptors 4;NF-κB:核因子-κB nuclear factor kappa-B;ZO-1:紧密连接蛋白 zonulaoccludens-1;Occludin:闭合蛋白。
2.5 怀山药对鲤肠道微生物的影响
由表5可知,覆盖度在各组之间没有显著差异(P>0.05),与对照组相比,LCY组Ace指数和Chao指数显著升高(P<0.05)。Shannon指数代表了微生物群落的多样性,Simpson指数代表了微生物群落的均匀度,结果表明,与对照组相比,LCY组和HCY组肠道Shannon指数与Simpson指数均显著升高(P<0.05)。
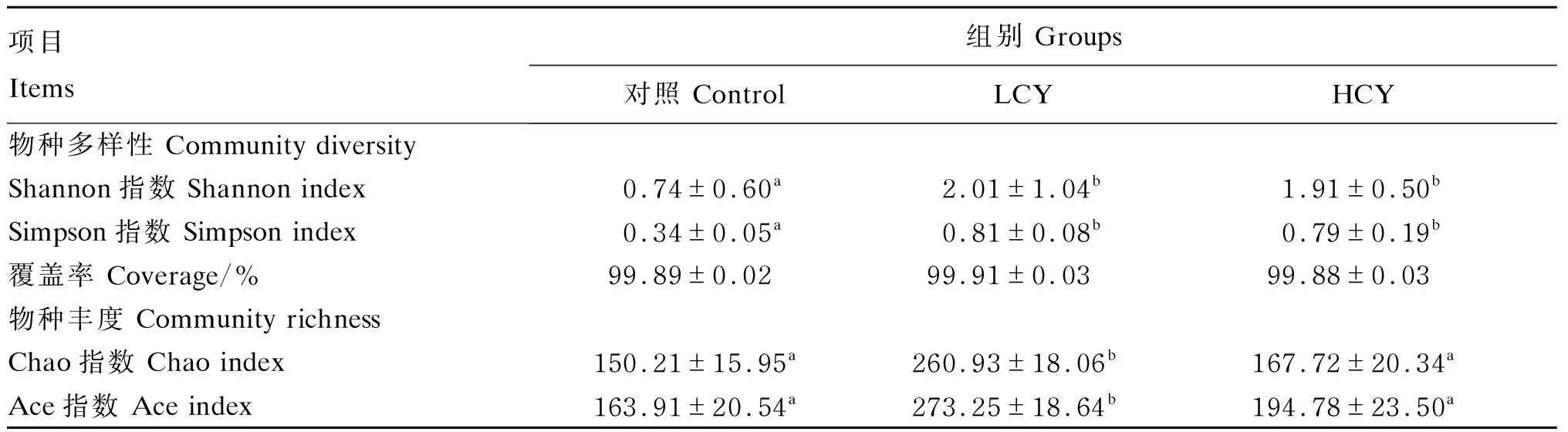
表5 怀山药对鲤肠道微生物多样性的影响
由图4可知,各组肠道菌群在门水平上均主要由梭杆菌门(Fusobacteria)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)组成。其中梭杆菌门相对丰度最高,分别占总数的54.29%(对照组)、83.83%(LCY组)和86.97%(HCY组)。与对照组相比,LCY和HCY组梭杆菌门相对丰度显著升高(P<0.05),而变形菌门相对丰度则显著降低(P<0.05)。此外,与对照组相比,怀山药添加组拟杆菌门相对丰度升高,厚壁菌门相对丰度降低,厚壁菌门/拟杆菌门比值下降。
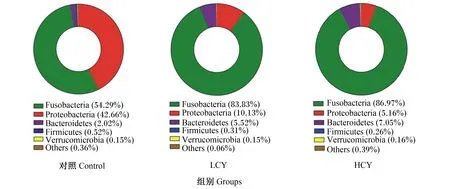
Fusobacteria:梭杆菌门;Proteobacteria:变形菌门;Bacteroidetes:拟杆菌门;Firmicutes:厚壁菌门;Verrucomicrobia:疣微菌门;Others:其他。
由图5-A可知,在属水平上相对丰度较高的菌群有鲸杆菌属(Cetobacterium)、气单胞菌属(Aeromonas)、希瓦氏菌属(Shewanella)和肠杆菌属(Enterobacter)。与对照组相比,LCY和HCY组鲸杆菌属相对丰度显著升高(P<0.05)(图5-B),而气单胞菌属相对丰度显著性降低(P<0.05)(图5-C)。希瓦氏菌属、肠杆菌属相对丰度与对照组相比无显著变化(P>0.05)(图5-D、图5-E)。
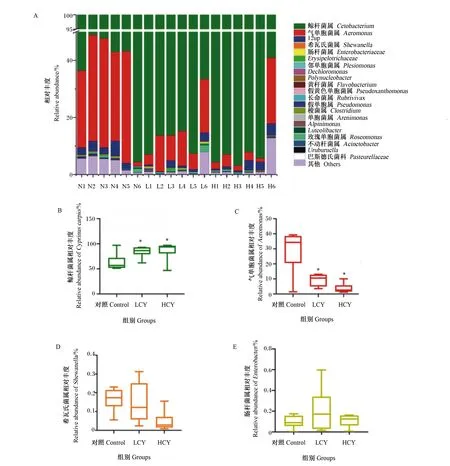
图5 属水平鲤肠道内容物微生物群落组成(A)、鲸杆菌属的相对丰度(B)、气单胞菌属相对丰度(C)、
2.6 怀山药对鲤肠内容物短链脂肪酸含量的影响
由图6可知,与对照组相比,LCY组和HCY组鲤肠内容物乙酸含量显著升高(P<0.01),而丙酸、正丁酸、异丁酸、正戊酸和异戊酸的含量与对照组相比没有显著变化(P>0.05)。图7显示了各组鲤肠道总短链脂肪酸的含量,可以发现,试验组与对照组相比均显著升高(P<0.05)。
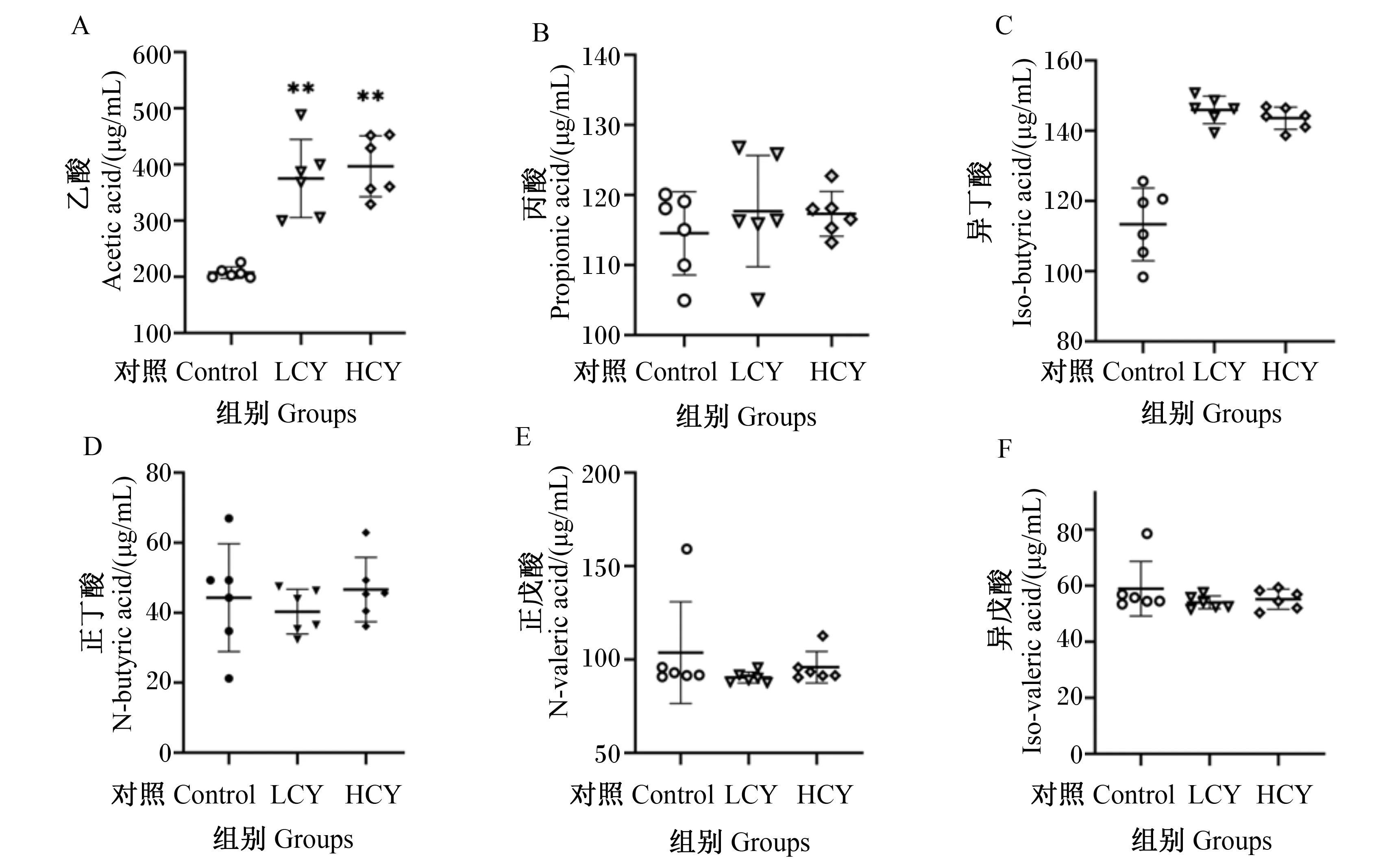
图6 怀山药对鲤肠道内容物短链脂肪酸含量的影响
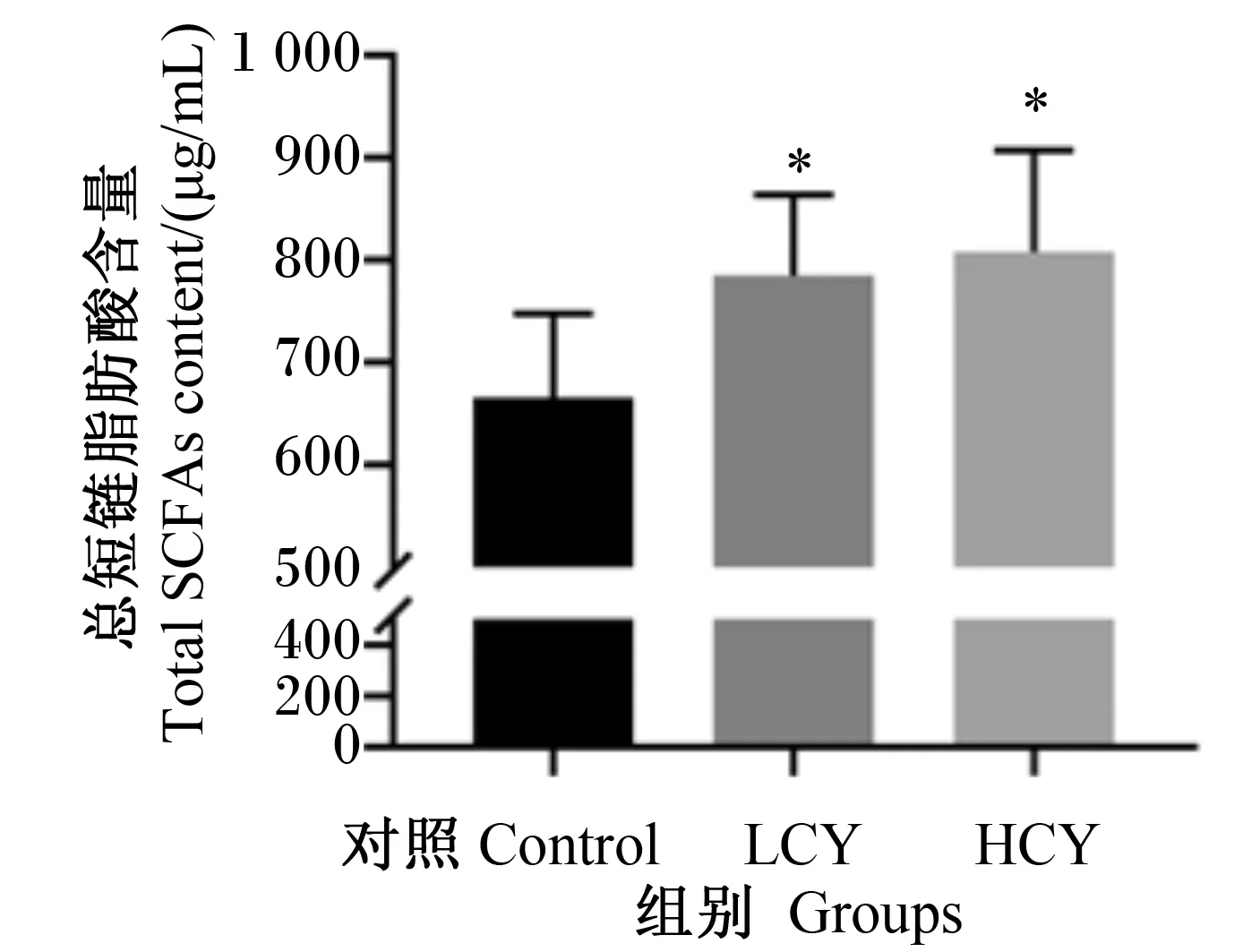
图7 怀山药对鲤肠内容物总短链脂肪酸含量的影响
3 讨 论
3.1 怀山药对鲤生长性能及肠道组织形态的影响
中草药饲料添加剂可改善动物饲料质量,解决传统抗生素饲料添加剂的药物残留问题[9]。邓华富[10]在基础饲粮中添加1%山药粉,研究对断奶仔猪生长性能的影响。结果表明,山药能显著提高断奶仔猪的平均日增重和平均日采食量。杨仕群等[11]在山地乌骨鸡饲粮中添加1%、2%和4%的山药,显著提高了平均日增重和饲料摄入量。陆克文等[4]研究发现了添加1%山药粉可显著提高1~21日龄和14~21日龄仔猪的平均日增重。上述研究表明,山药作为饲料添加剂在畜禽动物生长性能方面可以起到很好的促进作用。在水产动物研究中,乔志刚等[6]在黄河鲤基础饲料中加入质量分数为2%的怀山药,可提高黄河鲤特定生长率、增重率,但差异不显著,这与本研究结果相似。在本研究中,饲料系数在添加怀山药后虽然下降,但保持较高的值,分析原因可能是鱼的初体重偏高,相比幼鱼来说,它对营养物质吸收有一定差异。水产动物在不同的生长阶段投饵次数应不同,投饵次数过多,饲料在肠道内的蠕动速度就越快,若超出对饲料的消化速度就会导致一定数量的饲料无法被充分消化吸收,造成饲料浪费,提高饲料系数。
肠吸收能力的增强可能是促进鲤生长的原因。肠道是机体营养物质消化、吸收的主要场所,肠道健康依赖于正常的生理结构,而肠绒毛长度、肌层厚度则是评价肠道消化吸收能力的重要依据[12]。绒毛的长度与肠上皮细胞数量呈正相关,肠绒毛长度增加,肠上皮细胞数增多,消化吸收能力增强,生长发育加快。黏膜的上皮细胞由单层的柱状上皮细胞组成,它们散布在许多杯状细胞中,杯状细胞分泌消化酶和黏液,从而保护上皮细胞并润滑肠道。在本研究中,试验组肠绒毛长度及完整性、肌层厚度和杯状细胞的数量相较于对照组,有一定程度的增加,并且肠黏膜褶皱显著增多,这表明吸收表面积增大,消化和吸收能力增强。这与前述增重率相比于对照组有升高趋势的结果相一致,说明添加怀山药能在一定程度上增强鲤肠道对营养物质的吸收,促进鲤生长。
3.2 怀山药对鲤肠道酶活性和肠道免疫相关基因相对表达量的影响
抗氧化剂系统是脊椎动物中最重要的免疫防御系统[13],酶的活性通常间接表明宿主清除活性氧(ROS)的能力。其中抗氧化酶中的氧化氢酶和超氧化物歧化酶通常被用作评估免疫潜能的功能参数[14],其可通过清除自由基降低氧化应激,预防、阻止或减少氧化损伤,保护机体免受疾病的侵袭。在本研究中,饲料中添加山药粉后,鲤肠道中的氧化氢酶和超氧化物歧化酶的活性显著增加,这表明抗氧化能力的提升。这一结果与草鱼饲料中添加条斑紫菜多糖[15]和凡纳滨对虾饲料中添加白芍多糖[16]的研究结果相吻合。溶菌酶是一种具有抗菌活性的蛋白酶,可通过降解革兰氏阴性菌细胞壁中多糖从而产生抑制作用。有研究发现,在鲤饲料中添加多糖[17]和尼罗罗非鱼饲料中添加丹参[18]会诱导溶菌酶的活性或表达量增加。在本试验中,饲料中添加怀山药,溶菌酶活性显著升高,这与山药中的山药多糖等生物活性成分密切相关,此外可能由于活性物质经由肠道菌群介导,促进了肠道中溶菌酶的分泌。
在宿主防御反应中,一类抗炎症因子能下调细胞炎性反应、维持机体内细胞因子平衡[19],如IL-10、TGF-β等。IL-10和TGF-β作为重要的抗炎细胞因子,响应于炎症刺激,参与多项免疫调节,抑制细胞因子的过度释放,具有减轻炎性损伤的作用[20]。本试验添加山药粉后中肠IL-10和TGF-β基因相对表达量显著增加,与鲤添加棕榈果实提取物的结果[21]一致。促炎性细胞因子要有IL-1β和TNF-α等。IL-1β和TNF-α是由单核巨噬细胞等免疫细胞分泌的,是引起炎症反应,抵抗病原入侵的第1介质[22],在鱼类早期感染和炎症调节中发挥重要作用,可通过炎性反应提高机体抗感染能力,通常被认为是预测炎症反应的生物标志物[23]。TNF-α在机体产生炎症反应时,能促进IL-1β的分泌,并与之发生协同作用[24-25]。一些研究表明,多糖作为有效的免疫刺激剂,可以诱导TNF-α和IL-1β基因相对表达量,积极调节免疫系统,从而提高鱼体的免疫应答和抗病性。Watanuki等[26]报道,在鲤鱼饲料中添加螺旋藻上调了IL-1β和TNF-α基因表达。Wang等[27]的研究中,熟地黄同样能上调IL-1β和TNF-α的表达,提高鲤的免疫能力。Toll样受体是与免疫相关的模式识别受体,是连接特异性和非特异性免疫的媒介,能通过提升对细胞因子合成与释放而控制促发炎症反应。其中TLR4可以识别并结合革兰氏阴性菌脂多糖,激活核因子-κB(NF-κB)信号转导通路,从而诱导炎性细胞因子表达[28]。越来越多的证据表明,多糖作为一种有效的免疫刺激物,直接参与巨噬细胞的活化[29],通过TLR4/NF-κB通路促进炎性因子的产生(促炎因子和抗炎因子),从而刺激免疫反应。在哺乳动物中,Li等[30]研究表明,山药中的非淀粉多糖通过TLR4/NF-κB信号通路来激活巨噬细胞,促进IL-6和TNF-α基因相对表达量。Zhang等[31]发现,大黄多糖(Rhubarbpolysaccharides)能激活巨噬细胞表面TLR4复合物并转导胞外信号到胞内,诱导NF-κBp65的表达。本研究的试验结果表明,山药多糖可能通过TLR4/NF-κB通路激活鲤肠上皮巨噬细胞,引起机体的免疫应答,提升能免疫力。
紧密连接蛋白是组成肠黏膜机械屏障的重要部分[32],紧密连接蛋白Occludin与ZO-1可以形成稳定的连接,对维系肠黏膜屏障的完整性意义重大。已有研究报道了黄芪多糖[33]和白芨多糖[34]对ZO-1和Occludin基因相对表达量的增强作用。此外,一些研究表明,酚类化合物影响这些蛋白的紧密结合能力,增强屏障完整性[35]。在本研究中,饲料中补充山药增加了Occludin和ZO-1在肠道中基因相对表达量,说明怀山药可提升肠道屏障保护作用,这与肠道组织形态观察结果是一致的。
3.3 怀山药对鲤肠道微生物和短链脂肪酸含量的影响
肠道菌群被称为机体的第二器官,与机体的代谢、免疫等功能密切相关。本试验分别从门、属2个水平对添加怀山药后鲤肠道菌群结构及多样性的变化进行了分析。在门水平上,鲤肠道的优势群落主要由梭杆菌门、变形杆菌门和拟杆菌门组成,且超过50%的微生物类群属于梭杆菌门,这与Van Kessel等[36]对鲤的肠道菌群研究结果一致。目前在鱼类肠道样本中检测到的梭杆菌几乎都属于鲸杆菌属,是一种常见的淡水鱼肠道中广泛分布的菌种。有研究显示,鱼类肠道中大量定植的鲸杆菌属可产生维生素B12,与机体代谢密切相关[37]。在壳聚糖-银纳米复合材料(CAgNCs)添加饲喂的斑马鱼肠道中鲸杆菌属丰度显著升高,并促进了维生素的产生[38]。因此,本研究添加山药粉后,鲤肠道菌群中鲸杆菌属相对丰度的显著升高可能会促进维生素B12的产生,供给机体营养需要,促进机体健康。变形菌门是包括鱼类在内的大多数物种肠道菌群的重要组成部分[39],它包含许多病原菌,如大肠杆菌、沙门氏菌等,其与肠道的屏障作用有关,变形菌门的高丰度会导致紧密连接蛋白表达降低,从而引起肠道损伤的发生[40]。在鲤肠道中存在的变形菌大部分属于气单胞菌属,是一种条件致病菌。本研究表明,与对照组相比,饲料中补充怀山药可以显著降低鲤肠道中气单胞菌属的相对丰度,说明山药可能对减少致病性肠道菌群的数量,增强宿主的抗病能力有积极的影响。厚壁菌门和拟杆菌门可以编码多种与糖相关的酶,在非消化多糖的利用中发挥重要作用[41]。在人类及哺乳动物研究中表明,厚壁菌门/拟杆菌门比值的降低表征着脂质代谢的改善[42]。本研究证明,怀山药可以通过调节厚壁菌和拟杆菌的相对丰度来减少宿主对食物中多余脂类物质的吸收,从而防止摄入过多的能量来维持正常体重。此外,肠杆菌属和希瓦氏菌属被认为是引起多种疾病的主要条件性致病菌,而希瓦氏菌属隶属于弧菌科,是人类和水产动物的潜在病原。但Ray等[43]研究显示,从印度鲤鱼(Indian carp,Cyprinidae)消化道分离出的肠杆菌可以产生淀粉酶、纤维素酶和蛋白酶,在鲤鱼肠道食物消化过程中发挥积极的作用。Dailey等[44]研究发现希瓦氏菌属可以产生利于机体肠道健康的脂肪酸,如二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)。本研究结果显示,与对照组相比,添加怀山药对鲤肠道中肠杆菌属和希瓦氏菌属的相对丰度无显著影响。具体其发挥的功能还需要进一步在种的水平上开展研究。短链脂肪酸是肠道微生物消化膳食成分发酵后的产物,可降低肠道内pH,抑制病原微生物的增殖,同时改善肠道菌群结构和肠道屏障完整性,参与免疫调节,有效预防肠道炎症[45]。本研究中,饲料中添加怀山药可调节鲤肠内短链脂肪酸的含量,尤其是乙酸、丙酸、丁酸和总酸的含量,这可能与山药中的富含的山药多糖密切相关。越来越多的证据表明,多糖具有促进产短链脂肪酸细菌增殖的潜力[46],如拟杆菌和梭杆菌。
4 结 论
综上所述,饲料中添加怀山药对鲤的生长性能无显著影响,但可以显著提升鲤的肠道屏障功能,改善鲤的肠道菌群结构,提高短链脂肪酸含量,有望作为潜在的鲤饲料添加剂。

