单增李斯特菌双元调控系统hssS/hssR缺失株的构建及其生物学特性
安 妮,张 钰,方小伟,梁雄燕,刘 晶,杨玉莹,方 春
(长江大学动物科学学院,荆州 434025)
单核细胞增生性李斯特菌(又称为产单核细胞李氏杆菌)简称单增李斯特菌(LM),是革兰阳性胞内寄生菌,在自然界分布广泛,可导致人兽共患病[1-2]。动物感染李斯特菌主要是由于食入被李斯特菌污染的饲料,继而通过排泄物、分泌物排出细菌,污染肉制品、奶制品或水产品,并通过这类食物感染人,从而引起人的李斯特菌病。李斯特菌病患者通常为老年人、婴幼儿及孕妇等抵抗力低下者,主要引发败血症、脑膜炎、胃肠炎、流产等疾病[3-4]。
LM能抵抗外界多种恶劣环境,如强酸、强碱、高盐、低温和强氧化环境,这一特性对食品安全构成了严重的威胁[5-7]。在细菌感染宿主的过程中同样会面临各种环境,如胃酸、吞噬体中的弱酸环境及非特异性炎性因子的识别[8-9]。双组分调控系统(TCSs)是帮助细菌适应自然界和食品加工过程中遇到的许多应激因素的主要系统之一,该系统由感应外界信号的组氨酸激酶(HK)和调控胞内相关基因表达的应答调控因子(RR)组成,研究证明,PhoP/PhoR、LisR/LisK、CheY/CheA等多种TCSs介导单增李斯特菌抗应激、毒力和对抗生素的抵抗力[10]。LM中的双元调控系统HssSR的主要功能是调控血红素应激,通过激活hrtAB表达来排出多余的血红素,从而提高细菌的存活率[11]。单增李斯特菌LO28的基因组编码一个推定的HssR一致物Lmo2583,与金黄色葡萄球菌HssR具有48%的同源性[12]。但在金黄色葡萄球菌中,HssS/HssR除了抗血红素应激外,Hss或Hrt系统的失活会导致金黄色葡萄球菌毒力增强,而Hss和Hrt系统也存在于单增李斯特菌中[13]。但HssS/HssR的其他功能尚不清楚,因此本研究以单增李斯特菌10403S为亲本株,利用同源重组技术构建hssS/hssR基因缺失株,并通过应激生长试验、细胞试验和鸡胚毒力试验来评估其对单增李斯特菌抗应激能力和毒力的作用。
1 材料与方法
1.1 材料
1.1.1 菌株、载体、细胞及鸡胚 单增李斯特菌参考菌株10403S(血清型为1/2a型);大肠杆菌DH5α;穿梭质粒pKSV7由本实验室保存。小鼠单核巨噬细胞RAW264.7细胞株由长江大学动物科学学院郭利伟老师惠赠。鸡胚购自长江大学实验动物中心。
1.1.2 主要试剂 LB培养基购自上海生工生物技术有限公司;脑心浸液培养基BHI购自北京陆桥生物技术有限公司;2×TaqPlus Master Mix Ⅱ和琼脂糖购于南京诺唯赞生物科技有限公司;限制性核酸内切酶BamH I购自NEB公司;核酸染料Goldview购自上海自赛百盛公司;琼脂糖凝胶回收试剂盒、质粒提取试剂盒及DNA Marker购自武汉擎科生物技术有限公司;无缝克隆试剂盒购自北京艾德莱生物有限公司。
1.2 方法
1.2.1 引物设计与合成 根据参考单增李斯特菌株10403S(登录号为CP002002)的基因序列信息,使用Vector NTI软件设计hssS/hssR上、下游同源臂扩增引物(表1),引物由武汉擎科生物技术有限公司合成。
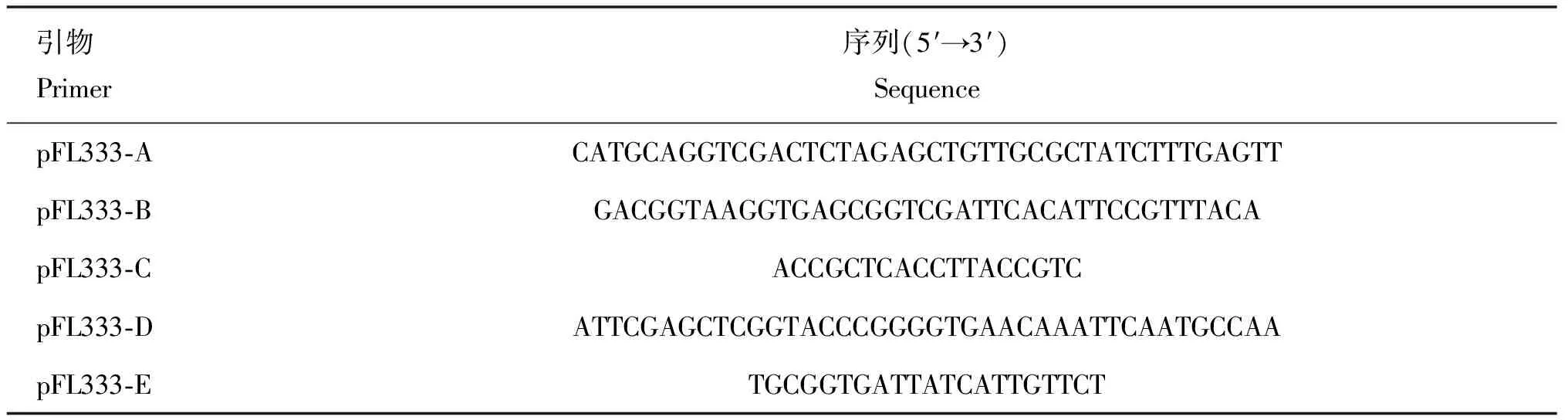
表1 本研究所用的引物
1.2.2 基因缺失株的构建 按照文献报道的方法构建基因缺失株[14],以单增李斯特菌10403S基因组为模板,通过融合PCR方法扩增hssS/hssR同源臂,同源臂回收后与BamH I线性化的pKSV7进行重组连接构建重组穿梭质粒pFL333。将pFL333电转至10403S感受态细胞中,在含10 μg·mL-1氯霉素的BHI中,41 ℃培养条件下连续传代实现同源重组;已重组的克隆在无抗BHI中于30 ℃培养箱中连续传代消除重组质粒,以获得缺失株ΔhssS/hssR。
1.2.3 生长曲线测定 根据文献方法测定细菌生长曲线[15-16]。将亲本株10403S和缺失株ΔhssS/hssR分别挑取单菌落,37 ℃震荡培养过夜,调OD600 nm至0.6,将菌液分别在含20 mmol·L-1H2O2、pH 7、pH 4.5和5% NaCl的BHI培养基中稀释100倍后,加入96孔酶标板中,每株菌设置4个平行,置于37 ℃静置培养,每2 h测定其OD600 nm,直至测到生长平台期并绘制生长曲线。
1.2.4 应激生长试验 参照文献[17-18]方法进行细菌体外应激生长试验。将生长至对数期的亲本株10403S和缺失株ΔhssS/hssR加入终浓度为20 mmol·L-1H2O2的BHI培养基中,37 ℃静置培养1 h,将H2O2作用前后的菌液进行倍比稀释,点板后置于37 ℃培养箱过夜培养,根据菌落计数计算出生长率。本试验进行3次独立重复。
1.2.5 细菌抗吞噬与胞内增殖试验 参照文献[15,19]方法进行细菌抗吞噬和胞内增殖试验。将生长至对数期的亲本株10403S和缺失株ΔhssS/hssR各取1 mL菌液离心收集,并用1 mL PBS重悬菌体,作为原液;以感染比(MOI)为细菌量∶细胞量=10∶1的比例感染单层的RAW264.7细胞,孵育30 min后,弃去培养液,用PBS洗3遍,并加入含有庆大霉素(200 μg·mL-1)的DMEM培养基,继续孵育1 h后,弃去培养液,PBS洗3遍,每孔加入1 mL灭菌去离子水,室温静置10 min,随后充分吹吸,将其倍比稀释后平板计数,以计算吞噬率;另一块细胞板加入低浓度庆大霉素(20 μg·mL-1)的DMEM培养基,继续培养6 h,以同样的方法裂解细胞后,进行平板计数,以计算细菌在胞内的增殖率。本试验进行3次独立重复。
1.2.6 鸡胚毒力试验 参照文献[20-21]方法进行鸡胚毒力试验。将生长至对数期的亲本株10403S和缺失株ΔhssS/hssR菌液离心收集,并用 PBS重悬菌体,作为原液进行倍比稀释,选取10-4、10-5、10-63个梯度,每个稀释梯度经尿囊腔接种0.1 mL至14日龄鸡胚6个,同时接种同样剂量的PBS作为阴性对照组,38 ℃ 65%湿度孵育24 h后开始照蛋,观察7 d(168 h),弃去48 h内的死亡胚,观察并统计48~168 h各稀释梯度鸡胚的死亡情况,使用改良寇氏法计算鸡胚半数致死量并绘制存活率曲线图。7 d后,将亲本株与缺失株中的10-5稀释度攻毒组内的鸡胚无菌取出肝,用研钵研磨后加入1 mL PBS混匀,连续梯度稀释后进行平板计数以计算鸡胚肝载菌量。本试验进行3次独立重复。
1.2.7 统计分析 所有试验均重复3次,并通过GraphPad Prism 5对组间数据进行分析处理,P<0.05和P<0.01分别表示差异显著和差异极显著,在图中分别用“*”和“**”标注。
2 结 果
2.1 LM hssS/hssR基因缺失株的构建
以LM 10403S株基因组为模板,分别扩增上、下游同源臂片段,大小分别为558和587 bp,以第一轮混合回收后的PCR产物扩增融合的同源臂片段(1 145 bp);将融合的同源臂与穿梭载体pKSV7重组连接后转化DH5α感受态细胞中,成功构建pFL333重组质粒。将重组质粒电转至单增李斯特菌10403S感受态细胞中,将电转成功的菌株,在41 ℃、氯霉素(10 μg·mL-1)条件下进行同源重组,获得重组菌株,将其置于30 ℃、无抗条件下传代培养20代后获得无氯霉素抗性的重组菌株,即为hssS/hssR基因缺失株(图1)。
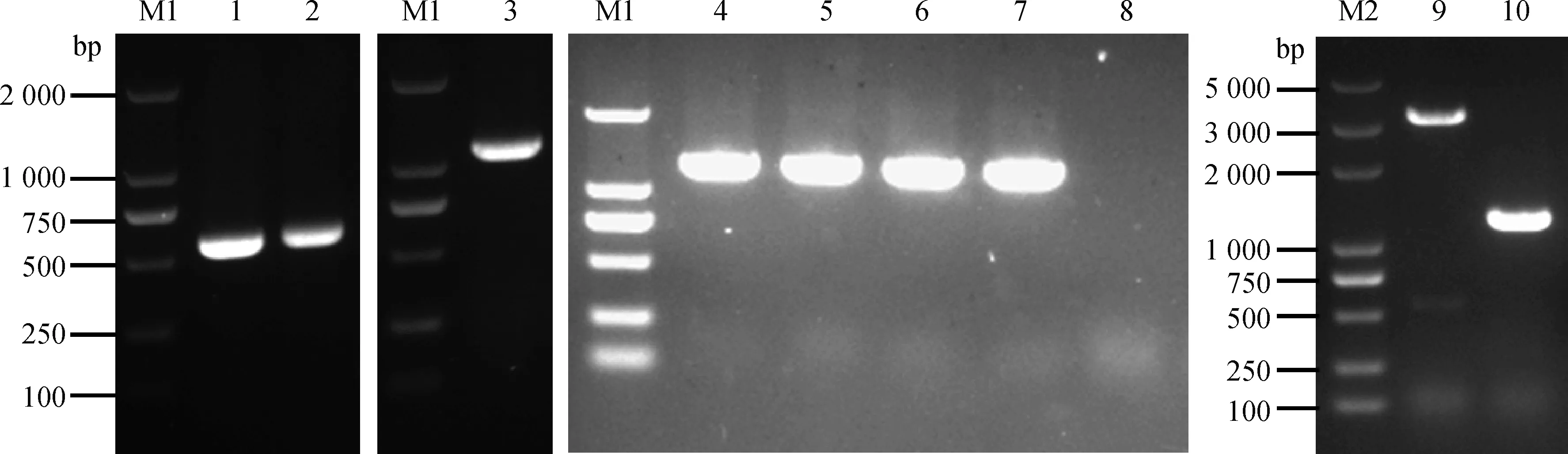
M1.DL2000 DNA相对分子质量标准; 1.上游同源臂; 2.下游同源臂; 3.上下游同源臂; 4~7.重组质粒pFL333; 8.阴性对照;M2.DL5000 DNA相对分子质量标准; 9.亲本株10403S; 10.缺失株ΔhssS/hssR
2.2 生长曲线测定
为了探索HssS/HssR双元调控系统是否介导单增李斯特菌的抗应激作用,本研究使用了不同条件(pH 4.5、20 mmol·L-1H2O2和5% NaCl)的BHI培养基来评估单增李斯特菌对酸、氧化和渗透压环境的抗应激能力。亲本株10403S和缺失株ΔhssS/hssR在pH 4.5、20 mmol·L-1H2O2和5% NaCl条件下的生长曲线显示(图2),在正常生长状态下(pH 7),缺失株与亲本株生长能力无差异;在酸和渗透压应激条件下,生长平台期以前亲本株和缺失株生长能力无差异,到达平台期后缺失株的存活量低于亲本株;而在氧化应激条件下,在任何生长时期缺失株的生长能力均低于亲本株。以上结果表明HssS/HssR可能介导单增李斯特菌的抗酸、抗渗透压和抗氧化应激,其中对抗氧化应激的作用最明显。
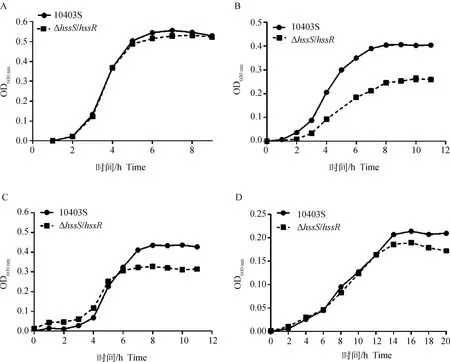
A.pH 7; B.20 mmol·L-1 H2O2; C.5% NaCl; D.pH 4.5
2.3 应激试验
通过生长曲线得知氧化应激对缺失株生长的抑制作用最大,接着通过氧化应激试验来进一步评估HssS/HssR对氧化应激的贡献。结果显示(图3),在氧化环境中应激处理1 h后,缺失株的生长率显著低于亲本株(P<0.01)。说明双元调控系统HssS/HssR介导单增李斯特的抗氧化应激作用。

**.P<0.01
2.4 细菌抗吞噬与胞内增殖试验
本研究用小鼠巨噬细胞RAW264.7研究缺失株抵抗巨噬细胞吞噬的能力及其在巨噬细胞内的存活增殖能力。结果显示(图4),与亲本株10403S相比,缺失株的吞噬率显著降低(P<0.01),说明缺失株的抗吞噬能力更强;且缺失株在胞内的增殖率显著升高(P<0.05),说明缺失株在胞内的增殖能力更强,进一步说明了HssS/HssR介导单增李斯特菌的胞内感染过程。
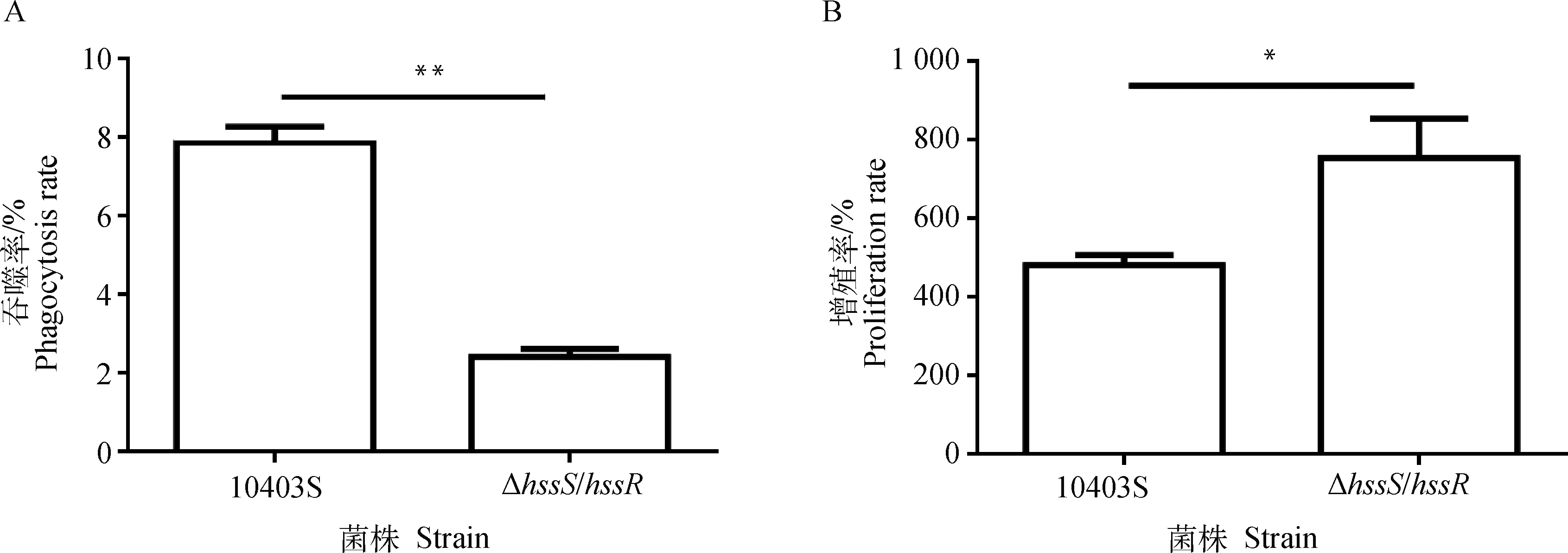
*.P<0.05; **.P<0.01
2.5 鸡胚毒力试验
为了探索HssS/HssR对单增李斯特菌毒力的作用,本研究分别用亲本株和缺失株对鸡胚进行攻毒,测定其存活率、半数致死量和肝载菌量。根据规定时间内的累计死亡率,按改良寇式计算法得出亲本株LD50为102.2,缺失株LD50为101.4,与亲本株10403S相比,缺失株的毒力更强;绘制10-5稀释梯度攻毒组的存活率曲线图(图5,第90小时后鸡胚不再死亡),缺失株在攻毒后的第60小时鸡胚存活率为67%,而亲本株存活率为83%,且在第60小时后缺失株组存活率一直低于亲本株,说明与亲本株10403S相比,缺失株ΔhssS/hssR的毒力更强;脏器载菌量结果(图6)显示缺失株ΔhssS/hssR在鸡胚肝定殖能力较亲本株强(P<0.01)。以上结果表明,hssS/hssR基因缺失后显著增强单增李斯特菌的毒力。

图5 攻毒后鸡胚的存活率曲线
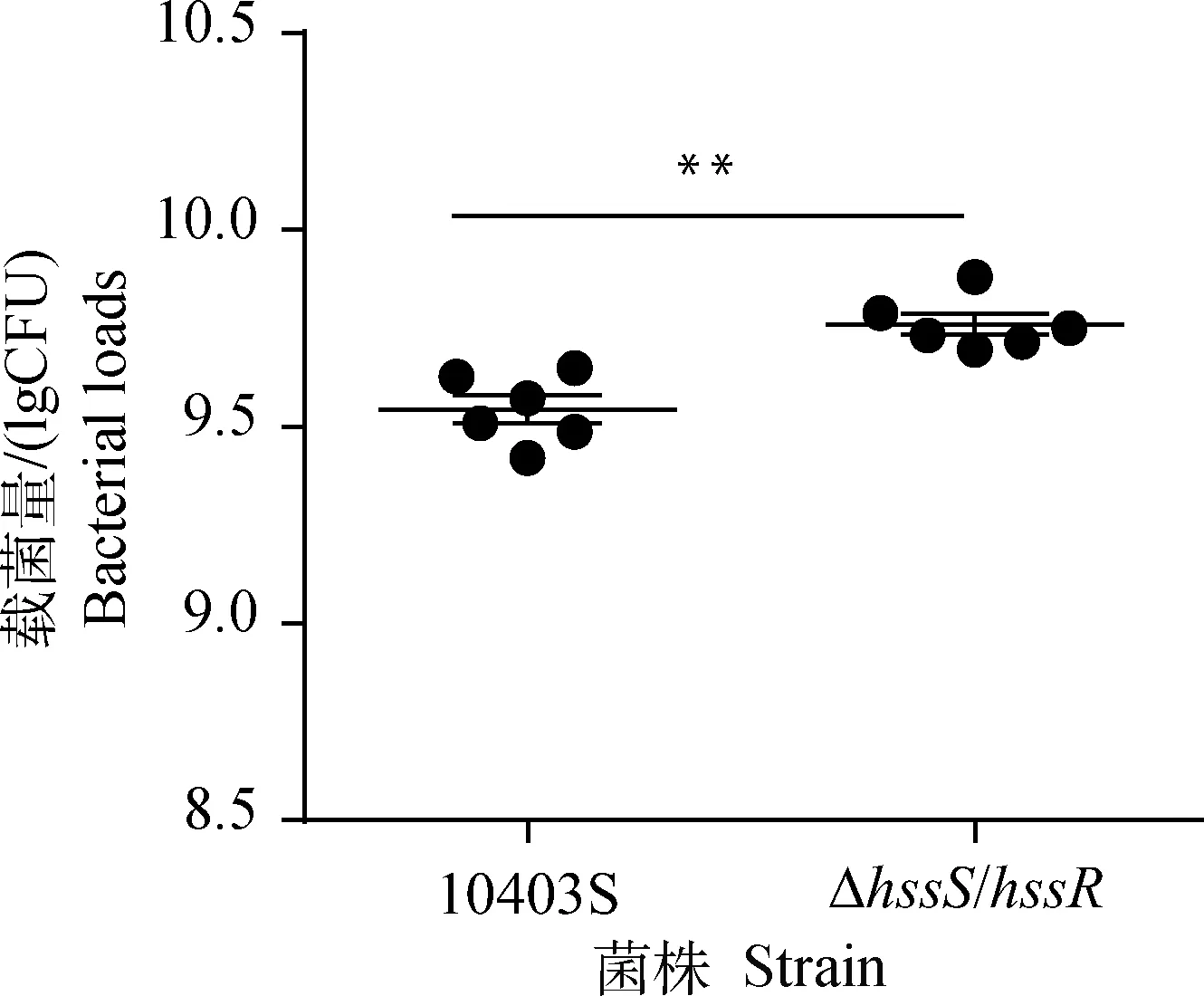
**.P<0.01
3 讨 论
单增李斯特菌在自然界中分布广泛,可耐受外界多种恶劣环境,如低温、低pH、高盐、强氧化等环境[21],单增李斯特菌已成为食品加工过程中非常常见的污染物之一,威胁到了人类的健康[22-23]。在感染过程中,TCSs发挥了不可或缺的作用,单增李斯特菌通过HK感受外界环境刺激后将信号传递给胞内的RR,然后通过调节不同的基因来增强其自身在环境中的生存能力,尤其是在恶劣的环境中,LM会上调毒力基因来促进其生存[16]。根据P2CS数据库最新数据显示,单增李斯特菌一般具有13~18对TCSs[24]。
本研究以10403S为亲本株,构建了hssS/hssR基因缺失株,应激存活试验表明hssS/hssR基因缺失后抗氧化应激能力显著降低,同时酸应激和渗透压应激条件下的存活率也降低,显示HssS/HssR可能在LM适应环境和应激过程中发挥了作用。Pöntinen等[25]发现在参考菌株EGD-e中敲除lmo2582不影响LM在37 ℃及低温下的生长能力,其他条件未见报道;本研究发现hssS/hssR的缺失并没有影响LM在37 ℃的生长能力,但明显降低了细菌在氧化应激环境(20 mmol·L-1H2O2)中的生长能力,说明HssS/HssR可能介导LM的抗氧化应激作用。巨噬细胞吞噬溶酶体内存在氧化应激[26],其中的氧化成分复杂,含有多种ROS和RNS,且有研究表明H2O2可显著促进LM毒力基因的转录[27],本研究发现与亲本株10403S相比,缺失株ΔhssS/hssR抗吞噬能力显著增强,且在小鼠巨噬细胞内的增殖能力也显著增强,说明hssS/hssR基因缺失后可能导致LM对氧化环境更敏感,从而促进毒力基因的转录,但具体调控机制还有待研究。Torres等[13]报道hssR失活会导致金黄色葡萄球菌在感染小鼠96 h后,肝载菌量上升,本研究中缺失株感染鸡胚后,在肝载菌量上升,与已有研究结果趋势一致。细胞试验与动物试验结果一致,初步显示HssS/HssR介导单增李斯特菌的毒力。
综上所述,本研究成功构建双元调控系统hssS/hssR缺失株,通过部分生物学特性比较结果显示单增李斯特菌HssS/HssR双元调控系统可能介导其抗氧化应激与毒力,但其具体调控机制还有待深入研究。
4 结 论
成功构建了单增李斯特菌hssS/hssR基因缺失株,hssS/hssR基因的缺失不影响单增李斯特菌的生长状况,但导致单增李斯特菌在氧化应激条件下的生长能力显著降低,同时增强其抗巨噬细胞吞噬能力、巨噬细胞内增殖能力以及对鸡胚的致病性。双元调控系统HssS/HssR可能介导单增李斯特菌抗氧化应激作用和毒力。
——紫 苏

