不同阳离子醋酸类离子液体作萃取剂分离丙酸甲酯-甲醇共沸体系
李顺民,张亲亲,辛 华,吴天照,宋廷贺,张志刚
(沈阳化工大学 化学工程学院 辽宁省化工分离技术重点实验室,辽宁 沈阳 110142)
丙酸甲酯(MP)是重要的有机溶剂[1],可用作合成甲基丙烯酸甲酯的中间体[2-3]。目前,合成MP 的主要方法有两种[4-5],但两种方法均面临MP和甲醇的分离问题,MP 和甲醇会形成共沸物,无法通过常规蒸馏进行分离。常用的分离方法有变压精馏、共沸精馏和萃取精馏[6-8]。其中,萃取精馏因具有选择性高、操作简单等优点而被广泛应用。
萃取剂选择是萃取精馏的关键。王菊等[9]测定并关联了MP+MeOH 体系的二元汽液平衡数据,韩淑萃等[10]采用Aspen 软件模拟了以苯酚为萃取剂的萃取精馏工艺。但有机溶剂萃取剂选择性差、回收利用难、对环境有毒有害。近年来,离子液体(ILs)因可设计性强和蒸汽压极低等特性用于替代萃取剂[11],陆钱磊[12]探究了1-丁基-3-甲基咪唑双三氟甲磺酰亚胺盐、l-丁基-2,3-甲基咪唑双三氟甲磺酰亚胺盐及1-己基-3-甲基咪唑双三氟甲磺酰亚胺盐([HMIM][NTf2])三种ILs 的分离效果。
本工作采用COSMOthermX19 软件,从26 种阴离子和27 种阳离子组成的702 种ILs 中筛选出1-丁基-2,3-二甲基咪唑醋酸盐([BMMIM][Ac])、1-乙基-3-甲基咪唑醋酸盐([EMIM][Ac])和1-乙基-2,3-二甲基咪唑醋酸盐([EMMIM][Ac])作为萃取剂。测定了MP+MeOH 二元体系以及MP +MeOH+IL 三元体系在101.3 kPa 下的等压气液相平衡数据,通过L-W 和van Ness 方法对实验数据进行热力学一致性检验,并使用NRTL 模型对实验数据进行关联,讨论了三种ILs 的分离效果,并通过过量焓对分离机理进行了探索。
1 实验部分
1.1 试剂及仪器
MP:纯度99.5%(w),麦克林生物化学有限公司(中国上海)。甲醇:纯度99.5%(w),国药集团化学试剂有限公司。[EMIM][Ac](99%(w))、[EMMIM][Ac](98%(w))、[BMMIM][Ac](98%(w)):兰州雨陆精细化工有限公司,使用前在353.15 K 下干燥48 h,使含水量均小于500 mg/L。
DZF-6020 型真空干燥箱:上海博讯实业有限公司;ZSD-2 型卡尔费休水分测定仪:上海安亭电子仪器有限公司;CE-2 型气液平衡釜:北洋化工设备公司;GC7890A型气相色谱仪:Agilent公司。
1.2 实验方法
在101.3 kPa 条件下使用气液平衡釜测定等压气液相平衡数据。首先采用称重法配制MP 与ILs的混合试样,天平精度0.000 1 g;然后将配制好的MP 与ILs 的混合试样约50 mL 加入到平衡釜中加热至沸腾。沸腾后,体系温度稳定不变且保持约30 min 时,可视为已达到气液相平衡状态,记录此时平衡温度,并用微量进样器分别从气相和液相采样口进行取样分析,最后再分批次加入甲醇与ILs 的混合溶液。实验中对气液相平衡温度的测量选用精确校准过的水银温度计,标准不确定度为0.006 K。
采用配有顶空进样器的气相色谱仪对气相和液相试样进行分析,检测器为FID,色谱柱为DBWAXETR 型毛细管柱(30 m×0.32 mm×1 μm),进样口和检测器温度为473 K,柱箱采用程序升温加热,保持323 K 状态1 min,然后以5 K/min 的升温速率升至343 K。由于它们的蒸汽压可以忽略不计,ILs 仅存在于液体试样中。因此,ILs 含量通过测量真空干燥后液相试样的质量变化得到。
2 结果与讨论
2.1 ILs 的筛选
使用 COSMOthermX 软件计算了由27 种阳离子和26 种阴离子组成的ILs 对MP 和甲醇的溶解度和选择性。不同ILs 的选择性见图1,用于筛选的阳离子和阴离子见表1。从图1 可看出,阴离子对ILs 的选择性起决定作用,且[Ac]-基ILs 比其他ILs 具有更高的选择性。

表1 阴阳离子Table 1 Anions and cations
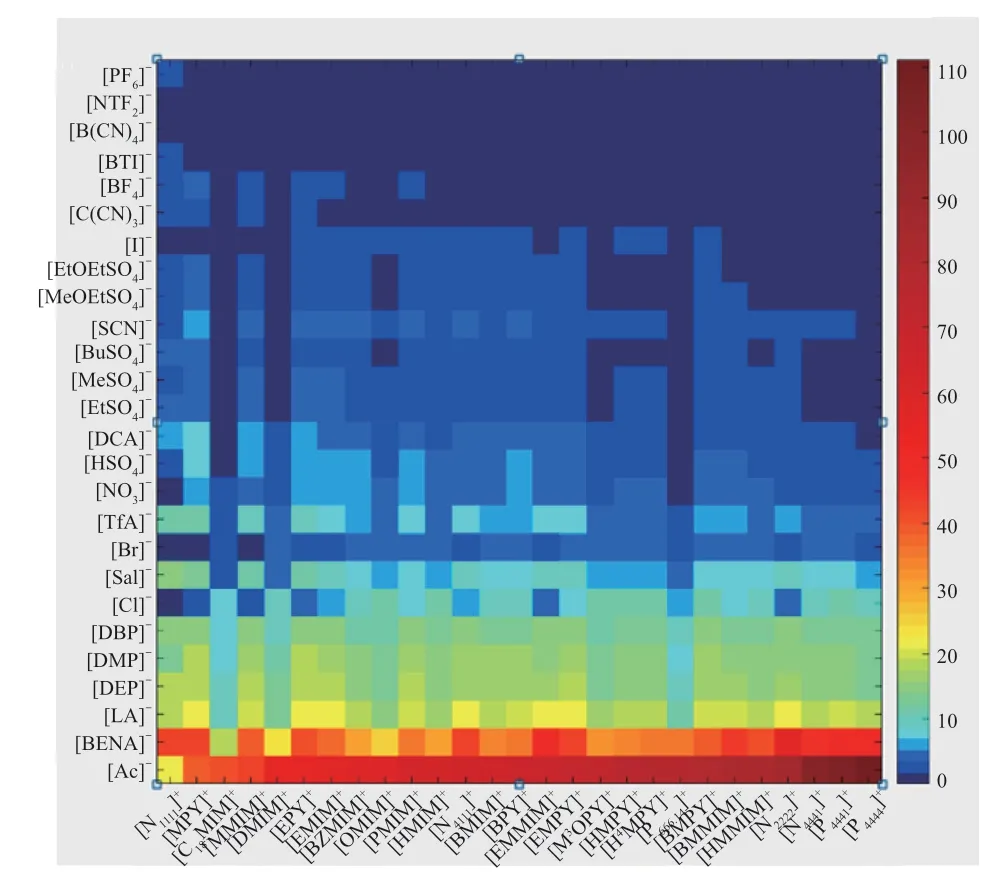
图1 COSMOthermX 计算的选择性数据Fig.1 The selectivity data calculated by COSMOthermX.
含有[Ac]-阴离子的ILs 对MP 及甲醇的溶解度见表2。
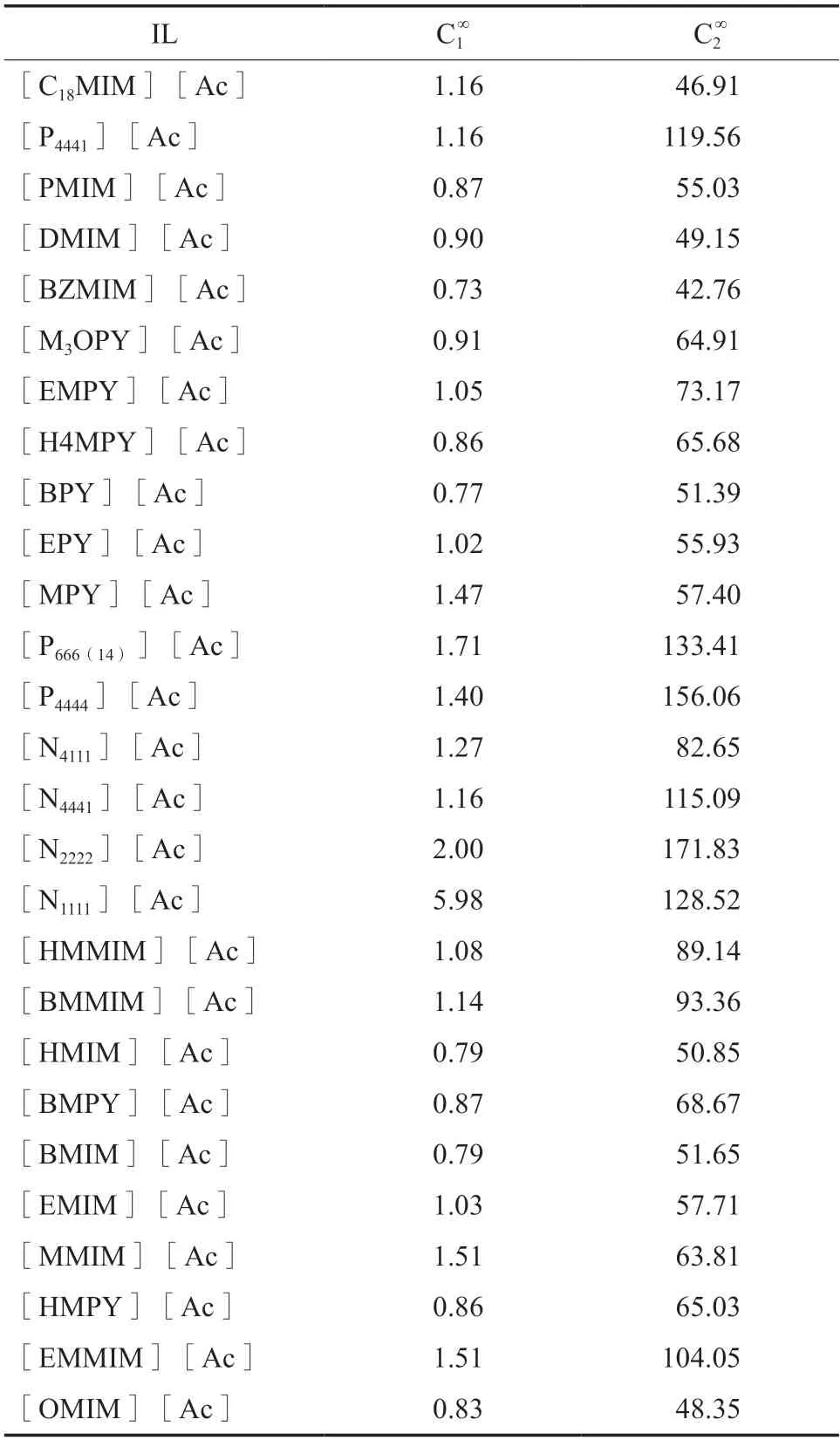
表2 含有[AC]-阴离子的ILs 对MP 及甲醇的溶解度Table 2 The predicted solubility of methyl propionate (MP)(1)and MeOH(2) in ionic liquids(ILs) containing[Ac]- anion
2.2 气液相平衡数据
为了证明实验装置和实验方法的可靠性,在101.3 kPa 下测得MP(1)+MeOH(2)体系的二元气液相平衡数据,结果见图2。由图2 可知,实验数据与文献值[12]基本一致,表明所用设备和方法可靠。
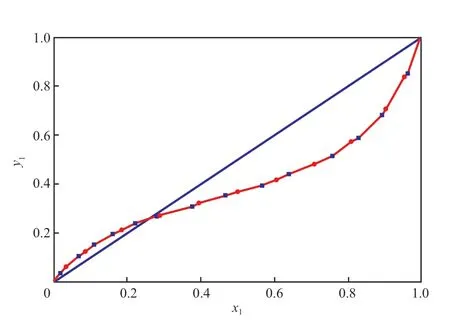
图2 MP(1)+MeOH(2)二元体系在101.3 kPa 下的气液平衡数据Fig.2 Vapor-liquid equilibrium(VLE) data for the binary system of MP(1)+MeOH(2) at 101.3 kPa.
三元体系MP(1)+MeOH(2)+[EMIM][Ac](3),MP(1)+MeOH(2)+[EMMIM][Ac](3),MP(1)+MeOH(2)+[BMMIM][Ac](3)在101.3 kPa 下的气液相平衡数据分别见表3~5。每种ILs 的摩尔分数保持在0.05,0.06,0.08,其中,x1和y1为液相和气相MP 的摩尔分数,x3为液相中ILs 的摩尔分数,是不包括ILs 的液相中MP 的摩尔分数,α12是MP 相对于甲醇的相对挥发度。
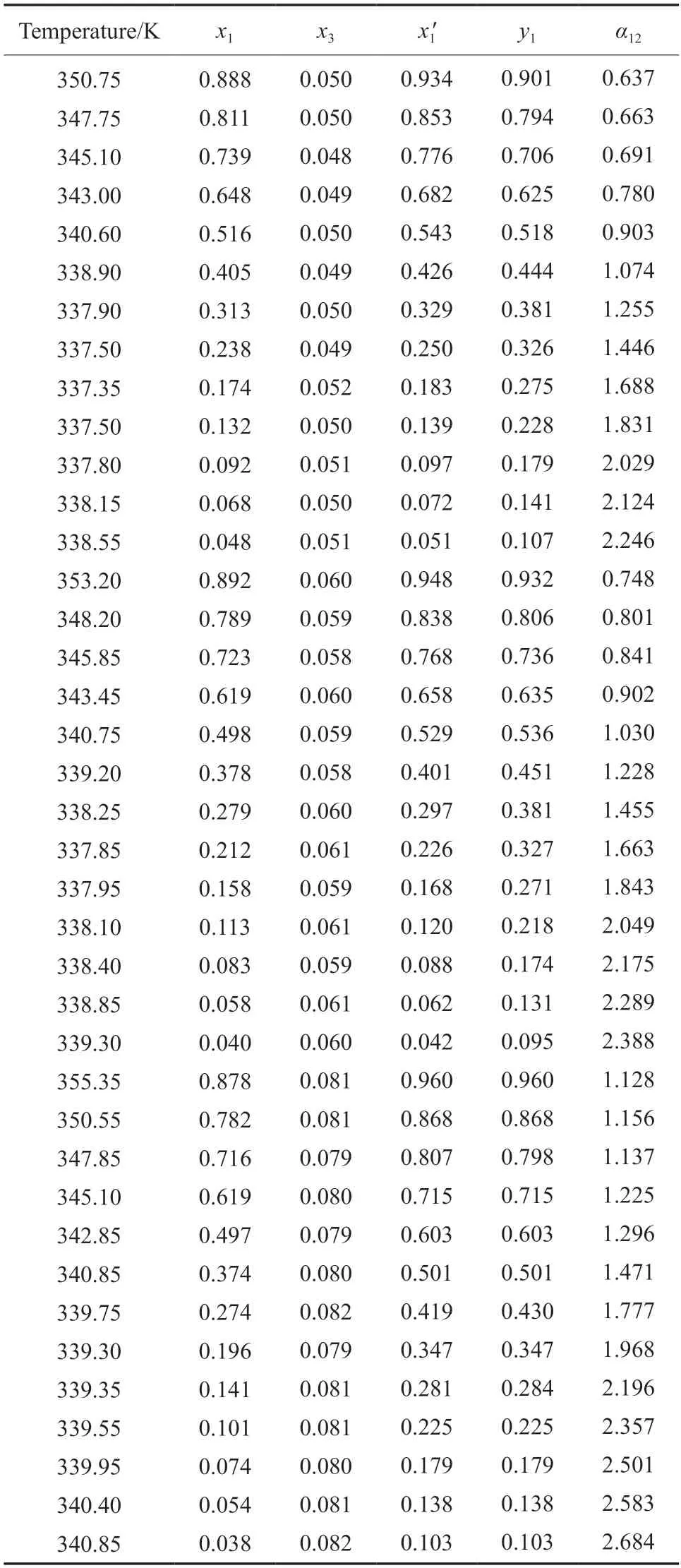
表3 101.3 kPa 下MP(1)+甲醇(2)+[EMIM][Ac](3)三元体系气液相平衡数据Table 3 VLE data for the ternary system of MP(1)+MeOH(2) +[EMIM][Ac](3) at 101.3 kPa
2.3 热力学一致性验证
二元数据的热力学一致性检测采用Wisniak 的L-W 法[13],三元数据的热力学一致性检测采用van Ness 法[14]。热力学一致性检验结果见表6。如果L-W 法中的参数Fk的值小于5,则第k个实验数据点在热力学上是一致的;如果L-W 法中的参数F值小于5 且van Ness 法中的参数Δy值小于1,则所有气液相平衡数据都符合热力学一致性。从表6 可看出,所有实验数据符合热力学一致性。
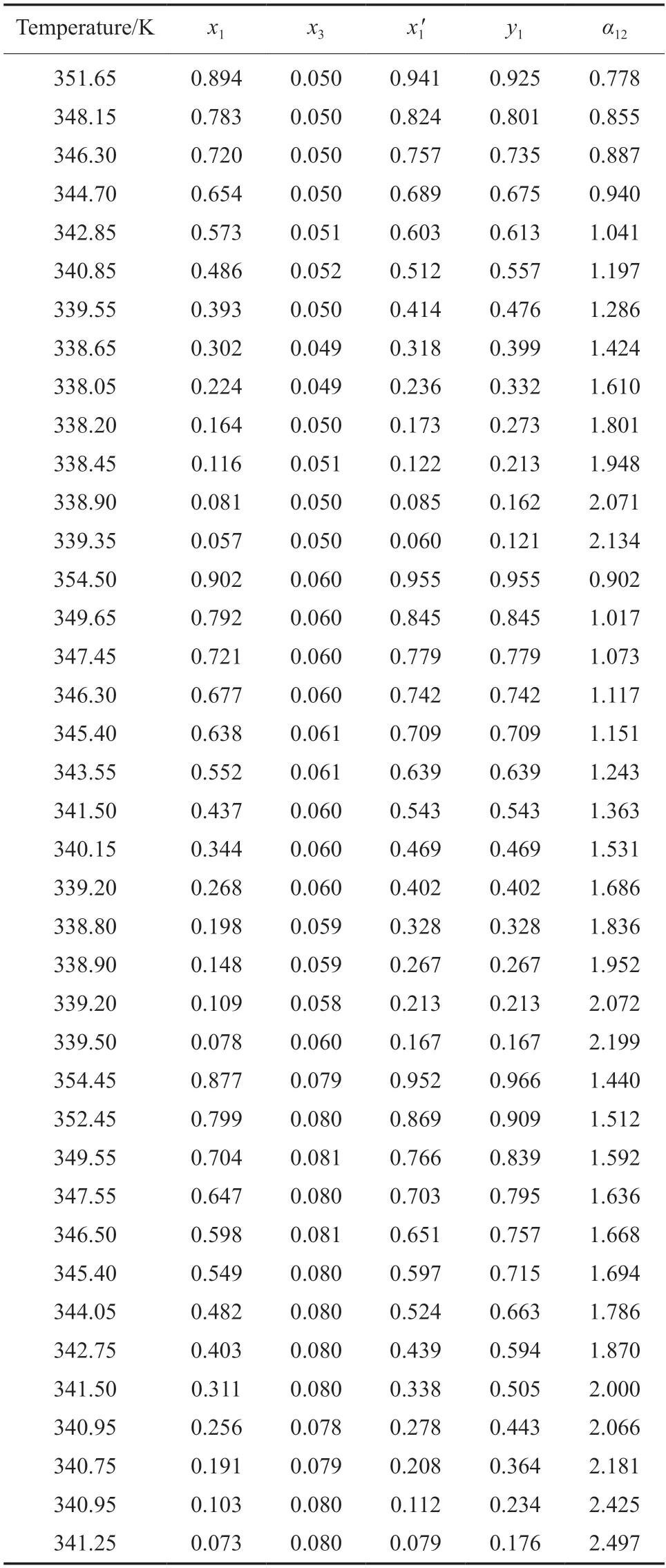
表4 101.3 kPa MP(1)+甲醇(2)+[EMMIM][Ac](3)三元体系气液相平衡数据Table 4 VLE data for the ternary system of MP(1)+MeOH(2) +[EMMIM][Ac]at 101.3 kPa
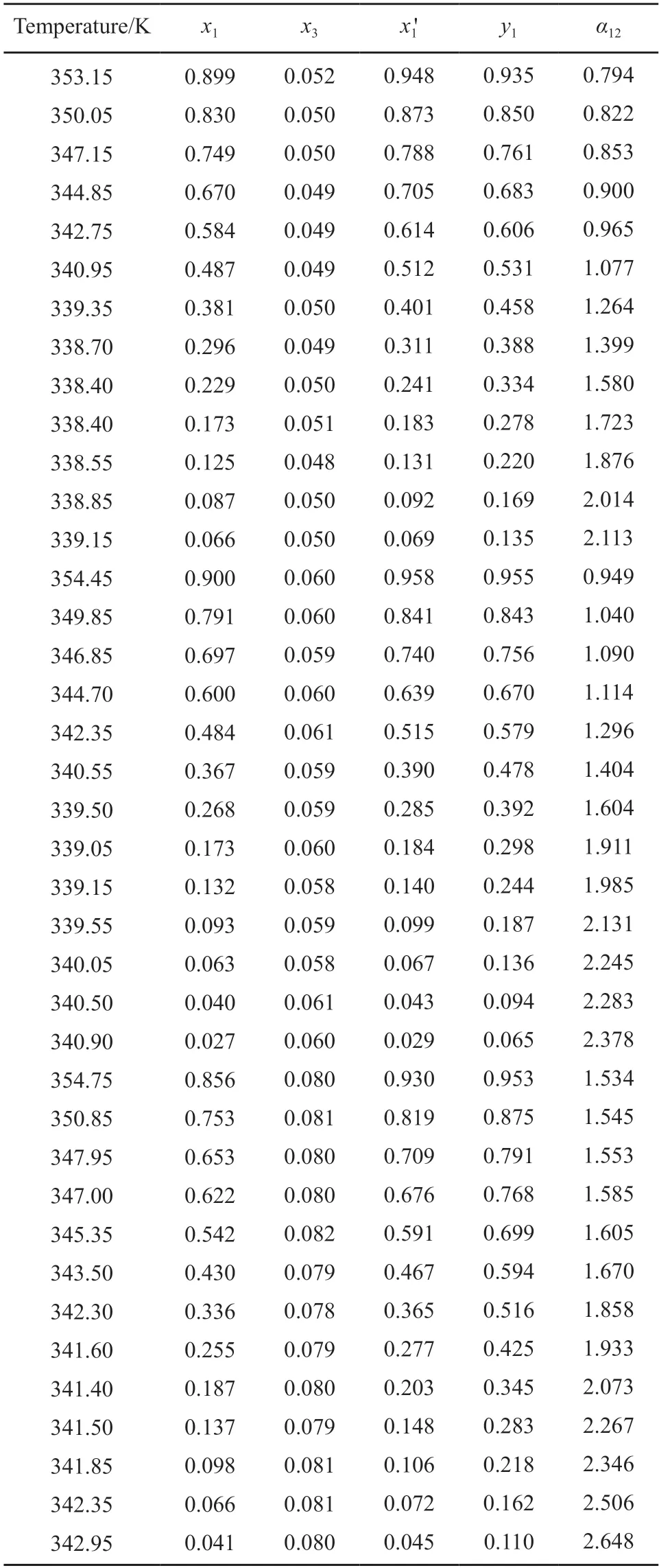
表5 101.3 kPa MP(1)+甲醇(2)+[BMMIM][Ac](3)三元体系气液相平衡数据Table 5 VLE data for the ternary system of MP(1) +MeOH(2) +[BMMIM][Ac]at 101.3 kPa
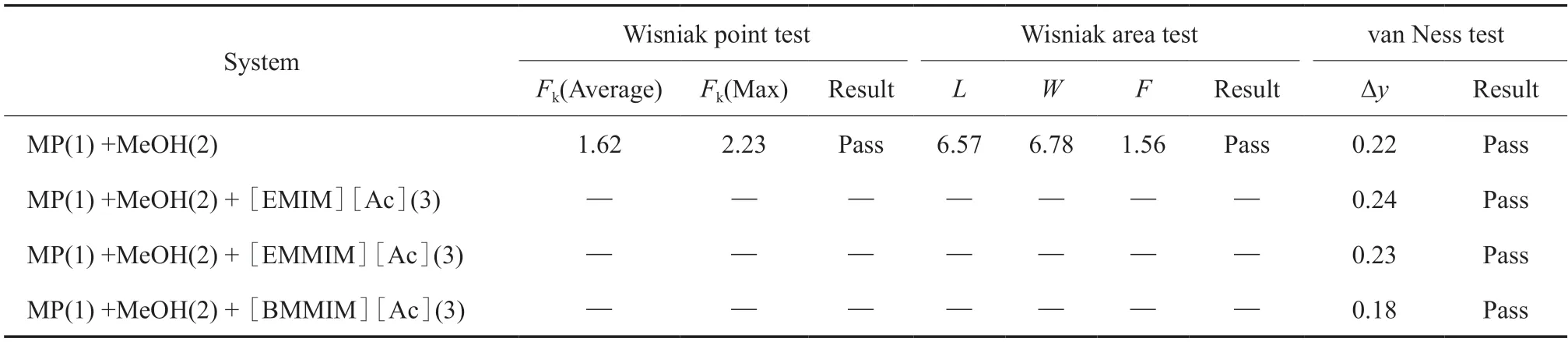
表6 热力学一致性测试结果Table 6 The tested results of thermodynamic consistency
2.4 数据关联性
将实验数据与合适的活度系数模型相关联,对于分离MP 和甲醇的萃取精馏过程的模拟和设计非常重要。对含ILs 的体系,常用的模型有NRTL,UNIFAC-Lei,UNIQUAC 等[15-16]。其中,UNIQUAC 模型中使用的两个参数r和q不随温度变化而变化,因此会导致拟合结果产生一定的误差。对其他含ILs 的醇-酯体系,UNIFAC-Lei 和UNIQUAC 模型的平均相对偏差(ARD)均过大,而NRTL 模型的ARD 偏差最小[17-18]。因此,本工作使用NRTL 模型进行数据关联。
模型参数由实验数据回归,采用Levenberg-Marquardt 方法最小化目标函数,表7 列出了回归所得模型参数和NRTL 模型的ARD。从表7 可看出,NRTL 模型适合用于描述本工作所研究体系的气液相平衡行为。
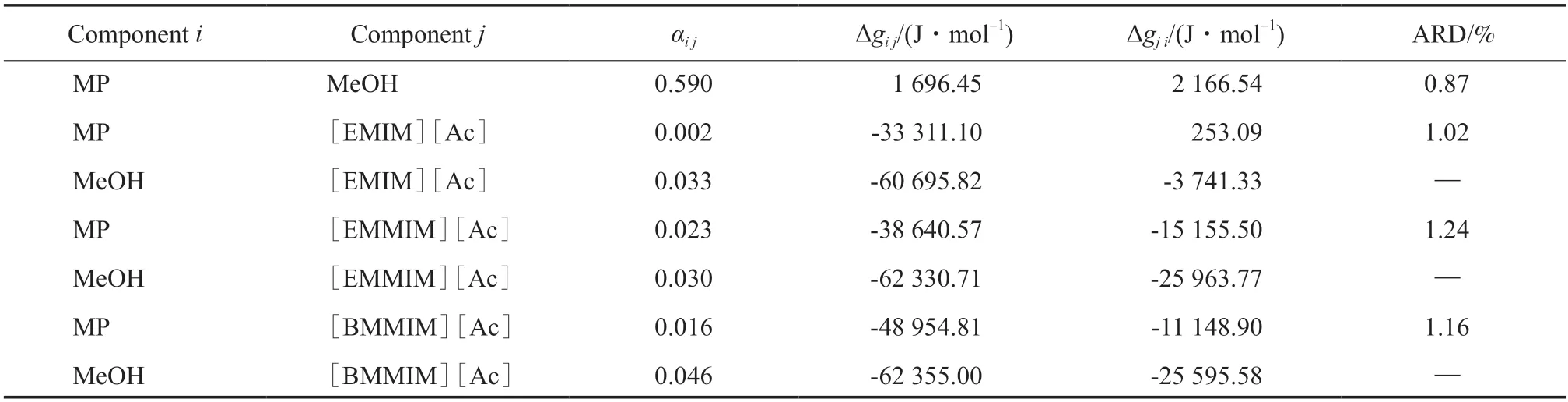
表7 NRTL 模型的二元交互参数Table 7 Binary interaction parameters of NRTL model
图3 为MP(1)+甲醇(2)+IL(3)三元体系在101.3 kPa 时的曲线。由图3 可看出,[EMIM][Ac],[EMMIM][Ac],[BMMIM][Ac]三种ILs 的加入可以提高气相中MP 的含量,即对MP 有盐析作用。此外,随三种ILs 浓度的增加,盐析效应变得更加明显,共沸点也向右移动。当三种ILs 的摩尔分数达到0.08 时,共沸点完全消失。

图3 三元体系在101.3 kPa 下的′-y1 曲线Fig.3 ′-y1 diagram for three system at 101.3 kPa.
图4 为[EMIM][Ac],[EMMIM][Ac],[BMMIM][Ac]对MP 相对于甲醇的相对挥发度的影响。从图4 可看出,三种ILs 的加入使MP 相对于甲醇的相对挥发度得到显着提高。随ILs 摩尔分数的增加,这种现象变得更加明显。当三种ILs 的摩尔分数增加到0.08 时,MP 相对于甲醇的相对挥发度在整个浓度范围内为大于1,表明共沸现象被消除。根据NRTL 模型的计算结果,[EMIM][Ac],[EMMIM][Ac],[BMMIM][Ac]的最小打破共沸摩尔分数分别为0.074 8,0.066 0,0.063 1。对MP+甲醇共沸体系,[HMIM][NTf2]的分离效果较好,在摩尔分数为0.1 时可以打破MP 和甲醇的共沸点[12]。本工作报道的三种ILs 的分离性能均优于文献报道的[HMIM][NTf2],另外,三种ILs 中,[BMMIM][Ac]的分离性能最好,其次是[EMMIM][Ac]和[EMIM][Ac]。

图4 在101.3 kPa 下[EMIM][Ac](a),[EMMIM][Ac](b),[BMMIM][Ac](c)对MP 相对于甲醇相对挥发度的影响Fig.4 Effect of[EMIM][Ac](a),[EMMIM][Ac](b),[BMMIM][Ac](c) on the relative volatility of MP relative to MeOH at 101.3 kPa.
2.5 过量焓分析
过量焓是经典化学热力学中溶液非理想行为的重要指标。如果过量焓大于0,则表示溶解过程是吸热的,溶质与溶剂之间的相互作用较弱。如果过量焓小于0,则表明溶解过程是放热的,溶质与溶剂之间形成的相互作用很强。二元混合物的过量焓由静电配位、范德华力和氢键组成[19]。使用COSMOthermX 19.0 软件计算[EMIM][Ac],[EMMIM][Ac],[BMMIM][Ac]分别与MP+甲醇二元系统在298.15 K 下的过量焓,计算结果见表8。
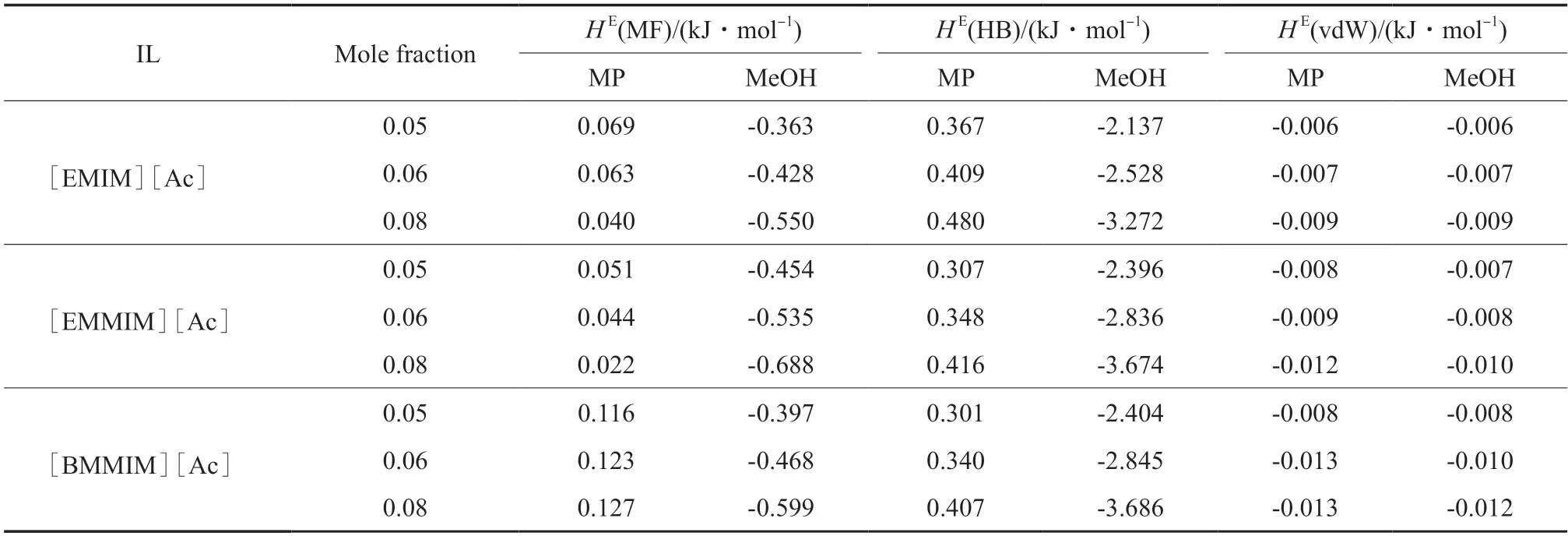
表8 在298.15 K 下不同组成的ILs 与MP 或甲醇二元体系的过量焓Table 8 The excess enthalpy of ILs and MP or methanol at a specific mole fraction of 298.15 K
由表8 可看出,三种ILs 与MP 的溶解过程是吸热过程,与甲醇的溶解过程是放热过程,表明IL 与甲醇之间的相互作用强于IL 与MP 之间的相互作用。因此,甲醇被ILs“绑定”,而MP 变得更易挥发,导致MP 对甲醇的相对挥发度增加。此外,随ILs 浓度的增加,ILs 与甲醇溶解过程的放热效应更加明显。且在相同摩尔分数下,三种ILs 与甲醇溶解过程的放热效应强度大小顺序为:[BMMIM][Ac]>[EMMIM][Ac]>[EMIM][Ac],表明三种ILs 与甲醇相互作用的大小顺序为:[BMMIM][Ac]>[EMMIM][Ac]>[EMIM][Ac],因此,[BMMIM][Ac]的分离能力强于[EMIM][Ac]和[EMMIM][Ac],与实验结果一致。
3 结论
1)使用COSMOthermX19 软件,从由27 种阳离子和26 种阴离子所构成的702 种ILs 筛选出[BMMIM][Ac],[EMMIM][Ac],[EMIM][Ac]三种ILs 作为分离MP+甲醇体系的萃取剂。
2)在101.3 kPa 下测定了MP+甲醇二元体系及MP+甲醇+ILs 三元体系的气液相平衡数据,三种ILs 的加入均可提高MP 对甲醇的相对挥发度,且当ILs 的摩尔分数达到0.08 时,能够打破MP 和甲醇的共沸。
3)NRTL 模型对研究MP+甲醇+IL 体系具有良好的适用性,NRTL 模型计算结果显示,[BMMIM]·[Ac],[EMMIM][Ac],[EMIM][Ac]打破MP+甲醇体系共沸的最小摩尔分数分别为0.063 1,0.066 0,0.074 8,优于文献报道的[HMIM][NTf2]的分离效果。
4)过量焓分析结果表明,三种ILs 与甲醇具有较强的相互作用,可提高MP 相对于甲醇的相对挥发度,而三种ILs 分离效果的差异可归因于它们与甲醇相互作用的强度不同。

