山东省黑松枯萎病病原鉴定、致病性及其生长适应性研究
吕娟,亓玉昆,季延平,张宗侠,赵海燕,刘慇,韩凤英,王清海*
山东省黑松枯萎病病原鉴定、致病性及其生长适应性研究
吕娟1,2,亓玉昆2,季延平2,张宗侠1,赵海燕3,刘慇2,韩凤英4,王清海2*
1. 济南市园林和林业科学研究院, 山东 济南 250103 2. 山东省林业科学研究院, 山东 济南 250014 3. 青岛市城阳区自然资源局, 山东 青岛 266109 4. 山东农业工程学院, 山东 济南 251100
为明确黑松枯萎病病原菌种类及其生物学特性,采用组织分离法和单孢分离法对其分离纯化,通过形态学、多基因系统发育分析对其鉴定,利用活体接种法测定其致病性,并探讨不同培养基类型、温度、pH、光照等处理条件下菌丝生长速率,确定其适宜生长条件。结果表明,引起黑松萎病的病原菌为尖孢镰刀菌()。该病原菌适宜生长温度为25 °C~30 °C,25 °C为最适温度;最适pH为5.0-10.0;PDA培养基和PSA培养基最适菌丝生长,持续光照、持续黑暗以及光照12 h:黑暗12 h处理对菌丝生长无显著性影响。
黑松枯萎病; 病原鉴定; 致病性
松树()是一种重要的优质用材树以及荒山绿化的先锋树种,在水土保持、涵养水源和防风固沙等方面发挥着重要作用。然而,松树在生长季节中易受到多种生物因素(比如松材线虫、病原真菌、日本松干蚧等)的危害,导致松针失绿,整株枯萎。其中松材线虫现阶段给我国松林带来重大危害及威胁[1],是近几十年来我国发生最严重、最危险的重大林业病害[2]。除此之外,松针褐斑病()[3]、松枝枯病()[4]、松枯梢病()[5]、松落针病(spp.)[6]、日本松干蚧[7]等也在不同时期、不同地域,造成松林大面积枯死。
山东省松林资源400,200多万m2,以生态公益林为主,主要为黑松()、赤松(),绝大多数为上世纪50-60年代栽植,树龄老化,加之近几年持续干旱以及冬春季异常低温,导致松树树势衰弱[4]。2019年10月下旬以来,在山东省沿海地区松林陆续出现松针失绿、变色枯萎,发病速度快,严重时整株枯死,造成松树大面积死亡。仅2019年12月至2020年2月青岛市松树枯死数量从50 332株增加至161 547株,经取样镜检鉴定松林,仅在少量松材线虫病疫情小班松林中发现松材线虫,排除该松树枯萎病是松材线虫侵染引起[8]。在松针失绿干枯部位,病征不明显。因此,为明确黑松枯萎的致病因子,本研究从染病的黑松上分离具有枯萎病典型症状的菌株,通过形态特征、多基因系统发育分析对其进行鉴定,并初步探究其生长适应性,为该病害的发生、流行规律及其防治提供参考依据。
1 材料与方法
1.1 供试材料
2020年3月,从山东省青岛市城阳区丹山采集整棵刚感病,尚未完全枯死的黑松(=5 cm,=1.8 m),针叶已经开始失绿,松针灰白色。将整棵树全部采集,从基部开始每隔20 cm,切段,从松树顶端开始样本进行编号,共分为9段,带回实验室放在4 ℃的冰箱里保存备用。
1.2 方法
1.2.1 病原菌的分离纯化采用组织分离法。将采集每段样品,主干侧枝部位切成0.5 cm厚的圆盘,然后剪成3~4 mm2的组织块,松针剪成5 mm松针段。样品先用70%乙醇溶液浸泡1 min,然后再用1%次氯酸钠溶液处理1 min,最后无菌水冲洗3次。每个PDA培养基平板上放置3块,25 ℃培养5 d。挑取单个菌落,转移到新的PDA平板中,25 ℃培养7 d,采用稀释法进行单孢纯化。将单菌落菌株移置于PDA斜面试管中培养,4 ℃保存。所有菌株均保存于山东省林业科学研究院森林保护研究所。
1.2.2致病性测定采用活体接种法。选用了健康无病的1年生黑松苗,进行盆栽,栽培所用土壤在121 ℃条件下湿热灭菌2 h,自然冷却后,进行盆栽。将盆栽后的黑松苗置于室外管理,60 d后,选择20棵健康无病、生长一致的黑松苗进行致病性试验。将分离纯化的菌株在PDA平板上培养5 d,在菌落边缘用打孔器制作菌饼(= 5 mm),以空白PDA培养基为对照。选择在阴天的下午,用无菌的手术刀在黑松苗干基部切成“T”型伤口,每个伤口接种1片菌饼,以接种空白PDA培养基为对照。在接种伤口处放置无菌水脱脂棉球进行保湿,用封口膜包裹固定。处理和对照各接种10棵黑松苗。将处理后的盆栽黑松苗至于室外进行浇水、除草等日常管护,观察记录。
1.2.3形态学鉴定 将纯化后的菌株接种在PDA平板上培养5 d后,在菌落边缘利用打孔器制作菌饼(= 5 mm),将菌饼置于PDA平板中央,每个平板置1块菌饼,25 ℃、12 h照射/12 h黑暗交替培养5 d,观察记录菌落特征。记录菌落正面、背面颜色、菌落边缘形状、均匀度,菌落质地。置于25 ℃的黑暗培养,待平板中长出子实体后,用挑针挑取少许,制作临时玻片,在光学显微镜下观察分生孢子形态,利用Qimaging拍照系统拍照。随机选取50个孢子,利用cellSens软件测量其大小。
1.2.4 分子鉴定采用改进的CTAB法进行提取DNA,选择的目的基因分别为核糖体转录间隔区序列(rDNA internal transcribed spacer,ITS)、翻译延伸因子- 1 α ( Partial Translation Elongation Factor-1α,)[9,10]进行扩增。扩增引物参考表1。反应体系:25 μL,包括Taq酶mix 12.5 μL,上游引物下游引物各1 μL,ddH2O 7.5 μL,DNA模板3 μL。PCR产物由上海派森诺生物科技有限公司进行双向测序。
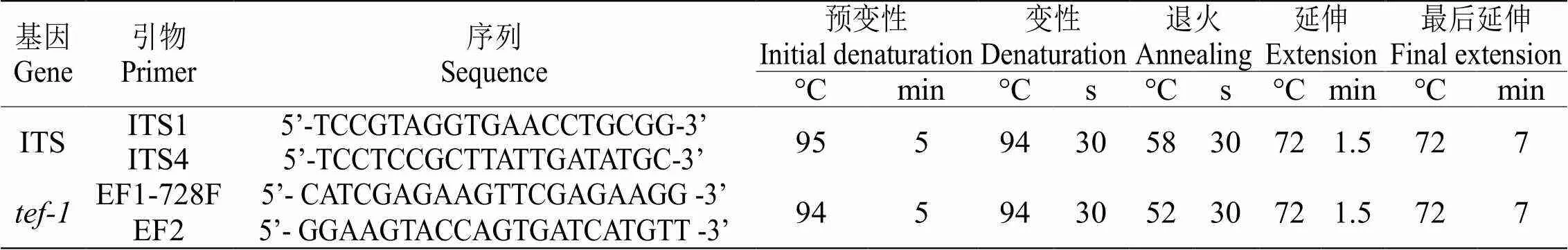
表 1 PCR扩增所用引物及反应程序
将ITS、序列提交到GenBank数据库中,基因编号见表2。将获得的序列在NCBI数据库进行比对。选取24株sp.参考菌株,以(菌株编号为ASHCAn)为外围菌株,运行MEGA 7.0软件中Clustal W对基因序列比对,然后利用Fasta alignment joiner软件通过首尾相连的方法,将 ITS、基因串联。利用MEGA 7.0软件,采用最大似然法(Maximum Likelihood)构建多基因系统发育树,循环1000次,并以自展率(Bootstrap)校对检测。

表 2 用于系统发育分析的参考菌株序列
*表示的是研究菌株。
*Strains collected in the present study.
1.2.5不同培养基对病原菌菌丝生长的影响在PDA培养基、PMA培养基、玉米粉琼脂培养基CMA、PSA培养基、燕麦片培养基OA、沙氏培养基SDA和马丁氏培养基Martin等培养基平板上,接种生长一致的病原菌菌饼(= 5 mm),25 ℃培养,每天16:00采用十字交叉法测量菌落直径,待有菌丝全部长满平板时,停止记录,计算菌丝生长速率。每个试验处理重复3次,平行测定4次。菌丝生长速率计算公式如下:菌丝生长速率=(菌落直径-初始菌饼直径)/培养天数。
1.2.6 不同温度对病原菌菌丝生长的影响取生长一致的病原菌菌饼(= 5 mm)接种到PDA平板中,分别放置于10、15、20、25、30、35 ℃等6个温度梯度恒温培养箱内,黑暗培养,测量记录方法同1.2.5。
1.2.7 不同pH值对病原菌菌丝生长的影响以PDA培养基为基础培养基,用1 mol/HCL和1 mol/NaOH溶液,分别将培养基pH值调制为4.0、5.0、6.0、7.0、8.0、9.0、10.0,共7个处理。在无菌条件下,取直径5 mm菌饼分别接种至不同pH的PDA平板中央,25 ℃黑暗培养,测量记录方法同1.2.5。
1.2.8 不同光照对病原菌菌丝生长的影响生长一致的病原菌菌饼(= 5 mm)接种到PDA平板中,设置光照24 h、黑白交替12 h、黑暗24 h等3个光照条件处理,25 ℃培养,测量记录方法同1.2.5。
1.2.9 数据分析处理试验数据利用spss 20.0进行数据分析,差异显著性分析采用采用LSD比较法。
2 结果与分析
2.1 黑松枯萎病症状
发病初期,黑松松针逐渐失绿,呈灰白色,随着病情扩展,后期松针变为黄褐色,干枯,易脱落,部分黑松存留少量绿色松枝,发病严重的整株枯死(图1)。松针变色从松针针尖向针鞘逐步扩展,但在松针上未见明显病斑症状及子实体。刚枯死的黑松木材新鲜湿润,有少量松脂渗出。

图 1 黑松枯萎病田间症状
2.2 分离菌株致病性测定
采取活体盆栽接种法,30 d后,接种的10棵黑松中有8棵在接种点附近出现黑色斑点,后期形成黑色子实体;初期顶端松针失水干枯,下方松针随后干枯,最终整株枯萎死亡(如图2),致死率为80%。而空白对照未发现枯萎症状,对接种后发病的植株部位进行分离,获得的菌株与接种菌株一致。

图 2 致病性试验
(A) 黑松苗接种30 d后症状, (B) 接种部位症状, (C) 对照
(A) symptoms onseedlings (2-years old) inoculated with isolate S81 for 30 days; (B) symptoms on inoculation sites; (C) CK
2.3 病原菌形态特征观察
菌株S81在PDA培养基25 ℃黑暗环境下培养10 d后,菌落白色、淡粉色或淡紫色,边缘整齐,气生菌丝较发达,菌落呈棉花状,菌落厚重;背面呈紫红色(如图3)。在光学显微镜下可以看到2种类型的孢子,分别是小型分生孢子和厚垣孢子。小型分生孢子呈椭圆形或长卵圆形,分生孢子大小为13.0 ± 2.9 × 3.8 ± 0.5 μm(=50),具1-2个隔膜;厚垣孢子呈球形或近球形(如图3)。其菌落形态特征、分生孢子形状、大小符合镰刀菌属(sp.)特征描述。

图 3 S81菌株菌落形态
(A)菌落形态, (B)-(C) 子实体, (D) 分生孢子
(A) cultural character; (B) acervulus; (C) conidia
2.4 病原菌分子鉴定结果
将获得的S81菌株与24株参考菌株的ITS、基因序列进行比对,以(菌株编号为ASHCAn)作为外围菌株,采用最大似然法(Maximum Likelihood)构建多基因系统发育树。系统发育树最高对数似然值为-3061.43。菌株S81与6株参考菌株聚在同一分支上,自展率为99%(图4)。
因此根据形态学与多基因分子序列分析,本次分离获得的菌株为尖孢镰刀菌()。
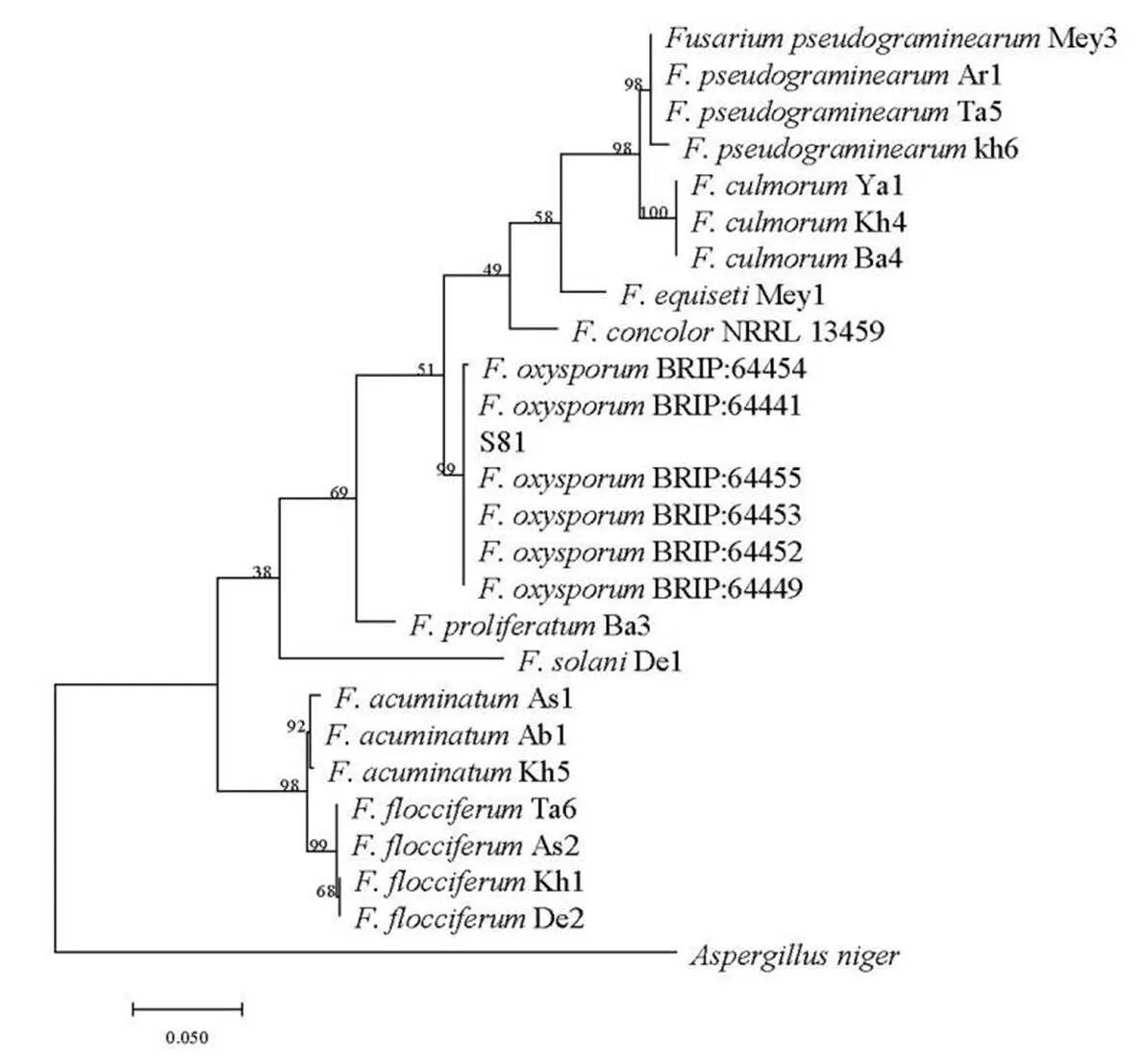
图 4 利用最大似然法基于黑松枯萎病菌ITS和tef-1的基因数据构建的系统发育树。自展率标于节点处,所用模式菌株由粗体表示,以Aspergillus niger为外围菌株,标尺指示0.05步变化。
2.5 不同培养基对菌丝生长的影响
由图5可以看出,S81菌株在不同的培养基上菌丝生长速率不同。在PDA和PSA培养基上生长最好,菌丝生长速率为1.22 ± 0.11 cm/d,1.25 ± 0.10 cm/d,明显高于其它培养基处理,在<0.01水平上具有显著性差异。SDA和CMA培养基不适宜菌株生长,菌丝生长速率仅为0.92 ± 0.19 cm/d和0.88 ± 0.16 cm/d。
2.6 不同温度对病原菌菌丝生长的影响
图6结果表明,不同温度对S81菌株菌丝生长速率的有着显著的影响,在温度25 - 30 ℃时菌丝生长速率最快,可达0.96 ± 0.17 cm/d – 1.07 ± 0.23 cm/d,在温度为20 ℃时,该菌株的生长速率显著降低,生长速率为0.75 ± 0.08 cm/d,在温度低于15 ℃或高于35 ℃时,该菌株生长缓慢或停止生长。
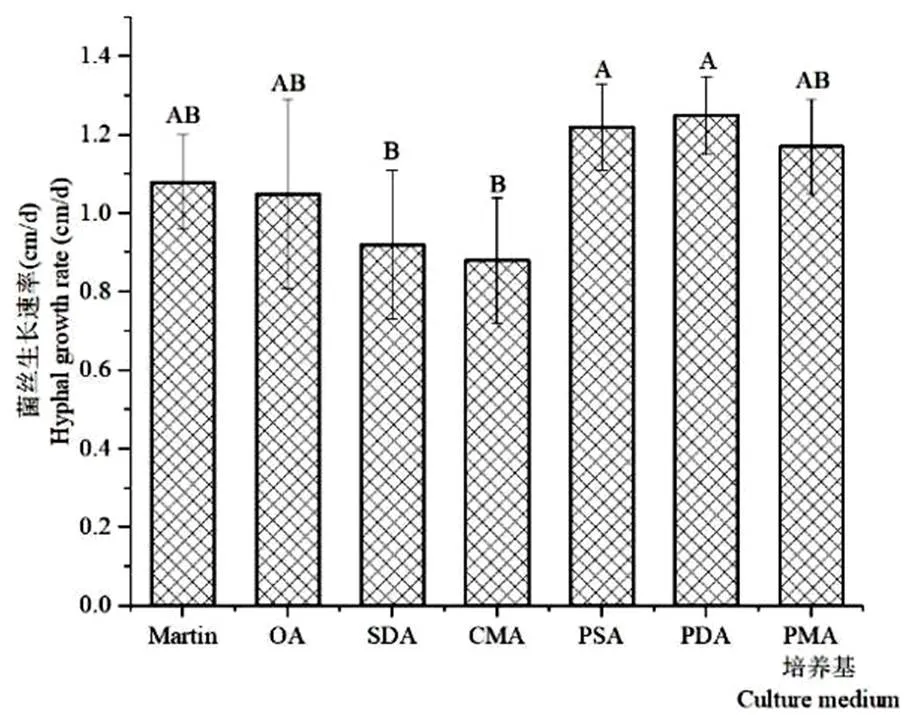
图 5 不同培养基对S81菌株菌丝生长的影响

图 6 不同温度对S81菌株菌丝生长的影响
2.7 不同pH值对病原菌菌丝生长的影响
适宜S81菌株菌丝生长的pH值范围较广,在pH 4.0 – 10.0的范围内菌丝均能生长。在pH 4.0条件下,菌丝生长受到抑制,菌丝生长速率仅为0.40 ± 0.24 cm/d,在pH 5.0 – 10.0之间,菌丝生长速率为0.96 ± 0.07 cm/d -1.08 ± 0.09 cm/d,在0.01水平上无显著差异(图7)。
2.8 不同光照对病原菌菌丝生长的影响
图8结果表明,24 h黑暗、24 h光照以及12 h黑暗:12 h光照等3种处理下,S81菌株菌丝生长速度分别为1.15 ± 0.14 cm/d、1.10 ± 0.12 cm/d、1.13 ± 0.15 cm/d,在< 0.01水平上无显著性差异。
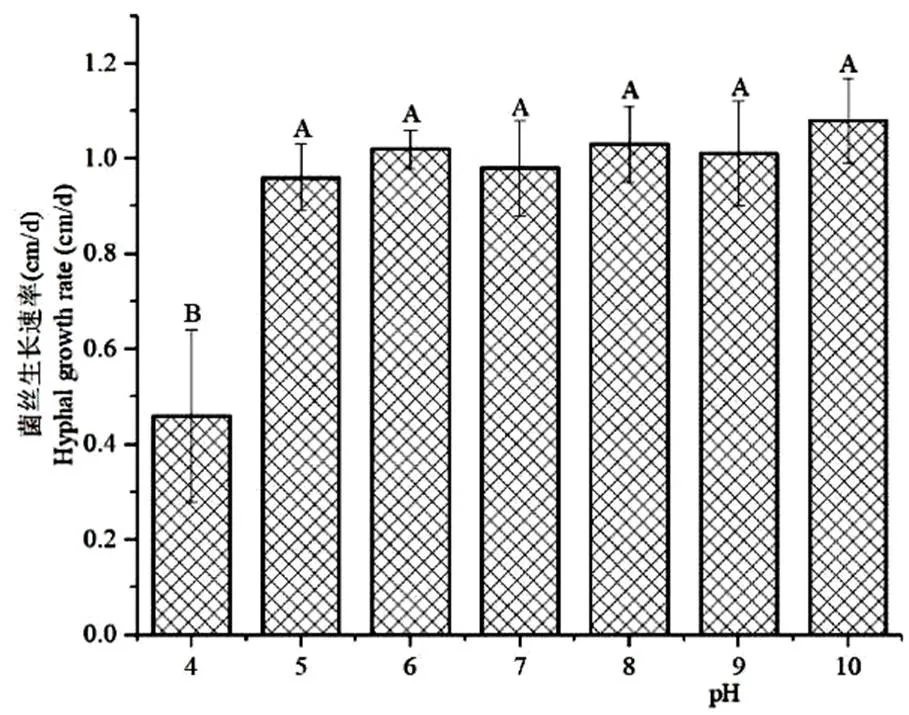
图 7 不同pH对S81菌株菌丝生长的影响
图 8 光照对S81菌株菌丝生长的影响
3 结论与讨论
本实验对山东青岛市城阳区丹山感病黑松采样,分离培养,通过对菌株的its、多基因系统发育分析,结合形态特征、培养性状,确定分离获得的菌株为尖孢镰刀菌()。通过接种1年生黑松盆栽苗,80%的黑松苗出现与林间相似的枯萎症状,表明尖孢镰刀菌可以引起黑松枯萎死亡。尖孢镰刀菌是一种土传植物病原真菌,全球广泛分布。寄主范围广,可侵染100多种具有重要价值的作物,引起寄主植物维管束褐变、叶片失水萎蔫、脱落,植物吸收营养的能力减弱,致使植物死亡,造成严重的经济损失[11]。在种的水平上,尖孢镰刀菌寄主范围广泛,然而,对于单个菌株,其具有明显的寄主专化性[12,13],尖孢镰刀菌具有致病性的至少有150个寄主专化型。由于种内具有相对丰富的生物多样性,尖孢镰刀菌能够在短时间内适应环境变化,形成新的致病菌株[11]。由于其强致病力以及造成的经济损失,尖孢镰刀菌是公认的全球第五大植物病原真菌[14]。
引起松树枯萎的因子有环境因子和生物因子。环境因子中大气污染、环境气候(极端天气)、土壤因素均可以引起松树干枯死亡。病原线虫、病害因素、虫害因素等生物因子中,最主要的是松材线虫。松材线虫病可以引起松林大面积死亡,是松树疫情,是目前松树枯萎重点考虑因素。除此之外,镰刀菌属真菌中有多个种均可以侵染松树造成松树死亡。是松属植物中最重要的病原菌之一,侵染松树,引起溃疡病[15],是重要的检疫对象。f. sp.在美国加利福尼亚、新西兰可以侵染辐射松()[16,17],在南非侵染展叶松(),引起根腐病[18]。[19,20]、[21]、[22]侵染阿勒颇松()、北美乔松()。[23]同样可以危害阿勒颇松引起猝倒病。也可以侵染意大利石松()[24]。能够侵染欧洲赤松()[25]、北美乔松[19]。可以危害辐射松[17]。,,,,,,,均可以引起北美乔松根腐病[19]。可以侵染多种松属植物,在哥伦比亚侵染展叶松和纸松()[26],在印度可以引起乔松()根腐病[27],危害意大利石松[24],在西班牙引起欧洲赤松猝倒病[25],在新西兰危害辐射松[17]。已有的报道表明,在中国尖孢镰刀菌可以侵染马尾松,引起猝倒病[28]。本实验结果证实,同样可以引起黑松枯萎死亡。明确致病因子是控制病害的重要前提,因此,在中国探讨松树枯萎原因时,镰刀菌属真菌尤其是尖孢镰刀菌是不可忽视的生物因素之一。
温度、光照和pH是影响菌株生长的重要的环境因子。本试验测试了温度、光照以及pH对尖孢镰刀菌S81菌株菌丝生长速率的影响,结果表明,尖孢镰刀菌S81对光照、酸碱度具有广泛的适应性,在pH 5.0 - 10.0范围内,24 h持续光照、24 h持续黑暗、12 h光照:12 h黑暗等3种光照条件下菌丝生长速率无显著性影响。温度对S81菌株菌丝生长具有显著性影响,最适温度25 ℃,低于15 ℃,或高于35 ℃,菌丝生长缓慢或停止生长。病害在林间的扩展蔓延与菌株自身的生物学特性紧密相关,摸清其生物学特性,对病害的预测预报及有效防控具有重要意义。本研究结果对于青岛市松树异常枯萎原因诊断分析及针对性防控提供了重要的基础数据,也为该病害今后的预测预报、防控提供了基础的理论依据。
[1] 杨宝君.松材线虫病致病机理的研究进展[J].中国森林病虫,2002,21(1):27-31,14
[2] 叶建仁.松材线虫病在中国的流行现状,防治技术与对策分析[J].林业科学,2019,55(9):1-10
[3] 吴小芹.我国松树主要针叶病害发生概况及其防治[J].森林病虫通讯,1993(1):37-41
[4] 姚文生,李占鹏,耿以龙等山东省松枝枯病发生情况调查[J].山东林业科技,2000(2):28-30
[5] 吴小芹.全球松树枯梢病发生状况与防治策略[J].世界林业研究,1999(1):16-21
[6] 宋玉双,何秉章,王福生.我国松落针病研究的新进展[J].森林病虫通讯,1994(2):42-46
[7] 赵石峰,常国斌,党中玉.我国日本松干蚧的发生情况和对策[J].林业科技通讯,1990(12):1-3
[8] 孙玉江,张磊,陈香芹,等.青岛市松树异常枯萎调查及处置方法探析[J].河北林业科技,2021(1)::33-37
[9] Le DP, Tran TT, Gregson A,.sequence-based diversity ofspecies recovered from collar rot diseased cotton seedlings in New South Wales, Australia [J]. Australas Plant Pathol., 2020,49:277-284
[10] Wang JP, Zheng CY. Characterization of a newly discoveredisolate toPerganda, a non-native invasive species in China [J]. Microbiol. Res., 2012,167:116-120
[11] Smith-White J, Gunn L, Summerell B. Analysis of diversity withinpopulations using molecular and vegetative compatibility grouping [J]. Australas Plant Pathol., 2001,30:153-157
[12] Armstrong GM, Armstrong JK. Formae speciales and races ofcausing wilt diseases. In: Fusarium: Diseases, Biology and Taxonomy (Cook, R., ed.) [M]. University Park, PA: Penn State University Press, 1981
[13] Gordon T, Martyn R. The evolutionary biology of[J]. Annu. Rev. Phytopathol., 1997,35:111-128
[14] Dean R, Van Kan JA, Pretorius ZA. The Top 10 fungal pathogens in molecular plant pathology [J]. Mol Plant Pathol, 2012,13:414-430
[15] Wingfield M, Hammerbacher A, Ganley R. Pitch canker caused by-A growing threat to pine plantations and forests worldwide [J]. Australas. Plant Pathol., 2008,37:319-334
[16] Storer A, Gordon T, Clark S. Association of the pitch canker fungus,f. sp., with Monterey pine seeds and seedlings in California [J]. Plant Pathol., 1998,47:649-656
[17] Dick MDK. Species ofonin New Zealand [J]. N. Z. Plant Prot., 2002,55:58-62
[18] Viljoen A, Marasas W, Wingfield M,. Characterization off. sp.causing root disease ofseedlings in South Africa [J]. Microbiol. Res., 1997,101:437-445
[19] Ocamb C, Juzwik J, Martin F.spp. andseedlings: root disease pathogens and taxa associated with seed [J]. New forests, 2002,24:67-79
[20] Lazreg F, Belabid L, Sanchez Jet al. First report ofcausing damping-off disease on aleppo pine in Algeria [J]. Plant Dis., 2014,98:1268
[21] Lazreg F, Belabid L, Sanchez JFirst report ofcausing damping-off disease on Aleppo pine in Algeria [J]. Plant Dis., 2013,97:557
[22] Lazreg F, Belabid L, Sanchez JFirst report ofcausing damping-off disease on Aleppo pine in Algeria [J]. Plant Dis., 2013,97:1506
[23] Lazreg F, Belabid L, Sanchez J. First report ofas a causal agent of Aleppo pine damping-off in Algeria [J]. Plant Dis., 2013,97:997
[24] Machón P, Pajares JA, Diez JJ,. Influence of the ectomycorrhizal funguson pre-emergence, post-emergence and late damping-off byandon Stone pine seedlings [J]. Symbiosis, 2009,49:101-109
[25] Machon P, Santamaria O, Pajares JA,. Influence of the ectomycorrhizal funguson pre-emergence, post-emergence and late damping-off byandon Scots pine seedlings [J]. Symbiosis, 2006,42:153-160
[26] Fajardo MA, León JD, Correa GA,. The causal agent of damping-off in(Schiede) and(Schwerdtf.) [J]. Floresta e Ambiente, 2019,26: e20190050
[27] Dar GH, Beig M, Ahanger F,. Management of root rot caused byandin blue pine () through use of fungal antagonists [J]. Asian J. Plant Pathol., 2011,5:62-67
[28] Luo X, Yu C. First report of damping-off disease caused byinin China [J]. J. Plant Dis. Prot., 2020,127:401-409
Identification, Pathogenicity, and Characteristic of Pine Wilt in Shandong Province, China
LV Juan1,2, QI Yu-kun2, JI Yan-ping2, ZHANG Zhong-xia1, ZHAO Hai-yan3, LIU Yin2, HAN Feng-ying4, WANG Qing-hai2*
1.250103,2.250014,3.266109,4.251100,
To verify the agents and its characterization ofwilt, the pure cultures were obtained by use of tissue isolation and monosporic isolation, and identified according to morphological characteristics, multilocus phylogenetic (ITS, and) analyses, and pathogenicity tests. The effects of culture medium, temperature, pH, and light condition on mycelial growth rate were determined. The results showed thatcould causewilt in Shandong province, China.The optimum culture conditions ofS81 were PSA and PDA culture medium, 25°C to 30°C, and pH value 5.0-10.0 for mycelial growth.S81 was insensitive to light conditions, and the mycelial growth rates were not significantly different (< 0.01) at all tested levels.
Pine wilt; pathogen identification; pathogenicity
S436.65
A
1000-2324(2022)01-0077-08
10.3969/j.issn.1000-2324.2022.01.013
2021-12-14
20212-01-24
山东省林业科技创新项目(2019LY003-4);中央林业改革发展资金防灾减灾项目(鲁财资环指[2021]27号)
吕娟(1980-),女,本科,高级工程师,从事园林与林业病虫害及防治技术研究. E-mail:lvjuan1029@163.com
Author for correspondence.E-mail:wqhhai@126.com

