θ节律刺激对脑卒中后患者上肢运动功能和日常生活能力影响的Meta分析
夏渊,卢悦,李爱玲,王珍玉,潘新永,李永杰
1.武汉体育学院健康科学学院,湖北武汉 430079;2.甘肃天水四零七医院神经外科,甘肃天水 741000;3.贵州省骨科医院康复医学科,贵州贵阳 550002
前言
脑卒中是一种危害严重的脑血管疾病,已成为全球首位致残原因,并给患者家庭及社会带来沉重的经济负担[1]。脑卒中后患者常伴有肢体运动功能障碍、姿势控制异常、肌张力增高、感觉和平衡功能的减退或丧失等症状,其中超过80%的脑卒中患者患病早期存在上肢运动障碍;发病后3~6 个月,仍然有半数患者存在上肢功能受损[2-4],严重影响患者的生存质量。目前常用的上肢康复方法繁多,但存在治疗周期长、成本高等局限性[5]。因此,找到一种安全、高效的方法改善脑卒中患者上肢功能和日常生活活动能力是目前临床上的难点和热点。
θ 节律刺激(Theta Burst Stimulation, TBS)是重复经颅磁刺激(repetitive Transcranial Magnetic Stimulation, rTMS)的一种新形式,应用于初级运动皮质(Primary Motor Cortex, M1)可诱导皮质兴奋性的改变[6]。脑卒中后患者大脑皮质兴奋性平衡发生改变,表现为患侧半球兴奋性降低,而健侧半球过度兴奋。目前认为兴奋性平衡改变的原因可能与健侧半球对患侧半球过度抑制有关,而通过θ刺激这种非侵入性刺激方式,可以重建或恢复这种平衡[7]。θ 刺激通常由30 Hz 或50 Hz 的3 个脉冲组成,每秒重复5次,共600 脉冲,按照不同的刺激参数可分为连续性Theta-Burst 刺激(Continuous Theta Burst Stimulation,CTBS)和间歇性Theta-Burst 刺激(Intermittent Theta Burst Stimulation, ITBS)[8]。ITBS 即2 s 的刺激序列(10 次脉冲),然后是8 s 的停顿,应用于患侧大脑时能够显著增加运动皮质的兴奋性[9]。CTBS则由一串40 s不间断的TBS组成,常用于刺激健侧大脑能够降低运动皮质的兴奋性[10-11]。目前有研究将TBS 应用于治疗脑卒中后上肢功能和日常生活活动能力,但存在样本量较小、文献质量不高等问题,故其研究结论尚存争议。本研究通过Meta分析的方式系统地评估TBS 对脑卒中患者上肢功能和日常生活活动能力的影响。
1 材料与方法
1.1 检索策略
系统检索知网、万方、维普、中国生物医学、ProQuest、Embase、PubMed、Cochrane Library、Web of Science、Scopus 数据库,搜索关于TBS 治疗脑卒中的随机对照试验(randomized controlled trials, RCT)。检索时间为从建库至2021年4月,检索策略采用主题词和自由词结合的方式,必要时追查纳入文献的参考文献。
中文检索词包括:脑卒中、重复经颅磁、θ 刺激、theta节律刺激等,具体检索式是(以知网为例):(SU=脑卒中OR SU=卒中OR SU=偏瘫OR SU=中风OR SU=脑血管中风OR SU=脑血管意外)AND(SU=重复经颅刺激OR SU=重复经颅磁刺激OR SU=rTMS OR SU=θ刺激OR SU=theta节律刺激)。
英文检索词包括:Stroke、rTMS、Theta Burst Stimulation、θ-brust stimulation 等,具体检索式为(以PubMed 为例):(Stroke[Mesh]OR cerebrovascular accident[Title/Abstract]OR CVA[Title/Abstract]OR BrainVascularAccident[Title/Abstract]OR Hemiplegia[Title/Abstract]OR Apoplexy[Title/Abstract]OR hemiparesis[Title/Abstract])AND(repetitive transcranial Magnetic Stimulation[Title/Abstract]OR rTMS[Title/Abstract]OR θ-burst stimulation[Title/Abstract]OR theta burst stimulation[Title/Abstract]OR Transcranial Magnetic Stimulation[Title/Abstract])AND(RCT[Title/Abstract]OR Randomized controlled Trial[Title/Abstract]OR Trial[Title/Abstract]OR randomized[Title/Abstract])。
1.2 纳入和排除标准
纳入标准:①研究设计:检索中英文数据库中关于TBS 治疗脑卒中后上肢功能和日常生活活动能力的RCT;②研究对象:纳入受试者均符合《各类脑血管疾病诊断要点》[12]中的脑卒中诊断标准,且经过MRI 和CT 进一步确诊,受试者年龄>18 岁,性别、病程不限,意识清晰,无认知障碍;③干预措施:对照组仅接受常规康复治疗,实验组在常规康复治疗的基础增加TBS刺激;④结局指标:a.上肢运动功能评定:采用上肢Fugl-Meyer量表(UE-FMA)、手臂动作调查测试表(ARAT)、美国国立卫生研究院卒中量表(NHISS);b.日常生活能力评定:采用改良Barthel 指数(MBI)。
排除标准:①文献重复发表;②数据无法提取;③非随机对照试验;④全文无法获取。
1.3 文献筛选和资料提取
由两位评审员对检索后的文献进行初步筛选。第一步,使用Endnote X9 软件对检索到的文献进行剔重,再通过阅读标题和摘要来纳入符合要求的文献,部分文献无法通过阅读标题和摘要确定的,通过阅读全文再确定是否纳入。第二步,对所纳入的文献进行数据提取,收集到Excel 表格中,包括:第一作者姓名、发表年份、国籍、年龄、样本量、干预措施、干预周期、结局指标。如遇分歧由小组集体讨论决定。
1.4 纳入研究的方法学质量评估
根据Cochrane 手册设立的风险偏倚评估标准,由两位评审员独立地对纳入的文献进行方法学质量评价。如果遇到分歧,由研究小组集体讨论解决。
1.5 统计学分析
采用Revman5.3软件进行数据分析,此次研究所有结局指标都为连续性变量,若同一结局指标采用为同一量表和单位则采用加权均数差(Weighted Mean Difference,WMD)为效应量,若同一结局指标采用不同量表或单位差别较大,则采用标准化均数差(Standard Mean Difference, SMD)为效应指标,各效应量均以95%CI 表达,P<0.05 为差异有统计学意义。对纳入研究进行异质性分析,当P>0.1,I2<50%,表示各研究之间具有同质性,采用固定效应模型;反之,则表明各研究之间存在异质性,采用随机效应模型进行Meta 分析,并使用亚组分析和敏感性分析找出异质性的来源。
2 结果
2.1 检索结果
通过对各大数据库进行首次检索共获取文献5 210 篇,使用EndNoteX9 剔除重复文献2 542 篇,剩余2 668 篇。通过初次阅读标题和摘要筛选出102篇;经深度阅读剩余文献,基于全文分析排除88 篇,最后纳入文献14篇研究。文献筛选流程见图1。

图1 文献筛选流程图Figure 1 Flowchart of literature retrieval
2.2 纳入文献基本特征
共纳入于2013~2020年发表的文献14 篇[13-26],共纳入受试者329 例,文献语种为中英文,试验组均为TBS 刺激,其中11 篇为ITBS,3 篇为CTBS,对照组均采用常规治疗,具体的文献基本特征见表1。
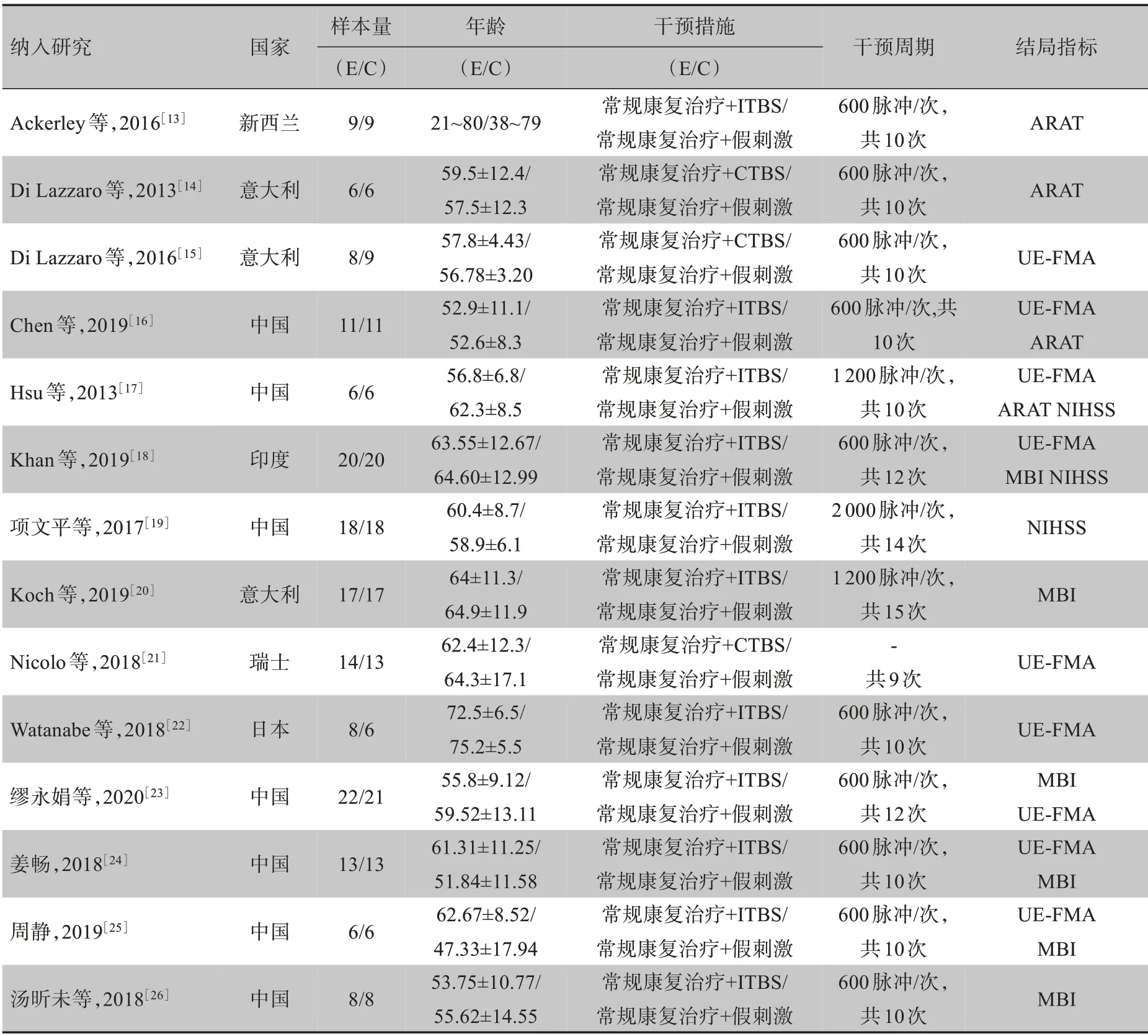
表1 纳入文献的基本特征Table 1 Basic information of the included literatures
2.3 纳入研究的方法学质量评估
由两位评审员对纳入的14 篇文献进行评估,其中7篇文献报道了具体的随机序列产生方法(如随机数字表、电脑随机等),5篇文献实施了分配隐藏,8篇文献对参与者或研究人员实施了盲法,7 篇文献对结局指标的评估者实施了盲法,所有文献均未发现结局数据缺失,6 篇文献存在选择性报告的可能性较小,未有充分的理由判断各研究是否存在其他偏倚。具体偏倚风险评估见图2。

图2 风险偏倚总结图Figure 2 Summary of risk of bias
2.4 Meta分析结果
2.4.1 UE-FMA共9 项研究[15-18,21-25]分析TBS 对脑卒中患者UE-FMA 评分的影响,总计213 例受试者,χ2检验表明各研究间的异质性较大(I2=77%,P<0.000 1),采用随机效应模型进行数据整合分析,发现TBS 组对脑卒中患者UE-FMA 评分的改善优于对照组,差异有统计学意义[WMD=7.24, 95%CI(2.18, 12.31),P=0.005],见图3。
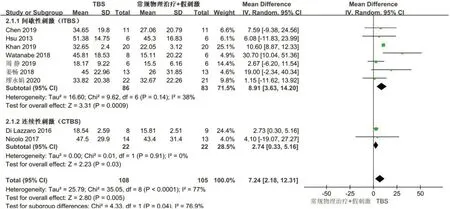
图3 TBS对脑卒中后患者UE-FMA评分影响的Meta分析Figure 3 Meta analysis of the effect of TBS on UE-FMA scores of post-stroke patients
根据刺激方式的不同分为CTBS 和ITBS 2 个亚组。其中7 篇文献[16-18,22-25]纳入的刺激方式为ITBS,共169 例,各研究之间无异质性(P=0.14,I2=38%)。结果显示ITBS 能够有效的改善脑卒中患者上肢的运动功能[WMD=8.91, 95%CI:3.63~14.20,Z=3.31,P=0.000 9]。2 篇文献[15,21]纳入刺激方式为CTBS,共44例。各研究之间无异质性(P=0.91,I2=0%),结果显示CTBS 也能够提高脑卒中患者上肢的运动能力[WMD=2.74,95%CI:0.33~5.16,Z=2.23,P=0.03]。两个亚组间效应量存在显著差异(P=0.04),其中ITBS的亚组具有最高效应量。
2.4.2 ARAT共4 项研究[13-14,16-17]分析了TBS 对脑卒中患者ARAT 评分的影响,总计64 例受试者,χ2检验表明各研究间的异质性不明显(I2=30%,P=0.23)。采用固定效应模型进行数据整合并分析发现,TBS组在增加脑卒中患者ARAT方面优于对照组,差异有统计学意义[WMD=8.83, 95%CI:3.26~14.40,P=0.002],见图4。
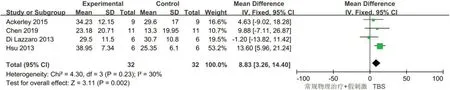
图4 TBS对脑卒中后患者ARAT评分影响的Meta分析Figure 4 Meta analysis of the effect of TBS on the ARAT score of post-stroke patients
2.4.3 NHISS共3 项研究[17-19]分析了TBS 对脑卒中患者NHISS评分的影响,总计88例受试者,χ2检验表明各研究间的异质性较大(I2=79%,P=0.009)。采用随机效应模型进行数据整合并分析发现,TBS在减少脑卒中患者NIHSS 评分方面优于对照组,差异有统计学意义[WMD=-4.11,95%CI:-6.99~-1.23,P=0.005]。通过逐篇剔除文献进行敏感性分析,发现剔除项文平等[19]研究后I2降低至0%,结果未发生改变。其异质性来源可能是由于其脉冲刺激的量相较于其他研究更多,见图5。
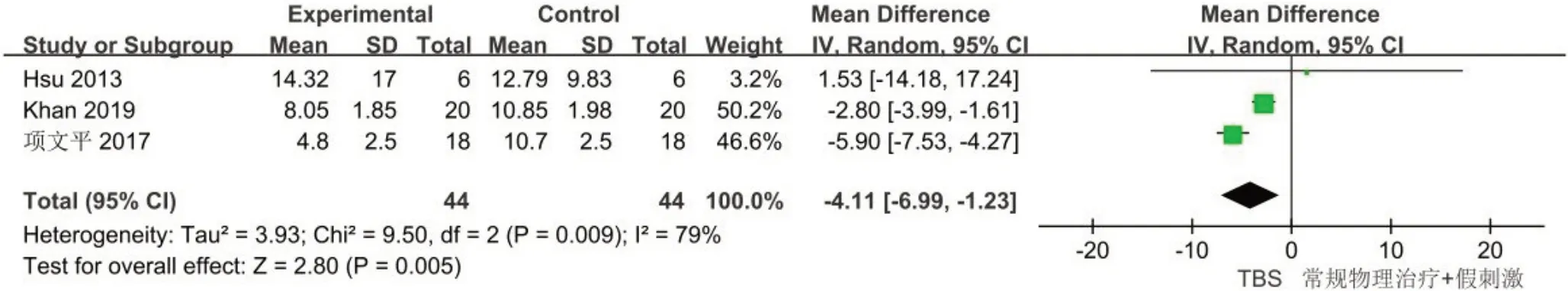
图5 TBS对脑卒中后患者NHISS评分影响的Meta分析Figure 5 Meta analysis of the effect of TBS on the NHISS score of post-stroke patients
2.4.4 MBI共6项研究[18,20,23-26]分析了TBS 对脑卒中患者MBI 评分的影响,总计171 例受试者,χ2检验表明各研究间的异质性较大(I2=70%,P=0.005)。采用随机效应模型进行数据整合并分析,Meta 分析结果表明,TBS 组在增加脑卒中患者MBI 方面优于对照组,差异有统计学意义[WMD=9.54,95%CI:3.81~15.27,P=0.001]。针对较大异质性通过逐篇剔除文献进行敏感性分析,发现在剔除汤昕未等[26]研究后异质性下降到I2=52%,剔除Koch 等[20]研究后异质性下降到41%,结果未发生改变。通过对汤昕未等[26]和Koch等[20]的研究进行分析,发现汤昕未等[26]的研究选取的是严重脑卒中患者,Koch 等[20]的研究中TBS 刺激部位为小脑,说明脑卒中的严重程度与TBS 刺激位置的不同可能是导致异质性较高的原因。见图6。
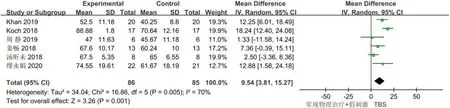
图6 TBS对脑卒中后患者MBI评分影响的Meta分析Figure 6 Meta analysis of the effect of TBS on the MBI score of post-stroke patients
2.4.5 发表偏倚检验对结局指标UE-FMA 进行发表偏倚检验,漏斗图结果显示,UE-FMA 可能存在一定的小样本效应以及发表偏倚,研究结果需谨慎解释,见图7。
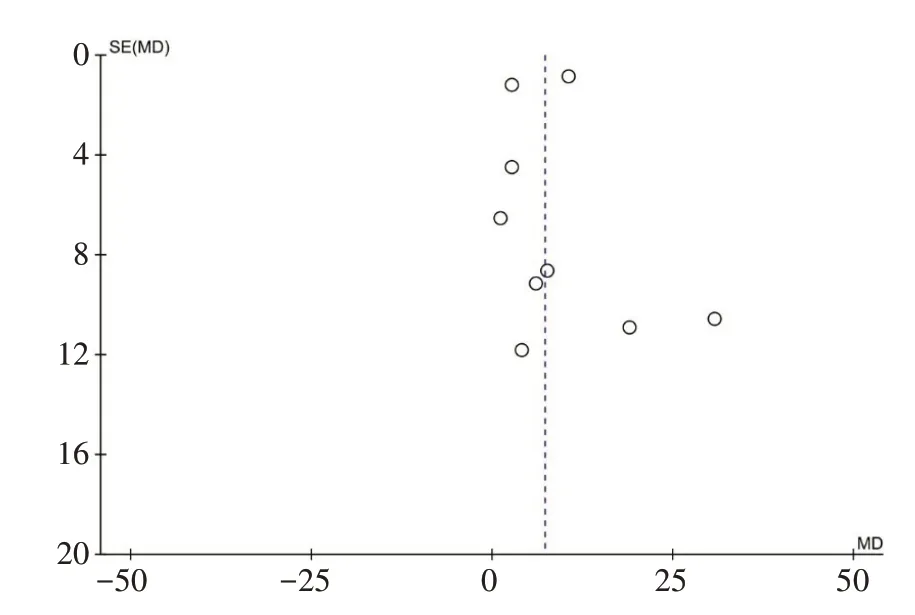
图7 关于UE-FMA的漏斗图分析Figure 7 Funnel plot analysis of UE-FMA
3 讨论
近年来脑卒中已成为我国的常见病,且出现年轻化的趋势,虽然医疗技术不断提高,但脑卒中后的致残率却高达80%以上[27],对人类健康构成巨大风险。TBS 作为rTMS 的一种形式,相较于传统rTMS使用了更低的刺激强度和更短的刺激时间,同时对突触可塑性产生更迅速、更持久的影响,是脑卒中康复治疗中的一项常用方法。脑卒中后上肢功能的恢复速度相较于下肢较慢,康复效果往往不尽人意,超半数患者在脑卒中后几个月或几年仍然存在上肢功能障碍,严重影响生活质量,因此上肢的功能恢复是康复的核心[5]。
既往研究表明[28-29],ARAT、UE-FMA和NIHSS被广泛应用于评估脑卒中后上肢运动功能[30],并具有良好的信效度。本研究通过以上方法对脑卒中后患者的上肢运动功能进行评估。Meta 分析的结果显示,与对照组相比,θ 刺激组能够明显提高ARAT 和UE-FMA 的评分和降低NIHSS 评分,且差异有统计学意义(P<0.05),其改善原因可能是由于大脑两侧半球神经网络重新恢复平衡有关。既往研究[31]表明,脑卒中后双侧大脑的交互抑制平衡被打破,具体表现为患侧皮质因病灶影响而兴奋性降低,而健侧皮质则兴奋性相对增强。ITBS通过对患侧皮质的刺激增强其兴奋性,促进大脑的可塑性,而CTBS 通过对健侧皮质的连续刺激可抑制皮层的兴奋性,无论是CTBS 还是ITBS 都是通过对大脑皮质兴奋性的调节,来重建两侧半脑间兴奋性的平衡,以改善脑卒中后患者偏瘫侧肢体功能[32-33]。本研究发现在UEFMA 量表中进行不同刺激方式的亚组分析后发现两种不同刺激方式存在统计学差异,且ITBS 在提高患者运动功能上要优于CTBS,这与Hsu 等[34]和Zhang等[35]结果一致,其原因可能是由于重症患者的康复过程中健侧半球参与更多,此时健侧半球的兴奋性可能起到了积极作用[36],而CTBS抑制了双侧大脑半球的激活[37],故CTBS 在重症患者中并不明显。而ITBS 可以通过对M1 区或S1 区兴奋性启动促进运动再学习的能力进而影响行为,即如果相关突触在随后运动中重复使用,ITBS可能会促进它们加强,通过这种方式,行为上的益处将会超过最初神经兴奋性的增加[38-39]。另外,通过漏斗图发现本研究可能存在一定的发表偏倚和小样本效应,这也提示研究结果需谨慎对待。
此外,本研究还通过改良Barthel 指数(MBI)对患者的日常生活活动能力进行评定,MBI 作为目前应用最广泛的评定脑卒中后日常生活活动能力的量表,有着很好的有效性和敏感性[40]。由于在MBI 评分上纳入研究所用TBS 均为ITBS,Meta 分析结果显示,ITBS刺激在MBI评分上要优于对照组,虽然结果存在较大异质性,但在敏感性分析中发现剔除汤昕未等[26]和Koch 等[20]的研究后异质性有了明显的下降,说明其异质性可能是由于刺激部位和脑卒中的严重程度不同导致。ITBS对日常生活活动能力的改善其原因可能是由于上肢功能与ADL能力存在明显正相关[41-42],ITBS 在改善上肢功能的同时进一步导致了ADL功能的恢复。
本研究也存在以下不足之处:①部分指标纳入文献较少,故未进行发表偏倚检测;②只纳入中英文文献,可能存在语言偏倚;③纳入文献患者病程和干预时间长短不一,刺激部位的不同可能是结果产生较大异质性的原因。
综上所述,TBS能够改善脑卒中患者上肢的运动功能和日常生活活动能力,且ITBS 的疗效要优于CTBS,再加上TBS 操作简单、安全,故适合在临床推广。为确保研究结果的科学性,还需要更多高质量、大样本的RCT试验予以进一步的验证。