肺原发性黏膜相关淋巴组织结外边缘区淋巴瘤5例临床病理分析
孙雪骐,黄麒睿,彭 芳
肺原发性黏膜相关淋巴组织结外边缘区(primary pulmonary extranodal marginal zone lymphoma of mucosa-associated lymphoid tissue, MALT)淋巴瘤是原发于肺内淋巴组织的恶性淋巴瘤,占肺原发淋巴瘤的70%~90%,但占肺部原发肿瘤的比例不足0.5%[1],临床较少见,一般为体检发现,易误诊。本文收集5例肺原发性MALT淋巴瘤,回顾性分析其临床病理学特征、诊断及鉴别诊断,并介绍预后及分子免疫治疗方法,旨在提高对其的认识水平。
1 材料与方法
1.1 材料收集赣州市人民医院病理科2019年1月~2020年10月活检确诊的5例肺原发性MALT淋巴瘤,5例均经两位资深病理医师复核确诊。收集患者的临床资料并电话随访患者预后。
1.2 方法标本均经10%中性福尔马林固定,常规石蜡包埋,3 μm厚切片,HE染色。免疫组化染色采用EnVision两步法,行高温抗原修复,DAB显色等步骤。一抗包括CD20、CD3、CD21、Ki-67、CD10、BCL-6、MUM1、BCL-2、CD5、CD23、Cyclin D1、CK、PAX-5、C-myc,均购自福州迈新公司,操作步骤严格按照试剂盒说明书进行,并设阳性和阴性对照。
2 结果
2.1 临床特征5例患者中男性3例,女性2例,男女比为1 ∶1.5,年龄42~59岁,中位年龄47岁。发生部位:右肺4例(上叶2例,下叶1例,上、下叶合并病灶1例),左肺下叶1例。4例为体检时发现肺部包块,1例为入院期间检查时偶然发现。CT示片状团块或斑片状高密度影,其中3例临床误诊为原发性肺癌,1例考虑为炎性病变,1例真菌感染。5例临床均行胸腔镜下肺叶或肺结节切除术,患者术后均进行随访,5例均存活,恢复良好,目前均无复发及淋巴结累及(表1)。
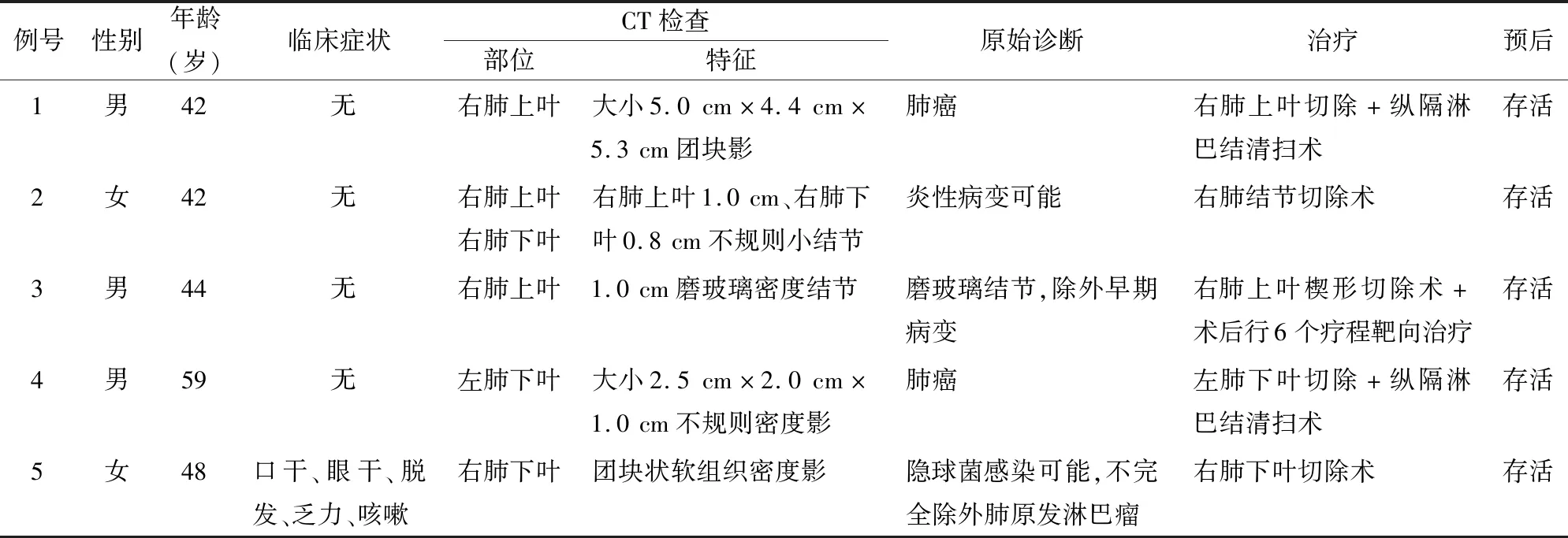
表1 5例肺原发性MALT淋巴瘤患者的临床资料
2.2 病理检查
2.2.1眼观 5例均为大小不等的肿块,与周围组织边界欠清,切面灰白、灰褐色,肿物大小1.2 cm×1.0 cm×1.0 cm~6.0 cm×5.0 cm×5.0 cm。
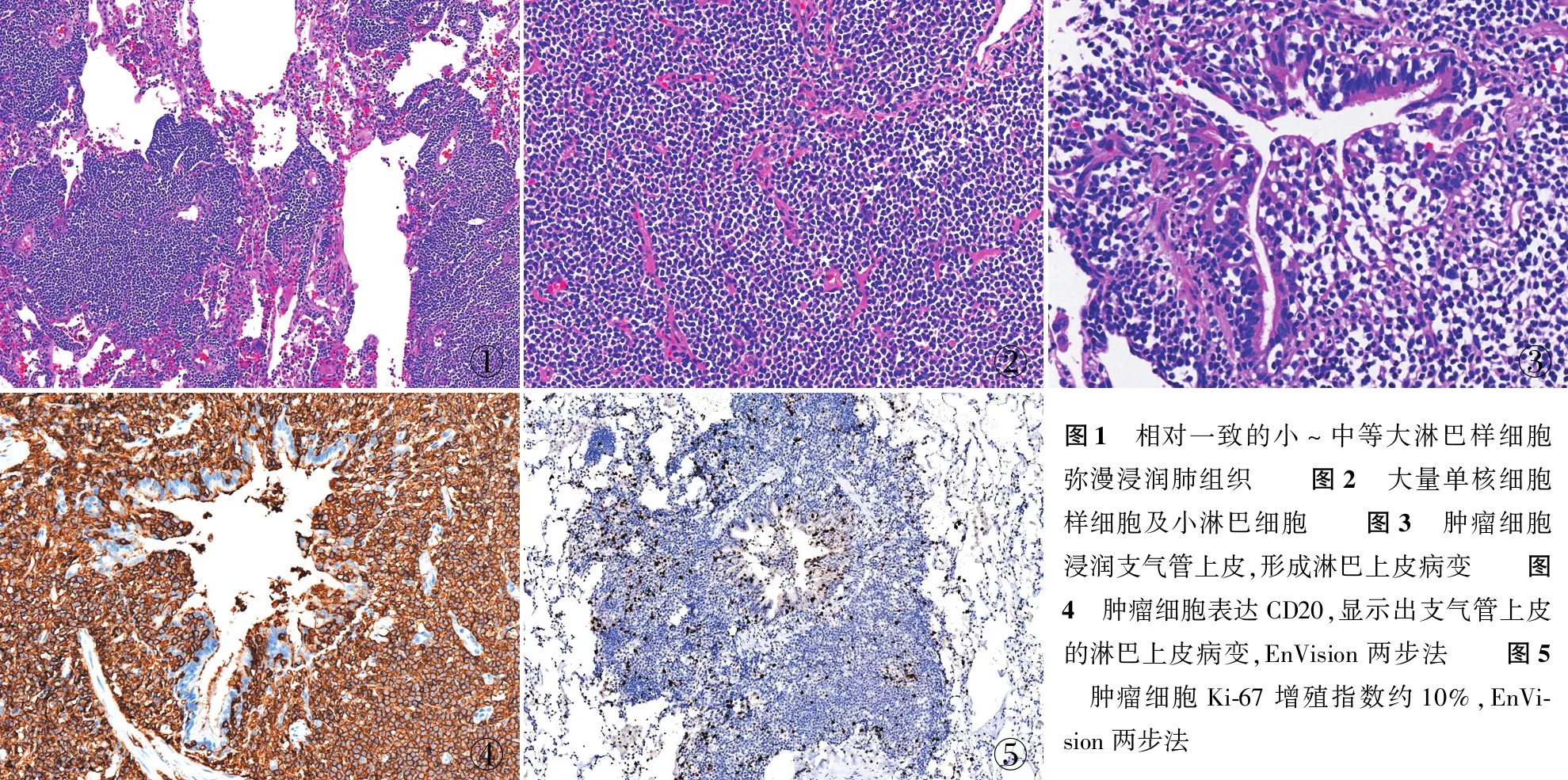
2.2.2镜检 5例镜下形态基本一致,低倍镜下均以小至中等大小的小淋巴样细胞弥漫性浸润为特征(图1),高倍镜下瘤细胞形如单核细胞样细胞和小淋巴细胞(图2),其间散在分布少许免疫母细胞及中心母细胞样细胞,部分病例可见浆细胞分化。当3个或以上肿瘤细胞浸润支气管、细支气管黏膜和肺泡上皮,可形成淋巴上皮病变(图3)。
2.3 免疫表型5例CD20(图4)、CD79a、PAX-5、BCL-2均阳性,CD3、CD5、Cyclin D1、CD10、BCL-6和CD30均阴性。CD20染色可突出淋巴上皮病变,Ki-67增殖指数为3%~20%(图5)。统一本组Kappa/Lambda比率来评判单克隆增生的诊断(Kappa ∶Lambda>2.5~3或Lambda ∶Kappa≥1),其中3例显示轻链限制性表达,另2例Kappa、Lambda显示阳性细胞比例相当。
3 讨论
MALT淋巴瘤是一种结外淋巴瘤,占所有B细胞淋巴瘤的7%~8%[2]。正常成人肺部淋巴组织稀少(除自身免疫性疾病如干燥综合征外),肺部原发性MALT淋巴瘤相对较少见,仅占肺原发性肿瘤的0.5%[1]。MALT淋巴瘤是淋巴组织在抗原作用下克隆性增生所致,肺MALT淋巴瘤被认为是MALT淋巴瘤继发于炎症或自身免疫过程中出现的,病因目前尚未明确[3]。尽管目前MALT淋巴瘤分子遗传学改变尚未得到全基因组测序的证实,但已有研究发现,API2-MALT1基因融合是MALT淋巴瘤中最经典的分子改变[4]。
3.1 临床特征MALT淋巴瘤好发于成年人,中位年龄61岁,女性稍多于男性。最常见的临床表现为无症状的患者影像学检查发现肿块,有症状的患者表现为咳嗽、呼吸困难、胸痛和咯血[5]。当肿瘤发生远处扩散时,优先扩散到其他黏膜部位而非淋巴结[6]。本组5例患者中位年龄(47岁)小于文献报道的年龄,可能与体检发现较早相关,且均为影像学检查发现,与文献报道一致。
3.2 病理特征MALT淋巴瘤的肉眼典型特征是白色肿块,边界不清,质地柔软,缺乏特异性。镜下MALT淋巴瘤的组织学特征是淋巴细胞浸润,肿瘤性B细胞主要存在于反应性滤泡的边缘区,并延伸到滤泡间区域,这些淋巴滤泡由细胞学形态多样的小细胞组成,包括小圆形淋巴细胞、中心细胞样细胞或单核细胞样细胞。肿瘤细胞侵犯细支气管或肺泡上皮,可观察到上皮内肿瘤细胞的植入,导致淋巴上皮病变[7]。
3.3 免疫表型MALT淋巴瘤的肿瘤细胞是单克隆B细胞,免疫组化标记CD20、CD79a和BCL-2阳性,肿瘤B细胞CD10、CD23和BCL-6均阴性,Ki-67增殖指数通常较低(<20%),生发中心内可见大量Ki-67阳性细胞。CD43在某些情况下阳性,但不具有特异性。极少数病例CD5可能阳性[8]。Kappa或Lambda可呈轻链限制性表达[9],B细胞或浆细胞中的轻链限制性表达高度提示克隆性肿瘤增生[10]。本组重复免疫组化结果显示,3例显示轻链限制性表达,另2例Kappa、Lambda显示阳性细胞比例相当。在某些情况下,免疫组化可能由于血清轻链、与滤泡树突状细胞的反应性或非特异性染色而表现出高背景,而对其中1条或2条轻链的敏感性可能较低[11]。浆细胞有丰富的胞质轻链,但无表面轻链,在识别克隆性B细胞群体方面,流式细胞术比免疫组化、原位杂交和IgH基因重排检测更敏感[12]。有研究侧重于免疫组化和原位杂交检测对Kappa和Lambda轻链的效用,这些研究仅仅是得出正确诊断的一个因素,反应过程则很少被报道有轻链限制,因此存在轻链限制性表达可能不能明确诊断淋巴瘤,必须结合患者的临床和其他组织病理学特征进行诊断[13-14]。
3.4 鉴别诊断由于MALT淋巴瘤发病率较低,且组织形态学特征不明显,特别是穿刺活检的小标本,易误诊或漏诊,因此MALT淋巴瘤通常都是排他性诊断,主要需与以下几种肿瘤性与非肿瘤性疾病鉴别。(1)其他小B细胞淋巴瘤:如滤泡性淋巴瘤、套细胞淋巴瘤、小淋巴细胞性淋巴瘤和淋巴浆细胞性淋巴瘤,MALT淋巴瘤细胞成分多样,免疫组化标记Cyclin D1、CD10、BCL-6表达缺失有助于排除套细胞淋巴瘤和滤泡性淋巴瘤,CD5和CD23表达缺失可排除慢性淋巴细胞白血病/小淋巴细胞淋巴瘤[1, 15]。近来有研究报道免疫组化新指标MNDA和IRTA1对鉴别MALT淋巴瘤和其他类型的B细胞淋巴瘤具有诊断意义[16]。MNDA在鉴别MALT淋巴瘤和滤泡性淋巴瘤中有很高的特异性[17]。IRTA1对MALT淋巴瘤具有高度特异性,但目前尚无合适的IRTA1抗体可供商业使用,因此限制了IRTA1免疫组化试剂未被广泛应用于常规临床应用。(2)弥漫性淋巴组织增生和淋巴细胞性间质性肺炎:淋巴细胞性间质性肺炎为间质性肺炎的一种,病变与周围组织分界不清,呈移行关系,淋巴细胞较杂,呈多克隆性增生并伴有不同程度的滤泡间纤维化,PCR检测显示免疫球蛋白基因无克隆性重排,在反应条件下也无轻链限制性表达[18]。(3)慢性非特异性炎症反应[7]:其与MALT淋巴瘤均可见小淋巴细胞浸润,MALT淋巴瘤常呈膨胀性浸润,与周围组织分界清楚,且MALT淋巴瘤的小B细胞浸润超出反应性淋巴滤泡增生的程度,具有沿支气管血管和小叶间隔扩散的特征性淋巴管模式,淋巴浸润使肺泡间隔变宽[19]。
3.5 预后及治疗MALT淋巴瘤患者预后良好,5年总存活率超过80%,中位生存期超过10年[20]。肺原发性MALT淋巴瘤进展的中位时间为5~6年,肺外受累和淋巴结受累是不良预后因素[6]。MALT淋巴瘤的治疗包括手术、化疗、免疫治疗和放疗[21]。研究[22-26]提示免疫调节药物(the immunomodulatory drugs, IMiDs)合并利妥昔单抗(抗CD20单克隆抗体)对MALT淋巴瘤患者的治疗有效果。
综上所述,肺原发性MALT淋巴瘤较少见,为低度恶性肿瘤,进展缓慢,起病隐匿,无特异性,常为影像学检查偶然发现,手术完整切除是首选的治疗方式。对于无法行手术切除的患者可以选用化疗、免疫治疗及放疗等手段。肺原发MALT淋巴瘤的标准化治疗方案仍需深入探讨。

