非小细胞肺癌恶性胸水中PD-L1(22C3)的表达及其临床意义
覃玲艳,顾冬梅,郭凌川,马文霞,尤志群,杨红丽
肺癌是最常见的恶性肿瘤。2018年国际癌症研究机构发布的肺癌发病率为11.6%,其病死率占癌症死亡总例数的18.4%,是癌症死亡的主要原因[1]。肺癌中大部分为非小细胞肺癌(non-small cell lung cancer, NSCLC),恶性胸水是中晚期NSCLC较为常见的并发症。胸水脱落细胞学检查具有微创、快捷、可重复等优点,已广泛应用于临床病理诊断中。免疫治疗是目前癌症研究的热点,其中程序性死亡受体-1(programmed death receptor-1, PD-1)/程序性死亡配体-1(programmed death-ligand 1, PD-L1)通路在肿瘤免疫逃逸中发挥重要作用,PD-L1是PD-1的一种配体,两者均可影响肿瘤免疫微环境[2]。本文采用免疫组化EnVision两步法检测PD-L1(22C3)在149例NSCLC恶性胸水细胞蜡块中的表达,并分析其表达与NSCLC临床病理学特征、ALK(D5F3)表达、EGFR突变及患者总生存期的关系,旨在探讨PD-L1(22C3)在NSCLC恶性胸水中的检测意义。
1 材料与方法
1.1 材料收集2017年12月~2019年12月苏州大学附属第一医院诊治的149例伴有恶性胸水并经细胞蜡块免疫组化证实为转移性NSCLC的标本,其中男性72例,女性77例,男女比约为1 ∶0.94,患者年龄37~92岁,中位年龄65岁;肿瘤直径≤3 cm者93例,>3 cm者56例;吸烟者55例,非吸烟者94例。由两名有经验的病理医师依据WHO(2015)呼吸系统肿瘤分类标准对各病例进行分类[3]:其中腺癌144例,鳞状细胞癌5例;高+中分化癌79例,低分化癌70例;有淋巴结转移76例,无淋巴结转移73例;伴远处脏器转移61例;有胸膜累及74例,无胸膜累及75例;接受放、化疗54例,未接受放、化疗95例。
1.2 细胞学涂片及沉渣包埋对临床送检的200 mL胸腔积液行常规细胞学涂片及沉渣包埋,经10%中性福尔马林固定,常规脱水,石蜡包埋,4 μm厚切片,镜下观察,评估细胞蜡块肿瘤细胞数均大于100个,行后续相关检测。
1.3 免疫组化采用全自动Benchmark XT检测系统进行免疫组化EnVision两步法染色。选择Ep-CAM、CK7、TTF-1、Napsin A、CK5/6、p40、p63、Calretinin、Ki-67等抗体作为转移性肺癌的诊断和鉴别诊断指标。同时检测ALK(D5F3)、PD-L1(22C3)的表达。所有抗体及试剂盒均购自北京中杉金桥生物公司。PD-L1(22C3)抗体稀释比为1 ∶50,试剂盒购自南京大鸟生物公司,染色步骤严格按照试剂盒说明书进行。
1.4 基因检测采用ARMS法(厦门艾德生物公司)检测恶性胸水细胞蜡块中EGFR基因18、19、20及21号外显子的突变情况。具体检测步骤参照试剂盒说明书。
1.5 结果判读Ep-CAM、CK7、Napsin A、CK5/6、Calretinin阳性定位于细胞质,呈棕黄色,TTF-1、p40、p63、Ki-67阳性定位于细胞核,呈棕黄色。ALK(D5F3)判读参照《Ventana anti-ALK(D5F3)评分解读指南》[4]。PD-L1(22C3)评分判读标准:只判读活的肿瘤细胞,至少读取100个形态良好的肿瘤细胞,任何可见的线性细胞膜染色(部分或完整)及细胞质和细胞膜染色均为阳性;细胞膜无染色,仅细胞质染色为阴性。由两名有经验的病理科诊断医师进行ALK(D5F3)、PD-L1(22C3)结果判读。肿瘤阳性细胞百分比TPS=(PD-L1阳性肿瘤细胞数/肿瘤细胞总数)×100%。
1.6 统计学分析采用SPSS 16.0软件对数据进行统计学分析。表达的差异性采用χ2检验、校正χ2检验,相关性采用Spearman秩相关检验,组间生存率采用Kaplan-Meier法绘制生存曲线,Log-rank检验比较生存曲线的差异性,以P<0.05为差异有统计学意义。
2 结果
2.1 NSCLC患者恶性胸水中癌细胞的鉴定NSCLC恶性胸水中转移性腺癌脱落细胞学HE染色,镜下见癌细胞呈散在或团片状分布,极性紊乱,核质比增高,胞质丰富,含有黏液,细胞核呈圆形、卵圆形或不规则形,核染色质深染呈粗颗粒状,部分细胞可见核仁(图1);胸水沉渣包埋细胞块HE染色(图2A),转移性腺癌相关免疫指标的表达:Ep-CAM表达于肿瘤细胞胞膜或胞质(图2B)、Napsin A表达于肿瘤细胞胞质(图2C)、TTF-1表达于肿瘤细胞胞核(图2D)、PD-L1表达于肿瘤细胞胞膜或胞质(图2E)。NSCLC恶性胸水中转移性鳞状细胞癌脱落细胞学HE染色,镜下见癌细胞大小不一,呈团片状分布,极性紊乱,核质比增高,胞质较少,细胞核呈圆形或不规则形,核染色质浓染呈粗颗粒状(图3);胸水沉渣包埋细胞块HE染色(图4A),转移性鳞状细胞癌相关免疫指标的表达:CK5/6表达于肿瘤细胞胞膜或胞质(图4B)、p40表达于肿瘤细胞胞核(图4C)、p63表达于肿瘤细胞胞核(图4D)、PD-L1表达于肿瘤细胞胞膜或胞质(图4E)。
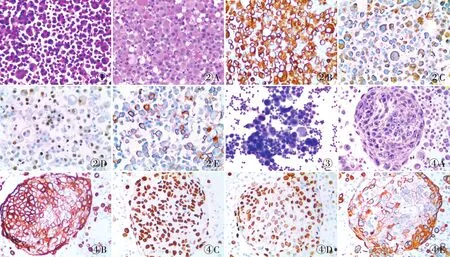
图1 NSCLC恶性胸水(转移性腺癌)的HE染色 图2 NSCLC恶性胸水(转移性腺癌):A.胸水细胞块HE染色;B.Ep-CAM呈胞膜或胞质阳性,EnVision两步法;C.Napsin A呈胞质阳性,EnVision两步法;D.TTF-1呈胞核阳性,EnVision两步法;E.PD-L1呈胞膜和胞质阳性,EnVision两步法 图3 NSCLC恶性胸水(转移性鳞状细胞癌)的HE染色 图4 NSCLC恶性胸水(转移性鳞状细胞癌):A.胸水细胞块HE染色;B.CK5/6呈胞膜或胞质阳性,EnVision两步法;C.p40呈胞核阳性,EnVision两步法;D.p63呈胞核阳性,EnVision两步法;E.PD-L1呈胞膜和胞质阳性,EnVision两步法
2.2 NSCLC患者恶性胸水中PD-L1(22C3)蛋白的表达在149例NSCLC患者恶性胸水中,PD-L1(22C3)阳性定位于细胞膜和(或)细胞质,17例PD-L1(22C3)阳性率<1%(图5A);29例为1%~49%(图5B),17例≥50%(图5C),总阳性率为42.3%。
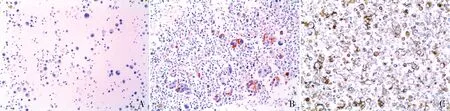
图5 PD-L1(22C3)蛋白在NSCLC恶性胸水中的表达,EnVision两步法:A.PD-L1阳性率<1%;B.PD-L1阳性率1%~49%;C.PD-L1阳性率≥50%
2.3 NSCLC恶性胸水中PD-L1(22C3)表达与临床病理特征的关系在NSCLC患者恶性胸水中,PD-L1(22C3)表达与肿瘤分化程度、有无淋巴结转移、有无其他脏器转移相关(P<0.05);PD-L1(22C3)的阳性率区间分布与肿瘤直径、有无其他脏器转移相关(P<0.05,表1)。
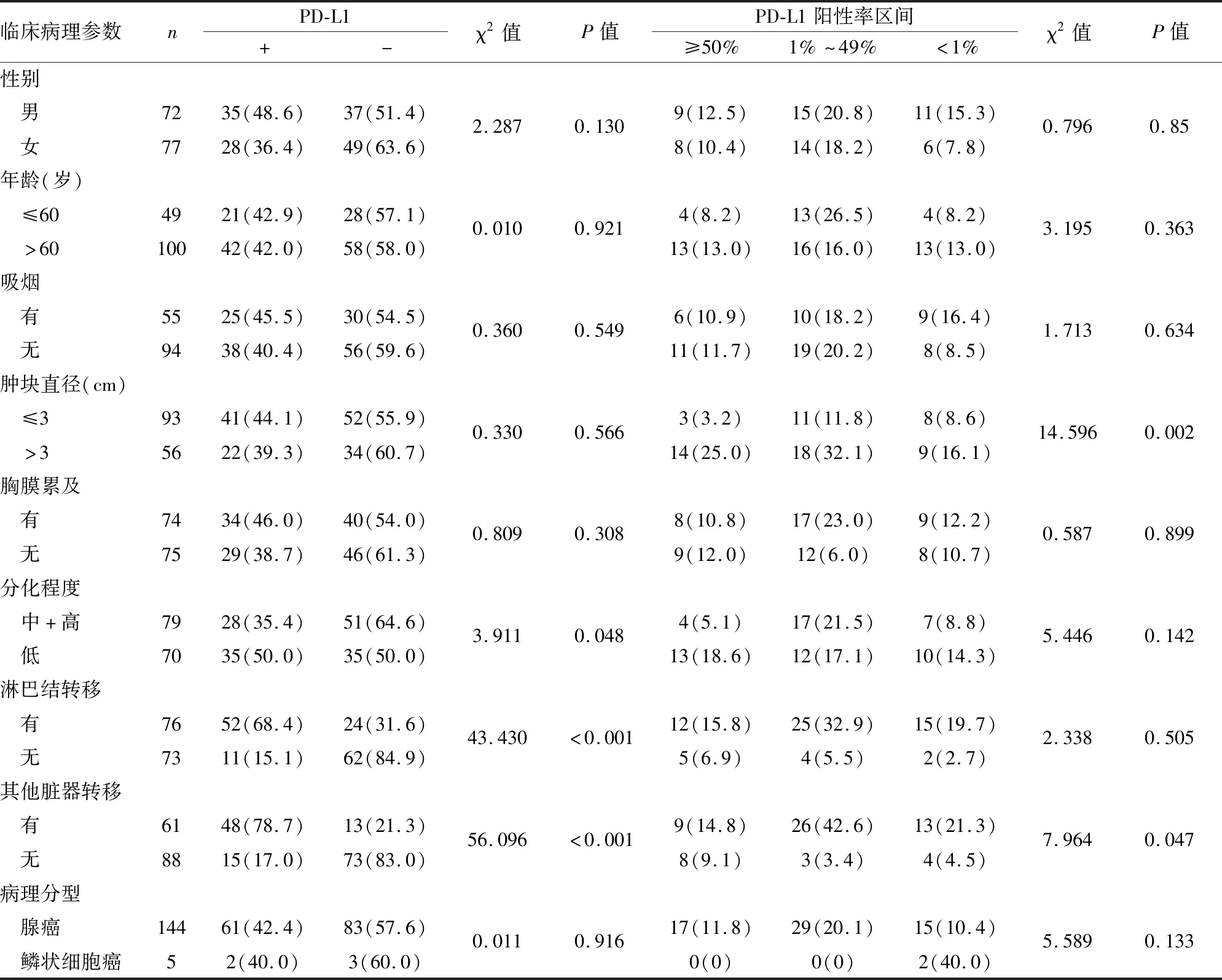
表1 PD-L1(22C3)表达与NSCLC临床病理特征的关系[n(%)]
2.4 NSCLC恶性胸水中PD-L1(22C3)表达与ALK(D5F3)表达及EGFR突变的相关性PD-L1(22C3)在NSCLC患者恶性胸水中的表达与ALK(D5F3)表达呈正相关(rs=11.49,P<0.05),与EGFR突变无关(rs=0.004,P>0.05,表2)。

表2 NSCLC中PD-L1(22C3)的表达与ALK(D5F3)表达及EGFR突变的相关性(n=97)
2.5 NSCLC恶性胸水中PD-L1(22C3)表达与患者预后的关系对149例伴有恶性胸水的NSCLC患者进行随访,PD-L1(22C3)阳性患者与阴性患者的中位总生存期分别为6和12个月,差异有显著性(P<0.05,图6)。
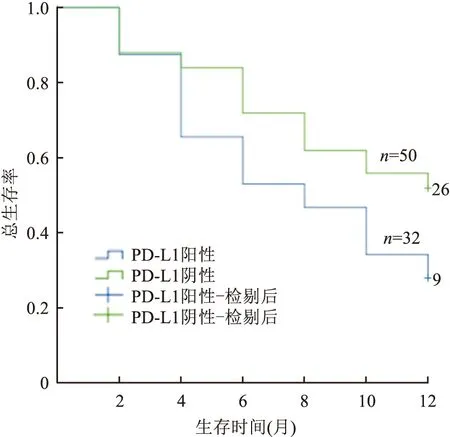
图6 NSCLC恶性胸水中PD-L1(22C3)表达与患者总生存期的关系
3 讨论
中晚期NSCLC常伴发恶性胸水,且部分患者存在基因靶向治疗受限或治疗后耐药等瓶颈,预后较差[5]。免疫治疗是目前癌症研究的新领域,PD-1/PD-L1通路在肿瘤免疫逃逸中起主导作用[6],通过对其相关通路机制的研究,可为临床NSCLC的免疫治疗提供新的理论依据。
目前,多种肿瘤中均发现PD-L1的表达,包括NSCLC、乳腺癌、胃癌、神经胶质瘤、黑色素瘤等。李毓飞等[7]报道,在胃癌组织中PD-L1的表达高于癌旁组织,且其表达与肿瘤直径和分化程度相关,提示肿瘤预后不良。Lin等[8]研究证实,PD-1、PD-L1(22C3)在肺癌组织中的表达与肿瘤直径、有无淋巴结转移及组织学分级相关。本实验结果表明,在149例NSCLC患者恶性胸水中,PD-L1(22C3)的总阳性率为42.3%,其表达与肿瘤分化程度、有无淋巴结转移、有无其他脏器转移相关(P<0.05)。提示PD-L1(22C3)参与NSCLC的发生、发展,可作为NSCLC恶性进展和预后评估的重要分子标志物。
随着对NSCLC靶向治疗的研究与进展,以ALK、EGFR为驱动基因的分子靶向治疗已在临床成熟应用,相关研究结果表明对于ALK融合蛋白阳性且EGFR基因突变的病例,采用EGFR-TKI及克唑替尼治疗均表现为临床获益[9]。本实验结果显示,PD-L1(22C3)与ALK(D5F3)的表达呈正相关(P<0.05),而与EGFR突变无关(P>0.05)。了解基因之间的相互作用有助于理解临床肿瘤靶向治疗时出现的耐药机制。
通过对抗PD-1/PD-L1通路免疫逃逸机制的研究,目前已有多种PD-1/PD-L1单克隆抗体治疗性药物问世,其中PD-L1单克隆抗体包括Nivolumb、Atezolizumab、Pembrolizumab、Durvalumab等[10]。前期临床研究结果表明在抗PD-1/PD-L1免疫治疗中,肿瘤细胞PD-L1高表达患者的中位总生存期、1年生存率、客观缓解率等比PD-L1低表达患者有明显优势[11]。本实验发现PD-L1(22C3)阳性患者与阴性患者的中位总生存期差异有显著性(P<0.05),检测PD-L1(22C3)在晚期NSCLC恶性胸水中的表达,可为临床肿瘤免疫治疗提供一定的参考依据。
综上所述,PD-L1(22C3)参与NSCLC的发生、发展,其表达与肿瘤进展和不良预后相关。行胸水细胞蜡块PD-L1(22C3)免疫组化检测具有简单易行、快速实用、微创并可重复检查等优点。检测中晚期NSCLC患者恶性胸水中PD-L1(22C3)的表达,对NSCLC患者的巩固治疗与预后监测均具有重要的临床应用价值。

