中国医疗机构药品目录管理评价指南
陈慧 苏广全 刘晓 田方圆 管滢芸 陈婷婷 赵颖楠 刘琳琳 卞晓岚 徐珽 李晓宇 沈爱宗 刘丽宏
中圖分类号 R95 文献标志码 A 文章编号 1001-0408(2022)06-0641-12
DOI 10.6039/j.issn.1001-0408.2022.06.01
摘 要 为提高我国医疗机构药品目录的管理水平,帮助医疗机构构建用药结构合理、调整程序规范、操作应用便捷、评价方法科学的医疗机构药品目录,从而最大限度地满足临床的合理用药需求。在中国药学会药学服务专业委员会的支持下,中日友好医院和中国科学技术大学附属第一医院(安徽省立医院)共同发起,联合多家医疗机构共同参与完成了《中国医疗机构药品目录管理评价指南》。本指南制定工作组严格根据世界卫生组织标准指南制定方法学要求,基于德尔菲法,从医疗机构药品目录的组织管理、目录结构、目录调整、目录应用及目录评价5个维度构建了医疗机构药品目录管理评价指标体系及量化评分表,用于帮助医疗机构对其药品目录管理质量进行评价,以期为医疗机构药品目录精细化管理发挥积极作用。
关键词 医疗机构;药品目录;管理;质量评价;指南
Guideline for the evaluation of medicine list in Chinese medical institutions
CHEN Hui1,SU Guangquan2,LIU Xiao3,TIAN Fangyuan4,GUAN Yingyun5,CHEN Tingting6,ZHAO Yingnan3,LIU Linlin7,BIAN Xiaolan5,XU Ting4,LI Xiaoyu6,SHEN Aizong7,LIU Lihong3(1. Dept. of Pharmacy, Beijing Chao-yang Hospital, Capital Medical University, Beijing 100020, China; 2. School of Pharmacy, Anhui University of Chinese Medicine, Hefei 230012, China; 3. Dept. of Pharmacy, China-Japan Friendship Hospital, Beijing 100029, China; 4. Dept. of Pharmacy, West China Hospital, Sichuan University, Chengdu 610041, China; 5. Dept. of Pharmacy, Ruijin Hospital, Shanghai Jiaotong University School of Medicine, Shanghai 200025, China; 6. Dept. of Pharmacy, Zhongshan Hospital, Fudan University,Shanghai 200032, China; 7. Dept. of Pharmacy, the First Affiliated Hospital of University of Science and Technology of China/Anhui Provincial Hospital, Hefei 230001, China)
ABSTRACT In order to improve the management level of medicine list of medical institutions in China, and help medical institutions build a medicine list of medical institutions with reasonable drug use structure, standardized adjustment procedures, convenient operation and application and scientific evaluation methods, so as to meet the needs of clinical rational drug use to the greatest extent, with the support of the Pharmaceutical Care Professional Committee of the Chinese Pharmaceutical Association, China-Japan Friendship Hospital and the First Affiliated Hospital of University of Science and Technology of China (Anhui Provincial Hospital) jointly initiate and complete Guideline for the Evaluation of Medicine List in Chinese Medical Institutions jointly with a number of medical institutions. In strict accordance with the methodological requirements of World Health Organization standard guidelines, based on the Delphi method, the guideline formulation working group has constructed the quality evaluation index system and quantitative scoring table of medicine list management in medical institutions from the 5 dimensions of organization and management, structure, adjustment, application and evaluation of the list. It is used to help medical institutions evaluate the quality of their medicine list management, so as to play a positive role in the fine management of medicine list in medical institutions.
KEYWORDS medical institution; medicine list; manage- ment; quality evaluation; guideline
自1977年頒布第1版《世界卫生组织基本药物示范目录》(WHO Essential Medicines List,WHO-EML)以来,WHO每隔两年都会根据全球疾病种类分布以及药品安全性与有效性等方面的资料对该目录进行更新。WHO-EML严谨科学的更新和推广程序成为了各国和医疗机构管理药品目录的参考范例[1]。
对于医疗机构药品目录的管理,我国也出台了较多的法律法规和政策文件,如:2011年出台的《医疗机构药事管理规定》指出,医疗机构药事管理与药物治疗学委员会的职责之一是制订本机构药品处方集和基本用药供应目录[2];2012年颁布的《抗菌药物临床应用管理办法》和2015年颁布的《抗菌药物临床应用指导原则(2015年版)》规定,医疗机构应当严格制订本机构的抗菌药物目录,加强对抗菌药物品种和品规数量的控制,并定期调整其结构[3-4];2019年我国发布了《第一批国家重点监控合理用药药品目录(化药及生物制品)》,并同时要求各级各类医疗机构应在省级重点监控合理用药药品目录的基础上形成本机构重点监控药品目录[5];2020年发布的《关于加强医疗机构药事管理促进合理用药的意见》要求医疗机构依据安全、有效、经济的用药原则和本机构治疗疾病的特点,及时优化本机构用药目录,形成科学合理的用药结构[6];同年发布的《抗肿瘤药物临床应用管理办法(试行)》规定,医疗机构应当建立抗肿瘤药物遴选和评估制度,根据本机构疾病诊疗需求制订抗肿瘤药物供应目录并定期调整[7];2021年发布的《国家重点监控合理用药药品目录调整工作规程》又进一步加强了对国家重点监控合理用药药品目录的管理,使得国家重点监控药品目录制订调整工作更加科学合理[8]。上述一系列政策的发布均提示,制订并管理好医疗机构药品目录至关重要。尽管健康中国研究中心药品与健康产品专家委员会联合8家医疗组织曾在2020年共同发布了《中国医疗机构药品评价与遴选快速指南》[9],为我国医疗机构目录内药品的准入与调出提供了借鉴价值,但目前仍未建立统一的针对医疗机构药品目录管理质量的全方位评价标准,医疗机构仍停留在自行遴选用药、自我管理的阶段,导致国家各类医药政策的落地效果不甚理想,不合理用药现象仍令人担忧。
为提高我国医疗机构药品目录的管理水平,帮助医疗机构构建用药结构合理、调整程序规范、操作应用便捷、评价方法科学的医疗机构药品目录,从而最大限度地满足临床合理用药的需求,有必要探索建立医疗机构药品目录管理质量的评价标准。2021年5月,在中国药学会药学服务专业委员会的支持下,中日友好医院和中国科学技术大学附属第一医院(安徽省立医院)共同发起,联合首都医科大学附属北京朝阳医院、上海交通大学医学院附属瑞金医院、四川大学华西医院、复旦大学附属中山医院等多家医疗机构共同参与完成了《中国医疗机构药品目录管理评价指南》,以期为医疗机构药品目录的精细化管理发挥积极作用。
1 指南制定背景和流程
本指南基于专家德尔菲法,严格根据WHO标准指南制订方法学要求进行,并已在国际实践指南注册平台进行注册,注册号为IPGRP-2021CN195。
1.1 指南工作组的组成及职责
指南工作组由专家指导组、专家组、秘书组和外审组组成。专家指导组由具有丰富指南制定经验的高级职称专家组成,主要职责是为指南确定主题和范围、管理审核利益声明、批准指南计划书、监督指南制定流程、批准推荐意见等。专家组为指南评价标准的制定提供意见,对于没有确切证据的问题或有争议的问题通过德尔菲法达成共识,并参与指南的起草和修订工作。秘书组负责系统地检索已有的临床证据、系统综述并提交给专家组参考、详细记录指南的制定过程、参与撰写指南初稿等。外审组则由对本指南主题感兴趣的人员及在指南制定过程中可能涉及的全环节工作人员构成,其不直接参与指南制定,而在前期负责评审指南的评价范围和相关问题,后期负责评审指南定稿文件。
1.2 指南相关证据的检索与质量评价
检索内容包括:医疗机构药品目录、目录管理、目录结构、目录调整、目录应用、目录评价等。
检索文献类型包括:(1)指南、共识;(2)由卫生行政部门、行业协会、学术组织或科研机构发布的文件;(3)各数据库收录的研究文献及综述。语种仅限中、英文。排除重复发表或原文无法获取的文献。
检索范围包括:(1)万方数据、维普网、中国生物医学文献服务系统、中国知网、PubMed、Cochrane图书馆等中、英文文献数据库;(2)国际指南协作网(Guidelines International Network,GIN)、TRIP指南数据库等指南数据库;(3)国家各卫生行政部门、药监部门或相关行业协会的官方网站。检索时间为2021年10月。
由于本指南的相关证据多为国家各部委发布的最新的医药类相关政策文件,因此不开展证据质量评价。当相关证据欠缺时,由专家组形成共识意见。
1.3 利益声明
本指南工作组成员及所在单位与评价目标均无相关利益冲突。
2 指南适用范围
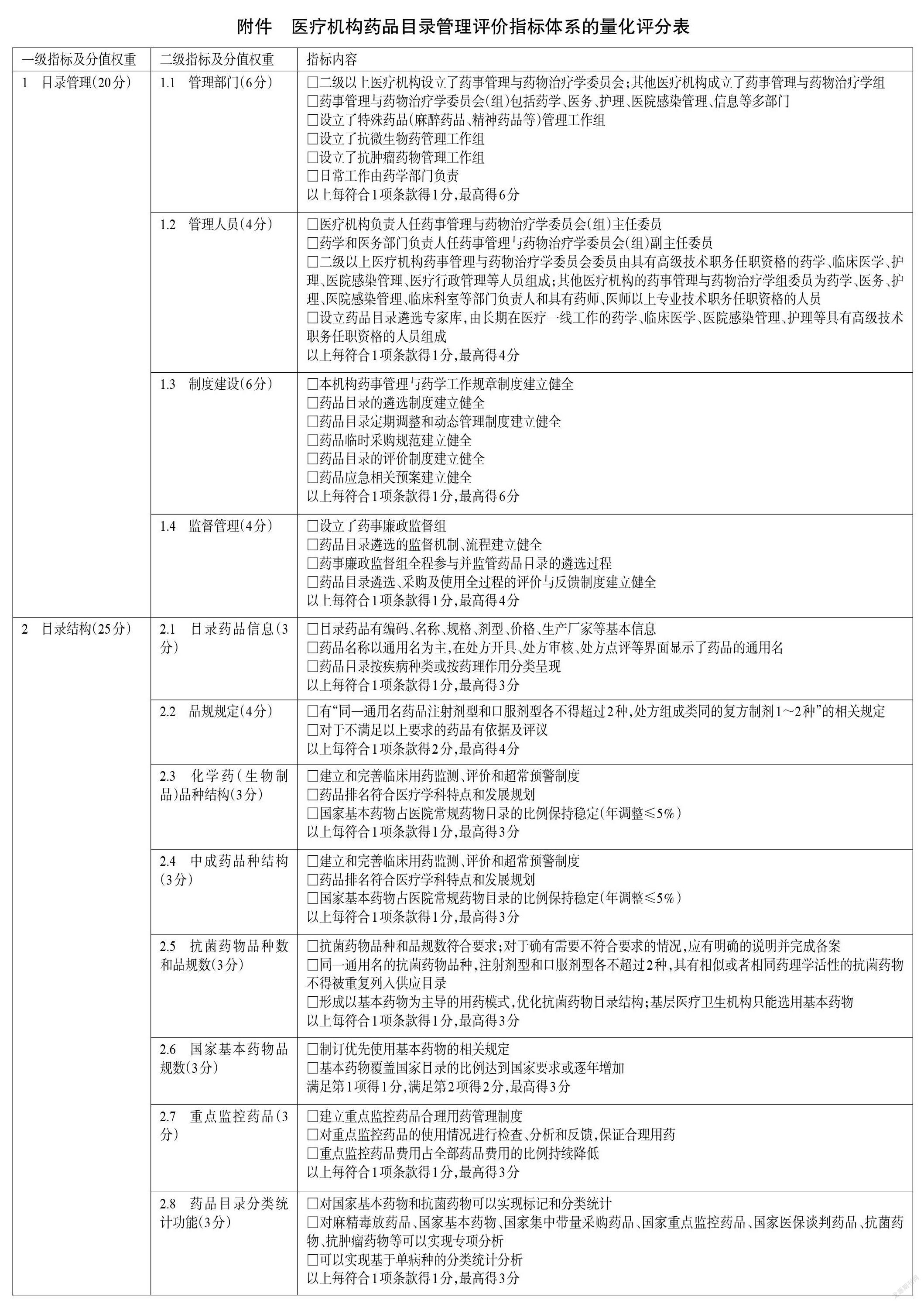
本指南是基于国家相关法律法规规定及当前可获得的最佳证据制定而成的,旨在为我国各级医疗机构药品目录管理质量的评价提供依据。因此,本指南主要适用于我国有药品目录管理需求的各级医疗机构及各级卫生管理部门,适用人群为各级医疗机构及卫生管理部门的管理人员、药师、医师、护师等相关医务人员。指标体系量化评分表采用百分制,评分细则详见附件。
该量化评分表的主要用途如下:(1)指标细则可为医疗机构管理药品目录提供参考;(2)量化评分表的评分结果可用于评估医疗机构药品目录的管理水平。一般情况下,医疗机构自评得分低于60分为不及格,提示该医疗机构药品目录管理工作亟需整改。
(说明:量化评分表已在参与指南制定的各家医疗机构内部进行过试运行,评價得分结果均较高。由于本指南制定期间所依据的相关政策在不断调整变化,加之医疗机构的自身情况各不相同,故各家医疗机构的试运行得分并不具有普适性。因此,在使用本指南的过程中,各医疗机构可侧重于自身目录管理质量进行纵向动态提升,或者依据实际情况对本指标细则及权重作出适当调整。)
3 评价维度、指标、目的及内容
3.1 目录管理
3.1.1 管理部门
评价目的包括:评价医疗机构药品目录管理评价的部门建设是否健全,药事管理与药物治疗学委员会(组)的相关制度是否落实,是否具有药品目录遴选及日常管理的负责部门。
《医疗机构药事管理规定》指出,“二级以上医院应当设立药事管理与药物治疗学委员会;其他医疗机构应当成立药事管理与药物治疗学组”[2]。基于上述政策要求,本条目的主要评价内容包括:(1)二级以上医疗机构是否设立了药事管理与药物治疗学委员会,其他医疗机构是否成立了药事管理与药物治疗学组;(2)药事管理与药物治疗学委员会(组)是否包括了药学、医务、护理、医院感染管理、信息等多部门;(3)是否设立了特殊药品(麻醉药品、精神药品等)管理工作组,负责特殊药品目录遴选的相关工作;(4)是否设立了抗微生物药管理工作组,负责抗微生物药目录遴选的相关工作;(5)是否设立了抗肿瘤药物管理工作组,负责抗肿瘤药物目录遴选的相关工作;(6)日常工作是否由药学部门负责[2,10]。
3.1.2 管理人员
评价目的包括:评价医疗机构药事管理与药物治疗学委员会(组)主任委员、副主任委员及委员的组成及资质是否符合要求;评价药品目录遴选专家组专家的组成及资质是否符合要求。
本条目的主要评价内容包括:(1)医疗机构负责人是否担任药事管理与药物治疗学委员会(组)主任委员,药学和医务部门负责人是否担任药事管理与药物治疗学委员会(组)副主任委员。(2)二级以上医疗机构的药事管理与药物治疗学委员会委员是否由具有高级技术职务任职资格的药学、临床医学、护理、医院感染管理、医疗行政管理等人员组成;其他医疗机构的药事管理与药物治疗学组委员是否为该医疗机构药学、医务、护理、医院感染管理、临床科室等部门负责人和具有药师、医师以上专业技术职务任职资格的人员。(3)医疗机构是否建立了由长期在医疗一线工作的药学、临床医学、医院感染管理、护理等专业的具有高级技术职务任职资格人员组成的药品目录遴选专家库[2,11]。
3.1.3 制度建设
评价目的包括:评价医疗机构药事管理与药物治疗学委员会(组)的制度建设以及药品目录的遴选情况,是否定期调整和动态管理制度建设。
《医疗机构药事管理规定》指出,药事管理与药物治疗学委员会(组)应当建立健全相应工作制度,并由药学部门负责日常工作[2]。基于上述政策要求,本条目的主要评价内容包括:(1)本机构药事管理与药学工作规章制度是否建立健全,且相关规章制度是否由药事管理与药物治疗学委员会(组)监督实施;(2)药品目录的遴选制度是否建立健全,包括新药引进、品种增补和替换及药品淘汰等的原则、范围、方法和程序,并形成制度规范;(3)药品目录定期调整和动态管理制度是否建立健全;(4)药品临时采购规范是否建立健全,基本用药供应外的药品是否按临时采购规范采购;(5)药品目录的评价制度(如合理用药点评制度等)是否建立健全;(6)药品应急相关预案是否建立健全,如易燃易爆危险药品安全应急预案、麻醉药品/精神药品/医疗用毒性药品/放射性药品(以下简称“麻精毒放药品”)防丢失应急预案、急救药品保障应急预案、突发公共卫生事件药品保障应急预案等[2,10-11]。
3.1.4 监督管理
评价目的包括:评价医疗机构的药品目录监督管理部门建设及制度建设是否健全。
《医疗机构药事管理规定》指出,医疗机构药事管理与药物治疗学委员会(组)负责药品目录相关制度的制订并监督实施[2]。基于上述政策要求,本条目的主要评价内容为药品目录的监督管理事项,包括:(1)医疗机构是否设立了由专职纪检人员组成的药事廉政监督组;(2)药品目录遴选的监督制度、流程是否建立健全,并严格按此实施;(3)药事廉政监督组是否全程参与并监管药品目录的遴选过程;(4)药品目录遴选、采购及使用全过程的评价与反馈制度是否建立健全,是否有合理且畅通的接受药品目录制订及使用相关建议和意见的途径,并有有效的解决和反馈措施[12]。
3.2 目录结构
3.2.1 目录药品信息
评价目的包括:评价医疗机构信息系统中的药品相关数据是否规范、完整,是否有助于药品识别,是否能保证后续药品采购、出入库、处方开具、审核、收费、调剂、发药等一系列运行数据的标准化和再利用。
根据医疗机构药品目录的核心功能,医疗机构信息系统中的药品相关数据应支持药品采购、储存、调配和使用,故上述相关数据应至少包括药品编码、名称、规格、剂型、包装、价格、生产厂家等基本信息;同时,医疗机构信息系统应支持药品医嘱安全、合理、合规地开具和支付,医师开具处方应当使用经药品监管部门批准并公布的药品通用名、新活性化合物的专利药品名称和复方制剂药品名称。此外,医疗机构药品目录应有适宜的分类和层级架构,以帮助医务人员更准确、高效地选用药品。分类方式可按疾病分类,也可按药理作用分类等[13],也可同时使用管理等级、药物剂型、给药途径等多种方式。基于上述政策要求,本条目的评价内容包括:(1)目录药品是否有编码、名称、规格、剂型、价格、生产厂家等基本信息;(2)药品名称是否以通用名为主,在处方开具、处方审核、处方点评等界面是否显示了药品的通用名;(3)药品目录是否按疾病种类或按药理作用分类呈现。
3.2.2 品规规定
评价目的:评价医疗机构是否落实有关品规的政策要求。
医疗机构应当按照经药品监管部门批准并公布的药品通用名购进药品。同一通用名药品的品种,注射剂型和口服剂型各不得超过2种,处方组成类同的复方制剂1~2种[14]。这样的政策限定是为了减少易混淆药品的品规,从源头上避免药品调剂和使用过程中可能出现的差错;同时,该政策限定在保障医疗质量与安全、控制医药费用不合理增长等方面亦具有积极意义。而在临床实际工作中,由于诊疗的复杂性,对于医疗机构确有配备多个品规需要的(如溶媒、胰岛素、儿童制剂等),应对其必要性和潜在风险进行评估[14]。基于上述政策要求,本条目的评价内容包括:(1)医疗机构是否有“同一通用名药品注射剂型和口服剂型各不得超过2种,处方组成类同的复方制剂1~2种”的相关规定;(2)对于不满足以上要求的药品是否有依据及评议。
3.2.3 化学药(生物制品)品种结构
评价目的包括:评价医疗机构化学药(生物制品)品种结构是否落实政策法规要求,是否符合自身医疗学科特点及发展规划。
医疗机构要建立和完善临床用药监测、评价和超常预警制度,对药物临床使用的安全性、有效性和经济性进行监测、分析、评估;并通过持续、有效、常态化的合理用药管理来保证药品排名与各医疗机构医疗特点及发展规划相符。各级医疗机构应形成以基本药物为主导的“1+X”用药模式(“1”为国家基本药物目录、“X”为非基本药物,由各地根据实际确定)。基本药物品种占医院常规品种的比例可体现医疗机构在基本医疗与创新和个体化医疗之间的取舍与权衡[15-16]。基于上述政策要求,本条目的主要评价内容包括:(1)医疗机构是否建立和完善了临床用药监测、评价和超常预警制度;(2)药品排名是否符合医疗学科特点和发展规划;(3)国家基本药物占医院常规药物目录的比例是否保持稳定(年调整≤5%)。
3.2.4 中成药品种结构
评价目的包括:评价医疗机构中成药品种结构是否落实法规政策要求,是否建立和完善临床用药监测、评价和超常预警制度,中成药的使用排名是否符合中医学科特点和发展规划,配备的中成药国家基本药物占医院中成药常规药物目录的比例是否保持稳定。
中医学科有独立的疾病诊断体系和药物治疗理念。《国家基本药物目录(2018年版)》分为化学药和生物制品、中成药、中药饮片3个部分。因此,本指南关于目录结构的评价也采取相应的策略,将化学药(生物制品)与中成药分组分析。本条目对中成药品种结构的具体评价内容与化学药(生物制品)保持一致。
3.2.5 抗菌药物品种结构
评价目的:评价医疗机构药品目录中的抗菌药物品种数与品规数是否符合政策要求。
医疗机构应严格控制抗菌药物购用品种、品规数,保障抗菌药物购用品种、品规结构合理。根据相关管理规定,三级综合医院抗菌药物品种原则上不超过50种,二级综合医院抗菌药物品种原则上不超过35种;口腔医院抗菌药物品种原则上不超过35种,肿瘤医院抗菌药物品种原则上不超过35种,儿童医院抗菌药物品种原则上不超过50种,精神病医院抗菌药物品种原则上不超过10种,妇产医院(含妇幼保健院)抗菌药物品种原则上不超过40种。同一通用名注射剂型和口服剂型各不超过2种,具有相似或者相同药理学特征的抗菌药物不得重复采购。头霉素类抗菌药物不超过2个品规;第三代及第四代头孢菌素类抗菌药物(含复方制剂)口服剂型不超过5个品规,注射剂型不超过8个品规;碳青霉烯类抗菌药物注射剂型不超过3个品规;氟喹诺酮类抗菌药物口服剂型和注射剂型各不超过4个品规;深部抗真菌类抗菌药物不超过5个品种。对于确因临床工作需要,抗菌药物品种和品规数超过规定的,应当向核发《医疗机构执业许可证》的卫生行政部门详细说明;若说明不充分或者理由不成立的,卫生行政部门不得接受其抗菌药物品种和品规数的备案。同时,医疗机构要对抗菌药物供应目录进行科学合理的动态调整,及时将临床效果确切、经济性好、安全风险低的药品纳入供应目录,逐步淘汰药效及药动学特性差、不良反应多和循证医学证据不足的药品,形成以基本药物为主导的“1+X”用药模式,合理优化抗菌药物供应目录。基层医疗卫生机构只能选用基本药物[包括各省(区、市)增补品种]中的抗菌药物品种[17-20]。基于上述政策要求,本条目的评价内容包括:(1)抗菌药物品种和品规数是否符合要求;对于确有不符合要求的情况,是否有明确的说明并完成了备案。(2)同一通用名的抗菌药物品种,注射剂型和口服剂型是否各超过2种;具有相似或者相同药理学活性的抗菌药物是否被重复列入供应目录。(3)是否形成了以基本药物为主导的用药模式;是否优化了抗菌药物目录结构;基层医疗卫生机构是否只选用了基本药物。
3.2.6 国家基本药物品规数
评价目的:评价医疗机构药品目录中的国家基本药物品规数是否符合国家政策要求。
基本药物是适应基本医疗卫生需求,剂型适宜、价格合理,能够保障供应且公众可公平获得的药品[21]。建立国家基本药物制度是党中央、国务院为维护人民健康、保障公眾基本用药权益实施的一项惠民工程,是医药卫生领域重大的体制机制改革,对保证基本药物的足额供应和合理使用、改革医疗机构“以药补医”机制、减轻群众基本用药负担具有重要意义,也是促进药品生产流通企业资源进一步优化和整合的重要途径[22]。《国务院办公厅关于进一步做好短缺药品保供稳价工作的意见》指出,“通过加强用药监管和考核、指导督促医疗机构优化用药目录和药品处方集等措施,促进基本药物优先配备使用,提升基本药物使用占比,并及时调整国家基本药物目录,逐步实现政府办基层医疗卫生机构、二级公立医院、三级公立医院基本药物配备品种数占比原则上分别不低于90%、80%、60%”[16]。基于上述政策要求,本条目的评价内容包括:(1)医疗机构是否制订了优先使用基本药物的相关规定;(2)医疗机构基本药物覆盖国家目录的比例是否达到国家要求或逐年增加。
3.2.7 重点监控药品
评价目的:评价医疗机构是否加强了对重点监控药品的临床应用规范化管理。
根据相关管理规定,医疗机构要建立重点监控药品管理制度,加强对重点监控药品目录内药品临床应用的全程管理。医疗机构要进一步规范医师处方行为,对纳入重点监控药品目录的药品制订用药指南或技术规范,明确规定临床应用的条件和原则;已有相关用药指南或指导原则的,要严格按照指南或原则执行。对纳入目录中的全部药品开展处方审核和处方点评,加强处方点评结果的公示、反馈及利用。对用药不合理问题突出的品种,采取排名通报、限期整改、清除出本机构药品供应目录等措施,保证合理用药[5]。基于上述政策要求,本条目的评价内容包括:(1)医疗机构是否建立了重点监控药品合理用药管理制度;(2)是否对重点监控药品使用情况进行了检查、分析和反馈,保证合理用药;(3)重点监控药品费用占全部药品费用的比例是否持续降低。
3.2.8 药品目录分类统计功能
评价目的:评价医疗机构信息系统是否支持药品的分类分析。
按照相关文件要求,医疗机构应对麻精毒放药品、国家基本药物、国家集中带量采购中标药品、国家医保谈判药品、国家重點监控药品、抗菌药物、抗肿瘤药物等品种进行监测和临床应用管理[22-25]。不仅全国医疗机构及全国基层医疗卫生机构信息化建设标准与规范均要求医疗机构对其国家基本药物和抗菌药物的使用情况进行分析[26-27],而且国家卫生健康委也要求全国医疗机构上报基本药物、抗菌药物及单病种治疗药物占比等指标数据[28];与此同时,2020年新发布的《三级医院评审标准(2020年版)实施细则》也将住院患者静脉输液使用率、住院患者中药注射剂静脉输液使用率、急诊患者糖皮质激素静脉输液使用率、住院患者质子泵抑制剂注射剂静脉使用率等纳入了药事管理专业医疗质量控制指标[10]。基于上述政策要求,本条目的主要评价内容包括:(1)医疗机构信息系统是否可以实现对国家基本药物和抗菌药物的标记和分类统计;(2)对麻精毒放药品、国家基本药物、国家集中带量采购药品、国家重点监控药品、国家医保谈判药品、抗菌药物、抗肿瘤药物等是否可以实现专项分析;(3)是否可以实现基于单病种的分类统计分析。
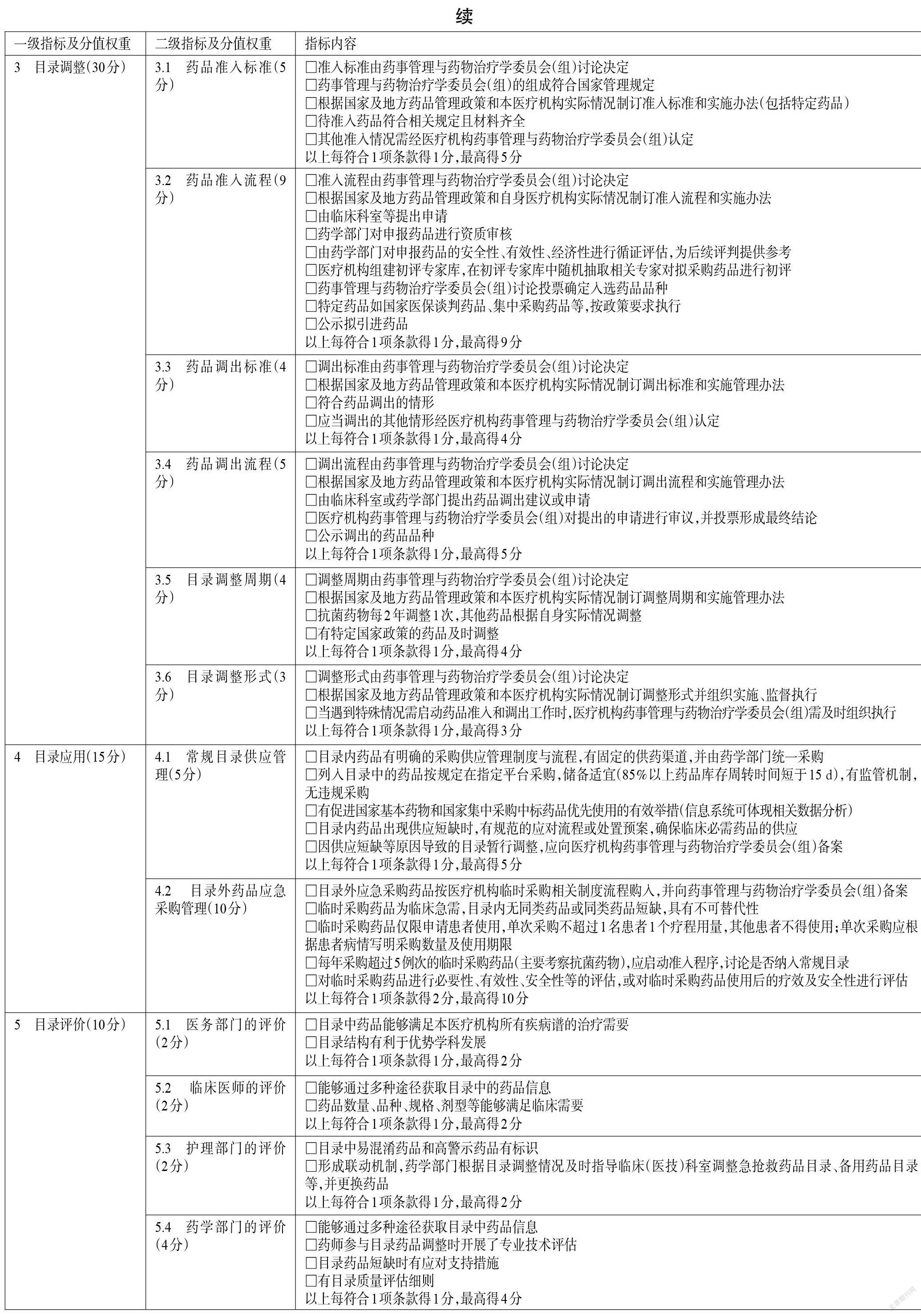
3.3 目录调整
3.3.1 药品准入标准
评价目的包括:评价医疗机构药品目录准入标准是否符合国家及地方药品管理相关政策要求,是否符合本医疗机构诊疗范围及临床治疗需求。
本条目的主要评价内容包括:(1)药品准入标准是否由医疗机构药事管理与药物治疗学委员会(组)讨论决定。(2)药事管理与药物治疗学委员会(组)的组成是否符合国家相关管理规定。(3)医疗机构是否根据国家及地方药品管理政策和本机构实际情况制订药品准入标准和实施管理办法,如药品医保属性、是否属于基本药物、是否符合“一品双规”等准入的基本原则[6]。对于国家有特别规定的药品,如抗菌药物、抗肿瘤药物、国家医保谈判药品、国家集中采购药品等,是否符合国家药品准入相关政策规定。如对于国家医保谈判药品,医疗机构应根据功能定位、临床需求和诊疗能力等及时配备,且准入流程应按要求统一实施。(4)准入药品是否按照安全、有效、经济、适宜的原则,即是否充分考虑药品安全性和临床治疗效果,并兼顾了药品价格,以满足本医疗机构就诊人群的需要。待准入药品是否符合国家相关规定并提供了所有资质材料,如药品生产企业营业执照、药品生产许可证、药品生产质量管理规范(good manufacturing practice of medical products,GMP)证书、药品注册批件、质检报告等。(5)其他准入情况是否经过医疗机构药事管理与药物治疗学委员会(组)的认定。
3.3.2 药品准入流程
评价目的包括:评价药品准入流程是否符合国家及地方药品管理相关政策要求,是否经集体决策,是否公正透明。
本条目的主要评价内容包括:(1)药品准入流程是否由医疗机构药事管理与药物治疗学委员会(组)讨论决定。(2)医疗机构应根据国家及地方药品管理政策和本机构实际情况制订本机构的药品准入流程和实施管理办法。(3)药品准入流程是否包括以下环节——①由临床科室等提出申请;②药学部门对申报药品的资质进行审核,如营业执照、药品经营许可证、GMP证书、质检报告、临床研究报告以及其他可以证明该药品优势的文件资料;③药学部门对申报药品的安全性、有效性、经济性进行循证评估,并依据循证评估结果形成初步的推荐意见供初评专家及药事管理与药物治疗学委员会(组)参考;④医疗机构组建初评专家库,在初评专家库中随机抽取相关专家对拟采购药品进行初评并提出意见;⑤药事管理与药物治疗学委员会(组)举行会议,结合前期初评意见和相关资料对申报药品进行讨论,投票确定入选药品品种,并公示拟引进药品。(4)对于国家医保谈判药品、集中采购药品等是否按国家政策要求执行[28]。
3.3.3 药品调出标准
评价目的包括:评价医疗机构药品目录调出标准是否符合国家及地方药品管理相关政策要求,是否符合本医疗机构诊疗范围及临床治疗需求。
本条目的主要评价内容包括:(1)药品调出标准是否由医疗机构药事管理与药物治疗学委员会(组)讨论决定。(2)医疗机构是否根据国家及地方药品管理政策和本机构实际情况制订药品调出标准和实施管理办法。(3)药品调出是否符合以下情形——①国家药品监管部门撤销其药品批准证明文件的或药品标准被取消的;②发生严重不良反应,经评估不宜再在临床使用的;③根据药品临床综合评价结果,可被风险效益比或成本效益比更优的品种所替代的;④其他特殊情形,如医保属性发生变化、不合理用药情况突出、进入重点监控药品目录、存在廉政问题等[29]。(4)其他调出情况是否经过医疗机构药事管理与药物治疗学会(组)认定。
3.3.4 药品调出流程
评价目的包括:评价药品调出流程是否符合国家及地方药品管理相关政策要求,是否经集体决策,是否公正透明。
本条目的主要评价内容包括:(1)药品调出流程是否由医疗机构药事管理与药物治疗学委员会(组)讨论决定。(2)医疗机构是否根据国家及地方药品管理政策和本医疗机构实际情况制订调出流程和实施管理办法。(3)药品调出流程是否包括以下环节——①由临床科室或药学部门向药事管理与药物治疗学委员会(组)提出药品调出建议或申请,并提供相关证明材料;②药事管理与药物治疗学委员会(组)进行审议,并投票形成最终结论;③对药品调出相关决议进行公示[6]。
3.3.5 目录调整周期
评价目的包括:评价目录调整周期是否符合国家及地方的药品管理相关政策,是否符合本医疗机构相关管理规定或临床药物治疗需求。
本条目的主要评价内容包括:(1)药品目录调整周期是否由医疗机构药事管理与药物治疗学委员会(组)讨论决定;(2)医疗机构是否根据国家及地方药品管理政策和本医疗机构实际情况制订调整周期和实施管理办法;(3)目录调整周期的制订是否符合国家及地方的药品管理规定,如抗菌药物每2年调整1次,其他药品由医疗机构根据自身实际情况制订合适的调整周期[20];(4)有特定国家政策的药品(如国家医保谈判药品、集中采购药品等)是否及时启动调整,并在规定时间(如药品政策发生重大改变、基本药物目录发布、医保药物目录变更等)及时启动调整[30]。
3.3.6 目录调整形式
评价目的:评价目录调整形式是否符合国家及地方药品管理相关政策要求。
本条目的主要评价内容包括:(1)药品目录调整形式是否由医疗机构药事管理与药物治疗学委员会(组)讨论决定;(2)药事管理与药物治疗学委员会(组)是否根据国家及地方药品管理政策和本医疗机构实际情况制订药品准入、调出的各项标准和流程,并组织实施、监督执行;(3)当遇到特殊情况需启动药品准入和调出工作时,药事管理与药物治疗学委员会(组)是否及时组织执行[6]。
3.4 目录应用
3.4.1 常规目录供应管理
评价目的:评价医疗机构药品目录内药品的供应管理情况,以促进医疗机构药品的规范供应和合理使用,切实保障临床治疗需求。
根据相关规定,医疗机构应当制订药品采购工作流程,严格执行药品购入检查、验收制度,不得购入和使用不符合规定的药品[2]。医疗机构必须通过各省(区、市)政府建立的非营利性药品集中采购平台开展采购,实行统一组织、统一平台和统一监管[31]。医疗机构不仅应将基本药物和国家集中采购中标药品纳入药品目录,而且应有相应措施促进基本药物和国家集中采购中标药品的规范使用,以保障人民群众用药的基本需求。医疗机构应对发生或预计可能发生短缺的药品开展信息评估、替代药品遴选,并规范替代药品的使用;可根据短缺药品分类分级情况,组织相关专业人员遴选替代药品,若替代药品不在医疗机构药品目录内,药事管理与药物治疗学委员会(组)应根据本医疗机构相关规定启动应急采购,当短缺药品恢复正常供应后,应当提出替代药品处置方案,并上报医疗机构药事管理与药物治疗学委员会(组)备案[32-33]。基于上述政策要求,本条目的评价内容包括:(1)目录内药品是否有明确的采购供应管理制度与流程,是否有固定的供药渠道,是否由药学部门统一采购;(2)列入目录的药品是否按规定在指定平台采购,是否储备适宜(85%以上药品的库存周转时间短于15 d),是否有监管机制,有无违规采购;(3)医疗机构是否采取各种有效措施促进国家基本药物和国家集中采购中标药品的优先使用;(4)目录内药品出现供应短缺时,是否有规范的应对流程或处置预案以确保临床必需药品的供應;(5)因供应短缺等原因导致的目录暂行调整,是否向医疗机构药事管理与药物治疗学委员会(组)备案。
3.4.2 目录外药品应急采购管理
评价目的:通过考察目录外药品应急采购管理的规范性、合理性,考量目录的科学性和客观性,杜绝过度使用临时采购来规避目录的审批流程。
2003年,WHO药物和治疗学委员会指出,药事管理与药物治疗学委员会的职能应包括评估和选用未列入医疗机构药品供应目录的药品等[11]。目录外药品(或称“临时采购药品”)是指未列入医疗机构药品目录且不常规采购,但在临床紧急抢救、特殊病种治疗需要或其他特殊需要时,可经临床科室申请,按医院临时采购相关流程进行采购的药品[3,7]。由于目录外药品不属于医疗机构药品正常保障的范畴,因此其采购量可从另一个侧面反映医疗机构的药品目录是否科学、合理,药事管理与药物治疗学委员会(组)是否权威、有效。
根据相关规定,医疗机构因特殊治疗需要确需使用本医疗机构抗菌药物供应目录外抗菌药物的,可以启动临时采购程序,但应当严格控制临时采购抗菌药物的品种和数量:同一通用名抗菌药物品种启动临时采购程序原则上每年不得超过5例次;如果超过5例次,则需讨论该药品是否应被列入至本医疗机构抗菌药物供应目录[3]。医疗机构因特殊治疗需要确需使用本医疗机构抗肿瘤药物供应目录外抗肿瘤药物的,可以启动临时采购程序,由临床科室提出申请,经本医疗机构抗肿瘤药物管理工作组审核同意后,由药学部门临时一次性购入使用[6]。我国仍在不断完善药品临时采购的相关政策制度,各医疗机构也在不断探索药品临时采购的相应规范,但可以达成共识的是:临时采购药品应符合必要性,即通过横向对比同类药品或同适应证药品的药理作用机制和药动学参数等,评定该药品的临床使用必要性;临时采购药品应具有有效性,即通过重点查看推荐该药品的临床指南、专家共识,以及应用该药品的文献及证据等级等,结合专家论证意见,评定该药品的临床治疗效果;此外,还应考察临时采购药品的安全性、经济性、医保属性和基本药物属性等,综合评定该药品的适宜性。
基于上述政策要求和文献,本条目的主要评价内容包括:(1)目录外应急采购药品是否按医疗机构临时采购相关制度流程购入,并向医疗机构药事管理与药物治疗委员会(组)备案。(2)临时采购药品是否为临床急需,目录内是否无同类药品或同类药品短缺,是否具有不可替代性。(3)临时采购药品是否仅限申请患者使用,其他患者不得使用;单次采购是否根据患者病情写明采购数量及使用期限。(4)每年采购超过5例次的临时采购药品(主要考察抗菌药物),是否启动准入程序,讨论是否纳入常规目录。(5)是否进一步发挥临床药师作用,对临时采购药品进行必要性、有效性、安全性等评估,或对临时采购药品使用后的疗效及安全性进行评估,以保障临床合理用药。
3.5 目录评价
3.5.1 医务部门的评价
医务部门根据临床科室的用药需求、患者的治疗需要,结合医疗机构自身的发展特色,对药品目录进行相关评价,有助于保证医疗机构药品目录满足广大患者不断增长的临床治疗需求,实现常用药品的全覆盖,并有利于医疗机构优势学科的发展。
医疗机构药品目录是基于《国家基本药物目录》,结合本医疗机构的医疗特色和临床需要所制订的药品目录。医疗机构药品目录不仅仅是一个目录,其调整将引发医疗机构医疗服务和医保报销等一系列变化。因此,本条目的主要评价内容包括:(1)目录中的药品是否能够满足本医疗机构所有疾病谱的治疗需要;(2)目录结构是否有利于优势学科发展[34]。
3.5.2 临床医师的评价
临床医师对药品的使用具有决策权,可以根据患者的疾病进程、个体差异和经济水平选择个体化治疗药物。临床医师对于药品目录的评价可帮助医疗机构丰富用药层次,以保障患者用药及时、安全、有效。
公立医疗机构根据自身功能定位和诊疗范围,基于《国家基本药物目录》合理配备基本药物,并结合医疗机构的特色,制订本医疗机构的药品目录,以保障临床用药需求。医疗机构药品目录的相关药品信息应能支持临床医师通过多种渠道查阅获取。基于上述政策要求,本条目的主要评价内容包括:(1)临床医师是否能够通过多种途径获取目录中的药品信息;(2)药品数量、品种、规格、剂型等是否能够满足临床需要。
3.5.3 护理部门的评价
作为住院医嘱的主要执行者,护士对医疗机构药品目录的评价有助于优化目录中有关急抢救药品、病区备用药品、麻精毒放药品、高警示药品、易混淆药品的结构设置,为临床安全、准确、及时用药助力。
根据《三级综合医院评审标准(2020年版)实施细则》,备用药品管理工作的好坏将直接影响药品的质量和患者的用药安全[10]。易混淆药品概念复杂,包括具有相同(或相近)药品名称但不同剂型不同规格的药品,或成分相近名称不同的药品,或可能由其他因素导致混淆的药品。减少目录中易混淆药品的数量将有助于保障临床准确用药。对于麻精毒放等特殊管理药品,应当按照有关法律、法规、规章的相关规定进行管理和监督使用[2]。高警示药品目录的制订将有助于医护人员及时掌握高警示药品信息。基于上述政策要求,本条目的主要评价内容包括:(1)目录中易混淆药品和高警示药品是否有标识;(2)是否能够形成联动机制,药学部门是否根据目录调整情况及时指导临床(医技)科室调整急抢救药品目录、备用药品目录等,并更换药品。
3.5.4 药学部门的评价
药品目录是保障医疗机构合理用药的基础。药师依据药品的药效学特点、制剂学特点、药动学特点、药物安全风险、药物经济学评价、药物循证证据,以及医疗机构处方评价等信息,及时发现药品目录中存在的问题,并推动目录调整和更新,有助于确保医疗机构药品目录管理质量的持续提升。
根据相关规定,药学部门应发挥管理职能,会同其他职能部门和临床科室,切实加强对药品遴选、采购、处方审核、处方调剂、临床应用和评价等各个环节的全过程管理;临床药师要对药品临床使用的安全性、有效性和经济性进行监测、分析、评估[14]。基于上述政策要求,本条目的主要评价内容包括:(1)药师能否通过多种途径获取目录中的药品信息;(2)药师参与目录药品调整时是否开展了专业技术评估;(3)目录药品短缺时是否有应对支持措施;(4)是否有目录质量评估細则。
4 指南的更新
指南发布后,计划在未来3~5年内按照国际指南更新方法和流程对本推荐意见进行更新。
参考文献
[ 1 ] 周瑞瑞,谢晓慧,陈哲,等.第5版和第6版《WHO儿童基本药物标准清单》及其与《国家基本药物目录》(2012年版)的对比分析及启示[J].中国新药杂志,2018,27(19):2222-2226.
[ 2 ] 卫生部,国家中医药管理局,总后勤部卫生部.医疗机构药事管理规定:卫医政法〔2011〕11号[EB/OL]. [2021-03-
30]. http://www.nhc.gov.cn/cms-search/xxgk/getManuscript-
Xxgk.htm?id=0149ba1f66bd483995bb0ea51a354de1.
[ 3 ] 卫生部.抗菌药物临床应用管理办法:卫生部令第84号[EB/
OL].(2012-04-24)[2021-07-01]. http://www.nhc.gov.cn/fzs/s3576/201808/f5d983fb5b6e4f1ebdf0b7c32c37a368.shtml.
[ 4 ] 国家卫生计生委办公厅,国家中医药管理局办公室,解放军总后勤部卫生部药品器材局.关于印发抗菌药物临床应用指导原则(2015年版)的通知:国卫办医发〔2015〕43号[EB/OL].(2015-08-27)[2021-12-31]. http://www.gov. cn/xinwen/2015-08/27/content_2920799.htm.
[ 5 ] 国家卫生健康委.关于印发第一批国家重点监控合理用药药品目录(化药及生物制品)的通知:国卫办医函〔2019〕558号[EB/OL].(2019-07-01)[2021-07-01]. http://www.nhc.gov.cn/yzygj/s7659/201907/d356ce8a4ba1461ca-
66c544724dffc5e.shtml.
[ 6 ] 国家卫生健康委,教育部,财政部,等.卫生健康委教育部财政部人力资源社会保障部医保局药监局关于印发加强医疗机构药事管理促进合理用药的意见的通知:国卫医发〔2020〕2号[EB/OL].(2020-02-21)[2021-07-11]. http:// www.gov.cn/gongbao/content/2020/content_5522549.htm.
[ 7 ] 国家卫生健康委.国家卫生健康委关于印发抗肿瘤药物临床应用管理办法(试行)的通知:国卫医函〔2020〕487号[EB/OL].(2020-12-28)[2021-07-11]. http://www.nhc.gov.cn/yzygj/s7659/202012/a7600740bed44d1db7015ca5a-
1be2cc0.shtml.
[ 8 ] 国家卫生健康委办公厅.国家卫生健康委办公厅关于印发国家重点监控合理用药药品目 录调整工作规程的通知:国卫办医函〔2021〕474号[EB/OL].(2021-09-03)[2021-
07-11]. http://www.nhc.gov.cn/yzygj/s7659/202109/5162-
329bf12d40ea9327b4e8db5103dc.shtml.
[ 9 ] 赵志刚,董占军,刘建平.中国医疗机构药品评价与遴选快速指南[J].医药导报,2020,39(11):1457-1465.
[10] 国家卫生健康委办公厅.国家卫生健康委办公厅关于印发《三级医院评审标准(2020年版)实施细则》的通知:国卫办医发﹝2021﹞19号[EB/OL].(2021-10-21)[2021-12-31].
http://www.nhc.gov.cn/yzygj/s7657/202110/b9fceda9371-
84f259ecae7ece8522d24.shtml.
[11] KATHLEEN H,TERRY G. Drug and therapeutics committees:a practical guide[EB/OL].[2021-12-31]. https://apps.who.int/iris/handle/10665/68553.
[12] 国家卫生健康委.关于印发2018年纠正医药购销领域和医疗服务中不正之风专项治理工作要点的通知:国卫医函﹝2018﹞186号[EB/OL].(2018-08-23)[2021-12-31].http://www.nhc.gov.cn/cms-search/xxgk/getManuscript-
Xxgk.htm?id=f7ec7ea4f4e34417a0d15da0079a1826.
[13] 陳新谦,金有豫,汤光.新编药物学[M]. 18版.北京:人民卫生出版社,2018.
[14] 卫生部.处方管理办法[EB/OL].(2006-02-14)[2021-12-31].
http://www.nhc.gov.cn/yzygj/s3572/200602/dd4277bbf37-
84ff589b9f12b6a0422ab.shtml?from=singlemessage.
[15] 国家卫生计生委办公厅,国家中医药管理局.关于加强药事管理转变药学服务模式的通知:国卫办医发〔2017〕26号[EB/OL].(2017-07-12)[2021-12-31]. http://www.nhc.gov.cn/yzygj/s7659/201707/b44339ebef924f038003e1b7d-
ca492f2.shtml.
[16] 国务院办公厅.国务院办公厅关于进一步做好短缺药品保供稳价工作的意见:国办发〔2019〕47号[EB/OL].(2019-10-11)[2021-12-31]. http://www.nhc.gov.cn/bgt/gwywj2/201910/7d2b39c6f68d46bd82f184731de80dcc.shtml.
[17] 卫生部办公厅.关于继续深入开展全国抗菌药物临床应用专项整治活动的通知:卫办医政发〔2012〕32号[EB/OL].(2012-03-06)[2021-12-31]. http://www.nhc.gov.cn/cms-search/xxgk/getManuscriptXxgk.htm?id=54251.
[18] 国家卫生健康委办公厅.关于持续做好抗菌药物临床应用管理工作的通知:国卫办医发〔2018〕9号[EB/OL].(2018-05-10)[2021-12-31]. http://www.nhc.gov.cn/cms-
search/xxgk/getManuscriptXxgk.htm?id=c79c998bdf8f47-
44858051cdfd1e6818.
[19] 国家卫生健康委办公厅.关于持续做好抗菌药物临床应用管理工作的通知:国卫办医发〔2019〕12号[EB/OL].(2019-03-29)[2021-12-31]. http://www.nhc.gov.cn/yzygj/s7659/201903/1d487eb7b7c74abc9fcb104f8b0905f2.shtml.
[20] 国家卫生健康委办公厅.关于持续做好抗菌药物临床应用管理工作的通知:国卫办医发〔2020〕8号[EB/OL].(2020-07-23)[2021-12-31]. http://www.nhc.gov.cn/yzygj/s3593/202007/8311bda4cf2443dfae4d719f1d0d72da.shtml.
[21] 国家卫生健康委,国家中医药管理局.关于国家药物基本药物目录(2018年版)的通知:国卫药政发〔2018〕31号[EB/OL].(2018-09-30)[2021-12-31]. http://www.gov.cn/zhengce/zhengceku/2018-12/31/content_5435470.htm.
[22] 国家卫生健康委,国家中医药局.关于进一步加强公立医疗机构基本药物配备使用管理的通知:国卫药政发〔2019〕
1号[EB/OL].(2019-01-17)[2021-12-31]. http://www.nhc. gov.cn/yaozs/s7657/201901/b3f6fb3f55314a7faff9738690-
8bd4f4.shtml.
[23] 国家卫生健康委办公厅.关于加强医疗机构麻醉药品和第一类精神药品管理的通知:国卫办医发〔2020〕13号[EB/OL].(2020-09-15)[2021-12-31]. http://www.nhc.gov.cn/yzygj/s7659/202009/ee4a21c2756f440e98f78d253-
3d7539a.shtml.
[24] 国务院办公厅.关于推动药品集中带量采购工作常态化制度化开展的意见:国办发〔2021〕2号[EB/OL].(2021-01-
28)[2021-12-31]. http://www.nhc.gov.cn/bgt/gwywj2/
202102/a8c4cf2af4aa48ba9ea42d1bf3b0f5f0.shtml.
[25] 国家医疗保障局,国家卫生健康委.关于适应国家医保谈判常态化、持续做好谈判药品落地工作的通知:医保函〔2021〕182号[EB/OL].(2021-09-09)[2021-12-31]. http://www.gov.cn/zhengce/zhengceku/2021-09/11/content_5636762.htm.
[26] 国家卫生健康委.关于印发全国医院信息化建设标准与规范(试行)的通知:国卫办规划发〔2018〕4号[EB/OL].(2018-04-13)[2021-12-31]. http://www.nhc.gov.cn/cms- search/xxgk/getManuscriptXxgk.htm?id=5711872560ad4-
866a8f500814dcd7ddd.
[27] 国家卫生健康委,国家中医药管理局.关于印发全国基层医疗卫生机构信息化建设标准与规范(试行)的通知:国卫规划函〔2019〕87号[EB/OL].(2019-04-28)[2021-12-31].
http://www.nhc.gov.cn/cms-search/xxgk/getManuscriptXx-
gk.htm?id=9d346a5ef0134e6a82c79c5c9ab96b77.
[28] 国家卫生健康委办公厅.国家卫生健康委办公厅关于印发全国医院上报数据统计分析指标集(试行)的通知:国卫办规划函〔2019〕383号[EB/OL].(2019-05-07)[2021-12-
31]. http://www.nhc.gov.cn/guihuaxxs/gongwen12/201905/20b748ccaa0443039ede499a0a7dab09.shtml.
[29] 国家医疗保障局.国家医疗保障局关于国家组织药品集中采购和使用试点医保配套措施的意见:医保发〔2019〕18号[EB/OL].(2019-03-05)[2021-12-31]. http://www.nhsa.gov.cn/art/2019/3/5/art_53_1016.html.
[30] 国家药品监督管理局.关于发布个例药品不良反应收集和报告指导原则的通告:国家药监局2018年第131号[EB/OL].(2020-09-24)[2021-12-31]. https://www.cdr- adr.org.cn/drug_1/zcfg_1/zcfg_zdyz/202009/t20200924_47831.html.
[31] 国务院办公厅.国务院办公厅关于完善公立医院药品集中采购工作的指导意见:国办发〔2015〕7号[EB/OL].(2015-02-28)[2021-12-31]. http://www.nhc.gov.cn/cms- search/xxgk/getManuscriptXxgk.htm?id=7d0741e719e24-
9689ec12d62c7936513.
[32] 國家卫生计生委,国家发展改革委,工业和信息化部,等.关于改革完善短缺药品供应保障机制的实施意见:国卫药政发〔2017〕37号[EB/OL].(2017-06-28)[2021-12-31].http://www.nhc.gov.cn/yaozs/s3581/201706/ec2c5910ba4-
341559e0176e5e237d5e6.shtml.
[33] 国家卫生健康委办公厅.国家卫生健康委办公厅关于印发医疗机构短缺药品分类分级与替代使用技术指南的通知:国卫办药政函〔2019〕625号[EB/OL].(2019-07-25)
[2021-12-31]. http://www.nhc.gov.cn/cms-search/xxgk/
getManuscriptXxgk.htm?id=495842935554402baf6470a7-
c6244343.
[34] 国务院办公厅.国务院办公厅关于完善国家基本药物制度的意见:国办发〔2018〕88号[EB/OL].(2018-09-19)[2021-
12-31]. http://www.gov.cn/zhengce/content/2018-09/19/
content_5323459.htm.
专家指导组
刘丽宏 中日友好医院 沈爱宗 中国科学技术大学附属第一医院(安徽省立医院)
卞晓岚 上海交通大学医学院附属瑞金医院 徐 珽 四川大学华西医院
李晓宇 复旦大学附属中山醫院 陈 慧 首都医科大学附属北京朝阳医院
专家组(执笔人)
概述部分
刘琳琳 中国科学技术大学附属第一医院(安徽省立医院)
冯钰斌 中国科学技术大学附属第一医院(安徽省立医院)
目录管理部分
刘 晓 中日友好医院 孔旭东 中日友好医院
赵颖楠 中日友好医院
目录结构部分
陈 慧 首都医科大学附属北京朝阳医院 于晓佳 首都医科大学附属北京朝阳医院
目录调整部分
田方圆 四川大学华西医院 金朝辉 四川大学华西医院
目录应用部分
管滢芸 上海交通大学医学院附属瑞金医院 房 嫣 上海交通大学医学院附属瑞金医院
目录评价部分
陈婷婷 复旦大学附属中山医院 周 殷 复旦大学附属中山医院
外审组(排名不分先后)
曹俊岭 北京中医药大学东方医院 蔡本志 哈尔滨医科大学附属第二医院
杜书章 郑州大学第一附属医院 范国荣 上海交通大学附属第一人民医院
封卫毅 西安交通大学第一附属医院 封宇飞 北京大学人民医院
方晴霞 浙江省人民医院 菅凌燕 中国医科大学附属盛京医院
葛卫红 南京鼓楼医院 郭 澄 上海交通大学附属第六人民医院
黄品芳 福建医科大学附属第一医院 侯锐钢 山西医科大学第二医院
蒋志涛 北京好药师大药房连锁有限公司 罗 璨 江苏省妇幼保健院
刘国强 河北医科大学第三医院 李冬梅 青岛大学附属医院
李国辉 中国医学科学院肿瘤医院 陆丛笑 烟台毓璜顶医院
路 云 中国药科大学 欧阳华 厦门大学附属中山医院
沈承武 山东省立医院 王延风 中国医学科学院肿瘤医院
王婧雯 空军军医大学第一附属医院 吴 晶 天津大学
魏 理 广州医科大学附属第一医院 肖 勇 中国人民解放军第五医院
袁 洪 中南大学湘雅三医院 杨 丽 北京大学第三医院
杨建华 新疆医科大学第一附属医院 翟光喜 山东大学
邹丽颖 首都医科大学附属北京妇产医院 张 波 北京协和医院
张 峻 昆明医科大学第一附属医院 赵 飞 北京医院
赵立波 北京大学第三医院 赵环宇 首都医科大学附属北京同仁医院
栗世铀 北京启辰生生物科技有限公司
秘书组(排名不分先后)
冯钰斌 中国科学技术大学附属第一医院(安徽省立医院)
胡世林 中国科学技术大学附属第一医院(安徽省立医院)
苏 丹 中国科学技术大学附属第一医院(安徽省立医院)
苏广全 安徽中医药大学

