miR-30b在子宫内膜异位症中的表达及功能研究
黄敏 徐超逸 陈海燕 朱旦华 梁宗文 段萍


[摘要] 目的 檢测miR-30b在子宫内膜异位症中的表达水平,并探究miR-30b对子宫内膜异位症的治疗作用。 方法 2018年7月至2020年7月在温州医科大学附属第二医院手术获取的27例子宫内膜异位症患者病理组织为子宫内膜异位症组,15例子宫肌瘤患者子宫内膜组织为正常子宫内膜组。实时定量PCR(qRT-PCR)检测组织中miR-30b的表达量。培养人原代子宫内膜间质细胞(HESCs),5-乙炔基-2′-脱氧尿苷掺入(EdU)法来检测miR-30b对细胞增殖能力的影响。根据starBase 2.0软件预测与miR-30b相互作用的长链非编码RNA(lncRNA),使用qRT-PCR初步验证该lncRNA在异位内膜中的表达量及与miR-30b的相互关系。进一步建造子宫内膜异位症SD大鼠模型,在活体实验水平,使用miR-30b的模拟物来验证miR-30b对子宫内膜异位症异位囊肿的治疗作用。 结果 与正常子宫内膜(EN)相比,miR-30b在子宫内膜异位症(EC)中的表达显著下降。miR-30b的外源性过表达抑制了HESCs的增殖能力,同时,下调miR-30b的表达量可促进HESCs的增殖能力。StarBase 2.0软件预测lncRNA OIP5-AS1与miR-30b有多个结合位点,与正常内膜比较,lncRNA OIP5-AS1在异位内膜中表达上调,且与miR-30b的表达量呈负相关。此外,在子宫内膜异位症的大鼠模型中,miR-30b模拟物显著抑制子宫内膜异位症异位囊肿的生长。 结论 miR-30b在异位子宫内膜中低表达且抑制HESCs的增殖能力,可能成为子宫内膜异位症潜在的治疗靶点。
[关键词] 子宫内膜异位症;miR-30b;lncRNA OIP5-AS1;增殖;SD大鼠
[中图分类号] R711.7 [文献标识码] A [文章编号] 1673-9701(2022)04-0035-05
[Abstract] Objective To detect the expression level of miR-30b in endometriosis and explore the therapeutic effect of miR-30b on endometriosis. Methods All specimens were obtained during surgery in the Second Affiliated Hospital of Wenzhou Medical University from July 2018 to July 2020. Quantitative real-time PCR (qRT-PCR) was used to detect the expression of miR-30b in tissues. The pathological tissues of 27 patients with endometriosis were extracted as the endometriosis group, and the endometrial tissues of 15 patients with uterine fibroids were extracted as the normal endometrium group. Human primary endometrial stromal cells (HESCs) were cultured, and 5-ethynyl-2′-deoxyuridine incorporation (EdU) assay was used to detect the effect of miR-30b on cell proliferation ability. Long non-coding RNAs (lncRNAs) that interact with miR-30b were predicted according to starBase 2.0 software. The expression of this lncRNA in ectopic endometrium and its interrelationship with miR-30b were preliminarily validated using qRT-PCR. Furthermore,a SD rat model of endometriosis was constructed. At the in vivo level, miR-30b mimics were used to validate the therapeutic effect of miR-30b on endometriotic ectopic cysts. Results The expression of miR-30b was significantly decreased in ectopic endometrium (EC) compared with normal endometrium (EN). Exogenous overexpression of miR-30b inhibited the proliferation ability of HESCs. Meanwhile, down-regulation of miR-30b expression promoted the proliferation ability of HESCs. StarBase 2.0 software predicted that lncRNA OIP5-AS1 had multiple binding sites with miR-30b, and lncRNAOIP5-AS1 was up-regulated in ectopic endometrium compared with normal endometrium, and was negatively correlated with the expression of miR-30b. In addition, in a rat model of endometriosis,we observed that miR-30b mimics significantly inhibited the growth of endometriotic ectopic cysts. Conclusion miR-30b is lowly expressed in ectopic endometrium and inhibits the proliferation of HESCs, which may become a potential therapeutic target for endometriosis.
[Key words] Endometriosis; miR-30b; LncRNAOIP5-AS1; Proliferation; SD rat
子宫内膜异位症(简称内异症)的特征是子宫内膜样组织种植在子宫腔以外的部位,常见于卵巢、子宫骶韧带及子宫直肠陷凹,引起盆腔包块、进行性加重的痛经、性交痛及不孕等[1]。异位的子宫内膜在盆腹腔内能够成为病灶,必须经过粘附、侵袭和血管形成的三部曲,得以达到“生根、生长、生病”,与肿瘤的生物学行为类似[2-3]。近年来内异症的发病率呈上升趋势,约有10%~15%的育龄期女性受其困扰,严重危害女性的身心健康,并增加经济负担。主要的治疗手段为药物联合手术治疗,但术后5年复发率达15%~50%[4]。因此,寻找新的治疗靶点目前仍然是临床的迫切需求。
miRNAs是一类小的非编码RNA(约20~24个核苷酸),可在转录后水平控制许多下游信使RNA(mRNA)的表达。微小RNA与mRNA的3′非翻译区(UTR)相互作用,诱导翻译抑制或RNA降解[5]。越来越多的证据表明,miRNAs参与多种细胞功能,包括细胞增殖、凋亡、迁移、血管生成和分化[6]。其中miR-30b在许多肿瘤中显著下调,并通过影响细胞生物学功能而抑制肿瘤发生[7]。但是,miR-30b在子宫内膜异位症中的表达和功能仍然是未知的。
长链非编码RNA(lncRNA)是一类长度大于200 nt的RNA,可以作为“分子海绵”与mRNA竞争性结合miRNA,发挥内源性竞争RNA(ceRNA)的作用,与细胞增殖、凋亡、侵袭和迁移密切相关[8]。lncRNA OIP5-AS1是一种新发现的lncRNA。一些学者对其在某些种类肿瘤中的表达状态和功能作用进行研究。Zou等[9]发现LncRNA OIP5-AS1在结直肠癌(CRC)细胞中抑制细胞活力并促进放射诱导的细胞凋亡。LncRNA OIP5-AS1通过调节肝细胞癌中miR-3163/VEGFA促進细胞增殖和迁移并诱导血管生成[10]。但其在内异症中从未被报道。
本研究旨在验证miR-30b在内异症中的表达水平及对人子宫内膜间质细胞(HESCs)增殖能力的影响。初步探讨miR-30b是否通过ceRNA机制与lncRNA OIP5-AS1相互作用调控内异症的发生发展。此外,本研究建立子宫内膜异位症大鼠模型,进一步验证miR-30b在活体水平对内异症的作用,现报道如下。
1 资料与方法
1.1 实验器械及主要试剂
普通手术器械及眼科剪(温州长风有限公司);miR-30b模拟物、抑制剂及其各自的阴性对照药品(广州锐博生物科技有限公司);TRIzol试剂盒(Invitrogen,美国卡尔斯巴德);NanoDrop ND-1000分光光度计(Nanodrop Technologies,美国威尔明顿);反转录试剂盒(Toyobo Co,日本);Ham′s F12/DMEM(Gibco BRL,美国马里兰州盖瑟斯堡);10%胎牛血清(Gibco BRL,美国马里兰州盖瑟斯堡);细胞培养瓶(BD Biosciences,美国);Lipofectamine 2000(Life Technologies,美国)。
1.2 研究对象
1.2.1 临床标本 收集2018年7月至2020年7月在温州医科大学附属第二医院行腹腔镜手术及术后病理证实为子宫内膜异位症患者的27例新鲜异位内膜组织,取15例非子宫内膜异位症的子宫肌瘤患者新鲜正常子宫内膜组织。纳入研究27例的内异症患者组年龄25~39岁,平均(30.8±2.34)岁,15例正常内膜组年龄26~40岁,平均(32.50±2.19)岁。两组研究对象年龄比较,差异无统计学意义(P>0.05),具有可比性。所有患者的排卵情况正常,月经周期正常,并且至少在3个月内没有给予性激素药物治疗。所有组织样品均在温州医科大学第二附属医院手术时收集。将样品储存在液氮中以备后用。本研究的所有方案均已获得温州医科大学附属第二医院医学伦理委员会的批准(伦理批准号:LCKY2020-88),所有书面知情同意书均由患者在参与本研究前签署。
1.2.2 实验动物 选取性成熟雌性SD大鼠25只,6~8周龄,体重180~200 g,均购自温州医科大学实验动物中心,动物许可证号:SCXK(浙)2015-0001。给予标准光照(12 h光照,12 h黑夜),室内温度18~22℃,湿度40%~50%,标准饲料和水。实验结束后,所有大鼠经戊巴比妥钠麻醉安乐死。研究经动物伦理委员会批准执行。
1.3 实验方法
1.3.1 RNA提取和实时定量PCR 使用TRIzol试剂从冷冻组织中提取总RNA,并用200 ml无核酸酶的水洗脱,NanoDrop ND-1000分光光度计检测RNA浓度,样品在260/280的吸光度比要求在1.8~2.0。取2 μg总RNA于反转录试剂盒中进行反转录反应。将反转录产物在PCR扩增仪中进行扩增,反应条件为94℃ 10 min预变性;95℃ 30 s、60℃ 20 s、72℃ 20 s,循环40次。以小核RNA(snRNA)U6作为内参,使用2-DDCt方法计算miR-30b的相对表达水平。
1.3.2 人原代子宫内膜间质细胞(HESCs)的分离培养 人原发性子宫内膜间质细胞(HESCs)按照先前描述的方法分离[16-17]。用含2%青霉素-链霉素的磷酸盐缓冲盐水(PBS)冲洗异位子宫内膜(EC)组织,然后将其切成约1 mm3的碎片,并在含HEPES(25 mmol/ml),1%链霉素-青霉素,胶原酶Ⅳ(1 mg/ml,15 U/mg)和脱氧核糖核酸酶(0.1 mg/ml,1500 U/mg)的水浴中放置4 h。通过400目的过滤器(Falcon,美国纽约)分离子宫内膜间质细胞,并用Ham′s F12/DMEM(1∶1),热灭活的10%胎牛血清(FBS)和1%青霉素混合液悬浮子宫内膜间质细胞。将细胞置入75 cm2的细胞培养瓶中,在含5% CO2的37℃的恒温恒湿培养箱中进行培养。利用波形蛋白的免疫组织化学染色进行细胞纯度鉴定。
1.3.3 细胞转染 miR-30b模拟物,miR-30b抑制剂及其各自的阴性对照购自广州锐博生物。使用Lipofectamine 2000进行miRNA转染。miR-30b抑制剂及其对照组的浓度为100 nmol,miR-30b模拟物及其对照组的浓度为50 nmol。
1.3.4 细胞增殖能力测定 使用EdU(5-乙炔基-2′-脱氧尿苷)掺入测定法检测细胞增殖能力。先将HESCs在无血清培养基中饥饿24 h。转染48 h后,使用EdU分析试剂盒检测细胞增殖能力。通过将EdU阳性细胞的数量除以DAPI染色的细胞总数,可以计算出EdU阳性细胞的百分比。所有实验至少重复3遍。
1.3.5 子宫内膜异位症大鼠模型的建立及动物给药 子宫内膜异位症大鼠模型是根据先前的研究,通过对大鼠子宫内膜的自体移植建立的[16]。用2%戊巴比妥(2 g/100 ml)麻醉大鼠,在下腹部切一个大约1 cm的小切口,并逐层打开腹腔。左右两侧结扎左子宫角,切除中间部分,然后放入冷培养基中。去除脂肪组织,并小心地将子宫内膜与子宫肌层分开。将子宫内膜切成约5 mm×5 mm的两段。在腹壁的每一侧分离出皮下间隙,并将两个子宫内膜片分别放置在左和右间隙中,使子宫内膜面向腹肌。术后每4天皮下注射0.1 mg/(kg·d)的苯甲酸雌二醇,共3次注射以促进自体移植物的生长。公式V=1/2(L×W2)用于计算异位子宫内膜异位囊肿的体积。将大鼠分为两组,并向子宫内膜异位囊肿中注入等体积的核酸溶液。模拟物对照组和miR-30b模拟物组注射1 nmol RNA;抑制剂对照组和miR-30b抑制剂组注射2.5 nmol RNA。
1.4 统计学方法
采用Graphpad Prism 5.0统计学软件进行分析,所有实验均重复3次。计量资料用(x±s)表示。多组间比较采用单因素方差分析,组间两两比较用LSD-t检验。P<0.05为差异有统计学意义。
2 結果
2.1 miR-30b在子宫内膜异位症中低表达
miR-30b在众多疾病中表达量下降,但在子宫内膜异位症中的表达量尚未报道。为了解miR-30b在子宫内膜异位症中的作用,使用实时定量PCR分析异位子宫内膜(EC)组织和正常子宫内膜(EN)组织中miR-30b的表达水平。miR-30b在正常子宫内膜组(n=15)表达量为(0.88±0.13),而在异位子宫内膜组(n=27)的表达量为(0.39±0.05),较正常子宫内膜组显著下降(P=0.0005)。见图1。
2.2 miR-30b抑制人原代子宫内膜间质细胞的增殖能力
为进一步探讨miR-30b在子宫内膜异位症中的生物学功能,培养人原代子宫内膜间质细胞(HESCs)。使用miR-30b模拟物阴性对照及miR-30b模拟物转染HESCs,上调miR-30b表达量,如封三图1显示,EdU增殖实验结果显示模拟物对照组增殖阳性的细胞比率为(0.048±0.003)%,而模拟物组增殖阳性的细胞比率为(0.036±0.001)%,细胞增殖能力较细胞对照组显著下降,差异有统计学意义(P<0.05),表明miR-30b过表达可以抑制HESCs的增殖能力;与此同时,使用miR-30b抑制剂及其阴性对照inhibitor NC转染HESCs,下调miR-30b表达量,miR-30b抑制物对照组增殖阳性的细胞比率为(0.027±0.000)%,miR-30b抑制物组增殖阳性的细胞比率为(0.055±0.005)%,miR-30b抑制剂组增殖能力较对照组明显上升,差异有统计学意义(P<0.01)。见表1。以上结果均表示miR-30b可以抑制HESCs的增殖能力。
2.3 在内异症中miR-30b与lncRNA OIP5-AS1的表达呈负相关
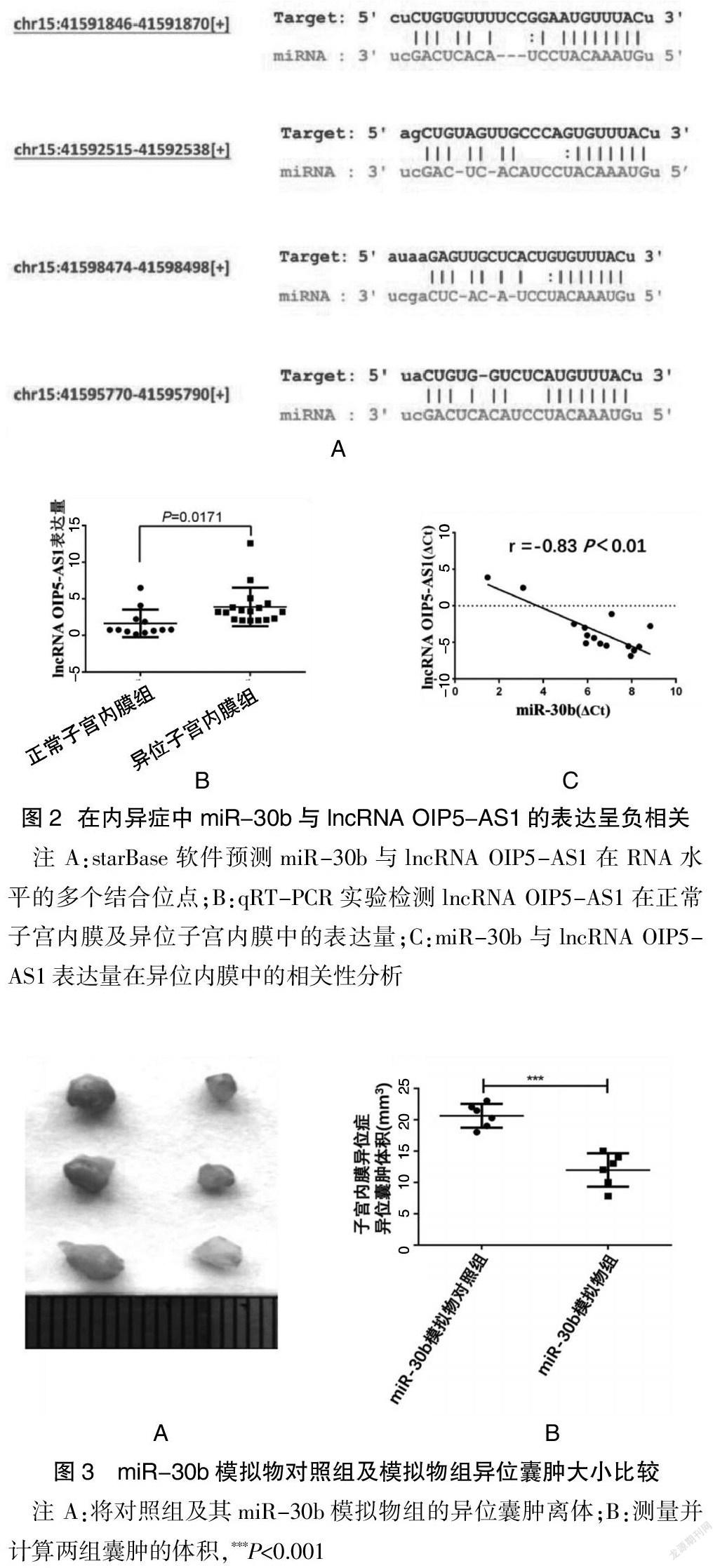
lncRNA OIP5-AS1的基因ID为 ENSG000002 47556,本研究通过starBase软件(starbase.sysu.edu.cn)进行生物信息学分析,图2A所示,预测miR-30b与OIP5-AS1在RNA水平的不同段碱基序列有多个结合位点。图2B显示,qRT-PCR验证lncRNA OIP5-AS1的表达量,正常子宫内膜组lncRNA OIP5-AS1的相对表达量为(1.64±0.54),而在异位子宫内膜中的相对表达量为(3.90±0.64),与正常子宫内膜组相比,lncRNA OIP5-AS1在异位内膜中的表达显著上升,差异有统计学意义(P=0.0171)。图2C显示,本研究进一步用Pearson相关性分析表明,与正常内膜相比lncRNA OIP5-AS1在异位子宫内膜中表达与miR-30b表达量呈负相关。
2.4 miR-30b抑制大鼠子宫内膜异位症模型的异位囊肿生长
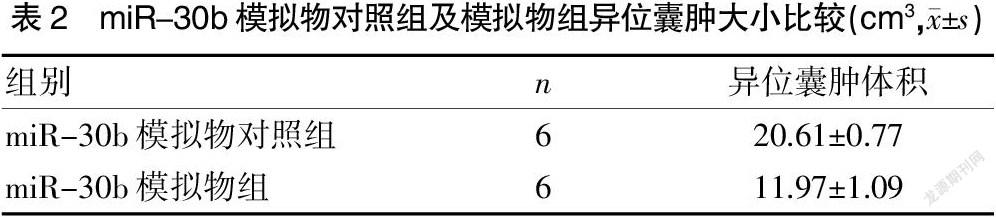
为进一步验证miR-30b在子宫内膜异位症中的作用,本研究建立子宫内膜异位症大鼠模型,分别将miR-30b模拟物(n=6)及其阴性对照mimic NC(n=6)的核酸混合液注射至大鼠的异位囊肿,5 d一次,共20 d。将异位囊肿离体后,观察到模拟物对照组异位囊肿体积为(20.61±0.77)cm3,miR-30b模拟物组异位囊肿体积为(11.97±1.09)cm3。见表2。与模拟物对照组相比,miR-30b模拟物组的异位囊肿体积明显缩小(图3A),图3B所示,差异有统计学意义(P<0.01)。表明miR-30可以抑制子宫内膜异位症异位囊肿的生长,对子宫内膜异位症有一定的治疗作用。
3 讨论
子宫内膜异位症是一种常见的妇科疾病,影响全球大约1.76亿的育龄期妇女[11]。然而,到目前为止,其发病机制未明,手术去除病灶及性激素药物治疗为主要的治疗手段,但高复发率和严重的副作用使其治疗效果大打折扣[4,12]。所以寻找一种高效且副作用小的治疗手段迫在眉睫。miRNA是一类含20~25个核苷酸的单链非编码RNA,参与多种细胞功能,如细胞迁移、侵袭、增殖、凋亡、分化等[13-14],并在子宫内膜异位症中扮演重要作用[15]。许多研究表明,miR-30b在多种疾病中差异表达,并调节这些疾病的发生和过程,包括膀胱癌[16]、胃癌[17]及结直肠癌[18],但miR-30b在子宫内膜异位症中的作用尚未被报道。
本研究觀察到与正常子宫内膜相比,miR-30b在异位内膜组织中的表达量显著下降。进一步提取人原代子宫内膜间质细胞,结果显示,上调miR-30b抑制子宫内膜间质细胞的增殖能力,而下调miR-30b则促进细胞的增殖能力,表明miR-30b可以抑制子宫内膜间质细胞的增殖,进而可以在一定程度上治疗子宫内膜异位症。lncRNA是另一类非编码RNA,可以作为“分子海绵”与mRNA竞争性结合miRNA,发挥内源性竞争RNA(ceRNA)的作用,进而参与细胞的众多生物学功能[19-20],因此本研究猜测miR-30b也通过与某个lncRNA竞争性结合影响内异症的发生发展。starBase软件预测了miR-30b与lncRNA OIP5-AS1间存在的多个结合位点,并初步验证miR-30b与lncRNA OIP5-AS1的负相关关系,提示miR-30b与lncRNA OIP5-AS1有可能通过ceRNA机制在内异症中发挥作用,miR-30b/lncRNA OIP5-AS1海绵体亦有可能是内异症的发病机制之一。在未来,本研究将使用荧光素酶报告实验及RNA沉淀等实验进一步验证miR-30b与lncRNA OIP5-AS1的关系。为了在活体实验中验证miR-30b的治疗作用,本研究建立子宫内膜异位症的大鼠模型,结果表明miR-30b模拟物抑制了异位囊肿的生长,进一步验证miR-30b可以一定程度上治疗子宫内膜异位症。
综上所述,miR-30b在子宫内膜异位症中低表达,且与lncRNA OIP5-AS1的表达呈负相关。在体外水平抑制HESC的增殖能力,在活体实验中抑制子宫内膜异位囊肿的生长,提示miR-30b可能是子宫内膜异位症治疗的新靶标,且miR-30b/OIP5-AS1海绵体为内异症的发病机制提供了一定的理论依据。
[参考文献]
[1] Chamie LP,Ribeiro D,Tiferes DA,et al. Atypical sites of deeply infiltrative endometriosis:Clinical characteristics and imaging findings[J]. Radiographics:A Review Publication of the Radiological Society of North America,2018, 38(1):309-328.
[2] Perricos A,Wenzl R,Husslein H,et al. Does the use of the "proseek (R) multiplex oncology I panel" on peritoneal fluid allow a better insight in the pathophysiology of endometriosis,and in particular deep-infiltrating endometriosis?[J]. Journal of Clinical Medicine,2020,9(6):2009.
[3] Vallee A,Lecarpentier Y. Curcumin and endometriosis[J].International Journal of Molecular Sciences,2020,21(7):2440.
[4] Li WN,Wu MH,Tsai SJ. Hypoxia and reproductive health:The role of hypoxia in the development and progression of endometriosis[J].Reproduction,2021,161(1):F19-F31.
[5] Gao X,Li S,Li W,et al.MicroRNA-539 suppresses tumor cell growth by targeting the WNT8B gene in non-small cell lung cancer[J].Journal of Cellular Biochemistry, 2017,120(2):2687.
[6] Zhang F,Liu J,Xie BB. Downregulation of microRNA-205 inhibits cell invasion and angiogenesis of cervical cancer through TSLC1-mediated Akt signaling pathway[J].Journal of Cellular Physiology,2019,234(10):18 626-18 638.
[7] Zhang Q,Liu S,Zhang J.Roles and regulatory mechanisms of miR-30b in cancer,cardiovascular disease,and metabolic disorders (Review)[J].Experimental and Therapeutic Medicine,2021,21(1):44.
[8] Zou L,Chen L,Xia PF. XIST knockdown suppresses vascular smooth muscle cell proliferation and induces apoptosis by regulating miR-1264/WNT5A/beta-catenin signaling in aneurysm[J].Bioscience Reports 2021,41(3):BSR20 201 810.
[9] Zou Y,Yao S,Chen X,et al.LncRNA OIP5-AS1 regulates radioresistance by targeting DYRK1A through miR-369-3p in colorectal cancer cells[J]. European Journal of Cell Biology,2018,97(5):369-378.
[10] Shi C,Yang Q,Pan S,et al. LncRNA OIP5-AS1 promotes cell proliferation and migration and induces angiogenesis via regulating miR-3163/VEGFA in hepatocellular carcinoma[J].Cancer Biology & Therapy,2020,21(7):604-614.
[11] Brunty S,Mitchell B,Bou-Zgheib N,et al. Endometriosis and ovarian cancer risk,An epigenetic connection[J].Annals of Translational Medicine,2020, 8(24):1715.
[12] Chen I,Veth VB,Choudhry AJ,et al. Pre- and postsurgical medical therapy for endometriosis surgery[J].The Cochrane Database of Systematic Reviews,2020,11:CD003 678.
[13] Xu Q,Xu Z.miR-196b-5p promotes proliferation,migration and invasion of lung adenocarcinoma cells via targeting RSPO2[J].Cancer Management and Research,2020, 12:13 393-13 402.
[14] Guzel TE,Ozturk S.miR-145 suppresses epithelial-mesenchymal transition by targeting stem cells in Ewing sarcoma cells[J]. Bratislavske Lekarske Listy,2021, 122(1):71-77.
[15] Agrawal S,Tapmeier T,Rahmioglu N,et al. The miRNA mirage:How close are we to finding a non-invasive diagnostic biomarker in endometriosis?A systematic review[J]. International Journal of Molecular Sciences,2018,19(2):599.
[16] Mahdavinezhad A,Mousavibahar SH,Poorolajal J,et al. Association between tissue miR-141,miR-200c and miR-30b and bladder cancer:A matched case-control study[J]. Urology Journal,2015,12(1):2010-2013.
[17] Xi Z,Si J,Nan J.LncRNA MALAT1 potentiates autophag yassociated cisplatin resistance by regulating the micro RNA30b/autophagyrelated gene 5 axis in gastric cancer[J].International Journal of Oncology,2019,54(1):239-248.
[18] Fan M,Ma X,Wang F,et al. MicroRNA-30b-5p func- tions as a metastasis suppressor in colorectal cancer by targeting Rap1b[J].Cancer Letters,2020,477:144-156.
[19] Liu S,Xie S,Chen H,et al. The functional analysis of transiently upregulated miR-101 suggests a "braking" regulatory mechanism during myogenesis[J].Science China Life Sciences,2021,64(10):1612-1623.
[20] Zhao Z,Liu G,Zhang H,et al. BIRC5,GAJ5,and lncRNA NPHP3-AS1 are correlated with the development of atrial fibrillation-valvular heart disease[J].International Heart Journal,2021,62(1):153-161.
(收稿日期:2021-02-19)

