松材线虫侵染前后马尾松树体内微生物多样性分析
温晓健,巫建军,李永先,王 璇,理永霞*,张星耀
(1.中国林业科学研究院森林生态环境与自然保护研究所 国家林业和草原局森林保护学重点实验室,北京 100091;2.浙江省遂昌县生态林业发展中心,浙江 遂昌 323399)
植物体内含有多种微生物,其中许多微生物与植物之间的相互作用对植物的生存、适应性和生态系统功能等方面都有有益的影响[1-2],大量研究表明内生菌在提高植物免疫防御[3]、病害控制[4]、营养获取[5]和植物对非生物胁迫的耐受方面[6]有明显的促进作用。比如Wu 等人[7]从野生蓝莓的内生菌中分离到一株深色有隔真菌,将该菌接种到蓝莓上可促进其根部生长和分枝,Carro-Huerga 等人[8]从葡萄树体里分离到一株木霉,该菌可减少葡萄上病原菌的定殖从而限制病害的发展。
松材线虫(Bursaphelenchus xylophilus)是全球森林生态系统中最具危险性、毁灭性的有害生物之一,具有极强的扩散性和破坏性,自1982 年入侵我国后,先后在亚热带、热带、暖温带、中温带以及秦岭等高海拔地区造成松林大面积枯死[9],造成了巨大的经济和生态损失,而且疫区仍在不断增加。松材线虫侵入寄主后,首先取食松树的薄壁细胞,当松树死亡后,开始取食树体内的真菌,使得其种群得以维持和扩大[10];松树内生微生物群落具有提高树木防御能力的潜力,但也可能随着病害的发展而转换角色,最终导致树木腐烂[11]。由此可见,松树内生微生物在松材线虫病的发展过程中发挥重要作用。充分了解松树体内微生物的群落结构有助于了解松材线虫病的发病过程,也为认识寄主和微生物的共生关系以及微生物资源的开发利用提供参考和科学依据。
许多研究结果表明松材线虫入侵对寄主松树的内生微生物群落多样性具有重要影响,而且松树的许多内生菌也具有很大的生防潜力。曾凡勇等[12]对不同健康状态黑松(Pinus thunbergiiParl.)树干内真菌进行了分离,发现不同健康状态下真菌种群没有显著差异,但是优势真菌及其比率不同。鲁国华[13]分析了不同健康状态马尾松(P.massonianaLamb.)和黑松树干内真菌的种类变化,认为松材线虫病影响了寄主松树真菌种群的变化。徐风美[14]通过对松材线虫病发生区和未发生区油松(P.tabuliformisCarr.)根部真菌进行分离和鉴定,发现根部外生菌根真菌和深色有隔内生真菌的相对丰度不同,这可能与松树对松材线虫病的抗性有关。Ma 等人[15]利用高通量测序技术研究了松材线虫侵染前后黑松不同部位的细菌群落结构,发现健康树和受害树针叶和根部细菌的群落结构不同,表明松材线虫可以影响寄主的细菌群落结构。Ponpandian等人[16]从赤松(P.densifloraSieb.et Zucc.)、刚松(P.rigidaMill.)、黑松和红松(P.koraiensisSieb.et Zucc.)不同组织部位中分离得到1 622 株内生细菌,从中筛选到44 株具有杀线活性的细菌,其中窄食单胞菌属(Stenotrophomonas)和芽孢杆菌属(Bacillus)细菌的杀线作用最突出。Kim 等人[17]从分离到的92 株松树内生细菌中筛选出3 株可诱导松树产生抗性的细菌,通过叶面喷洒这3 株细菌的菌悬液均可显著降低松材线虫病的发病程度。
1 材料与方法
1.1 样品采集
于2019 年9 月在浙 江省富阳区(30°3′N,119°58′E)和淳安县(29°36′N,118°58′E)采集健康马尾松和由松材线虫侵染引起的枯死马尾松各4 棵,枯死马尾松均为当年枯死树,经贝尔曼漏斗法分离后每克木材中松材线虫数量大于100 头,健康马尾松中没有分离到松材线虫,枯死树中均分离到松材线虫,其中3 棵健康马尾松和2 棵枯死马尾松来自富阳区,1 棵健康马尾松和2 棵枯死马尾松来自淳安县。所采集的马尾松均为25~30 年生,胸径为17~22 cm,树高为16~20 m。分别采集马尾松地下部分10 cm 深处的侧根、地上部分主干的上、中、下3 段和2 年生针叶,编号后封存于保鲜袋。
1.2 试剂和引物
植物基因组DNA 提取试剂盒、细菌基因组DNA 提取试剂盒、2 × Taq PCR MasterMix,D2000 DNA Marker 购自天根生化科技(北京)有限公司;PCR 引物对ITS1/ITS4 和27F/1492R 由北京六合华大基因科技有限公司合成。
1.3 样品处理
采用常规组织分离法分离马尾松不同部位的真菌和细菌。侧根处理前先将根表面的土用无菌水冲洗掉,再用灭菌滤纸擦干后备用。主干处理前先将粗糙的表皮刮掉。所有样品用75% 的乙醇浸泡1 分钟后用无菌水冲洗3 次,取最后1 次的冲洗液涂布于PDA 培养基(200 g 去皮马铃薯,20 g 葡萄糖,15 g 琼脂粉,去离子水1000 mL)和牛肉膏蛋白胨培养基(NA)(蛋白胨10 g,氯化钠5 g,牛肉浸出粉3 g,琼脂15 g,去离子水1 000 mL)平板做表面消毒效果检测。用无菌滤纸擦干组织表面的水分,用无菌枝剪剪去主干和根经酒精处理过的表面组织,再将剩余的主干和根剪碎成约3 mm ×3 mm × 2 mm 的木块,将针叶剪成约6 mm 长的片段,用于后续分离。
1.4 微生物的分离
1.4.1 真菌 用无菌镊子将剪碎的组织块置于90 mm 的PDA 培养基上,每个样品接种25 个组织块,健康和枯死马尾松各4 棵,根、干和针叶各200 块,共600 个组织块,置于25℃培养箱中黑暗培养,待其长出菌落后用无菌接种针挑取菌落边缘气生菌丝置于PDA 培养基上纯化培养。将菌落特征相同的菌株进行归类统计,将分离纯化后的不同菌落形态的菌株接种于PDA 培养基上,并对菌株进行编号,保存备用。
1.4.2 细菌 用无菌镊子夹取1 g 剪碎的组织块,置于5 mL 的无菌水中,28℃,200 r· min-1振荡培养1 h,混匀,吸取100 μL 培养液涂布于NA 培养基上,28℃培养24 h,挑取单菌落至NA 培养基上纯化,挑取纯化后的细菌单菌落至牛肉膏蛋白胨液体培养基(NB)(蛋白胨10 g,氯化钠5 g,牛肉浸出粉3 g,去离子水1 000 mL)中,28 ℃,200 r· min-1培养24 h,4℃保存备用。
1.5 微生物的鉴定
1.5.1 DNA 提取 将1.4.1 保存的菌株重新接种于PDA 培养基,25℃培养7 d,挑取菌丝于2 mL离心管中,采用植物基因组DNA 提取试剂盒(DP320)提取菌株DNA。对于菌液PCR 无条带的细菌菌株进行DNA 提取。取1.4.2 中细菌菌液1 mL 于1.5 mL 离心管 中,6 000 r· min-1离 心1 min,弃去上清液,采用细菌基因组DNA 提取试剂盒(DP302)提取菌株的总DNA。
1.5.2 PCR 扩增 采用真菌核糖体rDNA 区通用引物ITS1/ITS4(5′-TCCGTAGGTGAACCTGCGG-3′/5′-TCCTCCGCTTATTGATATGC-3′)进行PCR扩增。PCR 反应体系25 μL 包含:基因组DNA 1 μL,2 × Taq PCR MasterMix(KT201)12.5 μL,引物ITS1 0.5 μL,引物ITS4 0.5 μL,ddH2O 10.5 μL。扩增程序:94℃预变性3 min;94℃变性30 s,55℃退火30 s,72℃延伸45 s,35 个循环;72℃延伸10 min。
(1)子曰:下之事上也,不从其所命,而从其所行,上好[此物也,下必有甚焉者矣。故]上之好恶,不可不慎也,民之表也。(《缁衣》)
采用细菌16S rDNA 区通用引物27F/1492R(5′-AGAGTTTGATCCTGGCTCAG-3′/5′-TACGG TTACCTTGTTACGACTT-3′)进行PCR 扩增。利用4℃保存的菌液或基因组DNA 作为PCR 模板,PCR 反应体系50 μL 包含:菌液或基因组DNA2 μL,2 × Taq PCR MasterMix(KT201)25 μL,引物27F 1 μL,引物1492R 1 μL,ddH2O 21 μL。扩增程序:94℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸90 s,35 个循环;72℃延伸10 min。
1.5.3 基因序列测序及比对 取5 μL PCR 产物用1.0%的琼脂糖凝胶电泳进行检测,将剩余的PCR 产物送至北京六合华大基因科技有限公司测序,对拼接后的序列利用BLAST 软件进行序列相似性比对。结合本研究分离到的木霉菌株,选取部分代表菌株的ITS 序列,利用MEGA 6.0 软件的邻接法构建系统发育进化树,自展值(Bootstrap replications)为1 000 次。
1.6 取食木霉(Trichoderma spp.)对松材线虫种群数量的影响
将本研究分离到的6 种木霉属(Trichoderma)真菌分别接种至PDA 平板上,于25℃恒温培养7 d。将实验室保存的松材线虫虫株Nxy61 接至培养7 d 的灰葡萄孢平板并置于25℃恒温培养,7 d 后用无菌水将松材线虫从平板洗下,用无菌水重复换洗3 遍后计数。分别吸取约3 000 条松材线虫接种于培养7 的木霉和灰葡萄孢(Botrytis cinereaPers.)平板上,于25℃恒温培养7 d,7 d 后用无菌水完全冲洗平板,通过光学显微镜统计活体松材线虫的种群数量。每个处理5 个重复,以灰葡萄孢培养松材线虫作为对照。
1.7 统计分析
采用分离率和分离频率分析马尾松不同部位分离的真菌丰富程度及优势菌群,采用Shannon-Wiener 指数(H)、Simpson 指数(D)、均匀度指数(J)分析分离真菌的多样性特征,用Sorenson 指数(Cs)和Jaccard 指数(Cj) 分析不同组织和不同健康状态马尾松的真菌种类组成的相似程度[18]。
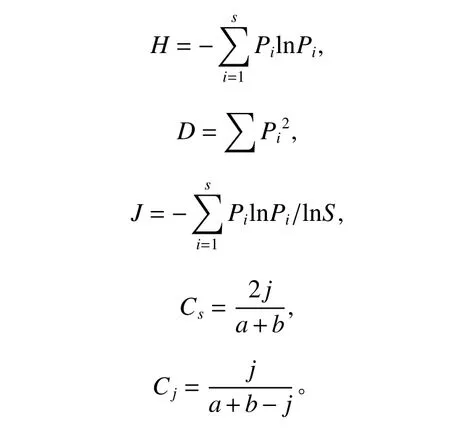
式中:Pi为第i种的个体数占总物种数S的比例。
j为两个组织或样本共有的真菌种数,a和b分别为每个组织或样本中的真菌种数。
利用SPSS 22.0 对松材线虫取食不同真菌后的种群数量进行单因素方差分析及Duncan’s 多重比较(p<0.05)。
2 结果与分析
2.1 马尾松不同组织的微生物组成
2.1.1 马尾松不同组织内的真菌组成 对浙江马尾松进行内生真菌分离,经纯化后分离得到健康马尾松内的真菌106 株,其中干部的分离率最高,为55%(55 株),其次为针叶和根部,分离率分别为46%(46 株)和5%(5 株)。经过ITS 序列比对将分离菌株划分为19 个属,木霉属(Trichoderma)为优势类群,占菌株总数的25.47%,而且不同部位的优势类群不同,根部优势属为毛色二孢属(Lasiodiolodia),干部为木霉属(Trichoderma),针叶为拟盾壳霉属(Paraconiothyrium)(表1)。枯死马尾松中分离得到真菌86 株,其中针叶的分离率最高,为44%(44 株),其次是干部和根部,分离率分别为32%(32 株)和10%(10 株)。经过ITS 序列比对将分离菌株划分为10 个属,木霉属(Trichoderma)也为优势类群,占菌株总数的34.88%,分不同部位来看,根部和干部的优势属为木霉属(Trichoderma),针叶为散斑壳属(Lophodermium)(表2)。
2.1.2 马尾松不同组织内的细菌组成 对浙江马尾松进行内生细菌的分离,经纯化后分离得到健康马尾松内的细菌59 株,经过序列比对将分离菌株划分为13 个属,其中伯克氏菌属(Burkholderia)18 株为优势菌群,占分离细菌总数的30.51%;沙雷氏菌属(Serratia)和肠杆菌属(Enterobacter)各10 株,占16.95%;泛菌属(Pantoea)4 株,占6.78%;其它细菌占28.81%。根据不同部位的分离情况,根部、干部和针叶的优势菌群分别是伯克氏菌属(Burkholderia)、肠杆菌属(Enterobacter)和沙雷氏菌属(Serratia)(表3)。从枯死马尾松中分离得到细菌56 株,经过序列比对将分离菌株划分为12 个属,其中伯克氏菌属(Burkholderia)22 株为优势菌群,占分离细菌总数的39.29%;肠杆菌属(Enterobacter)8 株,占14.29%;沙雷氏菌属(Serratia)6 株,占10.71%;芽孢杆菌属(Bacillus)5 株,占8.93%;其它细菌占26.78%。根据不同部位的分离情况,根部和干部的优势菌群分别是伯克氏菌属(Burkholderia)和肠杆菌属(Enterobacter)(表4)。
2.2 马尾松树体内真菌分布多样性及相似性
由表1 可知,健康马尾松不同组织间的真菌分布存在较大差异,干部分离到的真菌有13 个属,种类最多,Shannon-Wiener 指数(H)为1.81,针叶分离的真菌有8 个属,H为1.68,根部分离的真菌只有2 个属,H为0.50。Simpson 指数(D)以干部最高,为0.78,根部最低,为0.32;均匀度指数(J)以干部最高,为0.45,根部最低,为0.31。与健康马尾松相比,枯死马尾松不同组织分离到的真菌种类较少,干部和针叶都分离到5 个属的真菌,H分别为0.99 和1.09。Simpson 指数(D)以针叶最高,为0.56,根部最低,为0.32;干部和针叶的均匀度指数(J)相同,为0.29,根部最低,为0.22(表2)。
从表5 可看出,健康和枯死马尾松根叶的相似性均为0,健康马尾松干叶的相似性最高,枯死马尾松根干的相似性最高,但指数值均小于0.5,表明健康和枯死马尾松不同组织间的真菌菌群相似性都较低。
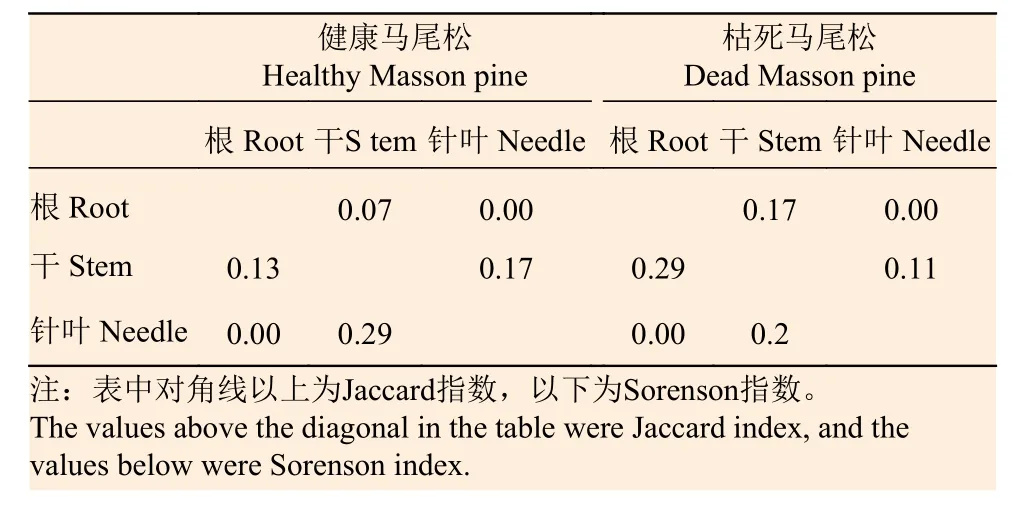
表5 健康和枯死马尾松不同部位真菌菌群相似性系数Table 5 The similarity indexes of fungal community of different tissue from healthy and dead Masson pine
由表1 和表2 可知,健康马尾松的真菌多样性高于枯死马尾松,Shannon-Wiener 指数(H)、Simpson 指数(D)和均匀度指数(J)依次为2.37、0.87 和0.51,均高于枯死马尾松的1.72、0.76 和0.39。从相似性指数来看,健康和枯死马尾松的真菌菌群之间相似性较低,Sorenson 指数(CS)和Jaccard 指数(Cj)分别为0.48 和0.32,均小于0.5。
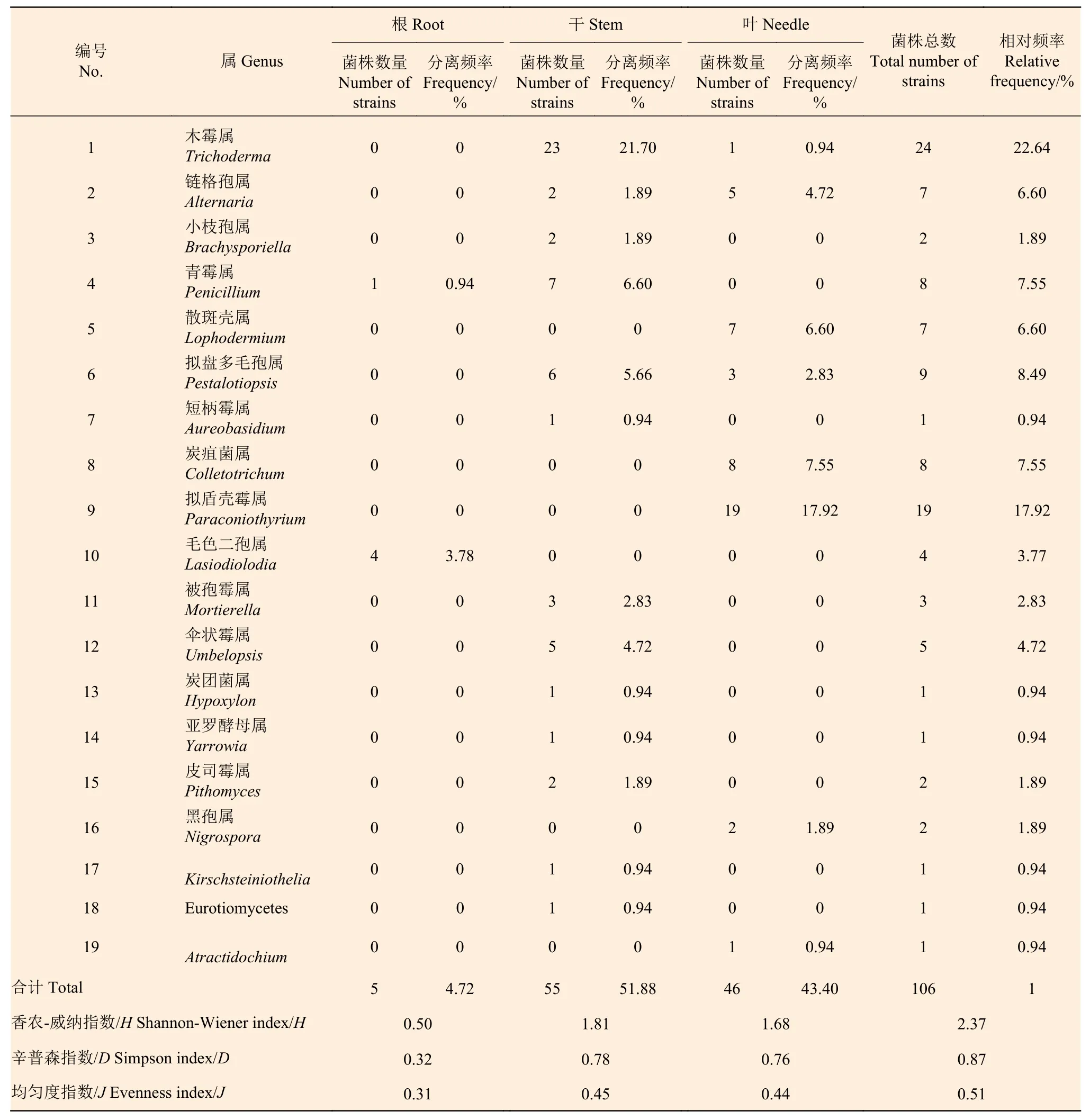
表1 健康马尾松不同部位内生真菌的组成及分离频率Table 1 The fungal composition and isolation frequency of different tissues in healthy Masson pine
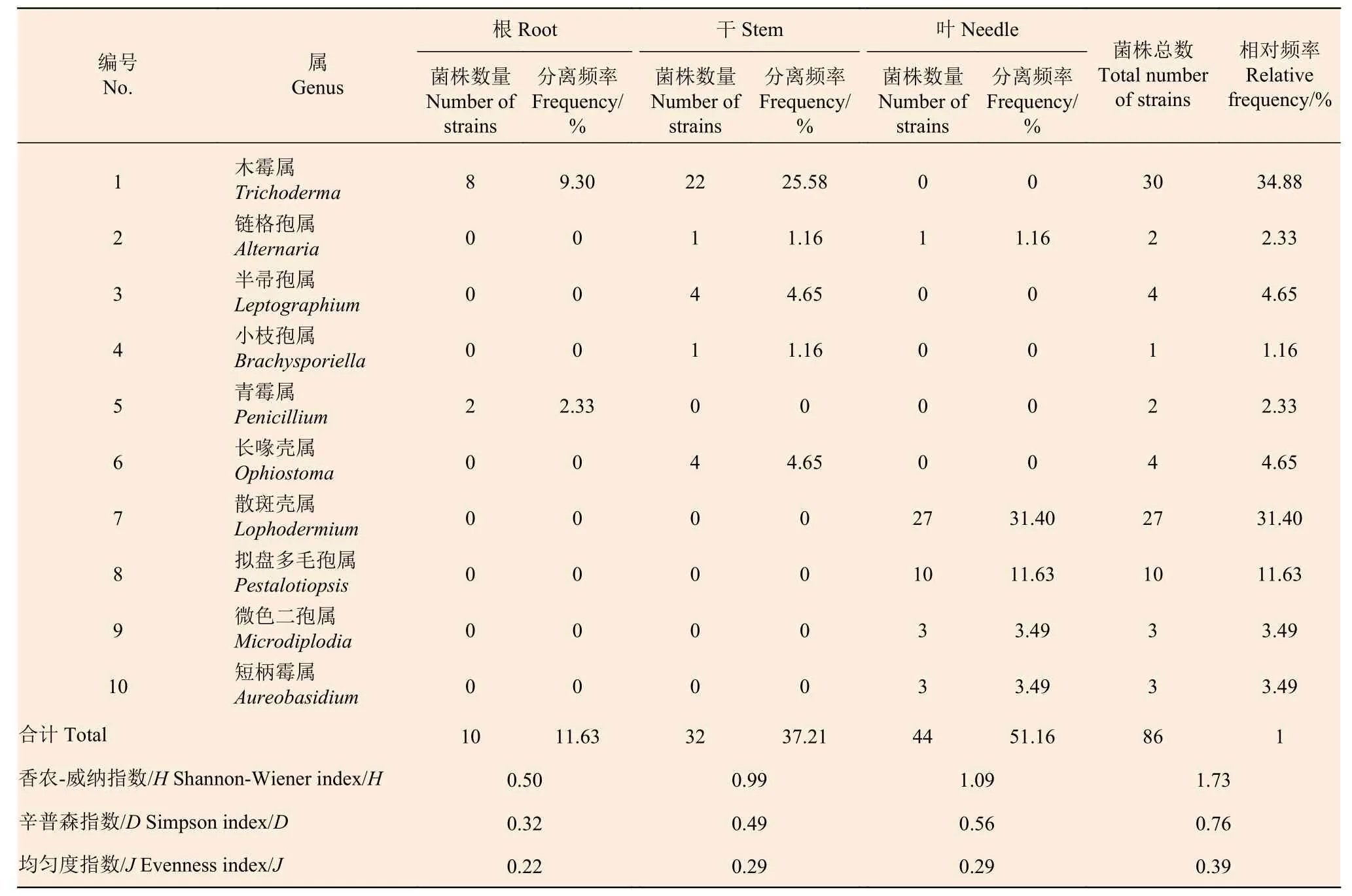
表2 枯死马尾松不同部位内生真菌的组成及分离频率Table 2 The fungal composition and isolation frequency of different tissues in dead Masson pine
2.3 马尾松树体内细菌分布多样性及相似性
由表3 可知,健康马尾松不同组织间的细菌分布存在较大差异,干部分离到11 个属(32 株)的细菌,种类最多,其次是根部的5 个属(21 株),最少的是针叶(4 株),只分离到3 个属的细菌。在枯死马尾松中,也是干部分离到的细菌种类最多,有10 个属(27 株),根部和针叶分别分离到3 个属(24 株)和2 个属(4 株)的细菌(表4)。健康和枯死马尾松中均为干部的细菌多样性最高,针叶的细菌多样性最低。
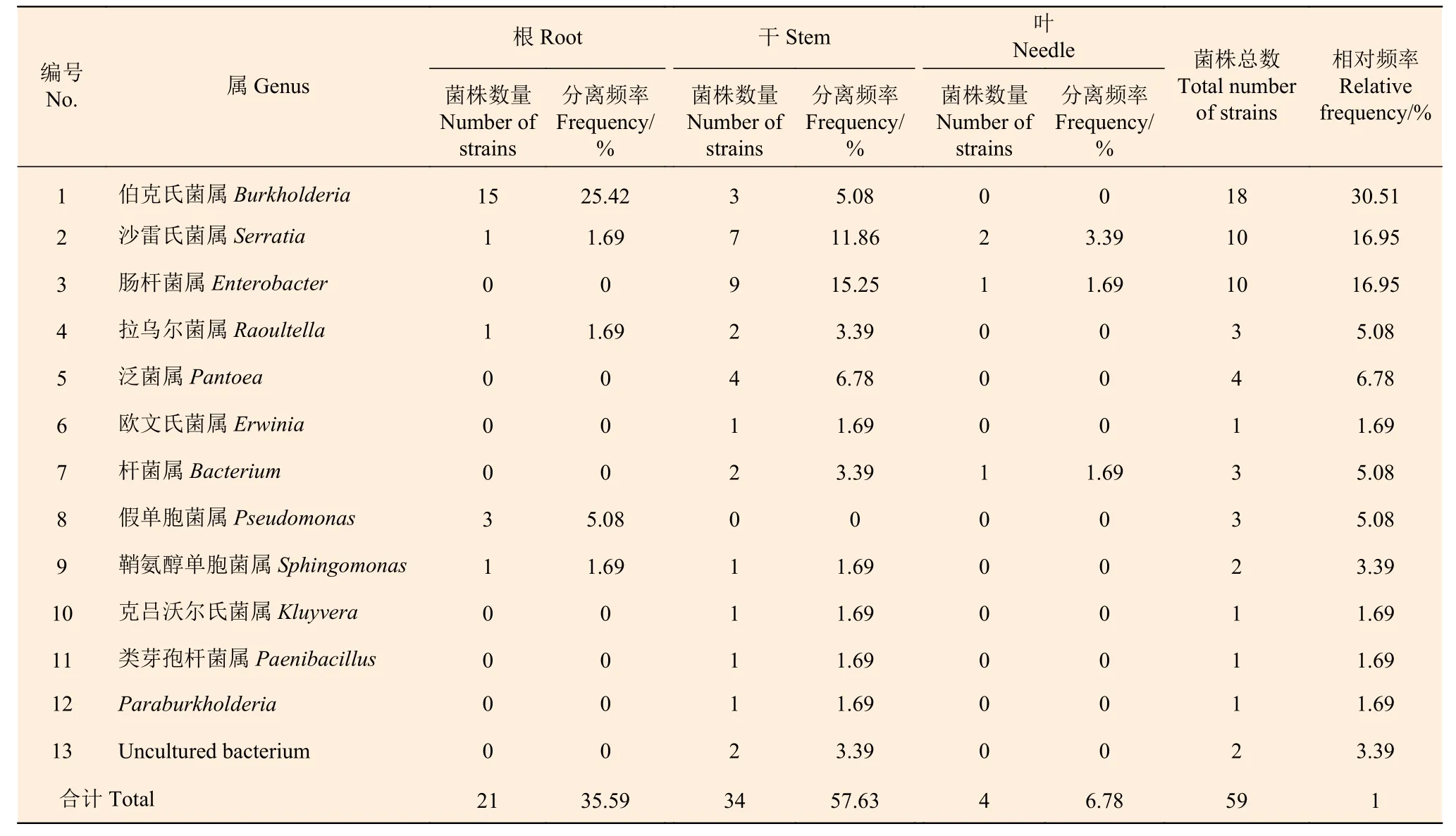
表3 健康马尾松不同部位内生细菌的组成及分离频率Table 3 The bacterial composition and isolation frequency of different tissues in healthy Masson pine
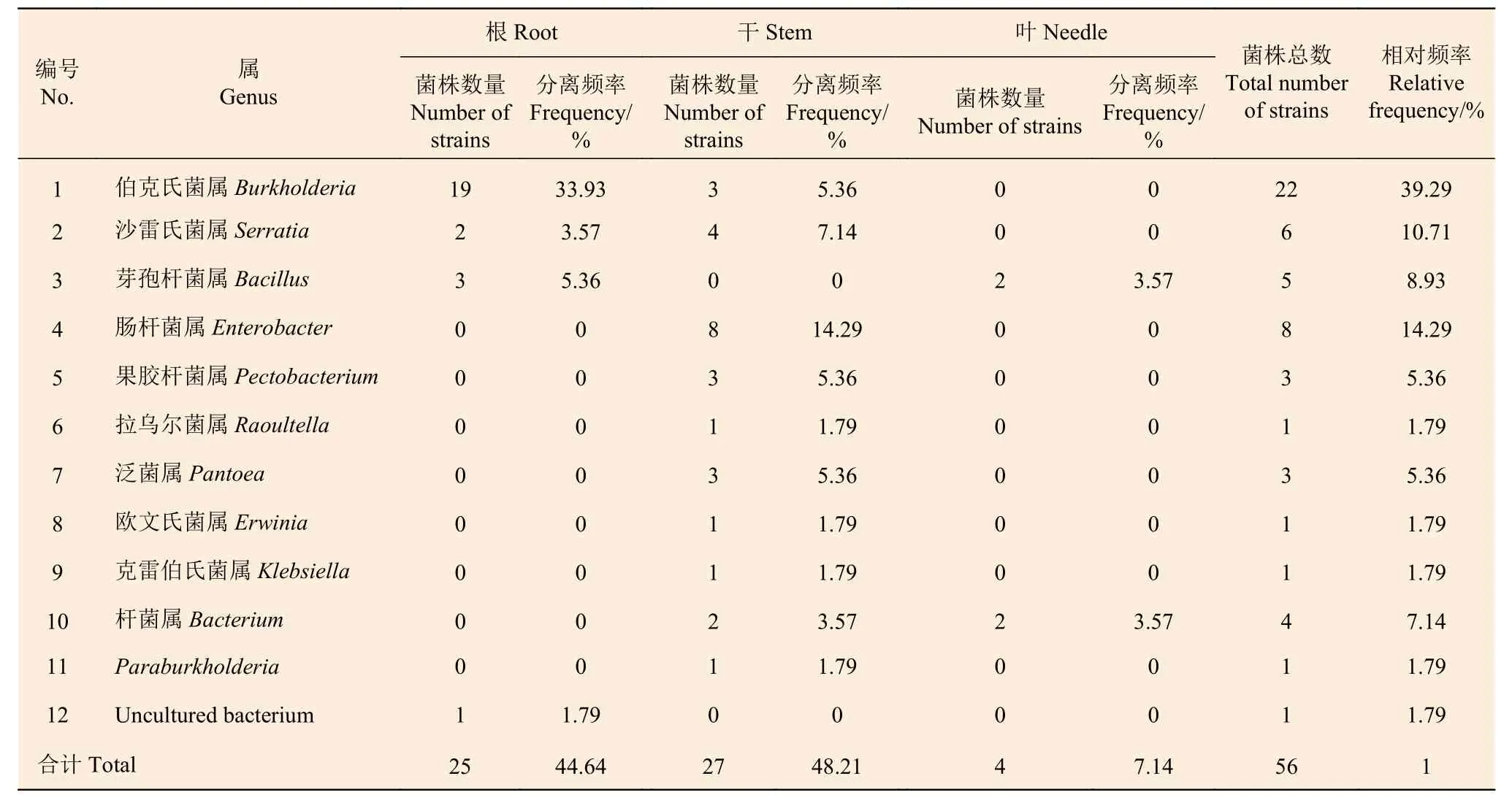
表4 枯死马尾松不同部位内生细菌的组成及分离频率Table 4 The bacterial composition and isolation frequency of different tissues in dead Masson pine
健康和枯死马尾松中共有的细菌种类有8 个属,其中干部共有的类群有8 个属,根部有2 个,针叶有1 个,Sorenson 指数(CS) 和Jaccard 指数(Cj)分别为0.70 和0.53,表明健康和枯死马尾松的细菌群落具有一定的相似性。
2.4 木霉属真菌的系统发育分析
本研究共分离到6 种木霉,在6 cm 培养皿内的PDA 培养基上培养4 d 后菌落形态见图1。以Protocrea farinosa为外族群,6 种木霉的系统发育进化树结果见图2。6 个种类的木霉在发育树中归于3 个进化支,FXY7 与T.harzianum亲缘关系最近,FXY8 与T.spirale亲缘关系最近,FXY37 归于longibrachiatum 分支,FXY19、FXY32 和FXY56这3 种木霉归于同一分支。
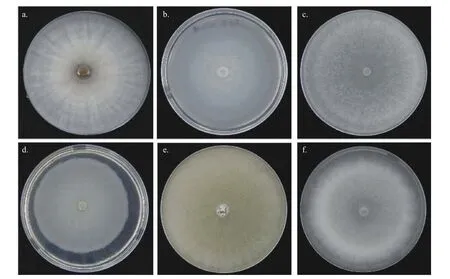
图1 6 种木霉的菌落形态Fig.1 Colony morphology of six Trichoderma species
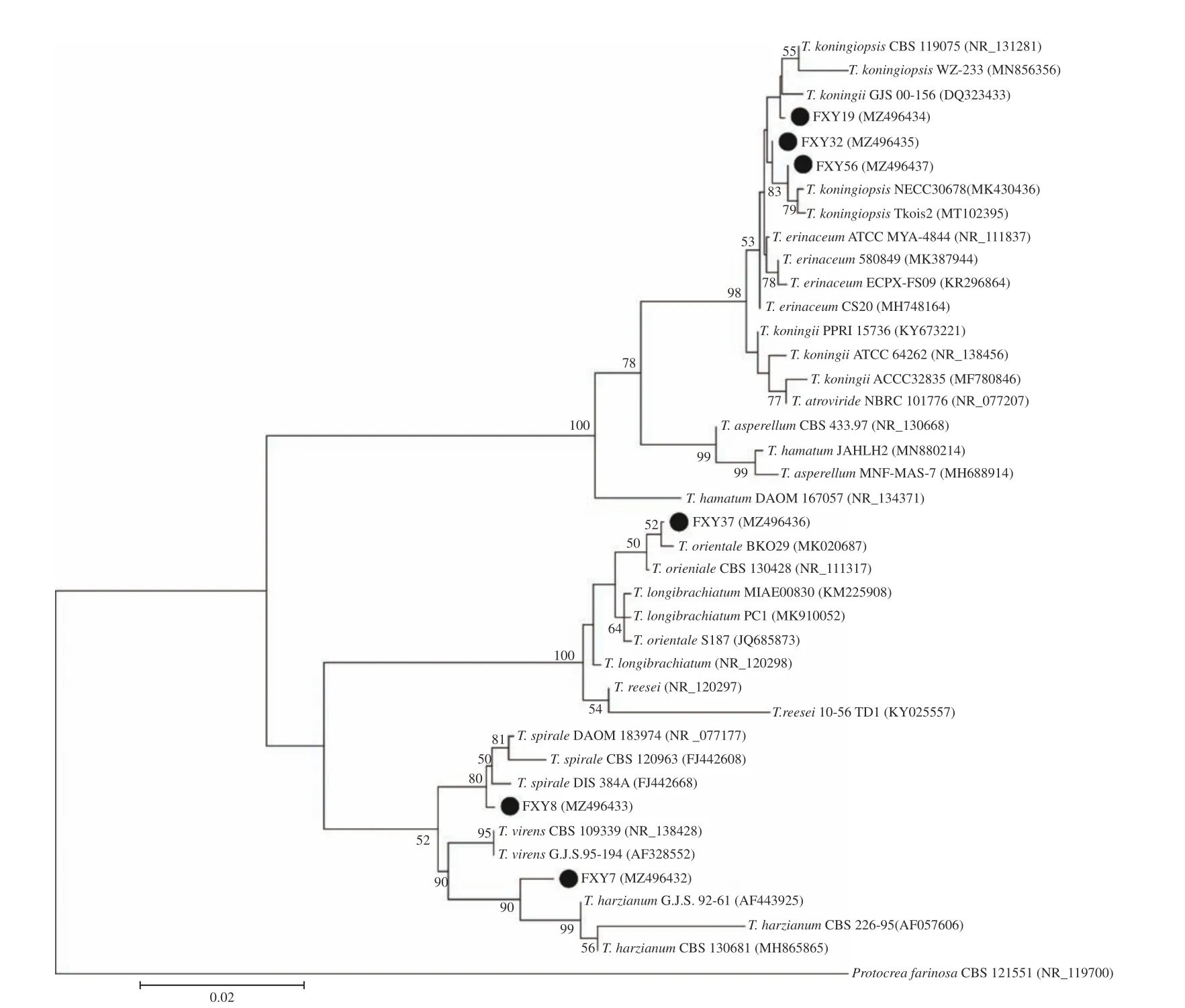
图2 基于ITS 序列构建的木霉系统发育进化树Fig.2 Phylogenetic tree of Trichoderma strains inferred from ITS gene sequences
2.5 取食木霉对松材线虫种群数量的影响
由图3 可知,不同木霉培养下的松材线虫种群数量具有显著差异,取食木霉FXY8 的松材线虫数量最多,达到162 300 条,显著高于灰葡萄孢培养的松材线虫数量,取食木霉FXY7 的松材线虫数量最少,只有4 275 条,最不利于松材线虫繁殖(F=6.21,df=6,28,p<0.05)。其它4 种木霉的培养效果与灰葡萄孢没有显著差异,但用FXY19 培养得到的线虫数量明显多于FXY56。
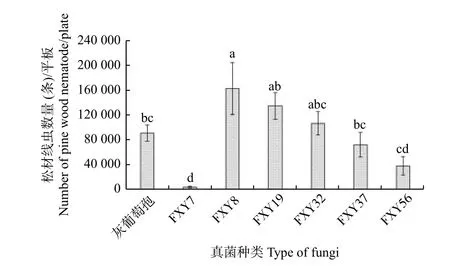
图3 取食不同真菌后活体松材线虫的种群数量Fig.3 Populationquantity of live pine wood nematodes fed on different fungi
3 讨论
本研究从浙江健康和枯死马尾松中共分离出隶属于22 个属的192 株真菌和16 个属的105 株细菌,健康和枯死马尾松真菌菌群之间的相似性较低,不同部位的优势菌群不同,但优势类群均为木霉属真菌(表1 和表2),而健康和枯死马尾松细菌菌群之间的相似性较高,优势菌群均为伯克氏菌属、沙雷氏菌和肠杆菌属,而且不同部位的优势类群也较为一致(表3 和表4)。从物种多样性来看,健康马尾松的真菌和细菌多样性都高于枯死马尾松,尤其是真菌,这表明由于松材线虫的侵染,降低了马尾松内生真菌的多样性。Zhang 等人[19]利用高通量测序技术对浙江健康和枯死马尾松的内生真菌和细菌群落结构进行分析,发现健康马尾松中优势真菌为青霉属、拟盘多毛孢属和木霉属真菌,在枯死马尾松中这三类真菌的丰度有所下降,而优势细菌在健康和枯死马尾松中的分布较为一致。他们还发现枯死马尾松的内生细菌和真菌的丰富度和多样性都低于健康马尾松,尤其是真菌,这与我们的分离结果也是一致的,表明我们的分离结果可以反映浙江健康和枯死马尾松内生真菌和细菌的菌群结构。
曾凡勇[20]对浙江健康、衰弱和枯死马尾松树干的内生真菌进行了分离,木霉均为优势菌,且衰弱木中分离到的真菌数量最多,枯死木中最少。肖育贵等[21]分析了四川不同健康状态马尾松树干木居真菌的种类,分离出的真菌种类主要有木霉属、镰刀菌属和多毛孢属等,健康木分离到的真菌数量最少。鲁国华等[22]对安徽省不同健康状态马尾松树干内的真菌种类进行了研究,发现健康马尾松树干的优势真菌为镰刀菌和木霉,濒死马尾松和死亡马尾松均为长喙壳和木霉,健康马尾松上分离到的真菌数量最少。本研究中对树干的真菌分离结果显示健康木的真菌种类和数量均高于枯死马尾松,这可能与采集枯死马尾松的时间和状态有关,树木的腐烂程度会影响树体内真菌的群落结构[23-24]。邓慧华[25]对福建省健康马尾松不同组织的内生真菌进行了分离,叶部分离到的内生真菌数量和种类最多,茎部次之,根部最少,毛霉属和木霉属是马尾松内生真菌中的优势属。结合本研究和前人的分离结果可知,木霉属是马尾松体内的优势真菌。
松树体内的真菌种群与松材线虫病的发生和发展密切相关。吕全等[26]研究了3 个马尾松树栖真菌菌株对媒介昆虫携带松材线虫数量的影响,发现不适宜松材线虫繁殖的真菌能促进松材线虫群体内更多个体转化为扩散型虫态,不同真菌对蛹室中线虫种群大小有显著影响。Maehara 和Futai[27]发现在只接种Trichodermasp.的木段上天牛携带的线虫数量很少,另外在木段上接种Trichodermasp.3 可以抑制蓝变菌的扩散,从而减少天牛携带的线虫数量[28-29],由此可见,木霉对松材线虫种群的扩散也有一定的抑制作用。本研究中共分离到6 种木霉,通过取食实验可知,FXY7 显著抑制了松材线虫的种群数量。木霉属真菌是一类高效的拮抗、促生菌,对松材线虫也具有一定的致死作用。钩状木霉Trichoderma hamatum孢子悬浮液对松材线虫毒性较强,致死率可以达到85.6%[30]。木霉菌株T-28 的乙酸乙酯提取物在72 h 校正死亡率达到100%[31]。木霉的挥发性化合物对松材线虫也具有一定的杀虫活性[32-33]。本研究分离到的木霉对松材线虫病是否具有其它生防作用还需进一步展开研究。
关于马尾松内生细菌群落结构的研究较少,袁文婷对健康马尾松茎部的内生细菌进行了分离,共分离到20 株细菌,通过内生性验证后对其中7 个菌株进行了种类鉴定,并未对群落结构进行描述。尹诗恒等[34]研究了松材线虫侵染下马尾松苗不同部位内生细菌菌群的结构变化,发现松干部位菌群结构变化极显著,其次是松针,根部基本不受影响。前人也从马尾松体内分离出一些具有生防作用的内生细菌,李亮亮等[35]从马尾松茎部分离到一株松材线虫拮抗细菌短小芽孢杆菌,并通过荧光标记法证明了该菌株在马尾松体内的内生性,为该菌今后的实际应用提供了理论依据。Song 等人[36]从马尾松顶芽和针叶中分离到一株Pantoea eucalypti,根据其基因组特征和携带质粒的功能推测该菌可促进松树生长。沙雷氏菌属细菌也是马尾松中经常分离到的一类细菌,从蛹室分离到的Serratia marcescens可以促进松褐天牛的死亡[37]。本研究中分离到多株沙雷氏菌属和芽孢杆菌属细菌,这些菌株对松材线虫病的控制作用还有待进一步研究。
4 结论
健康马尾松树体内的真菌多样性高于枯死马尾松,二者真菌菌群相似性较低,而且不同组织间真菌菌群相似性也较低;对于细菌来说,健康和枯死马尾松的细菌群落具有一定的相似性。这表明松材线虫入侵会影响马尾松树体内的真菌多样性,但对细菌的影响较小。另外本研究中分离到多株可能对松材线虫病具有生防潜力的内生菌,为探索松材线虫病的新型防控技术奠定了基础。

