高脂饮食诱导非酒精性脂肪肝的发病机制研究
李 春,梅 聪,周 琼,朱丽芹,王毅鹏,翁晓春,周松兰,唐 哲
(昆明市延安医院内分泌科,云南 昆明 650051)
随着人们生活水平的提高,非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)对人类健康的危害也越来越大[1,2]。NAFLD 包括单纯性脂肪肝(nonalcoholicsimple fatty liver,NAFL)、脂肪性肝炎(nonalcoholic steatohepatitis,NASH)、肝纤维化、肝硬化,甚至进展为肝细胞癌等一系列相互联系的病理改变[3]。与单纯NAFLD 患者相比,NASH 的存在增加了肝脏疾病的风险,也可能增加心血管疾病和恶性肿瘤等非肝脏相关疾病的风险[4-6]。NAFLD 发病机制复杂,“二次打击”理论(Two hit theory)其中之一,第一次打击诱发肝脏脂肪变性,第二次打击来自氧化应激引起炎症、纤维化、坏死等[7]。Kupffer 细胞在经典激活(M1)和选择性激活(M2)两种状态之间的转换可能也在NAFLD 的发生发展过程中发挥重要作用[8,9]。基于此,本研究通过高脂饮食建立NAFLD 的小鼠模型,动态观察小鼠肝脏的Kupffer细胞在疾病的发展和演变过程中的变化,分析其在炎症募集和炎症持续机制中的作用,明确Kupffer 细胞在M1 和M2 之间的转换与NAFLD 发病机制的关系,现报道如下。
1 材料与方法
1.1 实验动物与材料 30 只C57BL/6J 小鼠购自中科院上海实验动物中心,PBS 溶液:将1 包磷酸缓冲液(phosphate-buffered saline,PBS)粉剂(购自索莱宝)完全溶解于2000 ml 蒸馏水中,混匀后,调整pH 值在7.2~7.4 备用。4%多聚甲醛:将40 g 多聚甲醛(购自Sigma)完全溶解于加热的1000 ml 蒸馏水中,恢复室温后备用。甘油三酯(TG)、总胆固醇(TC)、丙氨酸氨基转移酶(ALT)、门冬氨酸氨基转移酶(AST)、胰岛素和血糖试剂盒购自Elabscience。IL-1β、IL-6、TNF-α、iNOS,MCP-1、VEGF 和IL-10 的ELISA 试剂盒购自Abcam。
1.2 高脂饮食诱导小鼠NAFLD 模型 30 只C57BL/6J小鼠随机分为普通饮食组、4 周高脂饮食组(88%普通饮食+10%猪油+2%胆固醇)和8 周高脂饮食组,每组10 只。所有食物均经高温消毒灭菌后使用。饲养环境条件:温度20 ℃~22 ℃,湿度50%~55%,明暗各12 h。
1.3 检测指标
1.3.1 小鼠状态监测 每周称重1 次小鼠体重,观察其食欲行为、精神状态和毛发情况等。
1.3.2 标本采集 小鼠处死前隔夜禁食,使用异氟烷吸入麻醉。切开腹腔后从下腔静脉取血,采集的血液标本在4 ℃下1000xg 离心10 min 后,取上层血清,保存在-80 ℃冰箱用于后续检测。切开右心房,以22G 导管行门静脉插管,用PBS 以10 ml/min 灌注肝脏5 min 后摘取肝脏。切取2 cm×2 cm 大小肝脏组织,使用4%多聚甲醛固定,石蜡包埋,连续切成5 μm 组织切片用于HE 染色。肝组织切片经HE染色后,光镜下评估肝脂肪变性和炎症活动情况,HE 切片用OLYMPUS 摄像系统进行观察和摄片。剩余的肝脏组织剪碎,用于Kupffer 细胞的分离和原代培养,加入30 ml 浓度为1 mg/ml 的Ⅳ型胶原酶液37 ℃水浴消化30 min,用100 μm 滤网过滤消化液,留取滤液,4 ℃下300xg 离心5 min,2 次,弃上清,以PBS 重悬沉淀,4 ℃下50xg 离心3 min,上层悬液再以300xg 离心5 min,弃上清,沉淀用高糖DMEM 培养基(含10%胎牛血清,100 U/ml 青霉素和100 μg/ml链霉素)重悬,在含5%CO2的细胞培养箱中37 ℃下培养2 h,弃去培养液,以PBS 洗涤1 次,再加入新鲜培养液继续培养。
1.3.3 血清学实验室指标检测 参考说明书使用TG、TC、ALT、AST、胰岛素(I)、血糖(G)试剂盒分别检测不同饮食组小鼠血清中各指标的含量。
1.3.4 细胞因子检测 Kupffer 细胞以PBS 洗涤3次后,用高糖DMEM 培养基(100 U/ml 青霉素和100 μg/ml 链霉素)重悬,调整细胞浓度至1×105/ml,接种于96 孔培养板中,每组3 个复孔,于24 h 后收集培养上清,根据说明书应用ELISA 试剂盒检测IL-1β、IL-6、TNF-α、iNOS、MCP-1、VEGF 和IL-10指标。
1.4 统计学分析 所有的数据使用Graphpad Prism 7.0 处理。连续型变量以()表示,分类变量以(%)表示。连续型变量使用非配对t检验,分类变量使用χ2检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 三组小鼠状态比较 各组小鼠在实验终点结束前均无死亡,习性、毛发、活动等均无异常。在高脂饮食初期,各组小鼠进食量无显著变化,之后4 周高脂饮食组和8 周高脂饮食组的小鼠进食量增加。三组实验前体重比较,差异无统计学意义(P>0.05);处死时,高脂饮食组的小鼠体重高于对照组,且8 周高脂饮食组体重高于4 周高脂饮食组,差异有统计学意义(P<0.05),见表1。
表1 各组小鼠体重变化情况(,g)

表1 各组小鼠体重变化情况(,g)
2.2 三组血清学指标比较 4 周高脂饮食组和8 周高脂饮食组胰岛素、血糖、TG、TC、AST 和ALT 水平均高于普通饮食组,且8 周高脂饮食组高于4 周高脂饮食组,差异有统计学意义(P<0.05),见表2、图1。
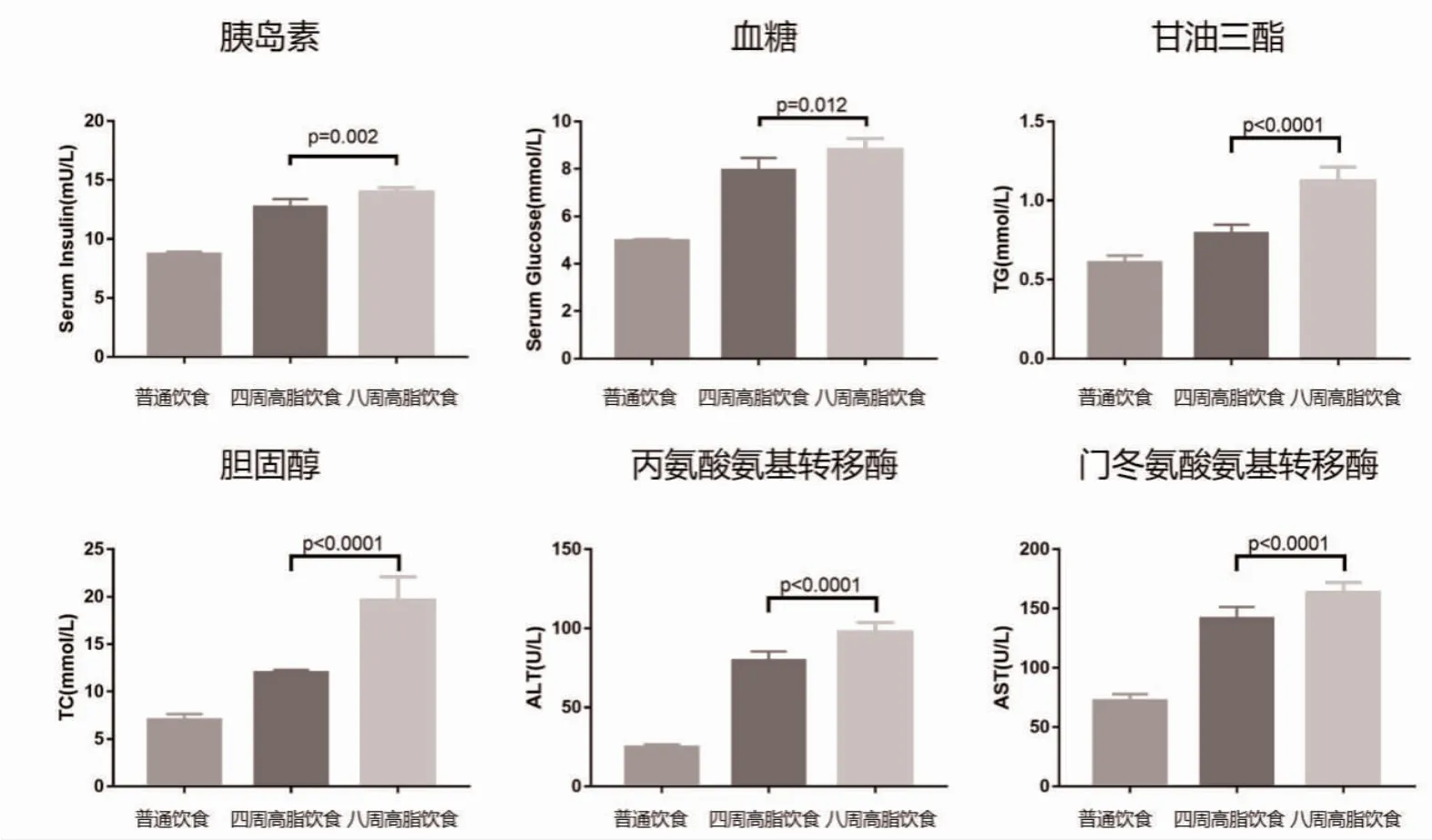
图1 三组血清学指标比较图
表2 三组血清学水平比较(n=10,)
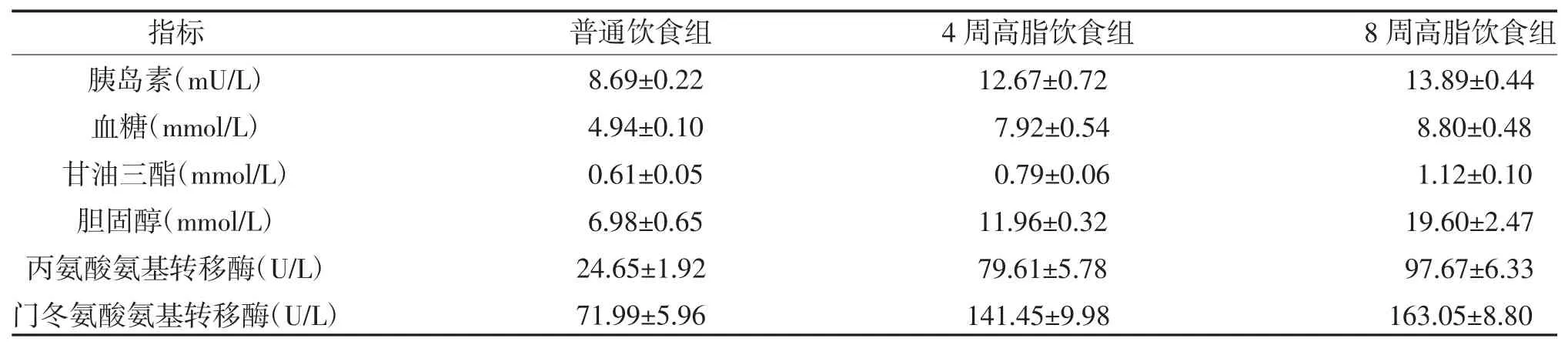
表2 三组血清学水平比较(n=10,)
2.3 三组组织学观察 普通饮食组小鼠肝脏外观表现尺寸正常,密度正常,有光泽,质软,色泽深红色,边缘锐利。肝组织切片HE 染色后可见肝细胞大小正常,呈窦索状分布,细胞内未见脂肪浸润,无小叶和汇管区炎性细胞浸润,无纤维组织形成,见图2A。4 周高脂饮食组肝脏明显肿胀增大,色泽土黄,边缘钝,标本密度降低(漂浮于中性甲醛液面上)。组织切片可见脂滴弥漫浸润肝细胞中,脂肪变性的肝细胞极度肿胀呈圆形,体积较正常明显增加;8 周高脂饮食组的肝脏外观与4 周高脂饮食组相似,标本密度降低更明显;组织切片可见脂滴弥漫浸润肝细胞中,脂肪变性的肝细胞极度肿胀呈圆形,体积较正常明显增加,胞浆的脂肪空泡较4 周高脂饮食组增多,呈大泡型。

图2 三组肝脏组织观察(HE 染色,×40)
2.4 三组细胞因子水平表征 4 周高脂饮食组和8 周高脂饮食组TNF-α、IL-6、MCP1、IL-1β、iNOS 及VEGF 水平均高于普通饮食组,且8 周高脂饮食组高于4 周高脂饮食组,差异有统计学意义(P<0.05);4 周高脂饮食组和8 周高脂饮食组IL-10 水平低于普通饮食组,且8 周高脂饮食组低于4 周高脂饮食组,差异有统计学意义(P<0.05),见表3、图3。
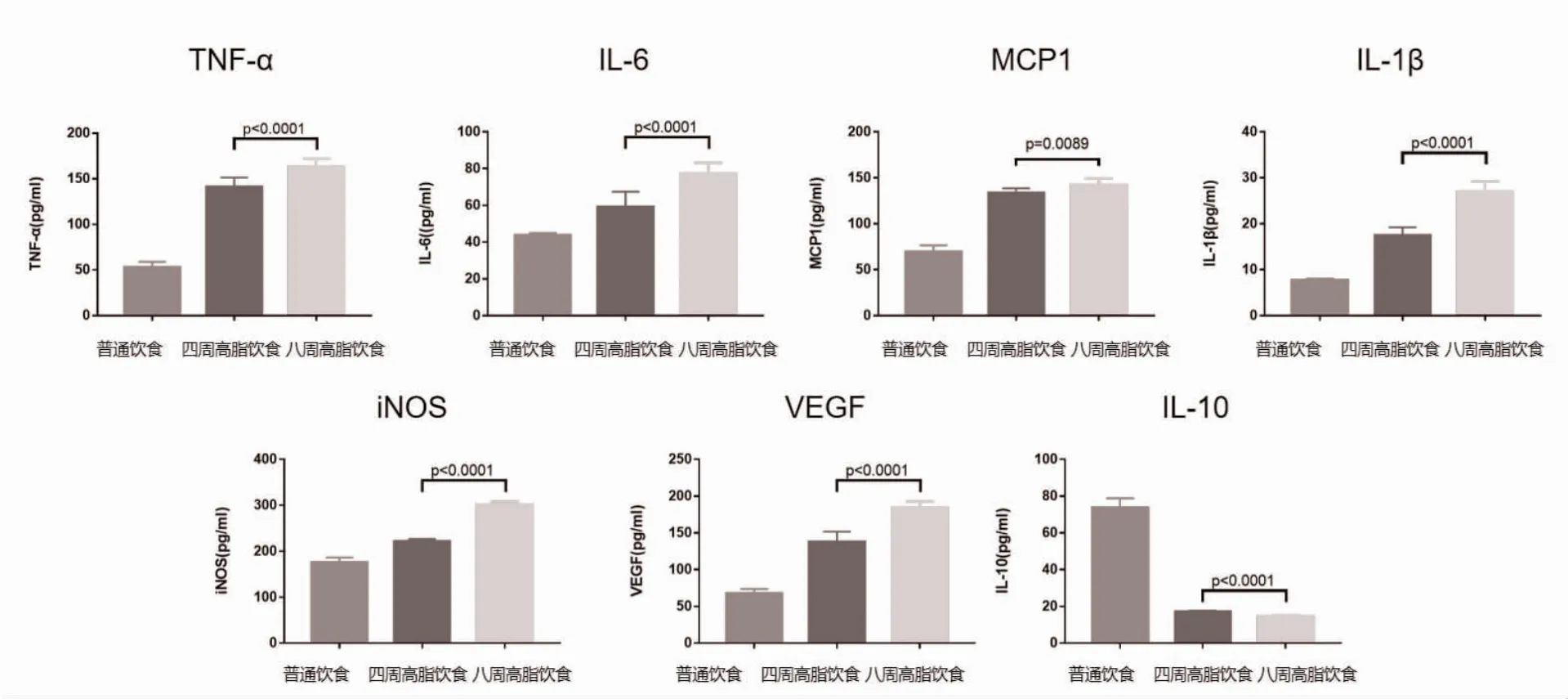
图3 三组促炎和抗炎细胞因子比较图
表3 三组炎症因子水平比较(n=10,)

表3 三组炎症因子水平比较(n=10,)
3 讨论
NAFLD 是最常见的慢性肝病。2 型糖尿病是NAFLD 的重要危险因素。NAFLD 患者通常表现为胰岛素抵抗,并且血糖上升或合并糖尿病的患者的死亡率显著上升[10]。此外,T2DM 似乎加速了NAFLD肝脏疾病的进展,必须优先提高对2 型糖尿病患者非酒精性脂肪肝重要性的认识[11,12]。本研究通过高脂饮食饲养小鼠建立NAFLD 动物模型,结果显示4周高脂饮食组和8 周高脂饮食组胰岛素、血糖、TG、TC、AST 和ALT 水平均高于普通饮食组,且8 周高脂饮食组高于4 周高脂饮食组,差异有统计学意义(P<0.05)。除了TG 和TC 升高外,小鼠胰岛素水平和血糖水平也显著升高,提示NAFLD 合并糖尿病的风险。另外,AST 和ALT 的升高也反应当前肝脏组织的炎症损伤状态。
除了血液检测指标之外,肝脏组织切片染色可直接显示NAFLD 的病理过程变化,并且在疾病的诊断中发挥重要作用。既往有学者报道了一种基于脂肪变性程度的NAFLD 组织病理学损害分级和分期系统[13]。本研究中肝脏组织HE 染色显示脏明显肿胀增大,可见脂滴弥漫浸润肝细胞中,脂肪变性的肝细胞极度肿胀呈圆形,体积较正常明显增加。高脂饮食组肝脏组织分离和原代培养的Kupffer 细胞(肝巨噬细胞)分泌大量促炎症细胞因子,包括TNF-α、IL-6、MCP1、IL-1β、iNOS 和VEGF,此外抗炎细胞因子IL-10水平分泌显著降低。表明NAFLD 小鼠模型的血糖和胰岛素水平均升高,这与临床中NAFLD 患者死亡的高危因素包括糖尿病密切相关[14]。而小鼠肝脏组织切片表现出的肝脏明显肿胀增大,色泽土黄,边缘钝,标本密度降低,脂滴弥漫浸润肝细胞中,脂肪变性的肝细胞极度肿胀呈圆形,体积较正常明显增加,这些特征均是NAFLD 的典型病理特征。分析原因为Kupffer 细胞能通过M1 和M2 通路进行转换和调节。已有研究表明[15-17],破坏Kupffer 细胞可以减轻肝脏的组织学表现,如脂肪变性、炎症、坏死等。M1/M2 型Kupffer 细胞比例失调会引起NAFLD 向肝细胞癌的转变,其比例显著降低,提示增加M1 型Kupffer 细胞的数量可能是潜在的逆转NAFLD 发展为肝癌的重要手段[18]。另有研究则显示脂质可诱导Kupffer 细胞分化,并且不同类型的脂质诱导分化的能力不同,本研究同样使用高脂饮食来使Kupffer 细胞释放更多促炎症细胞因子,抑制抗炎细胞因子释放,其结果一致[19]。长期运动可恢复NAFLD 肥胖小鼠Kupffer 细胞受损的吞噬能力,可能是通过增加脱氢表雄酮(DHEA)产生,改善肝脏炎症和纤维化防止NASH 发生[20],提示肝脏Kupffer 细胞功能的异常在NAFLD进展中的重要作用。
综上所述,本研究通过血液指标和组织切片图像证实了脂肪肝形成的病理生理学特征以及炎症细胞的浸润,Kupffer 细胞促炎细胞因子分泌增加而抗炎细胞因子水平下降使肝脏组织处于高炎症状态,向M1 型巨噬细胞分化造成组织炎症损伤是NAFLD 进展的关键因素。

