Graves 病患者合并胸腺增生的影响因素分析
肖金凤,刘艳静,张欣欣,何庆
(天津医科大学总医院内分泌代谢科,天津 300052)
Graves 病是临床甲状腺功能亢进症(甲亢)的最主要病因,约占全部甲亢的80%~85%。目前认为Graves 病的发生主要和自身免疫有关,其主要发病机制是由于机体产生刺激性甲状腺受体抗体(TRAb)而引起的甲亢[1]。相关研究报道,38%的Graves 病患者具有组织学胸腺异常[2],在临床工作中极易误诊误治,但目前研究仅限于病例报道及Graves 病治疗前后胸腺增生的变化,Graves 病合并胸腺增生的影响因素并未明确。为此,笔者收集了2018 年11月—2020 年11 月100 例Graves 病患者病例资料,分析报道如下。
1 对象与方法
1.1 研究对象 收集自2018年11月—2020年11 月在本院内分泌科确诊的Graves 病患者100 例,依据胸部CT 结果是否合并胸腺增生分为两组:Graves病未合并胸腺增生组49 例;Graves 病合并胸腺增生组51 例。纳入标准:(1)年龄≥18 岁。(2)经临床高代谢症状、甲状腺超声、甲状腺功能指标等检查确诊,且符合《中国甲状腺疾病诊治指南》中有关Graves 病的诊断标准[3]。(3)病程小于1 年。排除标准:(1)结节性甲状腺肿、甲状腺炎、甲状腺瘤。(2)Graves 病以外原因所致甲亢者。(3)合并重要脏器功能异常、恶性肿瘤、自身免疫性疾病、其他内分泌疾病者。(4)妊娠。本研究方案经天津医科大学总医院机构审查委员会批准,并放弃个人知情同意(批准编号为IRB2020-YX-029-01)。
1.2 方法
1.2.1 一般资料收集 询问患者一般情况、性别、年龄、病程、家族史等。
1.2.2 实验室检测 采集空腹肘静脉血2~3 mL,通过化学发光免疫分析法(美国雅培)测定血清FT3、FT4、促甲状腺激素(TSH),游离甲状腺功能(甲功)参考范围:FT3(2.43~6.01 pmol/L)、FT4(9.01~19.05 pmol/L)、TSH(0.35~4.94 mU/L);电化学发光免疫分析法(德国罗氏)测定促甲状腺素受体抗体(TRAb,参考范围0~1.75 IU/L);酶放大化学发光免疫分析法(德国西门子)测定甲状腺球蛋白抗体(TGAb,参考范围0~40.00 IU/mL)、甲状腺过氧化物酶抗体(TPOAb,参考范围0~35.00 IU/mL)。用眼球突出计测量眼球突出度。
1.2.3 影像学检查 所有病例均行胸部计算机断层扫描(computer tomography,CT)平扫检查,报告经放射科两位副主任医师审核。
1.3 统计学处理 采用SPSS 25.0 软件进行统计学处理。符合正态分布的计量资料用±s 表示,两组间比较采用独立样本t 检验,非正态分布资料以中位数(四分位数)[M(P25,P75)]表示,两组间采用非参数秩和检验;计数资料用百分率(%)表示,采用χ2检验;其中P<0.05 的指标纳入单因素Logistic 回归方程,并将单因素分析提示有显著性差异的因素纳入多因素Logistic 回归分析中;绘制受试者工作特征(ROC)曲线,计算曲线下面积(AUC),分析发病年龄预测胸腺增生的预测能力;P<0.05 为差异有统计学意义。
2 结果
2.1 一般资料比较 Graves 病合并胸腺增生组年龄小于Graves 病未合并胸腺增生组,谷丙转氨酶(ALT)高于Graves 病未合并胸腺增生组(P<0.05);两组病程、性别、吸烟史、甲状腺眼病、甲状腺肿、白细胞、中性粒细胞、谷草转氨酶(AST)、碱性磷酸酶(ALP)等差异均无统计学意义(P<0.05),见表1。
表1 两组临床资料比较[±s,M(P25,P75),n(%)]Tab 1 Comparison of clinical data between two groups[±s,M(P25,P75),n(%)]
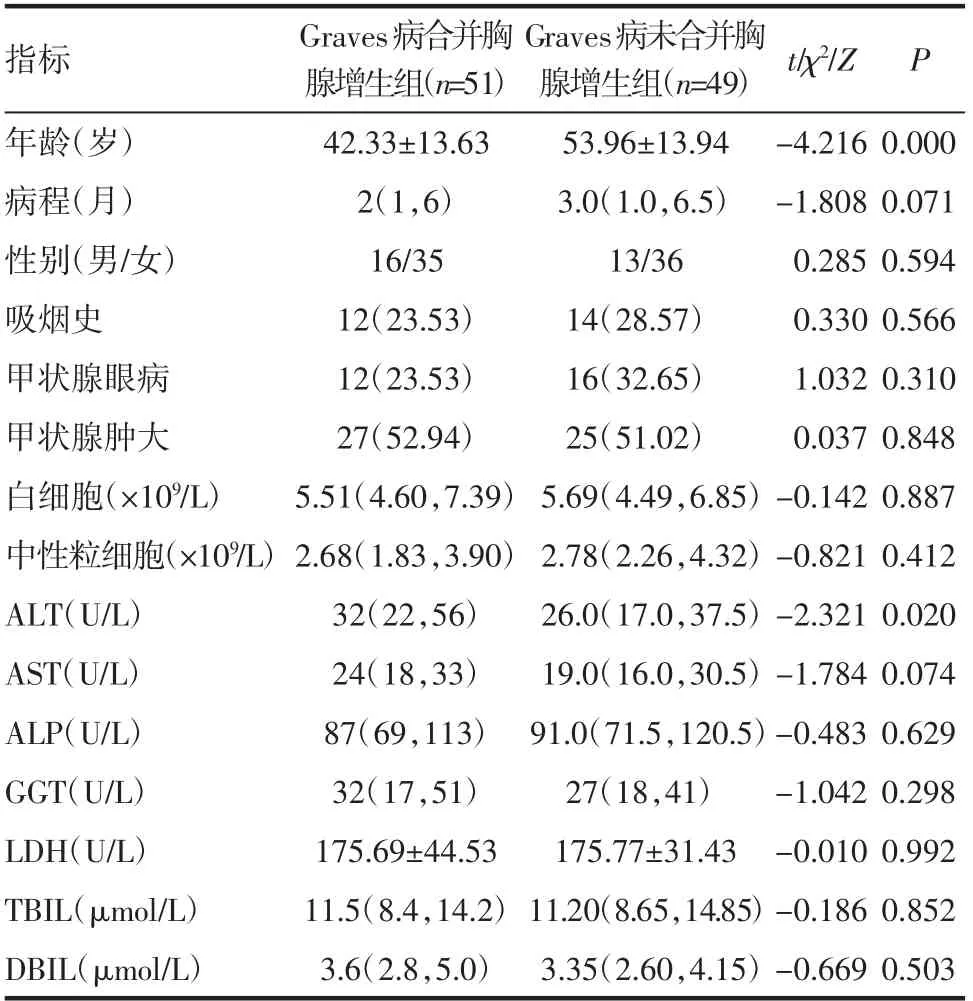
表1 两组临床资料比较[±s,M(P25,P75),n(%)]Tab 1 Comparison of clinical data between two groups[±s,M(P25,P75),n(%)]
注:ALT:谷丙转氨酶;AST:谷草转氨酶;ALP:碱性磷酸酶;GGT:γ-谷氨酰转肽酶;LDH:乳酸脱氢酶;TBIL:总胆红素;DBIL:直接胆红素
指标 Graves病合并胸腺增生组(n=51)Graves病未合并胸腺增生组(n=49) t/χ2/Z P年龄(岁) 42.33±13.63 53.96±13.94 -4.216 0.000病程(月) 2(1,6) 3.0(1.0,6.5) -1.808 0.071性别(男/女) 16/35 13/36 0.285 0.594吸烟史 12(23.53) 14(28.57) 0.330 0.566甲状腺眼病 12(23.53) 16(32.65) 1.032 0.310甲状腺肿大 27(52.94) 25(51.02) 0.037 0.848白细胞(×109/L) 5.51(4.60,7.39) 5.69(4.49,6.85)-0.142 0.887中性粒细胞(×109/L)2.68(1.83,3.90) 2.78(2.26,4.32)-0.821 0.412 ALT(U/L) 32(22,56) 26.0(17.0,37.5)-2.321 0.020 AST(U/L) 24(18,33) 19.0(16.0,30.5)-1.784 0.074 ALP(U/L) 87(69,113) 91.0(71.5,120.5)-0.483 0.629 GGT(U/L) 32(17,51) 27(18,41) -1.042 0.298 LDH(U/L) 175.69±44.53 175.77±31.43 -0.010 0.992 TBIL(μmol/L) 11.5(8.4,14.2)11.20(8.65,14.85)-0.186 0.852 DBIL(μmol/L) 3.6(2.8,5.0) 3.35(2.60,4.15)-0.669 0.503
2.2 游离甲功及相关抗体比较 Graves 病合并胸腺增生组FT3、FT4水平均高于Graves 病未合并胸腺增生组(P<0.05);两组促甲状腺素受体抗体(TRAb)、甲状腺过氧化物酶抗体(TPOAb)、甲状腺球蛋白抗体(TGAb)水平差异均无统计学意义(均P<0.05),见表2。
表2 两组游离甲状腺功能及甲状腺相关抗体比较[±s,M(P25,P75)]Tab 2 Comparison of free thyroid function and thyroid related antibodies between two groups[±s,M(P25,P75)]
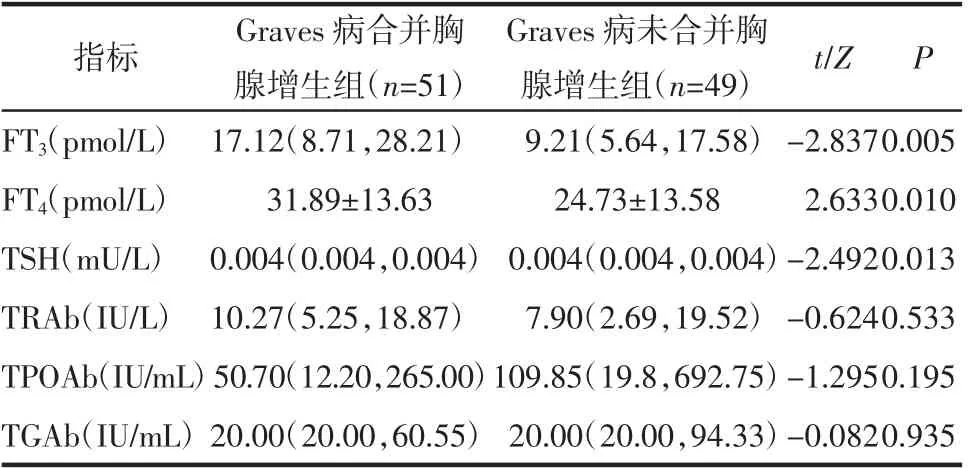
表2 两组游离甲状腺功能及甲状腺相关抗体比较[±s,M(P25,P75)]Tab 2 Comparison of free thyroid function and thyroid related antibodies between two groups[±s,M(P25,P75)]
注:TSH:促甲状腺激素;TRAb:促甲状腺素受体抗体;TPOAb:甲状腺过氧化物酶抗体;TGAb:甲状腺球蛋白抗体
指标 Graves 病合并胸腺增生组(n=51)Graves 病未合并胸腺增生组(n=49) t/Z P FT3(pmol/L) 17.12(8.71,28.21) 9.21(5.64,17.58) -2.8370.005 FT4(pmol/L) 31.89±13.63 24.73±13.58 2.6330.010 TSH(mU/L) 0.004(0.004,0.004) 0.004(0.004,0.004)-2.4920.013 TRAb(IU/L) 10.27(5.25,18.87) 7.90(2.69,19.52) -0.6240.533 TPOAb(IU/mL)50.70(12.20,265.00)109.85(19.8,692.75)-1.2950.195 TGAb(IU/mL)20.00(20.00,60.55) 20.00(20.00,94.33)-0.0820.935
2.3 影响Graves 病合并胸腺增生的相关因素回归分析 以Graves 病合并胸腺增生为因变量,对表1、2 中存在显著差异的危险因素进行单因素Logistic 回归分析,结果显示,年龄、FT3、FT4均与Graves病合并胸腺增生相关(P<0.05),见表3。
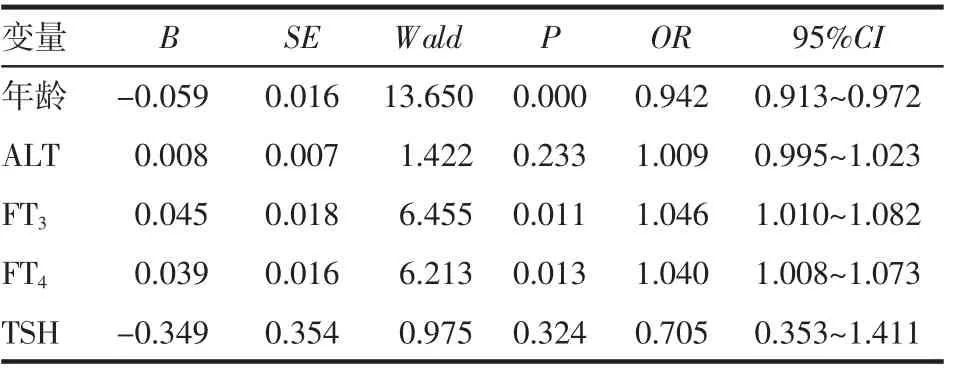
表3 评估Graves 病合并胸腺增生单因素Logistic 回归分析Tab 3 Univariate Logistic regression analysis for evaluating the Graves'disease with thymic hyperplasia
2.4 多因素Logistic 回归分析 以Graves 病合并胸腺增生为因变量,以上述单因素Logistic 回归分析中具有统计学意义指标的年龄、FT3、FT4、TSH 为自变量,进行多因素Logistic 回归分析,结果显示,回归模型中发病年龄是评价Graves 病合并胸腺增生的独立危险因素(P<0.05),见表4。
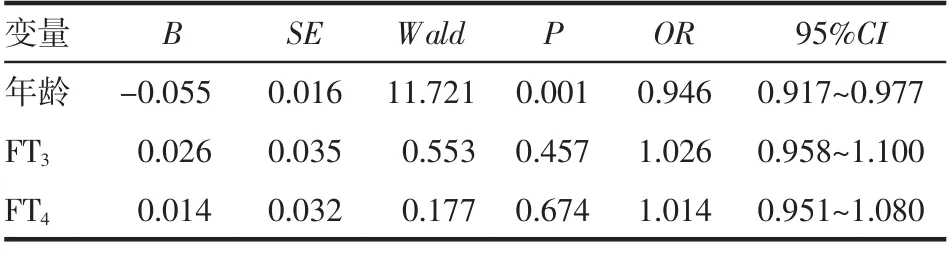
表4 评估Graves 病合并胸腺增生多因素Logistic 回归分析Tab 4 Multivariate Logistic regression analysis for evaluating the Graves'disease with thymic hyperplasia
2.5 分析年龄对Graves 病合并胸腺增生的预测价值 以灵敏度为纵坐标,(1-特异度)为横坐标,绘制ROC 曲线,年龄预测胸腺增生的AUC 为0.734,95%CI:0.632~0.836,年龄截断值为48.5 岁,灵敏度72.5%,特异度75.5%,约登指数0.480,见图1。
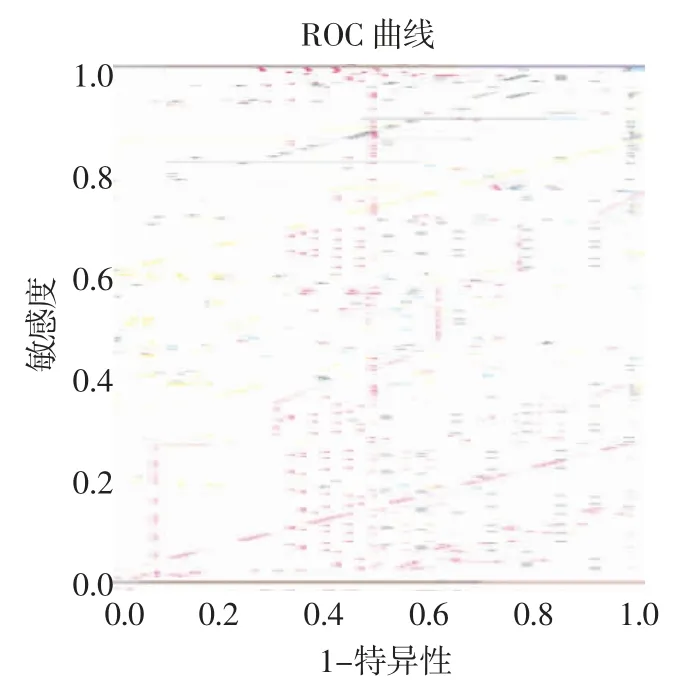
图1 年龄预测胸腺增生的ROC 曲线Fig 1 ROC curve of age of onset in predicting of Graves' disease with thymic hyperplasia
3 讨论
Graves 病合并胸腺增生最早于1912 年被报道,1964 年Gunn 等[4]发现,胸腺髓质淋巴滤泡和Graves 病之间具有重要联系。胸腺是人体内重要的免疫器官,也是T 细胞发育成熟的主要部位,与自身免疫耐受密切相关。当胸腺发生病理改变,如胸腺增生和胸腺瘤时可破坏自身免疫耐受,导致自身免疫性疾病的发生。胸腺增生与淋巴样增生有关,常合并自身免疫性疾病[5],可能与胸腺蛋白(一种导致T 细胞分化和增殖的胸腺激素)的升高有关[6]。由于胸腺在人类自身免疫耐受的发生中具有核心作用,因此有学者假定胸腺异常可能先于Graves 病的发生,并在Graves 病的发生、发展中起一定作用[7]。但Van Herle 等[8]发现与重症肌无力不同的是切除胸腺并不能改善甲亢症状。因此推测Graves 病患者的胸腺增生更有可能是Graves 病的结果,而不是原因。胸腺增生似乎是甲亢所致;然而,尚不清楚是自身免疫还是甲状腺激素本身起了更大的作用。
1996 年Murakami 等[9]从分子生物学水平、蛋白质水平证实,胸腺细胞膜上存在着与甲状腺细胞膜上相同的TRAb,并提示胸腺TRAb 可能作为自身抗原参与Graves 病发生、发展过程,而且在胸腺增生乃至胸腺瘤的发生中起一定作用。Giménez-Barcons等[10]证实在成熟胸腺细胞中表达功能性TSH 受体,并且发现甲状腺刺激性抗体(TSAb)可以通过TSH受体刺激胸腺细胞增殖。Villa-Verde 等[11]证实,胸腺上皮细胞中表达功能性T3受体,并且T3对胸腺生理具有多效性效应,还可间接刺激胸腺细胞分化。但是Graves 病合并胸腺增生的机制目前仍未彻底阐明。
本研究结果显示,Graves 病合并胸腺增生的发生率为51%,而相关研究报道38%的Graves 病患者具有组织学胸腺异常[2],这与本研究结果有所不同,分析可能与本研究样本量较小有关。与未合并胸腺增生组相比,合并胸腺增生组发病年龄较小,FT3、FT4水平较高(均P<0.05);但在性别、病程、是否伴有甲状腺肿大、甲状腺眼病、肝功能异常、粒细胞减少、TRAb、TPOAb、TGAb 方面,差异均无统计学意义差异(均P<0.05),这与张颖辉等[12]研究结果相似。Logistic 逐步回归分析显示,Graves 病患者是否伴胸腺增生与发病年龄呈负相关性(P<0.05)。Jinguji 等[5]发现Graves 病患者胸腺密度和年龄呈显著负相关,与本研究结果一致。ROC 曲线提示胸腺增生年龄截断值为48.5 岁,灵敏度72.5%,特异度75.5%,目前尚无相关研究。因TSH 检测低值为0.04,且大部分患者TSH 检测结果为小于0.04,进行统计分析时均以0.04 计算,故可能影响统计结果,故Graves 病伴胸腺增生组与不伴胸腺增生组TSH 差异尚不明确。
DallaCosta等[13]报道了107例胸腺增生合并Graves病,其中只有4 例为恶性。Jinguji 等[5]发现Graves 病患者在接受131I 治疗后胸腺体积和密度降低,且胸腺体积下降率和TRAb 变化率之间没有显著相关性。Graves 病患者发生胸腺增生的机制尚不清楚,但上述研究证实Graves 病患者合并胸腺增生时绝大多数为良性病变,且给予抗甲状腺药物或放射性碘治疗会导致胸腺退化,建议在控制甲亢后6 个月复查胸部CT[14]。因此,尽管目前微创胸腺切除技术不断提高,但对于Graves 病合并的胸腺增生并没有手术切除的必要性。
综上所述,在临床工作中对于发病年龄较小的Graves 病患者建议完善胸部CT 检查,明确有无合并胸腺增生,对合并胸腺增生的患者应首先积极治疗甲亢,待甲亢控制后再次复查胸部CT 明确胸腺变化,而不是考虑手术切除胸腺。由于本研究为样本量较小的回顾性研究,且患者选择可能存在偏差,为了进一步阐明Graves 病合并胸腺增生的机制及其治疗后的变化还需要对大样本进行进一步研究。

