黄河三角洲滨海湿地生态修复区春季土壤古菌和细菌群落结构探究
王炳臣,匡少平*,郑阳,史大磊,赵海涛,于贞贞,赵常兵,程飞
(1. 青岛科技大学环境与安全工程学院,山东 青岛 266042;2. 中国石油化工股份有限公司胜利油田分公司海洋采油厂,山东 东营 257237;3. 东营市海洋发展研究院,山东 东营 257091;4. 东营市投资促进局,山东 东营 257000;5. 潍坊市市政公用事业服务中心,山东 潍坊 261071)
黄河三角洲是中国北方最大的新生湿地,在污染物沉积、水分和温度调节方面具有重要作用[1]。河流泥沙在渤海潮间带沉积形成低潮滩盐土湿地,持续堆积促进低潮滩升高脱盐,形成的中、高潮滩逐渐被盐地碱蓬、柽柳和芦苇等植被覆盖[2],由低到高的潮滩植被变化在时间上存在生物演替过程。其中,芦苇植被定植土壤是湿地碳汇的主力,在维持土壤水分、减少水土流失、丰富动植物类型和平衡周边温度变化方面具有重要作用[3]。沉积输入的重金属也在植被演替过程中,由离子态变为络合态最终以沉淀态固定在底层,不再进入生态环境,实现了自然净化。然而,植被演替和湿地功能实现的起点来源于最初耐盐植被的定植,即盐地碱蓬在低潮滩持续生长。
低潮滩新生湿地常年受到海水侵蚀[4],阳光照射又为侵蚀海水蒸腾提供动力,加剧了盐渍化进程阻碍植被生长,破坏了土壤生态功能,促进了微生物种间竞争。盐地碱蓬作为典型滨海耐盐植被,株高约20~80 cm,可以借助体内水分进行耐盐生长[5]。其根系固定低潮滩表层土壤[6],有助于降水、潮汐与河流冲刷下的土壤脱盐。植株定植形成的阴影避免了阳光的直接照射,缓解了蒸腾效果。但低潮滩盐地碱蓬植被结构单一,土壤盐渍化程度高且抗逆性差,容易受到人为活动破坏,不易恢复。
低潮滩本身具有海水供排和交通运输便利的优势[7],是海产品养殖的重要区域。东营市永丰河口曾是极具观赏和生态价值的滨海“红地毯”——盐地碱蓬植被区[8],后开发为水产养殖区提供了丰富海产品。近年来,随着自然生态需求和养殖技术的发展,区域内水产养殖的社会经济价值逐渐降低,但碳汇、生物多样性和景观资源等生态价值逐渐增高[7],因此盐地碱蓬定植成为了该区域生态修复的主要方式。环渤海湿地研究中已经发现,盐地碱蓬可以显著提高土壤微生物多样性,在持续的脱盐和元素积累过程中,改善群落生境,提高代谢功能[9],耐盐性较低的微生物逐渐会成为优势菌群。林学政等[10]发现盐地碱蓬定植后,黄河三角洲滨海湿地中枯草杆菌(Bacillussubtilis)成为了优势菌属。Cong等[11]发现在植被定植的不同阶段,土壤总磷脂、脂肪酸含量均有所增加,影响了微生物的总量和组成。其中,植被死亡促进了土壤中有机物分解者增加,丰富了土壤中的营养物质、细菌和古菌群落[12],增加的菌群又促进了盐地碱蓬定植扩散,从而形成了正向循环改善滨海湿地生态功能。
基于此,永丰河口及其周边已纳入东营渤海污染攻坚战生态修复项目区,进行维护和养殖池清除,由承担单位在此基础上继续进行盐地碱蓬修复工作。青岛科技大学负责修复后生源要素N、细菌和古菌群落结构变化情况研究。根据样点分布和根植情况,永丰河口修复区可以分为:岸边生长区 (Shoreside Vegetation Zone, SG)、岸边高盐土未生长区 (High Saline Soil Zone Without Vegetation, HSW)、盐土生长区 (High Saline Soil Vegetation Zone, HSG)、河边未根植区 (Riverside Zone Without Vegetation, RW)、河边未生长过渡区 (Riverside Transition Zone Without Vegetation, RTW) 和河边生长区 (Riverside Vegetation Zone, RG)。其中,RG是修复的核心区域,其他区域植被可能来源于自发生长,也可能是修复后碱蓬种子脱落自发定植的结果[13]。相比RG,岸边有防潮堤为小型动物提供了生存空间[14],且人类活动和岸内植被也为动物提供了食物,因此岸边相关的SG和HSW受到更多人类活动和动物影响。
前期团队已经开展了复植分析和探究工作,但在土壤微生物和理化性质方面研究较少,所以本研究针对不同修复情况下表层土壤微生物和理化性质分析,探索植被春季萌发时表层土壤微生物的群落结构变化,分析其中的主要微生物及其功能,为加快植被修复和提高复植成功率提供数据支持。
1 材料与方法
1.1 原位土壤样品采集
根据实际修复情况,在2021年4月选择如图1所示的I-VI共6个典型样点 (SG、HSW、HSG、RW、RTW和RG) 采集原位表层土壤样品。每个样点使用无菌树脂采样器采集200 g土壤样品于无菌自封袋内混匀,并去除根茎、石块等大型颗粒,收集于6个1.5 mL和3个50 mL无菌离心管内放置在-20 ℃保温箱内,分别冻存于-80 ℃和-20 ℃冰箱内用于微生物和理化性质检测。
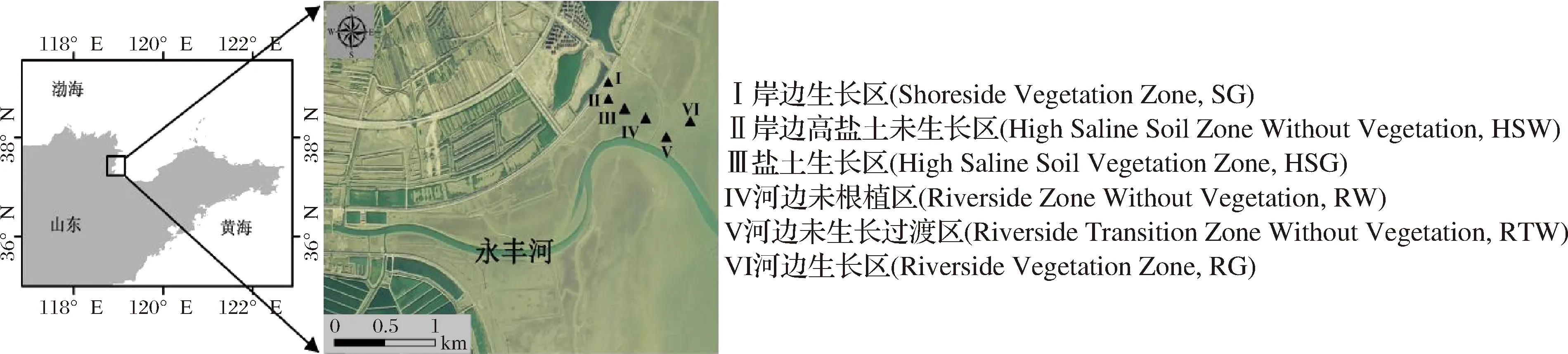
图1 采样位点图
1.2 土壤样品检测
pH和盐度检测:称取10.0 g原位样品于50 mL离心管内,按1∶3.5(m/v)添加超纯水振荡30 min,结束后离心,分别使用pH和盐度计进行检测。
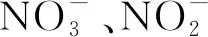
高通量检测:原位土壤样品中DNA利用FastDNATMSPIN Kit for soil试剂盒进行提取,并参照标准说明书流程操作,DNA样品送至公司进行测序。
1.3 数据分析和作图
主要使用R语言、CANOCO 4.5、SPSS 19.0和SigmaPlot 10.0等软件进行数据的分析和作图。
2 结果与分析
2.1 土壤理化性质分析
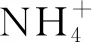
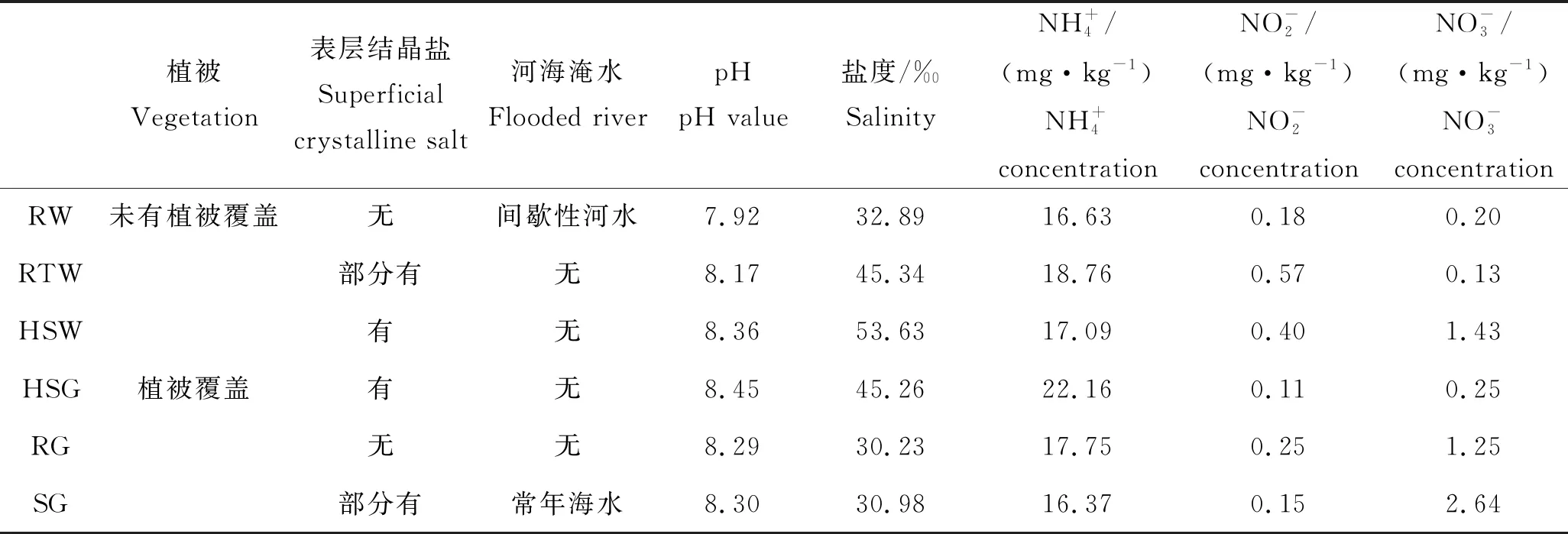
表1 样点特征与表层土壤理化性质
2.2 土壤细菌和古菌多样性
如图2所示,植被根植后表层土壤微生物群落间差异较大,RG主要以Muribaculaceae(9.37%)、Inhella(8.61%) 和Halanaerobium(8.25%) 为主,特别是Halanaerobium在其他植被覆盖的土壤样品中含量较少。SG主要以Muribaculaceae(14.81%) 和Helicobacter(8.00%) 为主,而HSG主要以Marinobacter(20.19%) 和Halomonas(7.14%) 为主。未有植被生长的表层土壤微生物群落差异较小,主要以Marinobacter(5.75%~17.91%)、Halomonas(9.01%~10.92%) 和Muribaculaceae(5.91%~10.26%) 为主,其中Marinobacter和Muribaculaceae分别在RW与HSW两个样品中占比较少。如图3所示,根植后表层土壤主要以Salinigranum(10.00%~34.17%) 和Halorubrum(12.08%~29.33%) 为主;未有植被生长的土壤主要以Halorubrum(12.54%~21.54%) 为主。其中,RW和RTW样品中的Halogranum(12.74%~26.86%) 和Halolamina(14.30%~20.25%) 相对丰度较高,但在HSW中含量较少;RTW中Salinigranum相对丰度较高为11.25%。以上结果说明,盐地碱蓬根植和覆盖情况是影响表层土壤细菌群落的重要因素,而耐盐则是滨海表层土壤中古菌的主要特征。
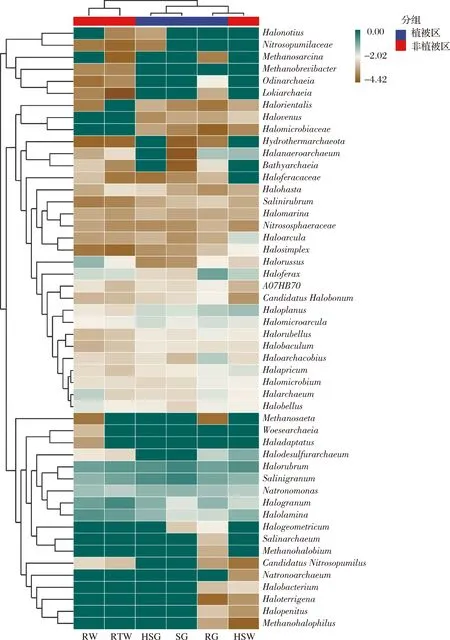
图3 古菌组成热图
2.3 土壤微生物群落分析
如图4所示,植被根植的表层土壤中微生物香农指数 (Shannon) 明显小于未有植被的土壤 (P=0.05),说明植被根植后土壤中细菌多样性和丰度有所下降。在古菌方面,两种不同根植情况的土壤表层微生物群落间Shannon (P=0.83) 和Observed species指数 (p=0.83) 差异不明显,说明低潮滩中盐分相比植被在古菌组成上更具影响力。
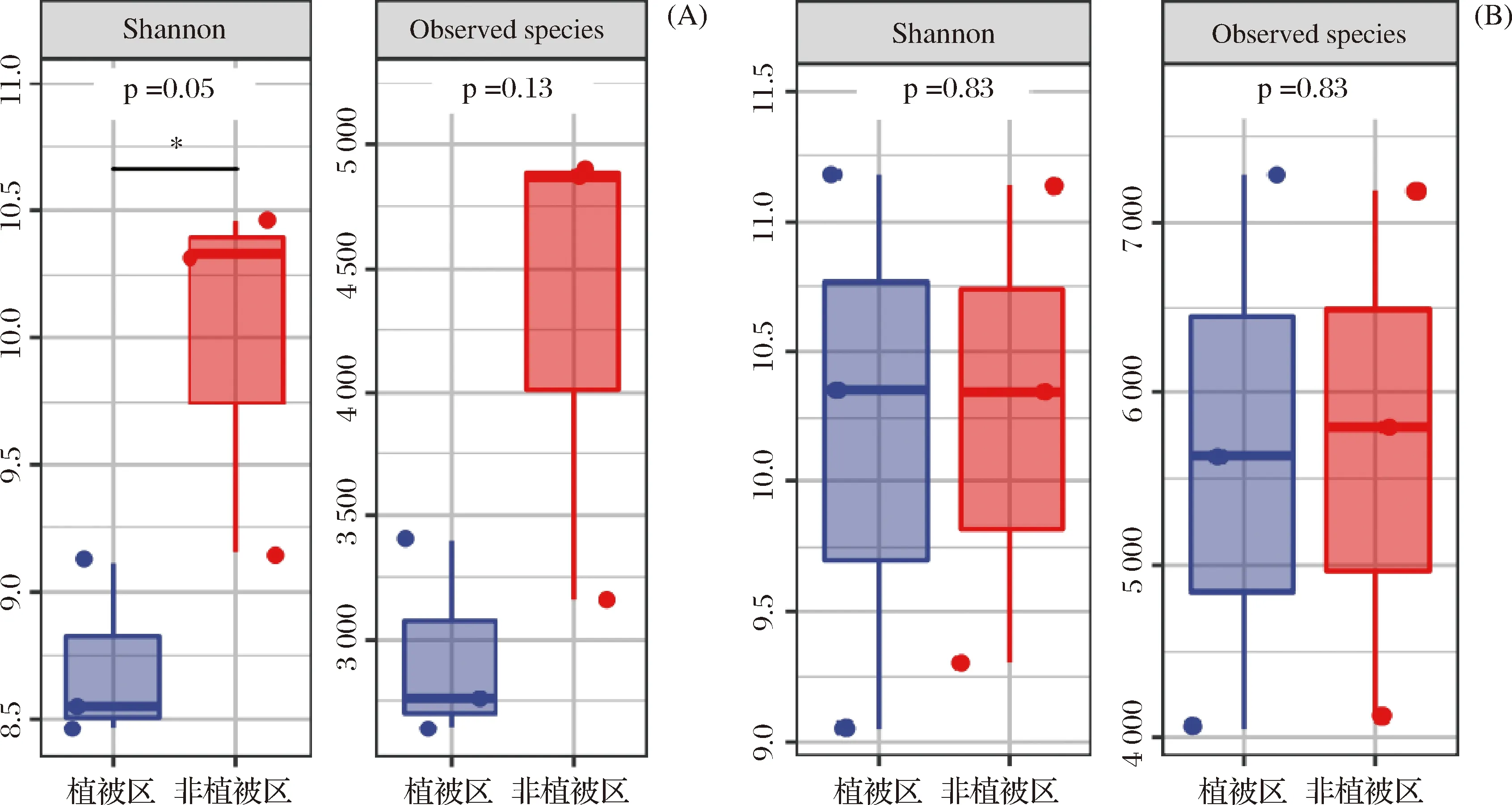
图4 细菌 (A) 和古菌 (B) 盒图
通过PCoA分析(图5),样品间细菌群落差异在第一和第二主坐标轴的总解释量为56.6%,其中样品来源导致的差异主要体现在第二主坐标轴,解释量为22.6%。样品中古菌差异总解释量为56.7%,其中样品来源差异体现在第一主坐标轴,解释量为29.5%。韦恩图分析发现(图6),不同样点间相同细菌较少仅108个OTUs,其中SG和HSG的细菌群落更为接近,未有植被生长的土壤中河流两岸RW和RTW共有796个OTUs高于其他样品间共有数量。古菌方面 (图7),不同样点共有OTU数为227,高于细菌,其中RW和RTW的共有OTU数最高为1 121,而植被生长的样点中HSG和SG共有数次之为1 157。以上结果说明,样点环境是除植被外影响微生物群落的原因之一;相比细菌,古菌更加保守且根植情况相同时相邻样点间差异更小。
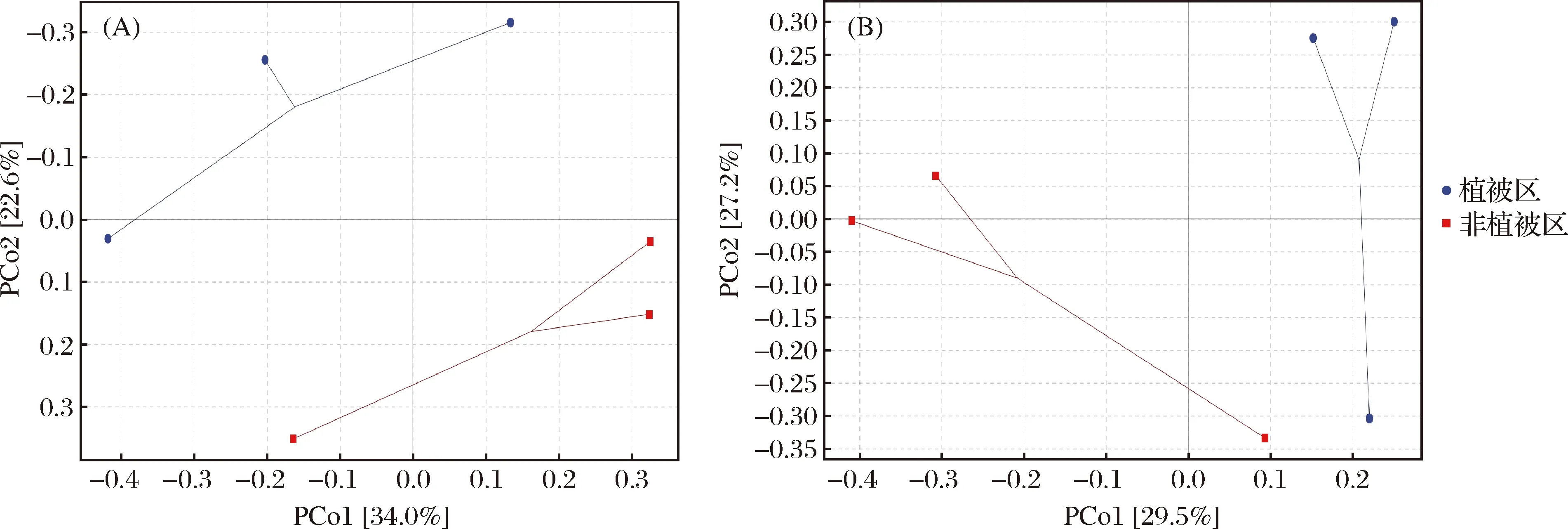
图5 细菌 (A) 和古菌 (B) PCoA分析
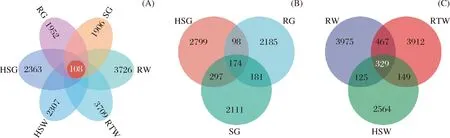
图6 总体、植被生长和非生长土壤中细菌Venn分析
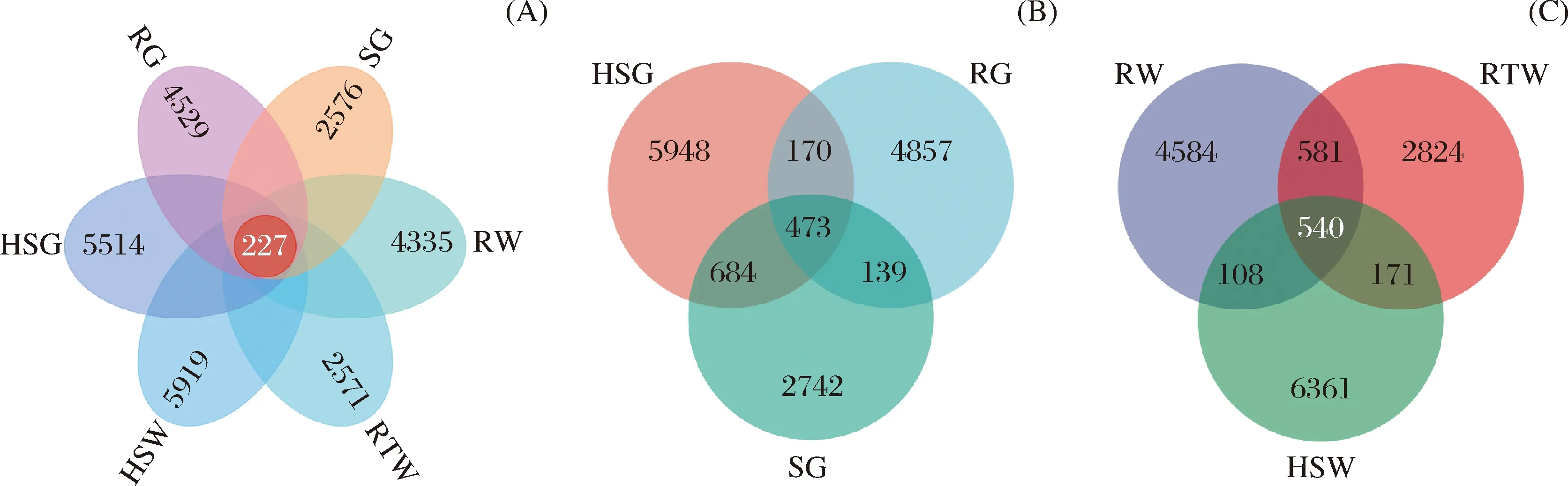
图7 总体、植被生长和非生长土壤中古菌Venn分析
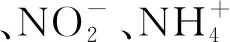
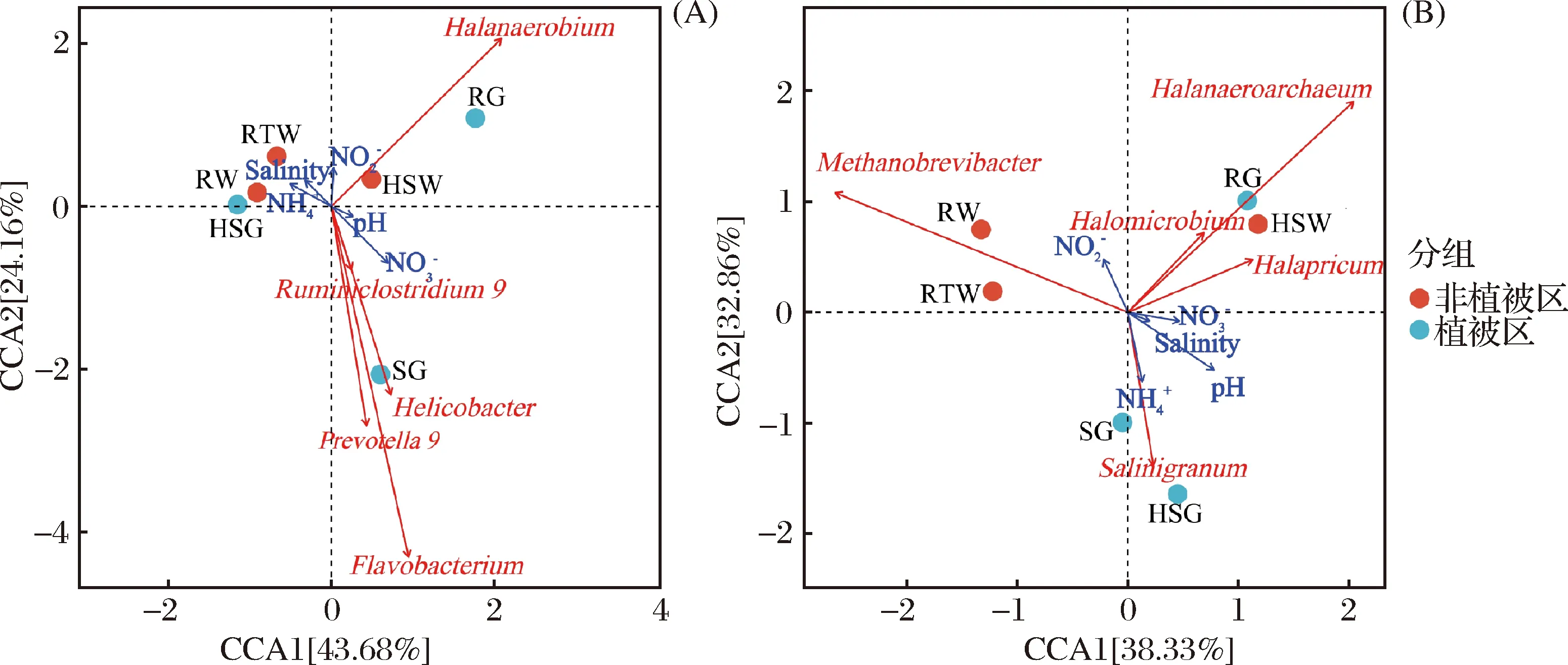
图8 细菌 (A) 和古菌 (B) 群落结构与环境因子间的典型相关分析 (CCA)
3 讨论
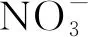
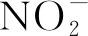
春季萌发时植被覆盖情况不同的表层土壤微生物存在差异,其中植被根植造成的细菌差异约为22.6%,而在古菌间则为29.5% (图5)[36],但细菌受到的植被影响更加显著 (p=0.05)。在植被覆盖区域包括RG、SG和HSG等3种类型,其中以HSG的土壤盐分含量最高,SG受到的人为活动影响最多且盐分也较高,RG在进行碱蓬修复种植后未受到过多人为活动影响,因此SG和HSG中共有的细菌OTU最多 (图6)[13]。在未有植被覆盖的样点中情况类似,但盐分是主导其中细菌差异的主要原因[37],除三者共有OTU外RW和RTW两个低盐土壤中共有的细菌OTU数越占10% (图7),大于两者和HSW的高盐环境所共有OTUs。古菌情况和细菌相似,其中植被的SG和HSG、非植被RW和RTW间共有OTU更多,同植被下三者间的共有OTU占比在10%左右。由此说明,细菌类型和功能更具多样性而古菌更加保守[38-39],植被根植后能够有效改变土壤功能承担者细菌的组成,盐分是影响非植被覆盖土壤细菌组成的重要因素[37]。
基于高通量结果对比了不同植被区微生物群落功能预测结果 (图9),未有植被覆盖的土壤中大肠杆菌素 (PWY0-1338,P<0.001) 和多粘菌素抗性 (ENTBACSYN-PWY,P<0.05) 合成,烟酸 (PWY-722,P<0.001) 与糖降解 (PWY-6713,P<0.001) 以及分支酸 (ALL-CHORISMATE-PWY,P<0.001) 和L-苏氨酸代谢 (THREOCAT-PWY,P<0.001) 的相关功能出现上调。相比之下,植被覆盖的表层土壤中,硫氧化 (PWY-5304,P<0.05)、1,2-丙二醇降解 (PWY-7013,P<0.05) 和抗病毒的噻唑合成 (PWY-6891,P<0.01) 方面出现上调,说明植被根植为表层土壤微生物提供了充足的有机质,促进了物质循环和能量流动改善了微生物生态[36,40];未有植被覆盖的情况下各微生物间仍存在竞争关系,其降解和代谢活动更加频繁但并未表现在元素循环等功能方面。

图9 植被覆盖和未覆盖的表层土壤中微生物功能预测差异图
4 结论
盐地碱蓬修复后为土壤微生物功能多样化修复提供了保障,营养盐、人类和动物活动在一定程度上影响着土壤微生物群落结构,细菌相比古菌群落具有更丰富的功能和多样性。未有植被覆盖的情况下表层微生物以竞争为主,因而在污染物降解和抗菌素开发方面具有较好的潜力。本研究仅为春季土壤,整个生长季中微生物和植被变化也值得进一步探索,微生物的生态功能、物质循环和能量代谢也值得深入挖掘,为下一步筛选优势抗逆性促生菌种提供更全面的数据支持。

