超高效液相色谱串联质谱法测定豆芽中的 尿素含量
吴基任,梁凤雅,林 青,杨兹伟,魏 静,梁晓涵
(海南省食品检验检测中心,国家市场监管重点实验室(热带果蔬质量与安全),海南海口 570314)
豆芽,也称豆芽菜,又名芽心、大豆芽、如意菜等,被誉为“活体蔬菜”。豆芽容易消化,中医理论认为豆芽具有清热解毒、健脾养肝的作用。豆芽含有丰富的钙、铁、钾、锌等微量元素及多种维生素、纤维素,适量食用可以预防口角发炎、便秘。豆芽一般采用水浸泡发芽、无土栽培。但是无良商贩在豆芽生产的过程中常施用尿素,以提升豆芽产量及缩短生产周期[1]。人如果长期食用含有大量尿素的豆芽,会在体内生成亚硝酸盐,可能增加人体患癌的可能性[2]。上述栽培方法不可避免地会产生尿素残留物,但没有引起注意,因为人们更多地关注豆芽上的植物生长调节剂(6-苄基腺嘌呤和4-氯苯氧乙酸)残留[3]。
尿素是一种高水溶性的有机化合物,具有低急性毒性,半数致死量(LD50)为15 g·kg-1。尿素进入人体后会刺激胃肠道,引起恶心、呕吐和腹泻,长期或反复摄入尿素可能导致不良生殖影响和目标器官损伤。此外,尿素溶于水中时产生的氨分子是一种具有高度刺激性和毒性的分子,大鼠的半数致死量(LD50)为350 mg·kg-1。尿素的分子结构没有明显的发色团和荧光团,因此目前测定尿素的分析方法需要进行衍生,否则很难克服来自复杂基质的干扰[4-5]。由于尿素是极性分子,在反相色谱中与样品基质中其他极性化合物的分离分辨率较低[6],而在质谱检测中也不可避免地存在较强的基质干扰或离子抑制[7]。研究表明,亲水相互作用色谱法在极性化合物的分离中具有较高的分辨率[8-9],为尿素反相色谱测定中遇到的问题提供了解决方案。因此,本文研究了亲水相互作用色谱-质谱法测定尿素的可行性,并将该方法应用于测定豆芽中的尿素含量。
1 材料与方法
1.1 样品
样品分为两部分:一部分为自培,共16 批;另一部分样品为课题组从农贸市场购买的豆芽,共16批。所有的样品在采收或购买当天均按照GB 2763—2021 的规定进行取样,取得的样品将其切碎,置于组织捣碎机内捣碎匀浆,放入聚四氟乙烯瓶中,于 -18 ℃条件下保存直至测定。
1.2 仪器与试剂
Nexera X2 超高效液相(日本岛津公司);TRIPLE QTRAP 5500 三 重 四 极 杆 质 谱 仪( 美 国SCIEX 公司);MS 3 digital 振荡器(德国艾卡公司);Centrifuge 5804R 高速离心机(德国艾本德公司);DTA-33 超声波提取器(湖北鼎泰恒胜公司);Autovap S60 氮吹仪(美国ATR 公司);XS-204 电子分析天平(瑞士梅特勒-托利多公司);Simpliclty超纯水制备仪(美国密理博公司);陶瓷均质子(上海安谱科学仪器有限公司);ACQUITY UPLC BEH Amide 色谱柱(100 mm×2.1 mm,1.7 μm),美国沃特斯公司);0.22 μm 聚四氟乙烯微孔滤膜(天津领航实验设备有限公司)。
甲醇、乙腈、甲酸(色谱纯,美国赛默飞世尔科技公司);甲酸铵(色谱纯,上海阿拉丁生化科技股份有限公司);尿素标准品(广州佳途科技有限公司)。
1.3 方法
1.3.1 标准溶液的配制
尿素标准贮备溶液:准确称取50 mg(精确到 0.1 mg)尿素标准品,加7.5 mL 去离子水溶解,用乙腈定容至50 mL,配制成1 mg·mL-1的尿素标准储备液,转移到50 mL 棕色螺纹瓶,密封存贮于 -20 ℃冰箱中。
尿素标准工作液:准确移取适量尿素标准储备液,用乙腈-水(85 ∶15,V/V)溶液配制成1 mg·mL-1的标准工作液。
1.3.2 样品处理
准确称取2 g(精确至0.001 g)样品于50 mL的具塞聚四氟乙烯离心管中,加入20 mL 乙腈-水(85 ∶15,V/V),2 粒陶瓷均质子,超声处理 5 min。在10 000 r·min-1下离心5 min,移取上清液至50 mL 容量瓶中,残渣再次加入20 mL 乙腈-水(85 ∶15,V/V)重复提取一遍,合并上清液,最后用乙腈-水(85 ∶15,V/V)定容混匀,过0.22 μm 尼龙滤膜,上LC-MS/MS 测定。
1.3.3 尿素标准曲线配制
使用1.3.2 处理方法获得空白基质液,将尿素标准工作液配制成系列基质标准曲线。
1.3.4 仪器分析条件
(1)色谱条件。色谱柱:ACQUITY UPLC BEH Amide(100 mm×2.1 mm,1.7 μm);流动相:乙腈 -0.5% 甲酸铵水溶液(85 ∶15,V/V),等度洗脱;流速:0.3 mL·min-1;柱温:40 ℃;进样量:5 μL。
(2)质谱条件。离子源:电喷雾离子(Electrospray Ionization,ESI)源;扫描模式:正离子扫描,多反应监测模式(Multiple Reaction Monitoring,MRM);碰撞气:氮气;电喷雾电压:4.0 kV;离子源温度:300 ℃; 雾化 气(Nebulizer Gas,GS1):50 psi; 加热 气(Heating Gas,GS2): 50 psi;气帘气(Curtain Gas,CUR):20 psi;碰撞室入口电压(Entrance Potential,EP):10 V;碰撞室出口电压(Collision Cell Exit Potential,CXP): 16 V;优化后的MRM 参数见表1。

表1 质谱参数
2 结果与分析
2.1 液相、质谱条件优化
由于尿素是一种高极性的有机分子,它在经典反相柱上的保留效果很差,无法与基质峰进行有效的分离。在方法开发过程中,对Waters ACQUITY UPLC BEH C18(100 mm×2.1 mm, 1.7 μm)、ACE Excel 3 C18(100 mm×2.1 mm,3 μm)和Phenomenex Kinetex XB-C18(100 mm×2.1 mm, 1.7 μm)等反相柱进行了测试;在所有被测试的反相柱上都观察到了强烈的离子抑制和基质效应,这归因于极性化合物的过早洗脱。最后,为了更好地保留被分析物以达到预期的分离效果,以ACQUITY UPLC BEH Amide(2.1 mm×100 mm,1.7 μm)色 谱柱(氨基色谱柱),乙腈-0.5%甲酸铵水为流动相的亲水相互作用色谱被成功地应用于目标化合物的分析。采用乙腈-0.5%甲酸铵水(85 ∶15,V/V)为流动相,尿素的保留时间为2.01 min,每个样品的运行时间在5 min 以内。
评估了在正负离子扫描模式下使用电喷雾电离(ESI)的可能性,结果表明,ESI 在正离子扫描模式下可以为分析物提供更高的MS 响应灵敏度和稳定性,从而提高了分析的性能。因此,本研究选择了ESI 正离子模式。
2.2 方法特异性研究
通过对不同来源(自培、外购)豆芽样品的分析,确定了该方法的特异性,以评估可能的基质干扰。对样品前处理和仪器色谱条件进行了优化,以保证尿素保留时间不受干扰。结果表明,分析物的保留时间没有受到干扰,见图1。
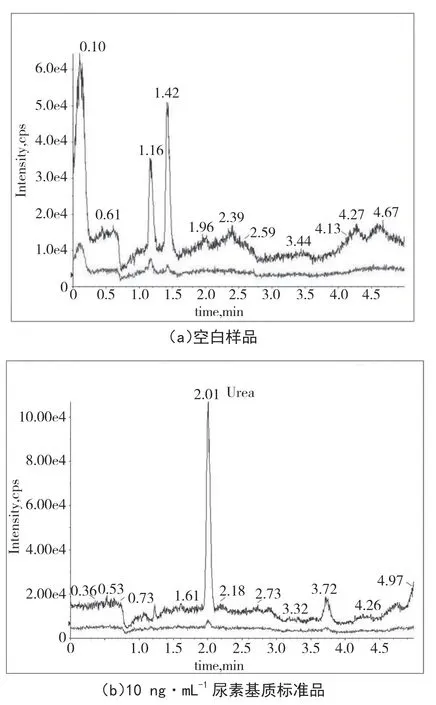
图1 样品MRM 质谱图
2.3 线性范围、检出限、定量限、精密度
按1.3.4 的工作条件,对基质匹配标准曲线(10 ng·mL-1、25 ng·mL-1、50 ng·mL-1、100 ng·mL-1、200 ng·mL-1、500 ng·mL-1和1 000 ng·mL-1)进 行 测定,以定量离子峰的峰面积为纵坐标,对应的标准曲线点质量浓度(ng·mL-1)为横坐标绘制标准曲线,校正方程为y=480.078 2x-9 826.133 08,回归相关系数r>0.998。通过对空白基质连续添加标准品进行测定,直到定量离子m/z=44.1 的SIM 峰值的信噪比达到3 ∶1 及10 ∶1 来确定方法的检出限和定量限。方法的检出限为0.1 mg·kg-1,定量限为0.3 mg·kg-1。《出口罐头食品中尿素残留量的测定》(SN/T 1004—2013)[10]规定尿素定量限为1 mg·kg-1,本方法的定量限低于行业标准方法。用质量浓度为20 ng·mL-1的标准工作液,进行重复测定6 次,该方法的RSD(n=6)为3.4%。实验表明本方法的线性、重复性、检出限满足《实验室质量控制规范 食品理化检测》(GB/T 27404—2008)[11]的相关要求。
2.4 回收率实验
将适量尿素标准工作溶液添加到空白样品,进行1 mg·kg-1、5 mg·kg-1、10 mg·kg-13 个 水 平(n=6)加标回收试验,平均回收率为86.1%~97.1%,方法的相对标准偏差为2.6%~6.5%,结果表明方法具有较高的精密度及重现性。
2.5 样品测定
通过该方法对自培及农贸采购的32 批豆芽菜样品进行测定分析,结果见表2。从表2 中可以看出所有样品均有检出尿素,使用SPSS 对自主栽培及农贸采购的豆芽样品中尿素的测定结果进行单因素方差分析,发现自培及农贸采购两组样品之间的尿素含量没有显著性差异(P=0.664)。
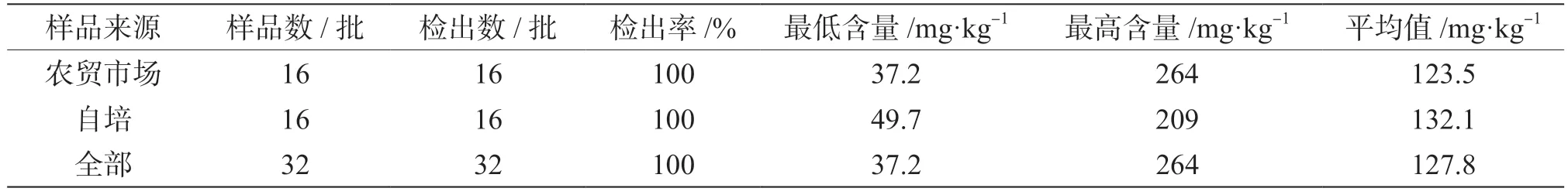
表2 两组样品中尿素的检测结果
3 结论
本研究通过优化样品提取净化条件和分离条件,建立了UPLC-MS/MS 法测定豆芽中尿素的方法。该方法前处理简单,具有较好的准确度和灵敏性,定量限优于现行有效的行业标准。运用该方法对自培、农贸市场豆芽样品进行测定,结果显示所有的样品均有检出尿素,经方差分析,自培及农贸采购两组样品之间的尿素含量没有显著性差异(P=0.664)。豆芽中的尿素有可能与豆芽生长发育过程中的内源性蛋白质代谢有关[12],这有待进一步的研究以确定豆芽中尿素含量的本底值,为豆芽生产监管提供科学的依据。

