MALDI质谱成像的实验教学设计
王珊珊, 王英辉
(长安大学理学院,西安 710064)
0 引 言
质谱(Mass spectrometry,MS)作为一种独特的分析技术,自身具有跨学科的特性。近年来,随着科学技术的进步,质谱仪器和技术均实现了迅猛发展,特别是随着电喷雾离子化及基质辅助激光解吸离子化(Matrix assisted laser desorption ionization,MALDI)这两种软电离离子化技术的引入,质谱已成为环境学[1]、生物学[2]、医学[3]等领域不可或缺的分析工具。
1997年,范德堡大学的Richard Caprioli教授等[4]所提出MALDI质谱成像(mass spectrometry imaging,MSI)技术,更是打开了质谱用于复杂生物样本原位分析的大门。MALDI MSI在经历了20多年的发展和改进后,相关的仪器技术和样品前处理方法已经较为成熟,可以应用于高校实验教学中。
其中MALDI MS的实验教学工作已经在一些高校中开展,且相关的实验教学设计已经被报道[5-9],但在MALDI MS基础上衍生出的MALDI MSI技术的实验教学设计并未见相关报道。这主要由于MALDI MSI实验过程相比于MALDI MS实验过程更为复杂,操作繁琐耗时。MALDI MSI实验通常包括样本冷冻切片,样本切片后的真空脱水,组织染色比对,成像基质的涂覆和成像数据采集及最后的成像数据处理这些复杂的过程[10-11]。一次完整的MALDI MSI实验通常需耗时12 h,导致其难以在高校实验教学中开展。本实验教学设计通过使用磷脂标准品代替复杂的切片样本,以免去繁琐耗时的组织收集和处理过程,大大简化了样本前处理步骤,缩短了实验时间和简化了操作步骤,使其可以应用于高校教学中。值得注意的是,本实验中虽然简化了样本前处理步骤,但是MALDI MSI中最为主要的实验操作步骤和数据处理过程仍囊括其中。学生通过该实验不仅可以掌握MALDI MSI的实验原理和仪器操作方法,还可以学习到MALDI MSI相关的数据处理和结果呈现方法。这些对于学生们后续的科学研究具有很好的指导意义,有助于培养学生的实践创新能力,使学生了解前沿的分子成像技术,拓宽其科研视野,让高校的大型仪器更好地服务于师生的科研和教学工作。
1 实验原理
MALDI MSI是在MALDI MS基础上发展出的一种新型分子原位成像技术,它的主要原理(见图1)是先将切片后样本贴附于氧化铟锡(Indium tin oxide,ITO)导电玻片上,在基质涂覆后送入MALDI质谱仪中进行质谱图的采集。在质谱图采集之前需要设定坐标参数,将样本网格化为多个像素点的集合,然后在目标分析物所在的质量区间内对每个像素点进行质谱图的采集。质谱图采集过程与MALDI MS实验过程类似,样本每个点中的化合物在激光照射下分别进行解吸和离子化,进而获得每个像素点对应的质谱图,所有像素点中的质谱图再通过成像软件整合为一张平均质谱图。后续借助质谱成像数据处理软件可以对平均质谱图中目标分析物的相关峰进行提取和整合,整合后得到的目标分析物相对峰强度和色彩强度相对应后,便可得到不同目标分析物在样本上的相对含量分布图。MALDI MSI实验得到的质谱成像图可以清晰直观地反映出不同化合物在样本中的相对含量分布,且一次实验可以同时得到多个化合物分子在样本中的相对含量分布。
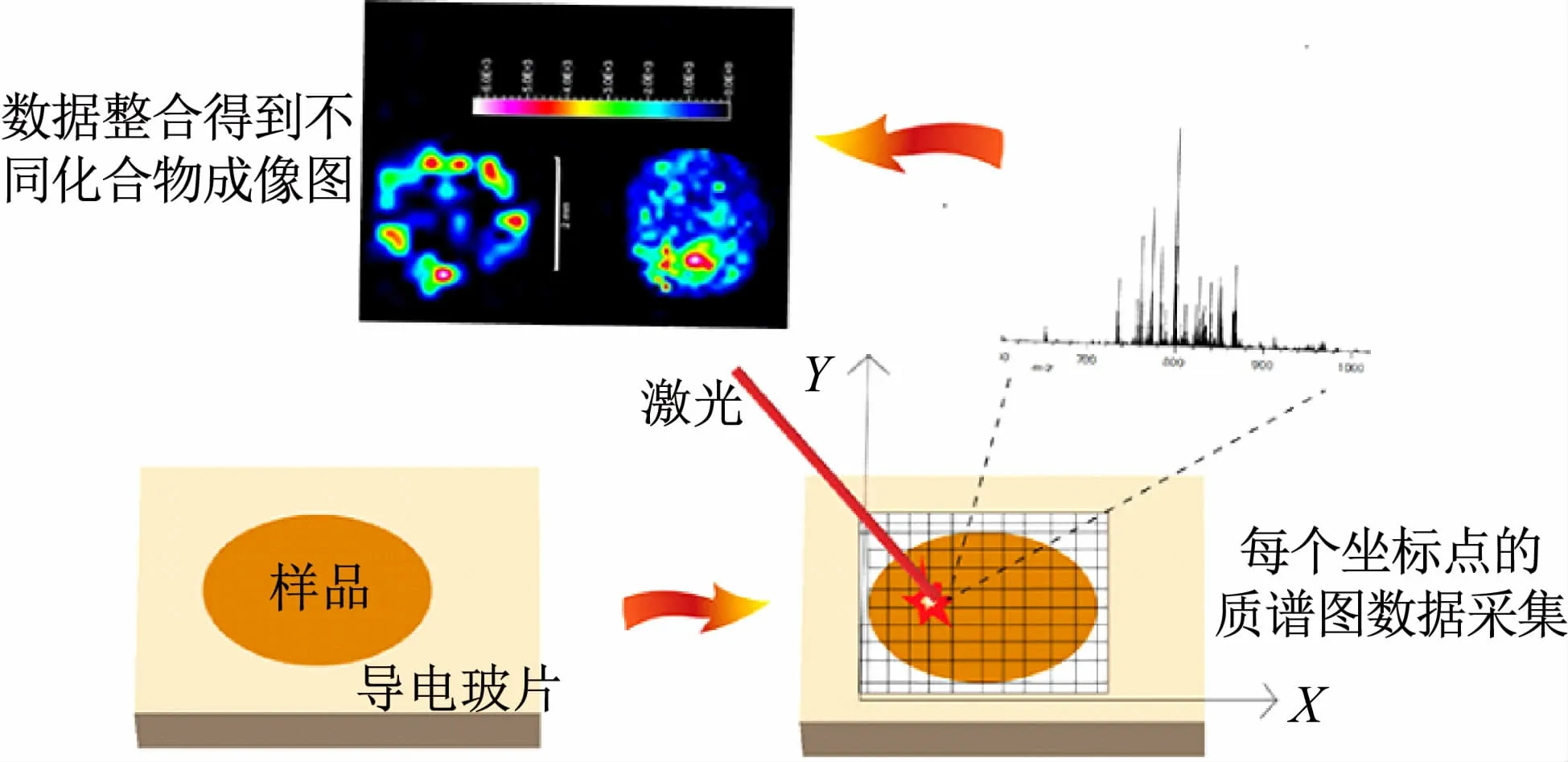
图1 MALDI MSI实验原理图
2 仪器与试剂
日本电子MALDI Spiral TOF-TOF质谱仪(JMSS3000,JEOL Ltd.,Akishima,Japan)用于MALDI MSI实验,布鲁克.道尔顿公司(Bruker.Daltonics,Bremen,Germany)ImagePrep基质喷雾仪用于基质的沉降。乙腈、甲醇均为色谱纯溶剂,购自默克Merck(Darmstadt,Germany)。2,5-二羟基苯甲酸(2,5-dihydroxybenzoic acid,DHB)、磷脂标准品PC(32:1)、PC(34:1)和三氟乙酸均购自Sigma-Aldrich(St.Louis,MO USA)。Direct-Q去离子水(Milford,MA,USA),18 MΩ.cm。其他试剂均为分析纯,未经过进一步纯化。
3 实验流程
图2所示为MALDI MSI实验流程示意图。

图2 MALDI MSI实验流程图
实验主要包括以下4个步骤:
(1)成像样本制备。本实验选择两个磷脂标准品PC(32∶1)与PC(34∶1)作为目标分析物,标准溶液采用甲醇和水作为溶剂,甲醇和水的体积比为1∶1,使用石英毛细管吸取磷脂标准溶液,分5次叠加点在ITO导电玻片上,样品点的大小在2 mm左右,并在样品点旁边点上外标物用于仪器校准,然后将包含磷脂样品点的ITO导电玻片用于后续的MALDI MSI实验数据采集和分析。实验中使用标准品的样品点代替生物组织样本,可以简化组织的采集和冷冻切片过程,且样品点直径可控制在2 mm左右,使得谱图采集时间较短,极大地节约了质谱成像实验时间。
(2)基质溶液配制和基质的涂覆。实验使用DHB作为基质,用体积比为80:20:0.1的甲醇、水和三氟乙酸的混合溶剂将DHB溶解,配置成7 mg/mL的溶液。基质溶液放入基质喷雾仪中采用设定好的程序进行基质的涂覆,其中基质沉积程序包括40个循环,每个循环由1 s喷涂时间、15 s孵育时间和60 s干燥时间组成。
(3)质谱成像数据采集。在数据采集前选择相应质量数的校准文件,采用外标法进行仪器校准。校准后进行采样范围的选择和参数的设定。对于MALDI MSI参数,激光重复频率为250 Hz,累积3 000 shots(轰击);为了节约实验时间,实验的空间分辨率设定为100μm。将2 mm直径的样品点送入仪器后,参数设定和数据采集可以在30 min内完成。
(4)数据处理与呈现。数据采集后生成的imzML格式文件,可使用开源的成像软件msIQuant[12]或BioMap[13]进行数据分析和处理。学生也可以自行下载这些软件后进行学习和后续的实验数据处理。实验过程可以让学生了解MALDI MSI的实验原理,后续的数据处理可以增强学生对于软件的学习能力和实践创新能力。
4 实验结果分析与讨论
4.1 标准品和基质的选择
实验中之所以选择用磷脂标准品制备MALDI MSI实验样本,主要有两个原因:①因为MALDI MSI在不同样本的脂质分子成像分析中具有广泛的应用,采用磷脂标准品作为样本可以帮助学生了解磷脂作为目标分析物时的质谱分析参数设定和研究方法,这对于学生后续科研中处理更为复杂的样本奠定基础;②因为磷脂分子中含有季铵盐端,在MALDI MSI中易于得到质谱信号,且实验中得到的结果重现性好。
在MALDI MS实验中,成像基质的选择对于实验的成功至关重要,对于磷脂化合物的成像分析,本实验中选择了文献报道较多的DHB作为基质[12-13],因为该基质是适合于磷脂化合物的成像实验,且基质的结晶较为均匀,结晶尺寸也符合成像实验标准。
4.2 成像数据的呈现与处理
采用上述实验方法得到的质谱成像平均谱图如图3所示,谱图中显示出了两个磷脂标准品PC(32:1)与PC(34:1)的质子加和峰以及DHB基质的相关峰。分子质量的不同使得两个化合物的相关峰可以清楚地被区分,另外DHB的相关峰并未在目标分析物的质量区间内产生干扰,这些都有利于后续数据的整合和处理。

图3 磷脂PC(32∶1)与PC(34∶1)的平均质谱图
数据采集后生成了imzML格式的文件,该文件可使用开源的成像软件msIQuant进行成像图的呈现。msIQuant成像软件的下载和使用在文献[12]中有详细的描述。学生在得到成像数据后可以通过参考文献进行软件下载、安装和使用。这不仅可以锻炼学生阅读和学习科研文献的能力,也可以提高学生对于复杂谱图数据的分析和处理能力。
数据通过格式转换后,使用成像软件msIQuant得到的磷脂标准品PC(32∶1)与PC(34∶1)质谱成像图如图4所示。图中标准品在约2 mm直径的样品点中的强弱分布较为清晰,样品点在边缘处浓度高、中心浓度低的现象主要由于“咖啡环效应”[16]导致,在不同区域分布不均匀也与点涂样品时的操作过程相关。
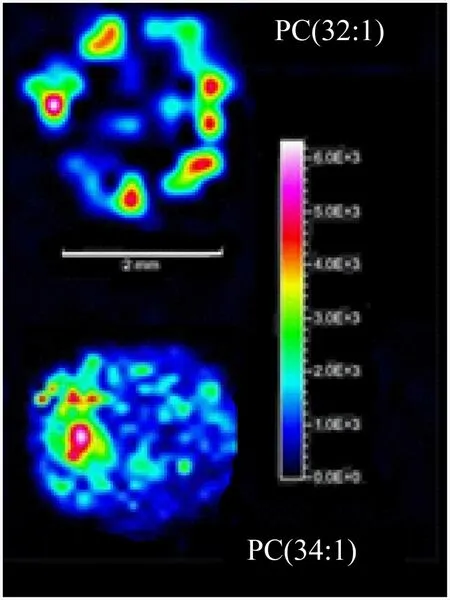
图4 磷脂PC(32∶1)与PC(34∶1)的质谱成像图
5 结 语
MALDI MSI技术由于具有可以在一次实验中同时获得多类分子的成像信息的优点,已发展为一种跨学科、应用领域广泛的新型分子原位成像技术。MALDI MSI实验包括组织病理切片、谱图采集和数据的统计处理等多个步骤,同时还涉及到复杂的样本前处理,所需实验时间过长、操作繁琐,因此难以在本科生教学实验中开展,另外质谱系统稳定性和重现性等多种问题也会影响最终的实验教学效果。本科生实验教学需要有准确的实验原理、简明的实验步骤、重现性好的实验结果和有说服力的实验意义,这样才能通过实验理论和实验操作的学习提高学生的科研创新能力,培养学生的科研思维。为了达到上述目的,本实验以标准品的样品点作为模拟样本,简化了样本前处理过程,实现了实验时间可控、实验步骤简单、实验重现性好的目标。学生通过该实验可以掌握MALDI MSI原理,熟悉质谱成像实验的步骤和大型仪器的操作方法,并学习到数据的整合和分析处理方法。

