假单胞菌腹膜透析相关性腹膜炎的临床特点与治疗转归
倪 册,杨立明,朱学研,张晓暄,周文华,谢舜昀 ,于梦园,庄小花,罗 萍,崔文鹏
1吉林大学第二医院肾病内科,长春 1300412吉林大学第一医院二部肾病内科,长春 1300313吉林市中心医院肾病内科,吉林吉林 1320114吉林省一汽总医院肾病内科,长春 130011
腹膜透析(peritoneal dialysis,PD)具有对血流动力影响小、经济、方便等优点,是一种适合终末期肾脏病患者的肾脏替代治疗方法。腹膜透析相关性腹膜炎(peritoneal dialysis-associated peritonitis,PDAP)不仅是PD常见并发症,也是导致PD患者拔管和死亡的主要原因[1]。假单胞菌腹膜透析相关性腹膜炎(Pseudomonasperitoneal dialysis-associated peritonitis,PsP)发生率不高,但预后较差,是一种严重的感染性并发症[2]。目前针对PsP的研究多为个案报道,2项较大样本的临床研究分别来自于澳大利亚[3]和我国香港地区[4]。2009年Siva等[3]报道的一项较大样本量的研究结果显示PsP预后较差,铜绿假单胞菌(Pseudomonasaeruginosa,Pae)与PsP拔管率高有关,但其研究资料及数据较为陈旧,并且未对铜绿假单胞菌PDAP(PseudomonasaeruginosaPDAP,PaeP)的治疗方案进行分析,尽管2018年Lu等[4]对PsP的治疗方案进行了探讨,但也未将PsP与非PsP的临床特点进行对比分析。本研究回顾性收集2015年至2019年吉林省4家三甲医院PD患者的临床资料,计算PsP发生率,分析PsP临床特点和影响PsP患者技术失败的危险因素,总结PaeP的治疗方案和PsP药敏情况,从而为进一步了解PsP临床特征、优化治疗方案提供依据。
对象和方法
研究对象回顾性收集2015年1月1日至2019年12月31日于吉林大学第二医院、吉林大学第一医院二部、吉林市中心医院、吉林省一汽总医院腹膜透析中心就诊的PD患者的临床资料,随访时间截至2020年1月31日。入组标准:符合2016年国际腹膜透析协会(International Society for Peritoneal Dialysis,ISPD)关于PDAP的诊断标准,至少符合以下3项中的2项:腹痛和/或腹膜透析液浑浊;透析液白细胞计数大于0.1×109/L,多形核细胞大于50%;透析液培养出致病菌[1]。排除标准:(1)临床资料不完整;(2)透析液培养出真菌;(3)透析液未培养或培养结果为阴性。本研究通过吉林大学第二医院伦理委员会审批(伦理审查编号:2020026)。
资料收集基线资料:包括年龄、性别、原发病、合并疾病、透析龄、首次PDAP的透析龄、是否伴有腹痛、PDAP史和抗生素应用史;实验室指标:血白细胞计数、血中性粒细胞计数、血中性粒细胞百分比、血红蛋白、血白蛋白以及血清钾、钠、钙、磷的水平;假单胞菌药敏情况;假单胞菌构成;初始疗效评价(有效)和总体疗效评价(治愈、复发、拔管、PDAP相关性死亡)。
相关定义(1)难治性腹膜炎:抗生素治疗5 d后,症状无改善且腹膜透析液未转清亮[1]。(2)初始治疗有效:合理抗生素治疗48~72 h内,PDAP症状明显缓解,腹膜透析液白细胞计数明显下降,不需要调整抗生素或根据培养结果调整为窄谱治疗方案[5]。(3)治愈:合理抗生素治疗2~3周,腹膜炎症状完全缓解,腹膜透析液转清,白细胞计数下降至正常水平[5]。(4)复发:上次PDAP治疗完成后4周内再次发生,致病菌相同或培养结果为阴性[1]。(5)拔管:患者治疗过程中因各种原因出现严重合并症需拔管。(6)PDAP相关性死亡:因活动性腹膜炎死亡,或因腹膜炎住院而死亡,或腹膜炎发生2周内死亡[5]。(7)技术失败:因各种原因导致PD转为长期血液透析(至少3个月)[6]。
统计学处理应用SPSS 22.0软件进行统计分析,绘图使用GraphPad软件。符合正态分布的计量资料以均数±标准差表示,组间比较采用t检验;不符合正态分布的计量资料以M(Q1,Q3)表示,组间比较采用非参数秩和检验。计数资料以率表示,组间比较采用χ2检验或校正χ2检验。PsP发生率的计算方法:一段时间内假单胞菌感染的次数除以有感染风险的透析年,用每年发生的次数来表示,复发性腹膜炎应被作为单次事件计数[1]。采用Kaplan-Meier法绘制生存曲线,Log-rank法进行显著性检验。将单因素中P<0.2或临床有意义的变量纳入多因素Cox回归模型,分析影响PsP技术失败的危险因素。P<0.05为差异有统计学意义。
结 果
一般资料共有1530例临床资料完整的PD患者,其中872例未发生PDAP,658例发生PDAP。排除透析液培养出真菌患者37例和透析液未培养或培养结果为阴性患者182例,最终纳入439例PD患者,发生664次PDAP,包括PsP 29次,非PsP 635次。PsP病原菌构成包括铜绿假单胞菌19例(65.52%),恶臭假单胞菌4例(13.79%),荧光假单胞菌2例(6.90%),浅黄假单胞菌2例(6.90%),施氏假单胞菌1例(3.45%),不明假单胞菌1例(3.45%)。其中,8例为混合致病菌感染(表1)。
PsP发生率及临床特点共随访4096.42人年,PsP发生率为0.007次/人年。将纳入的664次PDAP按致病菌分为PsP组(n=29)和非PsP组(n=635),PsP组难治性腹膜炎比例显著高于非PsP组(41.38%比19.69%,P=0.005),而两组患者年龄、性别、原发病、合并疾病、透析龄、首次PDAP的透析龄、腹痛、PDAP史、抗生素应用史及实验室指标差异无统计学意义(P均>0.05)(表2)。
PsP组与非PsP组治疗结果比较与非PsP组相比,PsP治愈率低(55.17%比80.79%,χ2=11.234,P=0.001)、拔管率高(24.14%比7.09%,χ2=8.934,P=0.003),但初始治疗有效(χ2=1.345,P=0.246)、复发(χ2=0.754,P=0.385)和PDAP相关性死亡(χ2=0.017,P=0.892)差异无统计学意义。生存曲线显示,PsP组技术生存率明显低于非PsP组(P<0.001)(图1)。
PsP技术失败的危险因素校正混杂因素透析龄、中性粒细胞计数后,多因素Cox回归分析结果显示,Pae是PsP患者发生技术失败的独立危险因素(HR=9.020,95%CI=1.141~71.279,P=0.037)。

表1 假单胞菌病原菌构成
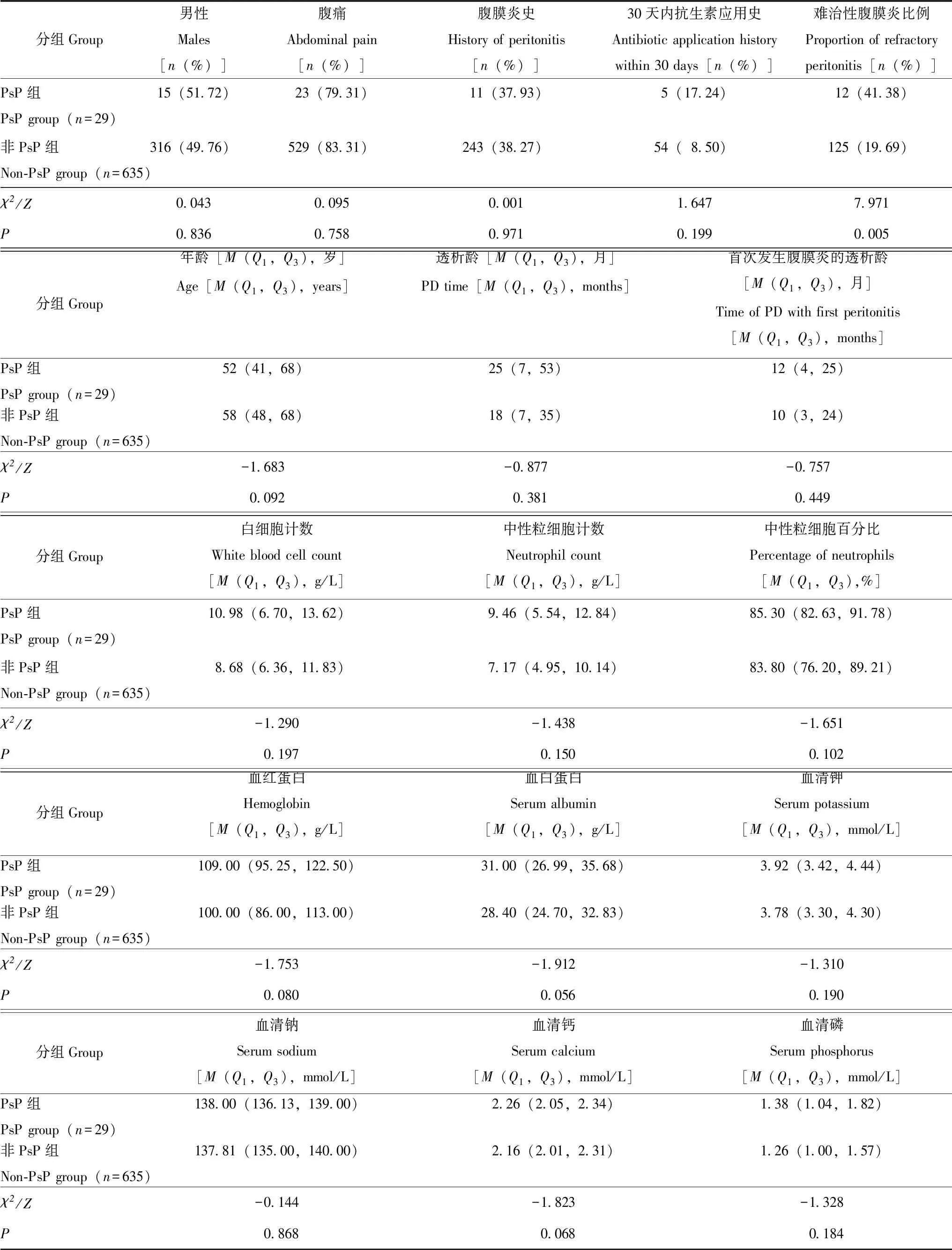
表2 PsP组和非PsP组的临床特点比较
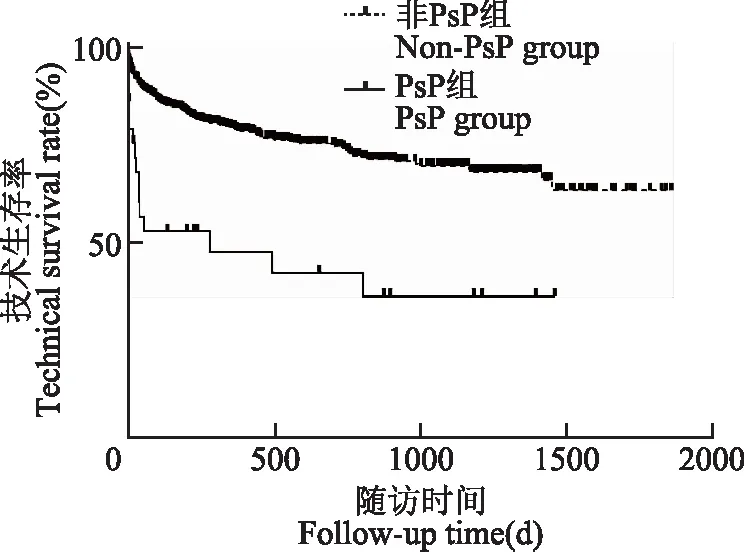
图1 PsP组和非PsP组患者的Kaplan-Meier生存曲线
PaeP治疗情况PsP组中有19例PaeP,其中2例合并导管相关性感染(出口或隧道感染)均拔管;5例发生过2次以上PDAP,仅1例治愈;8例透析龄>3年,4例(50%)拔管,4例(50%)治愈;4例合并肺炎的患者中3例痰培养结果为阴性,1例痰培养为光滑念珠菌,最终均拔管。19例PaeP中仅1例80岁患者因PDAP未能得到有效控制而死亡。
PsP药敏分析治疗PsP常用抗生素敏感率排名前3位的分别是阿米卡星(96.43%)、美罗培南(89.29%)、哌拉西林他唑巴坦(89.29%);耐药率排名前3位的分别是复方新诺明(55%)、头孢唑林(50%)、氨苄西林(50%)(图2)。
讨 论
假单胞菌属革兰阴性杆菌,主要分布在水、土壤和空气中,种类繁多,包括铜绿假单胞菌、荧光假单胞菌、恶臭假单胞菌等。铜绿假单胞菌是其中的代表菌种,其在潮湿的环境中可以长期存在。PD患者操作不规范和某些肠源性因素是PD患者发生导管相关性感染或PDAP的常见感染途径[7]。本研究结果显示,中国吉林省4家腹膜透析中心的PsP发生率为0.007次/人年,远低于Lu等[4]报道的0.040次/人年。分析其原因可能是香港地区的潮湿环境有利于假单胞菌定植[2],而东北地区气候干燥不适宜假单胞菌生存。医护人员应注重无菌操作的培训和宣教,保证患者清洁干燥的居家治疗环境有利于PsP的预防。

图2 假单胞菌的药物敏感性和耐药性分析
本研究中PsP比非PsP治疗更加困难,表现为PsP组治愈率低于非PsP组,拔管率高于非PsP组,并且Kaplan-Meier生存曲线也提示PsP的技术失败率更高。值得注意的是,Pae在PsP致病菌中占大多数,且对常用抗生素不敏感,因此推测Pae可能是PsP治疗结果较差的主要原因。为验证这一推测,应用Cox回归法分析影响PsP技术失败的危险因素,结果表明PsP的技术生存率低于非PsP,Pae感染是PsP技术失败的危险因素,这可能与Pae易在导管内形成生物膜有关[8]。生物膜不仅增加了其对抗生素的耐药性[9],而且增加了腹膜炎复发的可能性[10],从而导致PaeP患者治疗效果差,预后不良。生物膜由细菌及其分泌的细胞外基质如多糖、蛋白质、胞外DNA(extracellular DNA,eDNA)等构成,已知胞外基质的合成受Rhl、Las、喹诺酮信号(pseudomonas quinolone signalling,PQS)系统等群体感应系统调控[11- 12],环鸟苷二磷酸 (cyclic-di-guanosine monophosphate,c-di-GMP)作为第二信使也在其中扮演重要角色[13],钙离子对生物膜的形成也是至关重要的。研究表明Pae的胞外多糖Psl和eDNA(来自坏死的中性粒细胞或其他裂解的细菌)形成的eDNA-Psl纤维网增加了生物膜的稳固性,从而增加了Pae的耐药性[14]。目前在Pae的治疗方面,eDNA和c-di-GMP已成为研究热点[15- 16],针对生物膜的研究也将为未来Pae的治疗提供新思路。
Pae已经成为PDAP和导管相关性感染的常见病原菌之一,导管内生物膜的形成增加了PaeP复发的可能性以及治愈的难度。本研究中2例合并出口或隧道感染的患者均未治愈。可见Pae导管相关性感染的预防非常重要。2017年ISPD颁布的导管相关性感染诊治指南中指出,在导管出口处应用庆大霉素软膏可降低PsP导管相关性感染的风险,但其对庆大霉素耐药性的影响尚需更多研究来证实[17]。
然而,PDAP患者的治疗结局往往与多种因素有关。本研究中5例发生过2次以上PDAP的PaeP患者仅1例治愈,可见有多次PDAP史的PaeP患者往往治疗结局不佳。可能原因包括依从性较差、对抗生素耐药、长时间接触腹膜透析液使腹膜防御功能降低等。本课题组最近的一项研究表明,长透析龄(≥36个月)的PDAP患者治疗结局往往较差[18]。本研究中8例长透析龄PaeP患者4例(50%)拔管,4例(50%)治愈,治愈的4例患者中2例最终选择左氧氟沙星联合头孢哌酮舒巴坦方案,1例选择美罗培南联合头孢他啶方案,还有1例选用3种抗生素联合治疗。选用3种抗生素的患者初始应用美罗培南联合万古霉素无效,更改为美罗培南联合庆大霉素后腹膜透析液白细胞计数明显下降,但临床症状缓解不明显,为进一步加强治疗又增加了头孢哌酮舒巴坦,最终达到治愈。2016年ISPD颁布的PDAP诊治指南建议,PsP应该根据药敏结果选择2种作用机制不同的抗生素[1]。上述治疗成功的案例提示对于PeaP应至少选择2种敏感抗生素,必要时可联合3种针对Pae的抗生素治疗。文献报道PD患者在透析初始或透析过程中如存在多种合并症发生,如动脉粥样硬化、呼吸系统疾病等,则通常会影响患者的预后[19]。在本研究中4例合并肺部感染的PaeP患者均拔管,提示合并其他部位感染的患者往往治疗效果较差。有研究表明老年人的PDAP拔管率并不高于年轻人[20],但老年患者往往免疫功能较差,且易合并多种其他基础疾病,从而增加患者的全因死亡风险。PaeP组唯一1例死亡的患者年龄80岁,因PDAP未能得到有效控制。因此,临床中面对这类人群,应在治疗PDAP的同时关注其他合并疾病,并给予全身支持治疗。
近年来的研究并没有对假单胞菌属药敏情况做出详尽分析。本研究结果提示假单胞菌对阿米卡星、美罗培南、哌拉西林他唑巴坦的敏感性较高,可以适当选用;而对复方新诺明、头孢唑林、氨苄西林的耐药性较高,应在治疗过程中尽量避免。
本研究存在一定的不足。第一,本研究为回顾性研究,可能存在偏倚;第二,尽管收集了吉林省4家医院全部PDAP患者的临床资料,但是由于本地区PsP的发生率低,故而研究组的样本例数偏少,降低了统计学的效能。
综上,PsP发生难治性腹膜炎的比例高,治愈率低,拔管率高;Pae是PsP技术失败的独立危险因素。应关注PaeP患者的PDAP史、透析龄、合并症及年龄情况,并根据本地区药敏结果进行综合治疗,从而提高PeaP的治疗效果。

