橡胶树胶乳高表达的法尼基焦磷酸合成酶的功能*
邓小敏 杨署光 田维敏
(中国热带农业科学院橡胶研究所 农业农村部橡胶树生物学与遗传资源利用重点实验室 省部共建国家重点实验室培育基地-海南省热带作物栽培生理学重点实验室 海口 571101)
天然橡胶是关系到国计民生与国防安全的重要战略物资之一,其中聚顺式天然橡胶(cis-1,4-polyisoprene rubber)主要来源于橡胶树(Heveabrasiliensis),由特化的乳管细胞中起源于内质网的橡胶合成机器——橡胶粒子合成(史敏晶等,2016)。天然橡胶生物合成从本质上仍是植物类异戊二烯代谢。该生物合成过程可分为3部分,即上游的甲羟戊酸合成途径、五碳合成前体异戊二烯焦磷酸(isopentenyl diphosphate,IPP)和二甲基丙烯基焦磷酸(dimethylallyl diphosphate,DMAPP)的合成途径,以及IPP经橡胶粒子上的橡胶转移酶立体选择性聚合生成聚顺式异戊二烯橡胶 (Lietal.,2016;邓小敏等,2018a;Cherianetal.,2019。橡胶树和橡胶草(Taraxacumkok-saghyz)基因组、转录组和蛋白质组学等技术的应用展示了参与这些过程的基因成员(Lauetal.,2016;Tangetal.,2016;Makitaetal.,2018;Liuetal.,2020)。除了个别基因在橡胶草和橡胶树中进行了功能验证外,这些研究主要聚焦在基于蛋白序列的同源序列比对分析预测与基因表达水平的检测上,即仅从基因序列信息层面、基因表达水平层面和蛋白质序列及其修饰类型等层面说明其与乳管细胞天然橡胶合成的关系,但是还缺乏直接的酶学证据证明这些关键酶参与了天然橡胶前体的合成,因而难以加深对天然橡胶合成机理的认识。
生产上主要使用乙烯利刺激橡胶树增产,乙烯不仅促进了由水通道蛋白介导的排胶时间延长,同时也增强了胶乳中与天然橡胶合成相关的能量与物质代谢(庄海燕等,2010),特别是还参与小橡胶粒子再生相关的小橡胶粒子SRPP蛋白的表达与修饰调控过程(Wangetal.,2015;Yuetal.,2020)。除了乙烯利明显的刺激增产效果外,本课题组前期研究发现另一重要植物激素——茉莉酸不仅促进次生乳管细胞的发育,亦能够通过信号级联传导正调控割胶后天然橡胶的再生过程。茉莉酸通过促进法尼基焦磷酸(farnesyl pyrophosphate,FPP)合成酶(farnesyl pyrophosphate synthase,FPS)基因HbFPS1和小橡胶粒子蛋白基因HbSRPP1的转录水平促进割胶后的橡胶再生(Dengetal.,2018)。法尼基焦磷酸是橡胶粒子天然橡胶生物合成的直接引发剂(Cornishetal.,1999),一般认为由法尼基焦磷酸合成酶催化香叶基焦磷酸(geranyl pyrophosphate,GPP)和IPP聚合而成。
橡胶树基因组中含有预测的3个法尼基焦磷酸合成酶HbFPS1、HbFPS2和HbFPS3编码基因。这3个酶的编码基因不仅在胶乳中的转录水平与蛋白水平上存在着差异,而且其一级结构的氨基酸序列也存在差异。在转录水平上,HbFPS1和HbFPS2基因在胶乳中的表达量较高,并且HbFPS1基因的表达量高于HbFPS2基因,而HbFPS3基因在胶乳中表达最低(郭冬等,2015;Guoetal.,2015)。在蛋白水平上,乙烯处理前后的小橡胶粒子差异蛋白质谱中仅鉴定到丰度较高的HbFPS1和HbFPS2蛋白,而未鉴定到HbFPS3蛋白,这说明HbFPS1和HbFPS2蛋白编码基因的高转录水平与其在小橡胶粒子上发挥作用的蛋白丰度水平正相关(Wangetal.,2019)。氨基酸序列分析发现HbFPS1和HbFPS2蛋白的相似性达95%,而HbFPS3蛋白与前二者相似性仅为84%,尽管HbFPS1、HbFPS2和HbFPS3的一级结构存在差异,但是其三级主体结构仍较相似(Guoetal.,2015)。这些研究说明高同源性蛋白HbFPS1和HbFPS2可能是参与天然橡胶生物合成中的重要蛋白,为了在酶学水平上明确HbFPS1和HbFPS2的酶催化产物,明晰其在天然橡胶合成中的作用,本研究将表达纯化HbFPS1和HbFPS2蛋白,并研究其催化底物偏好性和产物的特性,研究结果将为橡胶树产胶性状的遗传改良提供坚实的酶学理论基础。
1 材料与方法
1.1 植物材料与试剂
海南省儋州市中国热带农业科学院试验场内的7年生成熟橡胶树无性系Reyan7-33-97品系(平均树围约50 cm)以S/2 d/3的割制(阳刀1/2树围,3天一刀)采集胶乳。并且每个胶乳样品为等体积混合的10 棵割胶树的胶乳。
分子生物学相关试验所用的试剂为天根生化科技(北京)有限公司的植物总RNA 提取试剂盒和快速质粒小提试剂盒(DP105),Thermo Scientific 公司的蛋白预染Marker 和RevertAid First Strand cDNA Synthesis Kit,英潍捷基(上海)有限公司合成所需引物,宝日医生物技术(北京)有限公司的2× PrimerSTAR Max Permix和胶回收试剂盒,NEB限制性内切酶和T4 DNA 连接酶,北京全式金生物技术有限公司的pEASY-Blunt Cloning Kit和Trans1-T1及BL21(DE3)感受态细胞。本实验室保存的pET28a 载体,北京索莱宝生物科技有限公司的IPTG。
1.2 基因克隆与表达载体构建
参考郭冬等(2015)和Guo等(2015)中对橡胶树3个法尼基焦磷酸合成酶基因的命名及其编码框序列(HbFPS1:XM_021816652.1;HbFPS2:KT306000.1;HbFPS3:KT306001.1)设计HbFPS1基因引物:HbFPS1-F:5′-CCGGAATTCATGGCGGATCTGAAGT CAACT-3′ 和HbFPS1-R:5′-CCGCTCGAGTTTCTGT CTCTTGTAAATTTTGGC-3′;HbFPS2基因引物:HbFPS2-F:5′-CGCGGATCCATGTCTGATCTGAAGTC GACATTCTTG-3′和HbFPS2-R:5′-CCGGAATTCT TATTTCTGTCTCTTGTAAATTTTGGC-3′;HbFPS3基因引物:HbFPS3-F:5′-CGCGGATCCATGAGCGATCC AAAATCCAAGTTC-3′和HbFPS3-R:5′-CCGCTCGAG TCATTTGTTCCCGGCAGCATTCC-3′。利用RT-PCR方法以胶乳cDNA为模板进行PCR克隆。PCR扩增程序:95 ℃ 3 min;98 ℃ 10 s,58 ℃ 15 s,72 ℃ 2 min,共32个循环;72 ℃ 5 min。PCR扩增体系:13 μL PCR级水,15 μL 2× PrimerSTAR Max Permix,0.5 μL正反向引物,1 μL胶乳cDNA模板。目的条带胶回收纯化后HbFPS1基因片段直接用EcoRⅠ和XhoⅠ双酶切过夜,含HbFPS2基因片段用BamHⅠ和EcoRⅠ双酶切过夜,含HbFPS3基因片段用BamHⅠ和XhoⅠ双酶切过夜,经热失活后分别与EcoRⅠ和XhoⅠ双酶切、BamHⅠ和EcoRⅠ双酶切以及BamHⅠ和XhoⅠ双酶切后的对应载体在16 ℃连接过夜,连接产物分别转化Trans1-T1化学感受态细胞,复苏后分别在卡那霉素抗性平板上进行筛选。待菌落PCR 鉴定到含有目的基因的阳性菌后送英潍捷基(上海)有限公司测序确证目的基因的核酸序列。
1.3 蛋白序列与结构分析
采用ClustalW2.0软件对橡胶树HbFPS1、HbFPS2和HbFPS3 蛋白进行同源比对分析。HbFPS1和HbFPS2蛋白结构的同源模建参考Guo等(2015)的方法进行。以蒿属ArtemisiaspiciformisFPS1蛋白的晶体结构 (PDB id:4kk2.1)为模板分别构建HbFPS1和HbFPS2蛋白的三维结构。同源模建的HbFPS1蛋白和HbFPS2蛋白与双底物分子IPP和DMAPP或双底物分子IPP和GPP以及酶辅因子镁离子分别对接到相应的活性空间域中进行分析对比。采用ProtScale软件分析蛋白的亲疏水性。
1.4 原核表达与纯化
参考先前描述的方法(邓小敏等,2017;2018a)在大肠杆菌(Escherichiacoli)中表达橡胶树来源的HbFPS1基因、HbFPS2基因和HbFPS3基因。把经鉴定含有HbFPS1基因、HbFPS2基因和HbFPS3基因的重组质粒pET28-HbFPS1、pET28-HbFPS2和pET28-HbFPS3分别转化大肠杆菌表达菌株BL21(DE3),将阳性菌接种到30 mL LB培养基(含卡那霉素)中,37 ℃,220 r·min-1培养过夜,再次接种到新鲜的100 mL LB培养基(含卡那霉素),待OD600值约为0.6后,加入IPTG诱导剂至终浓度约0.5 mmol·L-1。16 ℃诱导表达过夜。菌液经8 000 r·min-1离心2 min 后收集菌体。使用磷酸缓冲液重悬再经低温超声破碎,12 000 r·min-1离心20 min,收集上清液。经过Ni+柱纯化目标蛋白。通过SDS-PAGE技术分析HbFPS1-His、HbFPS2-His和HbFPS3-His重组蛋白的表达。纯化蛋白的浓度按照Nanodrop测定。
1.5 蛋白质胶内水解与质谱鉴定
参考代龙军等(2012)的方法进行目标蛋白质胶块脱色、胶内蛋白质胰蛋白酶水解、MALDI/TOFTOF分子量校准和测试样品准备及肽段比对分析。
1.6 体外酶活性检测
橡胶树法尼基焦磷酸酶活性检测参考体外橡胶合成反应体系的方法(Dengetal.,2018)。纯化的HbFPS1蛋白和HbFPS2蛋白按照50 μg的含量加入反应体系中,分别添加5 μg·mL-1的反应底物IPP、DMAPP和GPP进行反应。随后添加1 U去磷酸化酶(NEB)37 ℃反应2 h,经提取液萃取后进行GC色谱分析。
1.7 体外橡胶合成效率的检测
体外橡胶合成效率参考Deng等(2018)的方法进行。400 μL反应体系包含10 μmol·L-1MgCl2,10 μmol·L-1DTT,5 μmol·L-1ATP,0.736 μmol·L-113C-MVA (mevalonolactone-2-13C)(Sigma Aldrich,Lot# MBBB5201 V),100 mmol·L-1PBS 缓冲液。在反应体系中试验组分别添加50、100、200 μg HbFPS1蛋白或HbFPS2蛋白,对照组添加对应体积的蛋白纯化液,最后添加25 μL经过0.45 μm滤膜过滤的新鲜胶乳,将反应体系置于30 ℃,70 r·min-1反应8 h。然后添加400 μL的饱和NaCl溶液并充分混匀,接着加入800 μL提取液(甲苯/正己烷,1∶1体积比)提取橡胶组分,16 000×g离心30 min,将上层有机相收集并用等体积正丁醇混合后过夜析出橡胶组分。再次经16 000×g离心30 min后弃掉有机相层,剩下的橡胶层干燥后制备分析样品。称取约0.3 mg橡胶样品包埋至薄层锡纸(Elemental Microanalysis,6 mm × 4 mm,BN261080)中。用稳定同位素仪(GV Instruments,IsoPrime JB312)和元素分析仪(Thermo,FLASH EA1112 Series)检测样品中的13C/12C 比例。结果按照原子百分比形式表示,其值等于橡胶样品中的13C含量相对于总C(13C+12C)的含量百分比。所有的分析进行2次生物学重复。t-test分析添加HbFPS1重组蛋白或HbFPS2重组蛋白的试验组与其对应的对照组之间的差异显著性。
2 结果与分析
2.1 橡胶树法尼基焦磷酸合成酶的序列分析
胶乳中高表达的HbFPS1和HbFPS2基因分别编码的HbFPS1蛋白和HbFPS2蛋白具有95%的氨基酸序列相似性(图1),说明HbFPS1和HbFPS2为基因组上的2个同源冗余基因,可能是进化后期发生的基因拷贝事件。而胶乳中低表达的HbFPS3基因编码的HbFPS3蛋白,其氨基酸序列与HbFPS1和HbFPS2蛋白仅存84%的相似性(图1),说明HbFPS3蛋白与HbFPS1和HbFPS2蛋白的差异相对较大,这些差异的氨基酸有可能对蛋白三维结构和性质产生一定的影响。HbFPS1、HbFPS2和HbFPS3含有已报道的法尼基焦磷酸合成酶的2个特征性结构域,分别是“DDIMD”和“DDYXD”,为活性中心特异结合镁离子与底物的功能区。
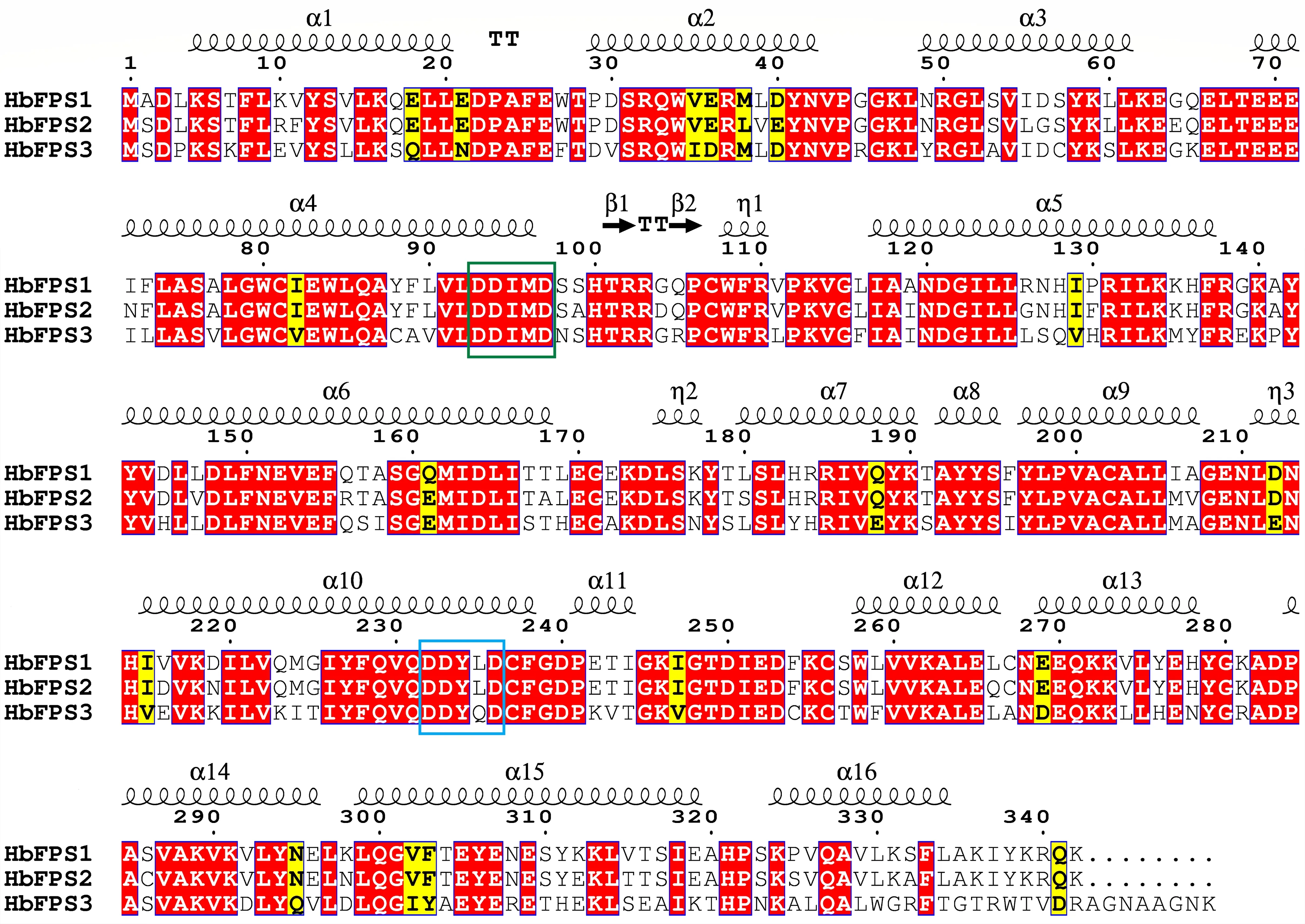
图1 橡胶树FPS蛋白氨基酸序列比对Fig.1 The amino acids alignment among rubber tree FPS proteins 矩形方框代表保守结构域。The squares represent the conserved motifs.
2.2 橡胶树HbFPS1和HbFPS2蛋白表达与纯化
虽然HbFPS1、HbFPS2和HbFPS3蛋白含有特征性的法尼基焦磷酸合成酶结构域和类似的空间结构,但仍然缺乏实证的酶学证据。而获得较纯的蛋白进行体外酶学催化是证明该类蛋白酶学性质的有效方法。为此目的构建了HbFPS1、HbFPS2和HbFPS3基因的原核表达载体,小量表达发现仅橡胶树胶乳高表达的2个同源基因HbFPS1和HbFPS2能够在大肠杆菌中表达与正确折叠,在上清中可见。而HbFPS3蛋白(pI=5.79,MW=40.27 kDa)表达形成大量包涵体蛋白,上清中未见明显的条带(图2A)。蛋白质亲疏水性分析发现,这3个蛋白的N末端50个氨基酸内的亲疏性差异十分明显,其中HbFPS3蛋白的N50疏水性较强,而HbFPS1和HbFPS2蛋白的N50亲水性较强(图2B、C、D),这种蛋白N端的亲疏水性的差异可能与HbFPS3蛋白在包涵体表达,而HbFPS1和HbFPS2蛋白在上清中的可溶性表达有关。重点研究可溶性表达的HbFPS1蛋白(pI=5.75,MW=39.42 kDa)和HbFPS2蛋白(pI=5.27,MW=39.56 kDa)的纯化与酶学性质。经常规镍柱纯化后获得了较纯的HbFPS1和HbFPS2蛋白(图3A)。为确证该纯化蛋白是否是橡胶树HbFPS1和HbFPS2,对该纯化蛋白进行蛋白质谱鉴定与分析,结果表明纯化的重组蛋白的特征肽段分别与橡胶树HbFPS1和HbFPS2序列一致(图3B、C、D),表明成功获得正确的重组蛋白HbFPS1-His和HbFPS2-His。
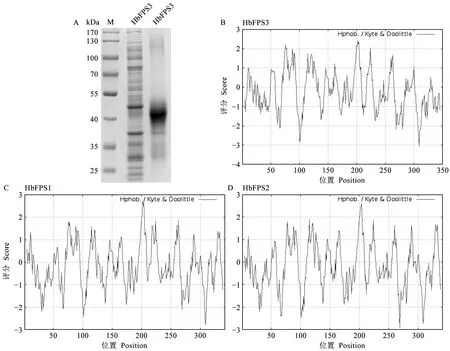
图2 橡胶树HbFPS3蛋白的表达与3个FPS蛋白的亲疏水性分析Fig.2 The recombinant prokaryotic expression of HbFPS3 and the hydrophilicity or hydrophobicity analysis of three rubber tree FPS proteinsA:HbFPS3蛋白主要在包涵体中表达(从左至右第3泳道),在上清液中未见明显表达(从左至右第2泳道);B-D:分别为HbFPS3、HbFPS1、HbFPS2蛋白的亲疏水性分析。A:The HbFPS3 was mainly expressed in the inclusion body (the third lane from left to right),and no obvious expression in the supernatant (the second lane from left to right);B-D:The hydrophilicity or hydrophobicity analysis of HbFPS3 protein (B),HbFPS1 protein (C)and HbFPS2 protein (D),respectively.
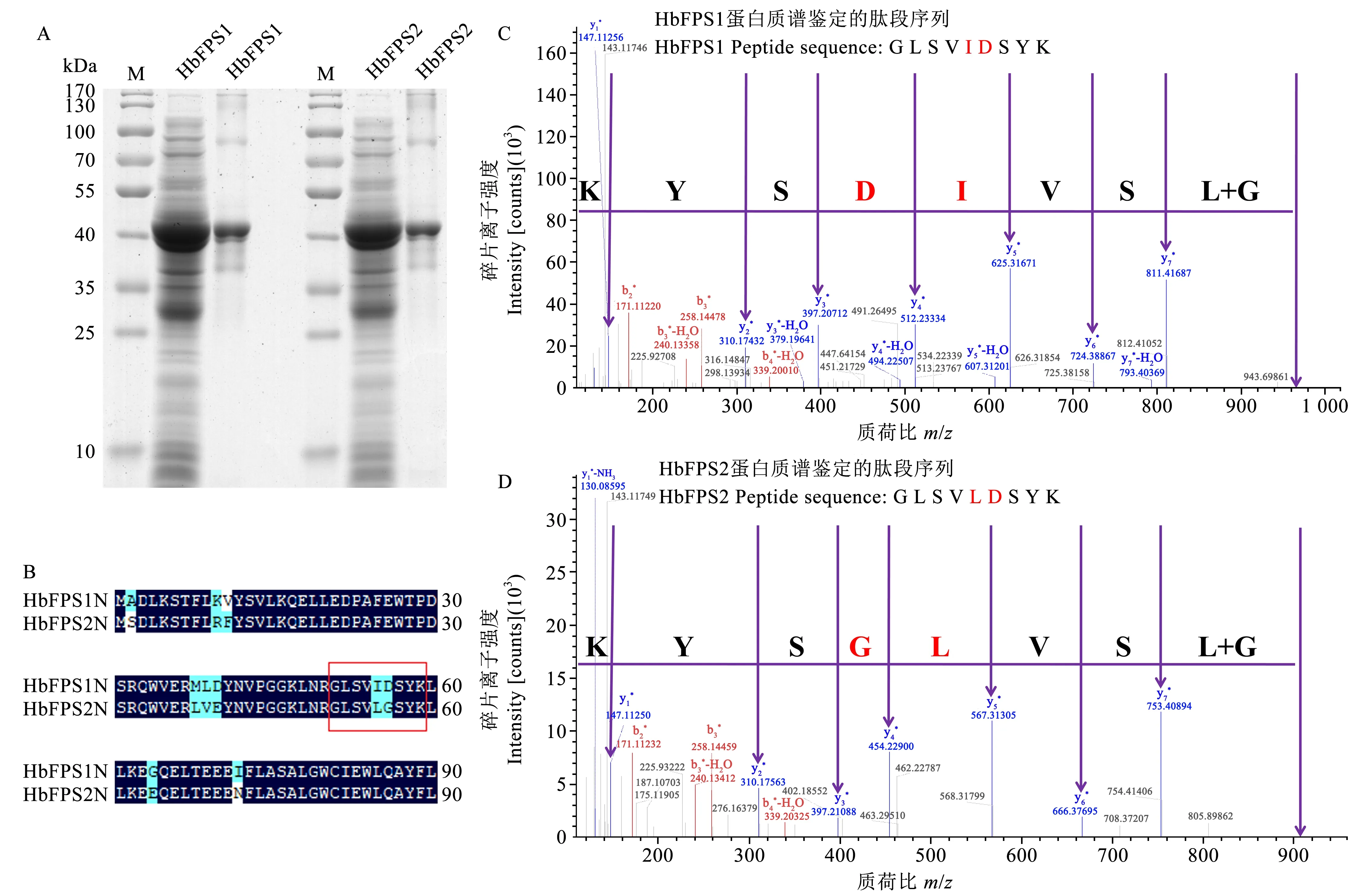
图3 橡胶树HbFPS1和HbFPS2蛋白的表达与质谱鉴定Fig.3 The expression and identification of rubber tree HbFPS1 and HbFPS2 proteinsA:HbFPS1和HbFPS2蛋白的SDS-PAGE分析;B:HbFPS1与HbFPS2蛋白N末端氨基酸序列比对;C:HbFPS1蛋白经酶解消化后得到的差异肽段的质谱检测图;D:HbFPS2蛋白经酶解消化后得到的差异肽段的质谱检测图。A:SDS-PAGE analysis of the HbFPS1 and HbFPS2;B:The different amino acids locate in the N-terminals between HbFPS1 and HbFPS2;C:The MS detection of the differential peptide of HbFPS1 obtained from enzymatic digestion;D:The MS detection of the differential peptide of HbFPS2 obtained from enzymatic digestion.
2.3 橡胶树HbFPS1和HbFPS2酶学与结构分析
在含50 μg重组蛋白的体外反应体系中,通过添加底物IPP和GPP反应,经GC色谱检测并与标准品比对,发现添加HbFPS1-His重组蛋白和HbFPS2-His重组蛋白的反应中检测到法尼基焦磷酸脱磷酸化产物法尼醇的产生(图4A、B),而仅含有反应底物的对照组没有检测到该产物(图4B),这从酶学层面证明了HbFPS1-His重组蛋白和HbFPS2-His重组蛋白确实能够催化IPP和GPP的聚合反应,HbFPS1和HbFPS2确实为橡胶树乳管细胞中活性的法尼基焦磷酸合成酶。特别的是,在重组蛋白的体外酶促反应体系中还发现HbFPS1-His重组蛋白和HbFPS2-His重组蛋白能够催化IPP与DMAPP直接合成FPP(图4B),说明在同一酶内IPP和DMAPP合成的GPP仅作为中间产物继续与IPP进行聚合反应生成FPP。为了明晰该酶的催化机制,采用同源模建的方法构建了HbFPS1和HbFPS2的蛋白结构模型,发现HbFPS1和HbFPS2蛋白的活性中心确实能够容纳并实现IPP和DMAPP分子的催化合成(图5A、B),所生成的GPP能够驻留在其活性中心继续与IPP进行接合生成最终产物FPP(图5C、D)。
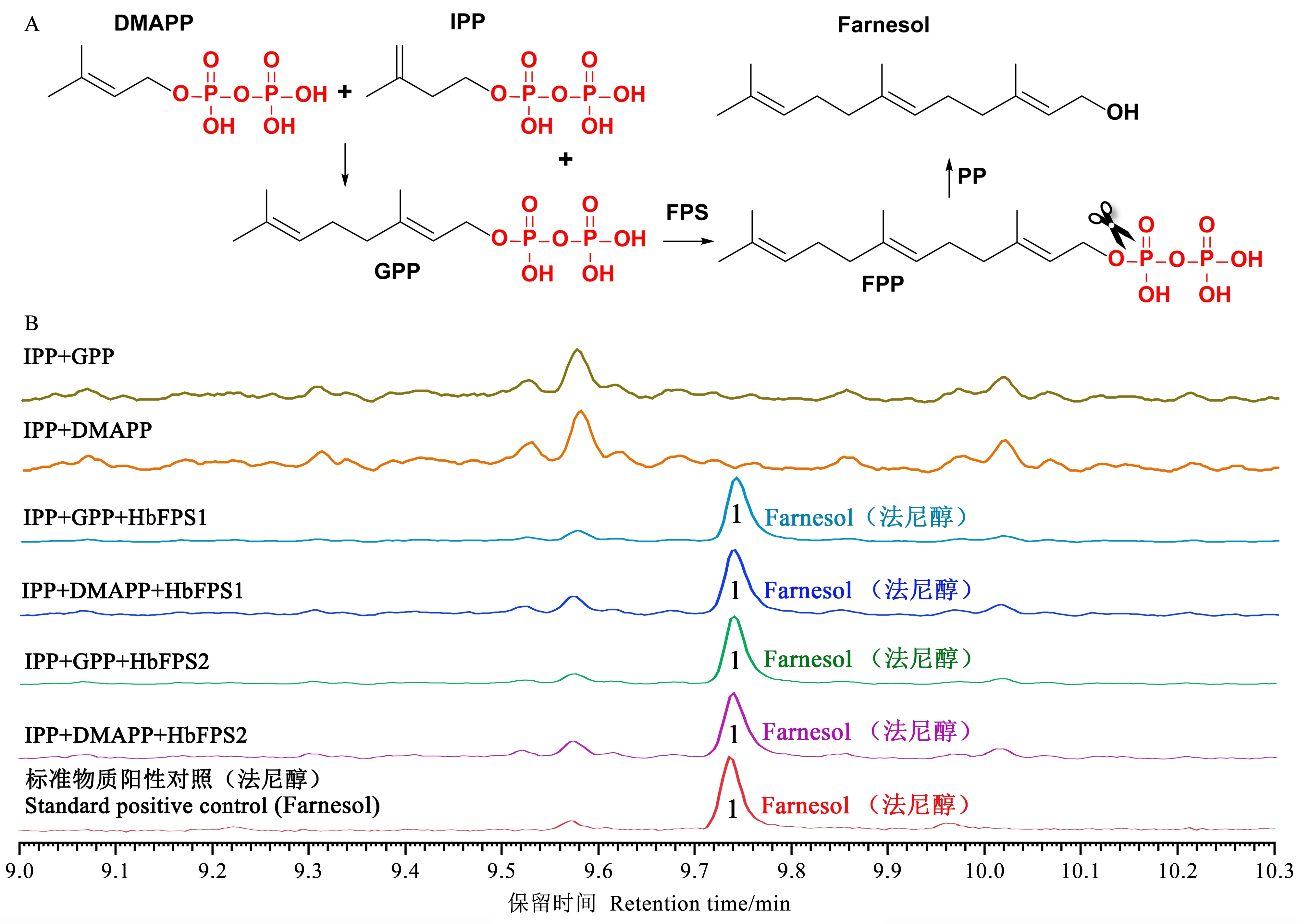
图4 橡胶树HbFPS1重组蛋白和HbFPS2重组蛋白的活性检测Fig.4 The catalytic reaction assay of rubber tree HbFPS1 and HbFPS2 recombinant proteins under different conditionsA:FPP聚合反应历程和其脱磷酸化产物;B:HbFPS1重组蛋白和HbFPS2重组蛋白的体外催化反应检测图,其中不同颜色对应的Peak 1为法尼醇。A:The generation of FPP and its dephosphorylated derivative are realized by consecutive enzymatic reactions;B:The GC results exhibited the enzymatic products of HbFPS1 and HbFPS2 as well as the negative controls and standard positive control,all the Peak 1 in different colors represent the farnesol.
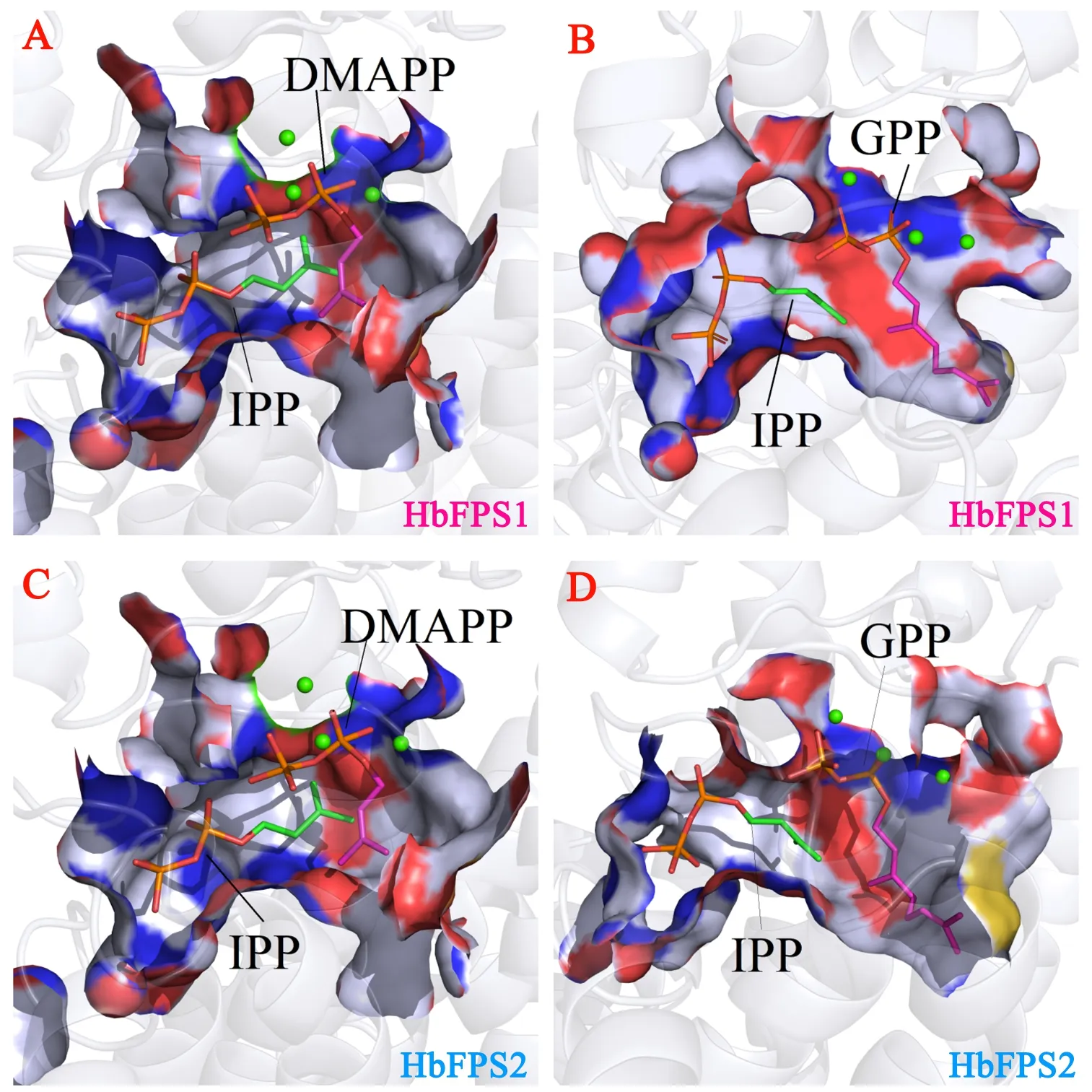
图5 HbFPS1蛋白和HbFPS2蛋白与不同对底物结合的同源模建分析Fig.5 The homologous modelling analysis of HbFPS1 and HbFPS2 proteins with different pairs of substrates
2.4 法尼基焦磷酸合成酶对橡胶合成效率的影响
既然酶学研究证实橡胶树HbFPS1和HbFPS2是能够催化FPP生成的法尼基焦磷酸合成酶,那么该酶是否或在多大程度上影响了天然橡胶合成将是评判HbFPS1和HbFPS2在天然橡胶生物合成中能否发挥调控作用的前提依据。而利用基于橡胶树胶乳中天然的小橡胶粒子的体外橡胶合成效率体系可以评价HbFPS1和HbFPS2在天然橡胶合成中的调控作用。在该系统中仅通过添加IPP和DMAPP合成的前体13C-MVA甲羟戊酸和体外重组酶反应后,通过提取天然橡胶并检测该天然橡胶中13C的含量变化来评价其影响天然橡胶合成效率的能力。结果(图6)发现,与对照相比,添加不同量的HbFPS1和HbFPS2重组酶能够不同程度地提升体外橡胶合成效率,而且在100 μg含量下的体外橡胶合成效率最高,这表明橡胶树HbFPS1和HbFPS2蛋白确实参与并促进了天然橡胶生物合成过程,并且其含量的高低与天然橡胶合成效率相关,但是较优的天然橡胶合成效率可能依赖于酶量与橡胶粒子含量处于比较合适的比例。
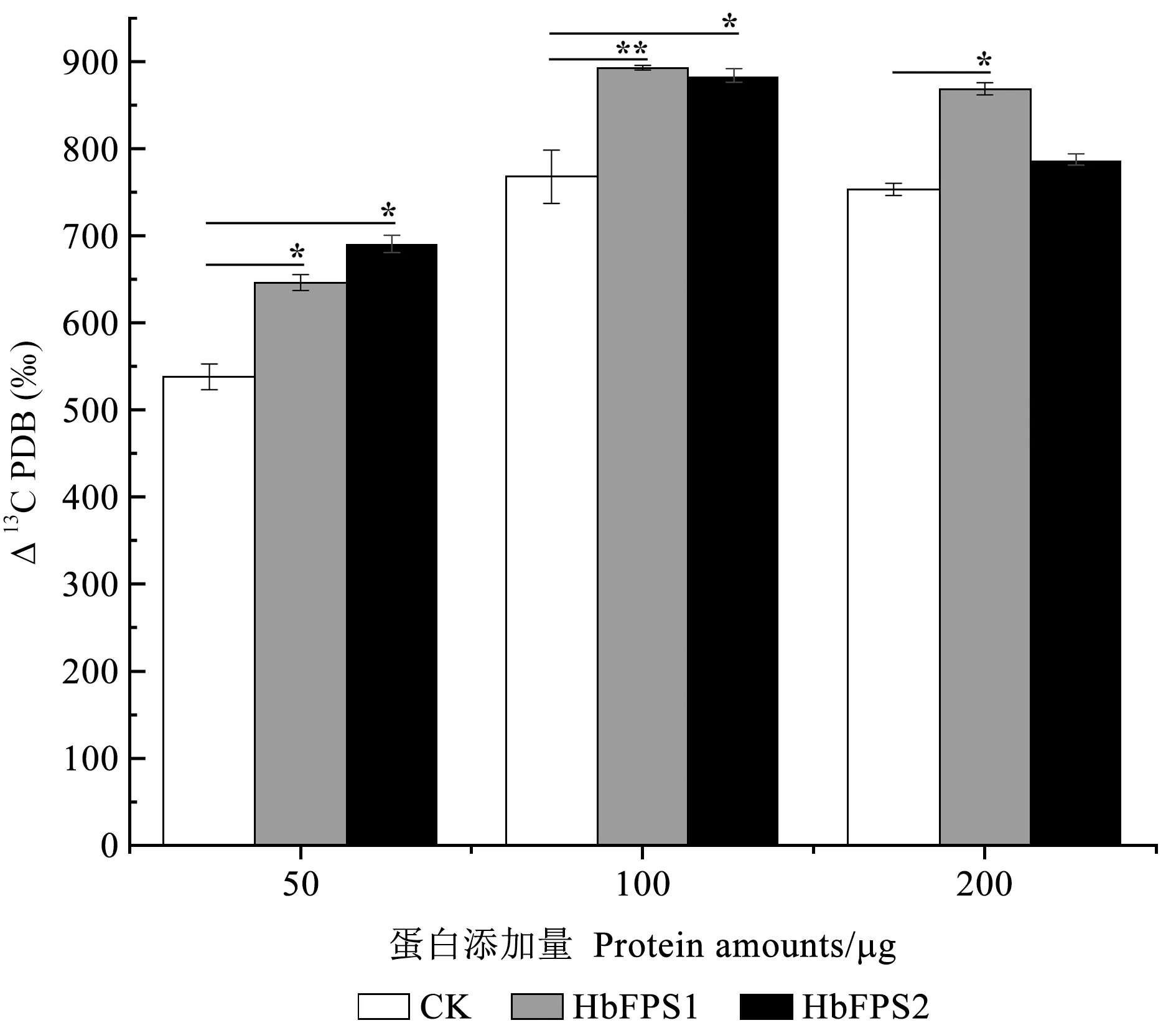
图6 不同添加量的橡胶树HbFPS1和HbFPS2蛋白对体外橡胶合成效率的影响Fig.6 The effects of different amounts of HbFPS1 and HbFPS2 proteins supplementation on the efficiency of in vitro rubber synthesis“*”和“**”分别表示HbFPS1重组蛋白或HbFPS2重组蛋白添加组与对照组的差异显著(P <0.05)及差异极显著(P <0.01)。The single asterisk (*)represents the significant difference between the HbFPS1 recombinant protein or HbFPS2 recombinant protein addition treatment and the controls (P <0.05),and the double asterisks (**)represent the extremely significant difference between HbFPS1 or HbFPS2 recombinant protein addition treatment and the controls (P <0.01).
3 讨论
产胶植物天然橡胶生物合成是典型的植物类异戊二烯代谢,与其他非产胶植物相比,都共有生成IPP和DMAPP基本合成原料的MVA途径和MEP途径,但是产胶植物形成了特化的乳管组织结构与具备天然橡胶合成的功能化橡胶粒子。解析天然橡胶生物合成与调控机制是调控橡胶树产量和质量性状的理论基础,天然橡胶生物合成酶的功能验证与评价及其组织形式是解析该机制的基本前提。通过正反向遗传学技术已经证明该合成途径中的HMGS、HMGR、FPS和CPT等蛋白能影响天然橡胶的合成。譬如过表达橡胶草FPS基因促进了根中天然橡胶的含量提升(曹新文等,2016);而下调橡胶草CPT基因的表达水平减少了天然橡胶的含量(Postetal.,2012)。过表达橡胶树HbHMGS2基因与过表达HbHMGR1基因皆促进了天然橡胶的合成(Jayashreeetal.,2018;Yuetal.,2020)。尽管在遗传学层面上,从“质”的角度证明了这些在代谢途径的不同节点上的基因有助于天然橡胶的生物合成,但是未能提供这些基因编码的蛋白是否具备相应节点上酶催化的功能及性质,而且也未能够从“量”的角度去探究这些蛋白与天然橡胶合成的关系,因为通过基因的过表达来研究基因功能属于定性的范畴,难以给出相对应的蛋白含量变化信息。
本研究从“质”和“量”的角度尝试研究橡胶合成关键酶的酶学功能及其含量的变化对天然橡胶合成的影响,并获得了新的发现。法尼基焦磷酸(FPP)合成酶(FPS)合成天然橡胶合成的起始物FPP,在某种程度上起着天然橡胶合成的开关作用,因此法尼基焦磷酸合成酶的功能十分重要。本研究从“质”的角度证明了HbFPS1和HbFPS2蛋白确实具有利用IPP和GPP底物合成FPP的酶学功能。一般认为香叶基焦磷酸合成酶(GPPS)催化IPP和DMAPP聚合生成的GPP与一分子IPP作为双底物被法尼基焦磷酸合成酶(FPS)催化生成FPP,HbFPS1和HbFPS2蛋白对IPP和GPP的这一催化结果与该一般认识基本相符。与此同时本研究又发现HbFPS1和HbFPS2重组蛋白具备直接催化IPP和DMAPP生成FPP的能力(图4B),这一发现拓展了对橡胶树FPS酶的功能认知,GPP很可能是FPS酶在催化一分子IPP和一分子DMAPP聚合过程中的中间产物,随后继续结合一分子IPP生成终产物FPP。这一发现将有助于重新理解乳管细胞中天然橡胶生物合成的精细生化过程及其调控机制。虽然橡胶树GPPS基因可能也与天然橡胶合成相关(邓小敏等,2018b),但是GPPS和FPS蛋白在乳管细胞中并存的生物学意义还有待进一步阐明。而且GPP和FPP也是其他萜类物质合成的底物,而乳管细胞中GPP和FPP等底物在天然橡胶合成与萜类物质合成中的分配机制还不清楚。相比经过GPPS合成GPP后作为底物供给FPS酶催化,本研究更倾向于认为橡胶树HbFPS1和HbFPS2酶能直接原位聚合DMAPP和IPP生成天然橡胶合成起始物FPP,这种特性能够明显地加快天然橡胶合成速率,提升其合成效率(图5B、D,图6),而不同FPS蛋白的亚细胞器分布可能与上述分配机制有关(Wangetal.,2019)。本研究从“量”的角度,发现在底物13C-MVA和橡胶粒子等含量一定的条件下,随着FPS酶含量的增加,反应体系的橡胶合成效率也增加直到达到检测峰值,蛋白含量的继续增加反而有所下降,这说明在底物13C-MVA和橡胶粒子等含量一定的条件下,酶与底物在较为合适的配比下才能达到较优的反应效率,才能促使该体系中目标产物的高效合成。
综上所述,基于目前的研究结果,推测从“质”和“量”的角度调控橡胶树FPS酶的性质与含量将有助于提升橡胶树天然橡胶的合成能力。为了验证这一假设,后续将从这2个角度入手利用本研究建立的基于天然橡胶粒子的体外蛋白功能研究平台,深入开展天然橡胶生物合成途径中包括FPS和CPT等在内的关键酶酶学功能与活性调节机制解析。通过验证这一假设可为橡胶树优质高产新品种选育提供新颖的思路和方法。
4 结论
法尼基焦磷酸(FPP)合成酶(FPS)是天然橡胶合成代谢途径中合成起始底物FPP的关键酶。本研究证明了橡胶树胶乳中预测的2个高表达的同源法尼基焦磷酸合成酶HbFPS1和HbFPS2不仅能够利用IPP和GPP为底物合成FPP,而且能够直接聚合IPP和DMAPP生成FPP,拓展了对橡胶树FPS酶催化机理的认知。本研究建立了基于天然橡胶粒子的体外蛋白功能研究平台,并证明HbFPS1和HbFPS2酶在一定的含量下能够更好地提升天然橡胶合成效率。通过调控橡胶树FPS酶的性质和含量来调控天然橡胶的合成,这为橡胶树优质高产品种的选育提供了新的思路和方法。

