血清神经胶质原纤维酸性蛋白和泛素羧基末端水解酶-L1与足月儿缺氧缺血性脑病的关系
张 琦,姜 泓,冯慧玲
(延安大学附属医院新生儿科,陕西 延安 716000)
随着医疗技术的进步与发展,危重症新生儿的救治水平得到很大提升,但存活新生儿中缺氧缺血性脑病(hypoxic-ischemic encephalopathy,HIE)等并发症也随之增加。由于HIE病因复杂,发病机制尚未完全明确,且大部分患儿的临床症状不典型,早期判断其严重程度及预后有一定困难。神经胶质原纤维酸性蛋白(glial fibrillary acidic protein,GFAP)是在中枢神经系统星形胶质细胞中发现的一种中间丝蛋白,是星形胶质细胞的特征性标志物[1]。泛素羧基末端水解酶-L1(ubiquitin carboxy terminal hydrolase-L1,UCH-L1)是一种富集于神经元的蛋白质,主要集中于神经元的核周体和树突。在新生儿脑损伤中,神经元和神经胶质细胞均有不同程度损伤,研究表明,同时监测神经元和星形胶质细胞生物标志物可确定不同的损伤机制,从而更全面地反映脑损伤[2]。目前,联合检测GFAP、UCH-L1评估足月儿HIE的报道甚少。本研究通过观察HIE足月儿血清GFAP、UCH-L1水平变化,探讨GFAP、UCH-L1与足月儿HIE严重程度的关系,旨在为早期识别和干预HIE患儿及降低HIE患儿的病死率和致残率提供参考。
1 资料与方法
1.1 一般资料选择2019年2月至2020年2月延安大学附属医院新生儿科收治的46例HIE足月儿为观察对象,男31例,女15例;胎龄37.00~41.10(39.02±1.58)周;出生体质量2 550.00~4 000.00(3 250.28±428.40)g;诊断和临床分度均符合中华医学会儿科学分会新生儿学组2004年修订的新生儿HIE的诊断标准[3],其中轻度HIE 13例(轻度HIE组),中度HIE 21例(中度HIE组),重度HIE 12例(重度HIE组)。HIE 组纳入标准:(1)胎龄 37~42周;(2)出生体质量≥2 500 g。排除标准:(1)电解质紊乱引起的抽搐;(2)颅内出血和产伤等原因引起的抽搐;(3)宫内感染;(4)遗传代谢性疾病;(5)其他先天性疾病所引起的脑损伤。轻度HIE组:男7例,女6例;胎龄37.00~40.60(39.19±1.66)周;出生体质量2 550.00~4 000.00(3 325.38±505.35)g。中度HIE组:男15例,女6例;胎龄37.10~41.10(38.77±1.59)周;出生体质量2 590.00~3 980.00(3 382.38±603.70)g。重度HIE组:男9例,女3例;胎龄37.00~40.10(38.78±1.64)周;出生体质量2 840.00~3 760.00(3 292.22±491.37)g。另选择同期在本院出生且无窒息及神经系统症状的30例足月儿为对照组,男13例,女17例;胎龄37.00~40.30(39.07±0.67)周;出生体质量2 630.00~3 980.00(3 333.33±199.16)g。对照组纳入标准:无窒息史的足月适于胎龄儿,孕周和性别与 HIE 组无差异,动脉血气分析 pH>7.20,1、5 min Apgar 评分均>7 分。轻度HIE组、中度HIE组、重度HIE组及对照组受试者之间性别、胎龄及出生体质量比较差异无统计学意义(P>0.05),具有可比性。本研究经延安大学附属医院医学伦理委员会审核批准,并征得患儿家长的知情同意。
1.2 HIE患儿治疗方法轻度HIE患儿给予常规的三支持治疗(维持良好的通气功能;维持脑和全身良好的血流灌注;维持血糖在正常范围)和三对症治疗(控制惊厥;降低颅内压;消除脑干症状);中、重度HIE患儿除了给予常规的三支持和三对症治疗外,同时于出生 6~72 h给予头部亚低温治疗,维持肛温在 34~35 ℃。
1.3 血清GFAP、UCH-L1水平检测各组受试者均于出生第1、3、7天采集外周静脉血1.5~2.0 mL,置于干燥促凝管中,凝血后以3 200 r·min-1离心5 min,取血清-70 ℃保存备用,采用酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)检测血清GFAP、UCH-L1水平,试剂盒由武汉华美生物工程有限公司提供,严格按照试剂盒说明进行操作。

2 结果
2.1 4组受试者血清GFAP、UCH-L1水平比较结果见表1。出生第3天,轻度HIE组患儿血清GFAP水平显著高于对照组,差异有统计学意义(P<0.05)。出生第1、3、7天,中度HIE组、重度HIE组患儿血清GFAP、UCH-L1水平均显著高于对照组,差异有统计学意义(P<0.05)。中度HIE组患儿出生第1、3、7天的血清UCH-L1水平及出生第7天的血清GFAP水平显著高于轻度HIE组,重度HIE组患儿出生第1、3、7天的血清GFAP、UCH-L1水平均显著高于轻度HIE组,差异有统计学意义(P<0.05)。重度HIE组患儿出生第1、7天的血清UCH-L1水平及出生第1、3、7天的血清GFAP水平均显著高于中度HIE组,差异有统计学意义(P<0.05)。中度HIE组、重度HIE组患儿出生第1、7天的血清GFAP水平显著高于出生第3天,差异有统计学意义(P<0.05)。
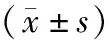
表1 4组受试者血清GFAP、UCH-L1水平比较
2.2 血清GFAP、UCH-L1水平与HIE严重程度的关系Spearman相关性分析显示,出生第1、3、7 天,血清GFAP 水平与HIE患儿的严重程度呈正相关(r=0.740、0.526、0.902,P<0.05),血清UCH-L1水平与HIE患儿的严重程度亦呈正相关(r=0.733、0.807、0.799,P<0.05)。
3 讨论
HIE具有高致残率、高致死率的特点,已成为新生儿期危害最大的常见病之一。目前,HIE的诊断和预后评估主要依据病史、临床表现、电生理及影像学检查,但由于新生儿的神经系统发育不成熟,其临床表现往往是非特异性的,缺乏明显的神经系统症状和体征,因而易被漏诊,且影像学检查存在滞后性和局限性,因此,如何早期诊断HIE并给予积极的早期干预和治疗,对其预后有重要意义。
GFAP是星形胶质细胞独有的骨架蛋白,由 432 个氨基酸序列排列组成,相对分子质量为 50 000~52 000,主要参与胶质细胞骨架构成、细胞黏附,维持脑内髓鞘形成和神经元结构等,在神经再生和维持星形胶质细胞的形态功能中具有重要作用[4]。脑损伤后,星形胶质细胞被激活(星形细胞活化增生、胞体肥大、突起增多增长),GFAP的合成增多,脑脊液及血液中GFAP水平升高[5]。在脑损伤早期,活化的星形胶质细胞对脑组织具有一定的保护作用,但随后过度活化的胶质细胞又可形成胶质瘢痕,阻碍神经元轴突再生,加重神经元损害,研究发现,创伤性脑损伤、脑梗死、HIE发生后患者的血清GFAP 明显高于健康对照组[6]。UCH-L1也被称为神经元特异性蛋白基因产物9.5,是一种由223 个氨基酸组成的相对分子质量约为24 000的小分子酸性蛋白质,其通过泛素相关途径调节细胞的增生、分化和凋亡,并可能参与相关的神经退行性疾病、肿瘤等的发生和发展过程[7]。既往研究发现,脑脊液及血液中UCH-L1水平升高一般与脑神经细胞损伤或血脑屏障破坏相关[8-11]。动物实验表明,急性脑损伤发生后,大鼠的脑脊液和血清中GFAP、UCH-L1 水平均显著升高[12-13]。DOUGLAS-ESCOBAR等[14]、MIR等[15]研究发现,HIE患儿脐血血清GFAP、UCH-L1水平显著高于健康新生儿。CHALAK等[16]和 PRELIPCEAN等[17]研究显示,新生儿出生时的血清GFAP、UCH-L1水平随HIE严重程度加重而升高。另外,蒋曙红等[18]、张军建等[19]和魏超平等[20]研究发现,中、重度HIE患儿出生后各时间点的血清GFAP、UCH-L1水平高于轻度HIE 组。以上研究提示,HIE病情越严重,血清GFAP、UCH-L1水平越高。
本研究结果显示,出生第1天,中、重度 HIE 组患儿的血清GFAP、UCH-L1 水平显著高于对照组,表明在HIE早期神经元细胞和星形胶质细胞即遭受一定程度的破坏。出生第3天,轻、中、重度HIE组患儿血清GFAP、UCH-L1 水平均较出生第1天降低,但出生第7天时,重度HIE组GFAP、UCH-L1水平反而较出生第3天时再次升高,可能是由于出生后早期的对症支持治疗使患儿神经元细胞和星形胶质细胞破坏的程度得到一定改善,细胞释放的UCH-L1、GFAP开始减少;随后,星形胶质细胞活化增生,GFAP 快速合成,其含量增加,但重度脑损伤患儿星形胶质细胞存在过度活化,可导致神经元细胞损害,故细胞释放的UCH-L1再次升高;结果提示,GFAP、UCH-L1水平的持续升高或许能进一步反映患儿后期神经系统损伤的严重程度。另外,本研究结果显示,出生第1、3、7 天,血清GFAP、UCH-L1 水平均随HIE患儿病情程度的增加而呈增高趋势,与HIE患儿的严重程度呈正相关,与相关文献[4-7,14-21]报道基本一致,提示血清GFAP、UCH-L1水平可反映脑损伤的严重程度。
综上所述,足月HIE患儿血清GFAP、UCH-L1水平与病情严重程度呈正相关,因此,早期检测血清GFAP、UCH-L1水平对早期发现HIE患儿并进行干预有一定的指导意义。但由于血清GFAP及UCH-L1的检测试剂多种多样,每个厂家试剂的标准浓度及检测范围差异较大,各研究者的研究样本数量均较小,目前尚无相应的参考范围,未确定血清GFAP及UCH-L1 具体数值与疾病发生、发展及预后的关系,未来需开展多中心大样本的研究来进一步完善。

