非小细胞肺癌中BLK和p-BLK的表达及其临床意义
杨 瑛,杨永凤,倪银芸,李 丽,步 宏,,张 立,
肺癌发病率和病死率位居我国恶性肿瘤的首位[1],非小细胞肺癌(non-small cell lung carcinoma,NSCLC)占肺癌的80%,且恶性程度较高。NSCLC可分为不同的组织学类型,主要包括腺癌(adenocarcinoma, ADC)(≥40%)和鳞状细胞癌(squamous carcinoma, SCC)(30%),大细胞癌(large cell carcinoma, LCC)(10%)较少见[2]。目前肺癌的早期诊断和治疗仍是临床和科研的共同难题,患者确诊时多数已为中晚期,导致治疗方式局限,5年生存率仅为16%。因此,寻找有效的早期NSCLC分子诊断治疗靶点是当前亟需解决的问题。BLK属于Src酪氨酸激酶家族(SFK)成员,其家族基因均具有磷酸酪氨酸识别的SH2结构域和脯氨酸基序识别的SH3结构域,在细胞生长分化、迁移存活及肿瘤相关的多种细胞表面受体信号传导调节中起促进或抑制作用[3],在恶性淋巴瘤中BLK激活后发生磷酸化,磷酸化BLK(p-BLK)异常激活肿瘤相关信号通路促进肿瘤发生、发展。目前,BLK在NSCLC中的研究较少,且p-BLK蛋白在NSCLC中的表达尚未见报道。本文采用免疫组化SP法检测136例NSCLC中BLK和p-BLK蛋白的表达水平,分析两者表达与NSCLC临床病理特征的关系及与预后的相关性。
1 材料与方法
1.1 临床资料收集2008年1月~2013年12月四川大学华西医院存档的136例NSCLC标本,患者术前均未接受放、化疗。根据国际抗癌联盟标准确定TNM分期,根据WHO对NSCLC分类标准确定肿瘤分化程度和组织学类型,患者中位随访时间为36个月(范围1~60个月)。本实验经我院医学伦理委员会批准,患者均知情同意。
1.2 免疫组化标本均经10%中性福尔马林固定48~72 h,脱水和浸蜡,石蜡包埋,4 μm厚切片,67 ℃烤箱中烤片4 h以上。免疫组化采用EnVision两步法染色,将切片在二甲苯和梯度乙醇中进行组织脱蜡水化,在Tris-EDTA溶液中以微波抗原修复3次×8 min,室温3%H2O2中封闭内源过氧化物15 min。抗体和试剂:BLK(10510-I-AP,Proteintech公司)、p-BLK(AF8133,Affinity公司)、DAB显色液(K5007,Dako公司)。一抗工作液(BLK稀释比1 ∶100、p-BLK稀释比1 ∶200)经4 ℃孵育过夜,与二抗山羊抗兔IgG(Dako公司)37 ℃孵育50 min。DAB显色3 min,苏木精复染细胞核,切片脱水透明,中性树胶封固。
1.3 结果判断BLK和p-BLK蛋白阳性主要定位于细胞质,呈淡黄色至棕褐色为阳性。由两位病理医师进行双盲法阅片。每张切片随机选取6个高倍镜视野(200×),根据半定量评分系统,从肿瘤细胞的阳性细胞百分比和细胞染色强度进行评分。(1)按阳性细胞染色强度计分:无着色为0分,淡黄色为1分,棕色为2分,棕褐色为3分;(2)按阳性细胞百分比计分:阳性细胞数<10%为0分,10%~25%为1分,26%~50%为2分,>50%为3分。将两项得分结果相乘:0分为(-)阴性,1~2分为(+)低阳性,3~6分为()中阳性,>6分为()强阳性。
1.4 统计学分析使用SPSS 16.0软件进行统计学分析。采用χ2检验及Spearman χ2检验进行BLK、p-BLK的表达与临床病理特征的差异性分析,采用Kaplan-Meier生存曲线进行生存分析,Cox比例风险回归模型进行预后分析。以P<0.05为差异有统计学意义。
2 结果
2.1 NSCLC组织和癌旁正常肺组织中BLK和p-BLK的表达免疫组化结果显示,肺SCC和ADC组织中BLK和p-BLK表达均定位于细胞质(图1~4)。NSCLC组织中BLK中+低表达率(77.2%)和高表达率(22.8%)及p-BLK中+低表达率(86.8%)和高表达率(13.2%)均明显高于癌旁正常肺组织中BLK(13.3%)和p-BLK(6.7%),差异均有统计学意义(P<0.05,表1)。

图1 肺鳞状细胞癌组织中BLK的表达:A.低阳性;B.中阳性;C.强阳性;EnVision两步法 图2 肺腺癌组织中BLK的表达:A.低阳性;B.中阳性;C.强阳性;EnVision两步法

表1 非小细胞肺癌和癌旁正常组织中BLK和p-BLK的表达[n(%)]
2.2 NSCLC中BLK和p-BLK表达与临床病理特征的关系本组136例NSCLC患者中BLK表达缺失6例(4.4%),p-BLK表达缺失8例(5.9%),性别和年龄信息均缺失3例(2.2%)。NSCLC组织中BLK表达与分化程度呈正相关(P<0.05,表2),与患者性别、年龄、病理分型和TNM分期均无相关性。p-BLK表达与NSCLC临床病理特征均无相关性(P>0.05,表2)。
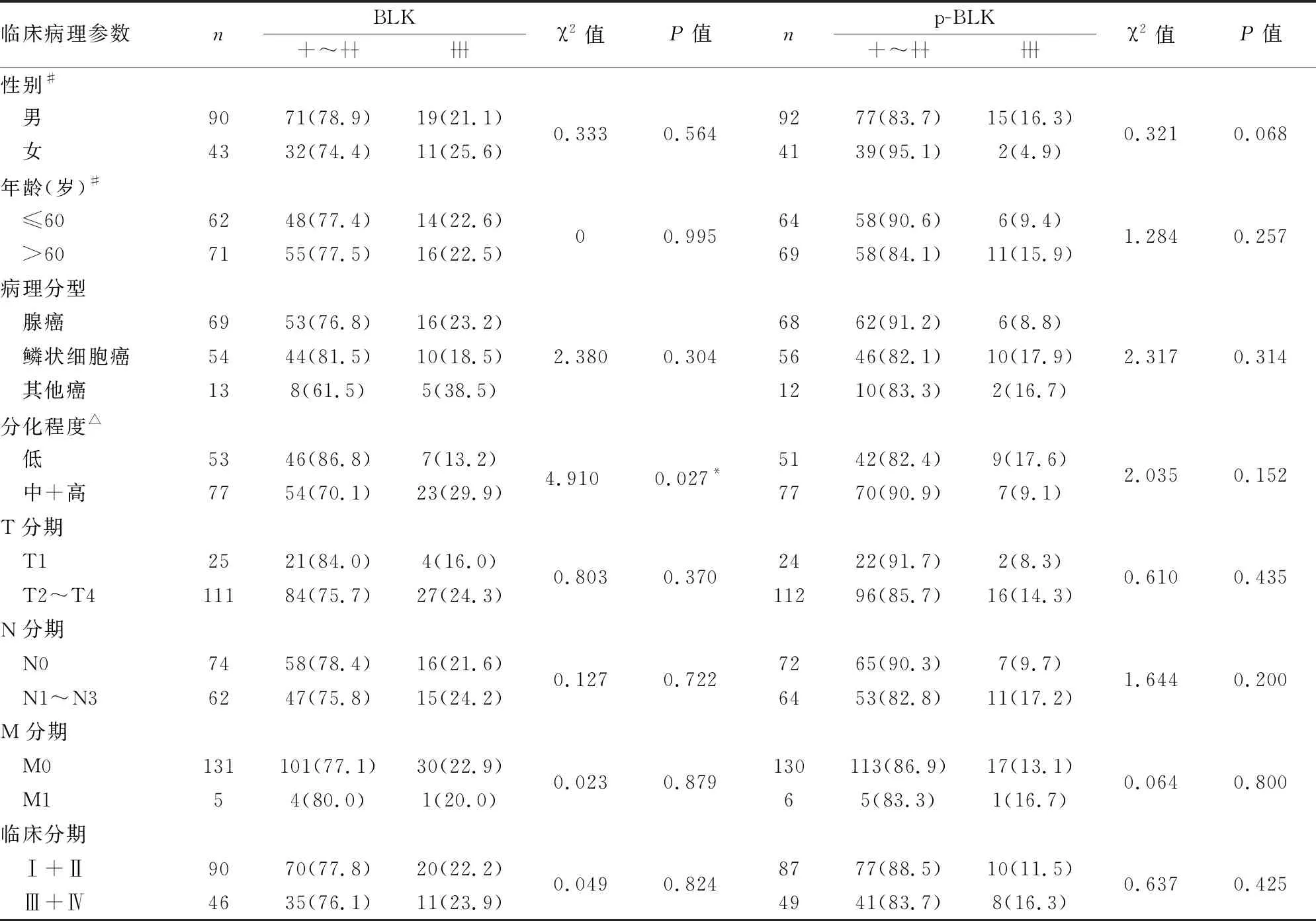
表2 非小细胞肺癌中BLK和p-BLK蛋白表达与临床病理特征的关系[n(%)]
2.3 NSCLC中BLK和p-BLK表达与预后的关系本组136例NSCLC患者有2例失访,通过Kaplan-Meier生存曲线分析BLK和p-BLK表达与患者5年生存率的关系。结果显示:BLK高表达与NSCLC患者的不良预后无相关性(P=0.127),但p-BLK中+低表达与肺SCC患者的不良预后有相关性(P<0.05)。BLK中+低表达/高表达的NSCLC患者分析结果显示,低分化亚组中BLK高表达的患者生存时间缩短,差异有统计学意义(P<0.05),BLK高表达患者在男性(P=0.273)、T2~T4(P=0.119)、N1~N3(P=0.056)、M0(P=0.130)、Ⅰ+Ⅱ期(P=0.115)中生存时间缩短,但差异无统计学意义(图5)。p-BLK中+低表达/高表达的NSCLC患者预后进行分析,p-BLK中+低表达与男性患者的不良预后呈正相关(P<0.05),p-BLK中+低表达患者在低分化(P=0.095)、T2~T4(P=0.183)、N1~N3(P=0.164)、M0(P=0.130)、Ⅰ+Ⅱ期(P=0.297)中生存时间缩短,但差异无统计学意义(图6)。由于本组病例数较小,未对远处转移的患者进行分析。
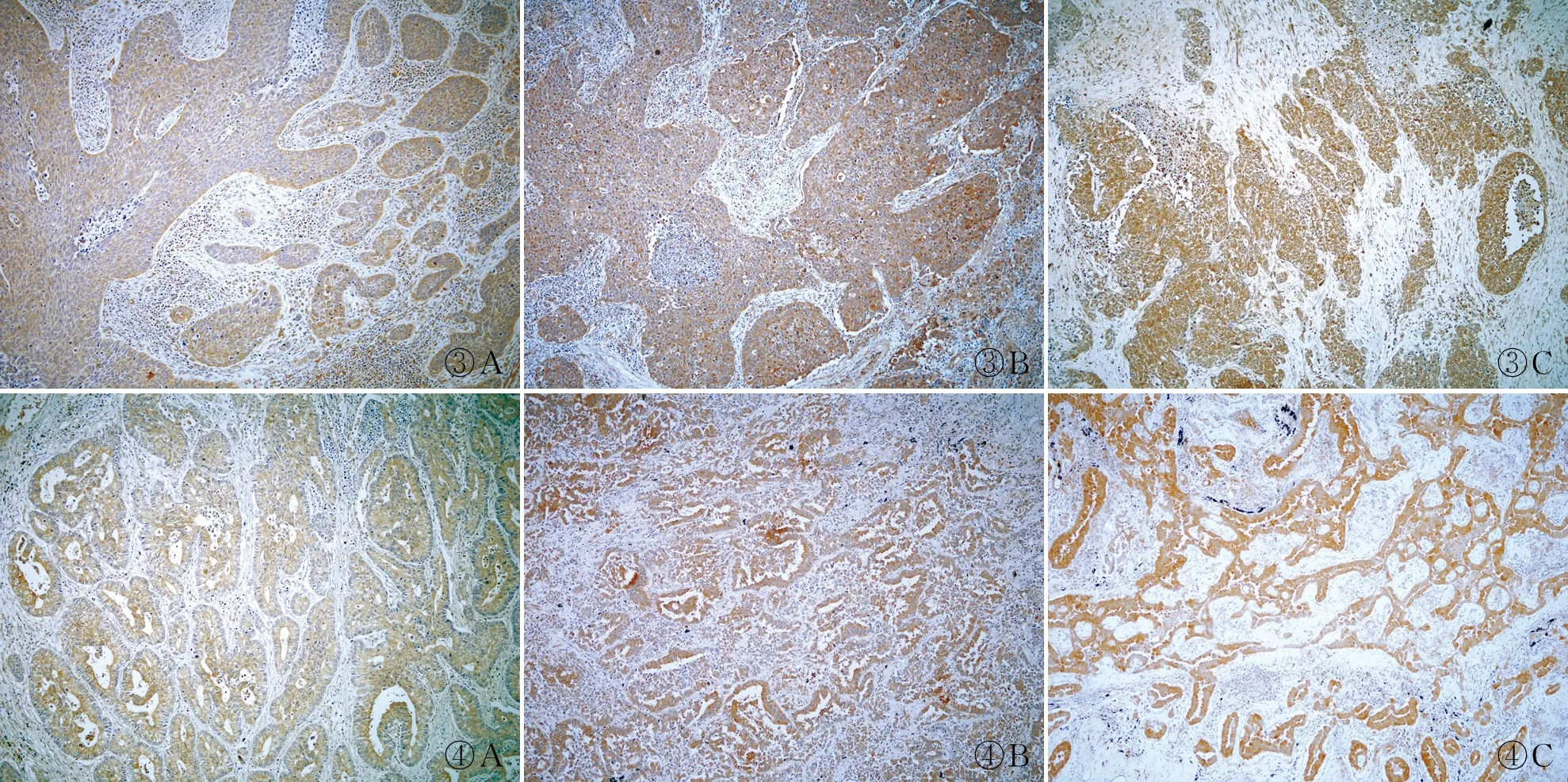
图3 肺鳞状细胞癌组织中p-BLK的表达: A.低阳性;B.中阳性;C.强阳性;EnVision两步法 图4 肺腺癌组织中p-BLK的表达: A.低阳性;B.中阳性;C.强阳性;EnVision两步法

图5 BLK蛋白表达与肺癌患者预后的关系: A.BLK表达与非小细胞肺癌患者生存期的关系;B.BLK表达与肺鳞状细胞癌患者生存期的关系;C.BLK表达与肺腺癌患者生存期的关系;D.BLK表达与低分化肺癌患者生存期的关系

图6 p-BLK蛋白表达与肺癌患者预后的关系: A.p-BLK表达与非小细胞肺癌患者生存期的关系;B.p-BLK表达与肺鳞状细胞癌患者生存期的关系;C.p-BLK表达与肺腺癌患者生存期的关系;D.p-BLK表达与男性肺癌患者生存期的关系
2.4 Cox回归模型分析NSCLC患者预后的影响因素根据NSCLC患者性别、分化程度、肿瘤浸润、淋巴结转移、远处转移、临床分期和BLK、p-BLK表达等变量,构建多因素Cox比例风险模型。结果显示:有淋巴结转移患者比无淋巴结转移患者生存时间明显缩短,差异有统计学意义(HR=2.496,95%CI=1.405~4.434,P=0.002);BLK高表达患者比中+低表达患者生存时间明显缩短,差异有统计学意义(HR=1.874,95%CI=1.035~3.394,P=0.038)。淋巴结转移和BLK高表达可做为影响NSCLC患者预后的独立危险因素(P<0.05,表3)。
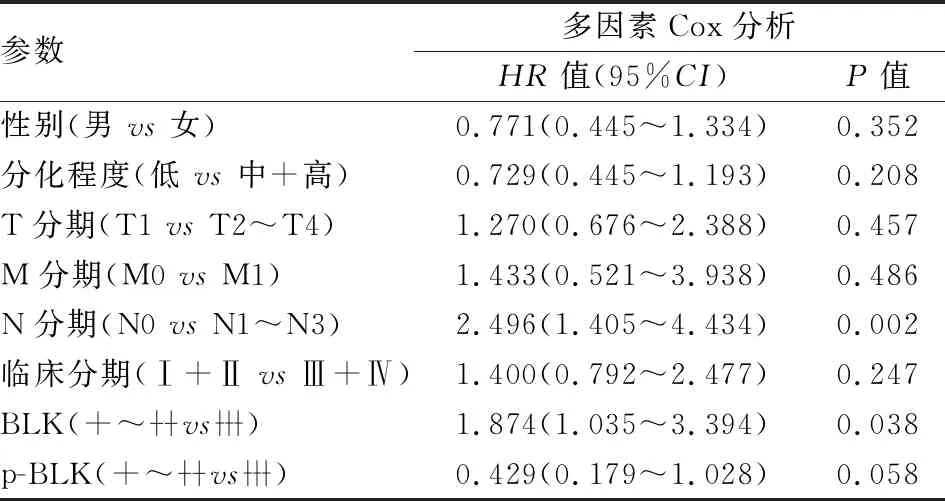
表3 多因素Cox分析非小细胞肺癌患者预后的影响因素
3 讨论
目前BLK基因的研究主要集中于自身免疫疾病,BLK基因位于8p23~p22区域,编码酪氨酸激酶BLK蛋白[4],参与B细胞受体信号传导和B细胞发育。研究表明,BLK表达上调可影响B淋巴细胞免疫耐受的机制,使个体易产生严重的自身免疫反应[5-6]。
SFK在肿瘤中的重要性已得到广泛认可,其成员在结肠癌、乳腺癌、肺癌和胰腺癌等多种恶性肿瘤中作为癌基因发挥作用,促进了SFK抑制剂的发展[7-9]。BLK作为SFK的成员之一,其表达与多种恶性肿瘤的致癌相关。研究发现皮肤T细胞淋巴瘤(cutaneous T-cell lymphoma, CTCL)患者的病变皮肤活检中,有恶性T细胞的BLK异位表达,且在体外促进CTCL细胞系的增殖,另BLK在T细胞白血病淋巴瘤(adult T-cell leukemia lymphoma, ATLL)耐药机制中也起重要作用[10-14]。有研究针对人BLK的致癌能力建立BLK活性依赖肿瘤小鼠模型,发现稳定表达BLK组成型活性人Ba/F3细胞移植在小鼠中形成肿瘤[15]。但在某些血液系统恶性肿瘤研究中发现BLK具有抑癌功能,与其激酶活性无关,文献报道BLK通路在小鼠慢性粒细胞白血病(chronic myelocytic leukemia, CML)干细胞中起抑癌作用,但不影响正常造血干细胞或造血[16]。本组中BLK和p-BLK在NSCLC组织中表达均定位于细胞质,高于正常肺组织中的阳性率,提示两者在NSCLC中具有重要作用。
恶性肿瘤中BLK的异位表达和组成型激活是潜在的致癌信号途径,其中DNA甲基化异常是基因表达异常的重要事件,也是最早被研究的重要表观遗传修饰之一,通过鉴定多种癌症的关键预后生物学标志物,可在分子水平研究肿瘤的发生、发展。有研究通过分析1 095个TCGA数据库中肺ADC的基因甲基化状态,发现包括BLK在内的10个异常甲基化和失调的基因与492例肺ADC患者的总生存率相关,其中BLK、CNTN2和WNT7A在肺ADC中的表达水平和患者生存率之间呈负相关,需进一步行预后分析或生物学实验进行验证。也有研究发现在人胶质母细胞瘤细胞中,增强子区域的DNA甲基化与转录因子相互作用,以激活基因表达并直接参与肿瘤细胞的迁移[17-18]。本组发现BLK表达与NSCLC分化程度呈正相关(P<0.05),但BLK高表达组患者在NSCLC低分化组中生存时间明显缩短(P<0.05),可能是由于BLK在NSCLC中的甲基化异常的影响,或样本数量较少有关。
目前,p-BLK与NSCLC的关系国内外尚无相关报道。本组结果显示,p-BLK表达定位于NSCLC细胞质,与BLK表达位置一致,p-BLK的中+低表达与肺SCC患者和男性患者的预后均呈正相关(P<0.05)。我国男性吸烟率(62.8%)远高于女性(3.1%),吸烟是男性肺癌的主要危险因素。国内外研究显示:吸烟与肺SCC关系尤为密切,随着吸烟剂量的上升而增强,非吸烟者中肺ADC占比呈上升趋势[19-20];提示p-BLK可能在男性肺SCC中具有重要作用,与患者吸烟情况的关系比较密切。
综上所述,本组肺癌中BLK和p-BLK蛋白的表达水平均高于正常肺组织,且BLK蛋白表达水平与低分化NSCLC患者预后具有相关性,p-BLK蛋白水平与男性肺SCC患者预后具有相关性,提示BLK和p-BLK在NSCLC发展和转移过程中具有重要作用。目前,多项研究证实BLK在恶性肿瘤中具有致癌或抑癌作用,其中主要研究方向为BCR信号异常和DNA甲基化,鉴于BLK在肺癌中的报道较少,其在肺癌细胞演进过程中的分子机制仍有待深入分析。

