乳腺癌术前MRI特征对保乳术中切缘阳性的预测价值分析
罗红兵,王春华,刘圆圆,陈哲,胥豪,周鹏,任静
乳腺癌是中国及全球女性发病率最高的恶性肿瘤[1-3]。目前,保乳术已成为早期乳腺癌的主要手术方式[4]。在保乳术中,肿瘤的切缘状态则是决定保乳手术是否成功及影响患者预后的关键因素[5]。MRI作为乳腺癌早期诊断、准确分期的重要检查方法[6-7],其具备全面、准确评估乳腺癌病灶范围的优势,已成为国内乳腺癌保乳术前的推荐检查方式[4]。本研究通过分析、比较浸润性乳腺癌保乳术中切缘阳性和阴性组病例的术前MRI特征和临床病理特征差异,探讨MRI特征对浸润性乳腺癌保乳术中切缘阳性状态预测的可行性及价值,旨在为乳腺癌保乳术前提供更精准和个性化的影像诊断信息。
材料与方法
1.研究对象
本研究回顾性收集本院2017年9月-2019年6月经手术后病理确诊且有完整术前MRI资料的浸润性乳腺癌(invasive breast carcinoma,IBC)患者共445例。排除以下病例:①3例为双乳癌;②66例临床病理数据不完整;③38例MRI检查前外院已行手术;④62例MRI检查前已接受化疗;⑤100例首次手术方式为乳房全切术。最终本研究共纳入176例(63.77%,176/276)首次手术方式为保乳术的病例进行分析,包括术中切缘为阳性病例56例(31.8%,56/176),最终12例(21.4%)切缘阳性病例手术方式改为乳房全切术,另44例(78.6%)最终手术方式仍为保乳术,术中切缘为阴性病例120例(68.2%,120/176)。所有患者均为女性。既往手术方式的选择是由乳腺外科医生,根据患者意愿、病灶情况等综合因素进行的选择,而本中心的保乳手术的适应证是:对有保乳意愿,能够达到切缘阴性及满意外形效果的患者选择保乳手术。而保乳手术的绝对禁忌证:病灶广泛且难以达到切缘阴性,又不可耐受放疗的患者。对保乳治疗后存在局部复发相关的危险因素的患者,可以在取得患者充分知情的前提下,外科医生根据具体情况选择行保乳手术。这些危险因素包括:①活动性结缔组织病,尤其是硬皮病和系统性红斑狼疮或胶原血管疾病者,对放疗耐受性差。②多中心病灶(多中心病灶指在2个或2个以上象限存在1个及以上病灶,或病理学类型和分子分型完全不一样的两个乳腺病灶)。③同侧乳房既往接受过乳腺或胸壁放疗者,需获知放疗剂量及放疗野范围。④肿瘤直径大于5 cm。⑤侵犯乳头(如乳头Paget’s病)。⑥已知乳腺癌遗传易感性强(包括BRCA1/2等已知的致病性突变),保乳术后同侧乳腺肿瘤复发风险增加的患者[4]。本研究经本院伦理委员会审核通过(审批号SCCHEC2015029)。
2.MRI扫描方法
采用Siemens Skyra 3.0 T磁共振扫描仪,专用16通道双侧乳房相控线圈,取俯卧位且头先进,双侧乳房自然悬垂于线圈内。扫描范围包含双侧乳腺组织及腋窝,扫描序列[8-9]为:平扫横轴面和矢状面T2WI扫描:使用TIRM序列, TR 3570 ms,TE 70 ms,层厚4.0 mm,层间距1.5 mm,FOV 340 mm×340 mm,采集矩阵358×448。横轴面Resolve-DWI扫描,TR 5700 ms,TE 66 ms,层厚5.0 mm,采集矩阵86×192,分段采集次数 3,b值分别取0 s/mm2和800 s/mm2。动态增强多期MRI扫描:采用超快速并行采集技术(CAIPIRINHA)、水脂分离压脂技术(Dixon)及时间分辨交叉随机轨迹成像(TWIST)三种技术的容积插入法屏气扫描检查(CDT-VIBE)序列,TR 5.64 ms,TE 3.69 ms,FOV 360 mm×360 mm,矩阵224×179,层厚2.5 mm,采用无间隔扫描,翻转角10°,共采集图像26期,单期时间分辨率约为13 s,总采集时间6分钟左右。横轴面薄层延迟期扫描:采用横轴面VIBE序列,TR 4.1 ms,TE 1.6 ms,FOV 320 mm×320 mm,矩阵448×358,层厚0.8 mm,翻转角10°。动态增强扫描开始前按0.1 mmol/kg体重注射钆双胺注射液,流率2.5 mL/s,后追加15 mL生理盐水以同样流率注射。
3.MRI分析及特征提取
由2名从事乳腺影像诊断的高年资医师,在不知道病理结果的情况下,依据乳腺影像报告和数据系统(breast imaging reporting and data system,BI-RADS)结合乳腺磁共振检查及诊断规范专家共识[10],对所有患者术前乳腺MRI资料进行独立分析,意见不统一时协商达成一致。每个病例需分析的MRI特征包括:①乳腺纤维腺体组织(fibro-glandular tissue,FGT)构成分类:a类(全脂肪类)、b类(散在纤维腺体类)、c类(不均质纤维腺体类)和d类(绝大部分纤维腺体类);②乳腺病灶同侧和对侧的乳腺实质背景强化(background parenchymal enhancement,BPE)类型:几乎不强化型、轻微强化型、中度强化型和明显强化型;③病灶类型:分为肿块,非肿块样强化(non-mass-like enhancement,NMLE)型;④针对肿块型病灶测量病灶最长径(增强后动脉早期序列测量),单位为毫米,分析肿块病灶形态(分为圆形、卵圆形和不规则两类),肿块病灶的边缘(分为清晰和不规则、毛刺状两类);⑤针对NMLE病灶评价其分布特征:分为小范围分布(包括线状、叶段分布或局灶分布)和大范围分布(包括区域、多区域或弥漫分布);⑥评价是否存在多中心病灶(多中心病灶指在2个或2个以上象限存在1个及以上病灶)。
4.病理资料
从每个病例手术后病理报告中提取病理资料:①术中切缘阳性的判定标准:依据术后的病理报告结果,在术中取材部位包括肿瘤中心、不同方向的肿瘤肉眼边界、切缘和肿瘤周围组织,且分别在肿瘤上下、左右、前后切缘6个点取材全面分析切缘情况,当距残端2 mm以内有癌细胞者判定该患者为切缘阳性病例[11]。②并收集基本病例诊断资料:包括每个病灶的病理诊断,细胞分级,是否伴有导管原位癌(intra-ductal carcinoma in situ,DCIS),淋巴结转移情况,ER、PR、HER2表达情况和Ki-67表达情况(根据Ki-67指数<20%为低表达,而≥20%为高表达)[12]。
5.统计学处理方法
采用SPSS 20.0软件处理数据。连续数据采用平均值±标准差表示,分类数据采用赋值的方式。采用独立样本t检验比较保乳术中切缘阳性与切缘阴性组间连续数据的差异,根据具体情况采用Pearson或连续校正的卡方检验比较两组间各分类数据的差异;将经单因素分析后有P<0.1的MRI特征和基本临床病理特征,进行多因素Logistic回归分析(采用向前LR法)。最后通过受试者操作特征(receiver operating characteristic,ROC)曲线并计算曲线下面积(area under curve,AUC)来评价回归模型对保乳术中切缘阳性的预测诊断效能。以双侧P<0.05为差异有统计学意义。
结 果
1.纳入研究病例基本情况和病理类型分布
本研究176例浸润性乳腺癌中:保乳术中切缘阳性组病例为56例(31.8%,56/176),年龄31~77岁,平均年龄约49岁,含2例浸润性小叶癌,1例浸润性微乳头状癌,1例伴有大汗腺特征和1例为伴髓样特征的癌,余51例为非特征类型浸润性癌;保乳术中切缘阴性组病例为120例,年龄31~78岁,平均年龄为47岁,含1例浸润性小叶癌,1例化生性癌,2例髓样癌,4例乳头状癌,余112例为非特殊类型浸润性癌。
2.两组间基本临床、病理资料单因素比较结果
两组的各项基本临床和病理特征,经单因素分析结果显示,除浸润性癌伴导管原位癌(ductal carcinoma in situ,DCIS)成分(F=21.475,P=0.000)和HER2阳性表达(F=5.663,P=0.017)差异有统计学意义外,其余各项临床及病理特征差异均无统计学意义(表1)。

表1 两组间基本临床及病理特征比较
3.两组间MRI特征的单因素比较结果
所有MRI特征经单因素分析显示,保乳术中切缘阳性组的MRI测量的病灶最长径(24.4±9.0)mm与术中切缘阴性组间病灶MRI测量最长径(20.5±6.9)mm间差异有统计学意义(t=3.162,P=0.002);且在切缘阳性组中,存在多中心病灶的比率(32.1%,18/56)要高于切缘阴性组中存在多中心病灶的比率(7.5%,9/120),F=17.853,P<0.001;切缘阳性组中NMLE病灶类型的比率(19.6%,11/56)也要高于切缘阴性组中NMLE的比率(3.3%,4/120),F=11.019,P=0.001(表2,图1、2)。
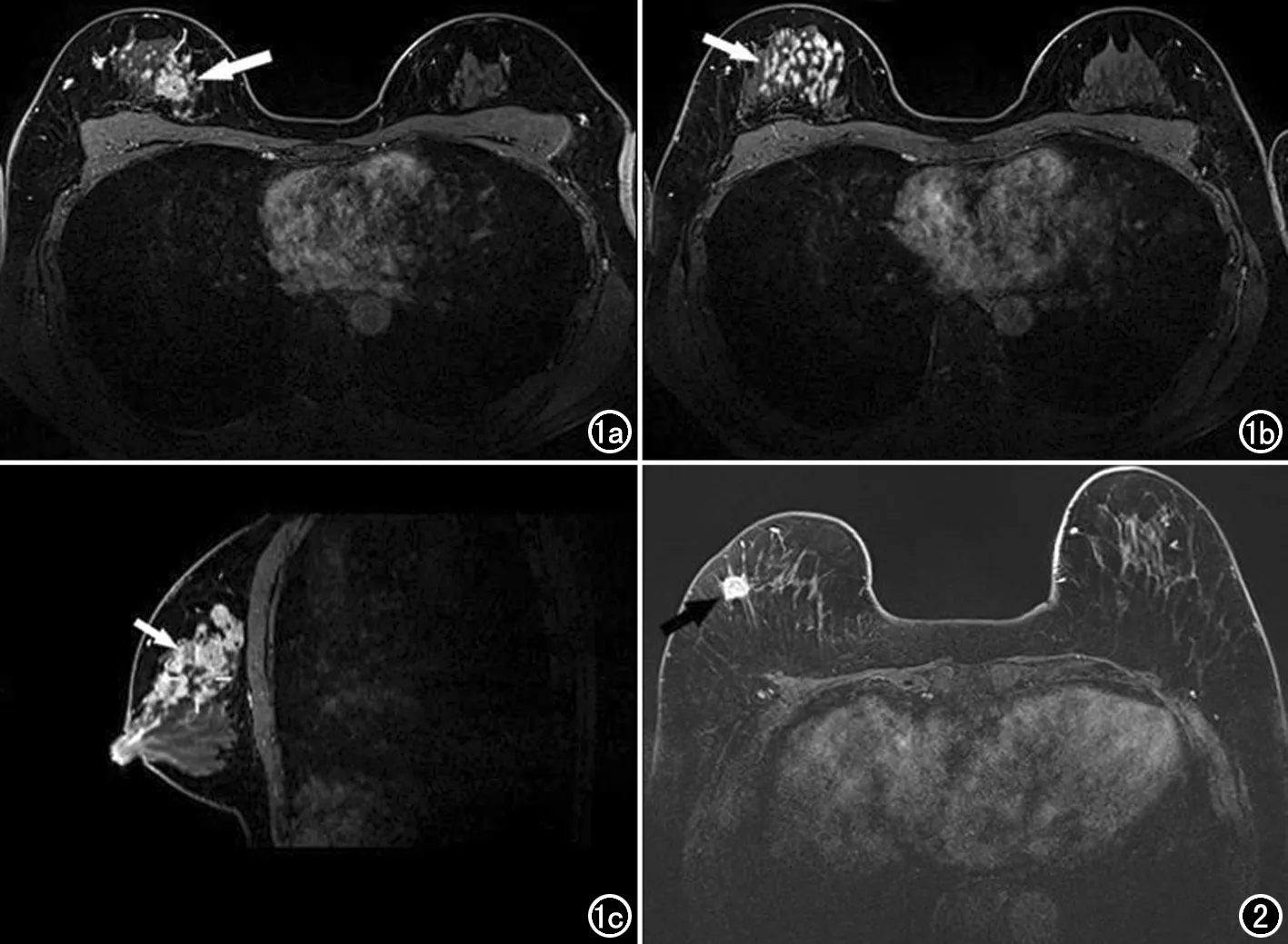
图1 女,31岁,首次保乳术中切缘阳性,术后病理确诊为非特殊类型浸润性癌II级,伴50%区域为导管原位癌成分(中核级,粉刺型)。a)增强早期MRI图像示肿块样主病灶(箭),大小约24mm×16mm; b) 增强早期邻近层面图像示多中心病灶特征(箭); c) 增强MRI矢状面图像示主病灶周围多区域分布的非肿块样强化特征(箭)。 图2 女,68岁,首次保乳术中切缘阴性,术后病理确诊为非特殊类型浸润性癌II级。MRI增强早期示病灶为孤立肿块,大小18mm×15mm。
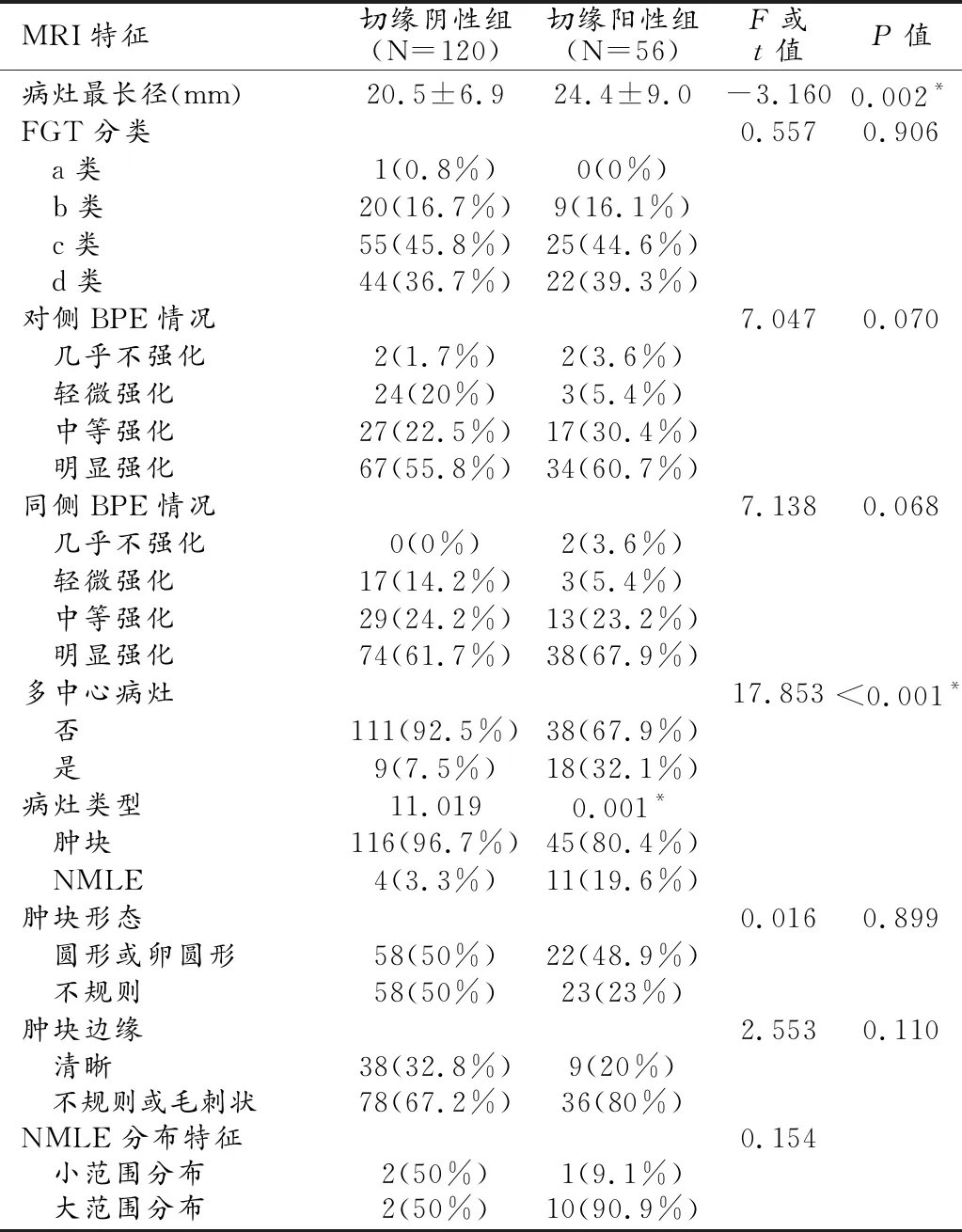
表2 两组间主要MRI特征比较
4.多因素Logistic回归分析结果及模型诊断效能
将经单因素分析后有P<0.1的MRI特征包括病灶最长径(P=0.002),存在多中心病灶(P<0.001),病灶类型(P=0.001),同侧BPE(P=0.068)和对侧BPE(P=0.070)情况,以及基本临床病理特征包括是否伴DCIS成分(P<0.001),HER2表达状态(P=0.017)进行多因素Logistic回归分析。结果显示,对浸润性乳腺癌保乳术中切缘阳性预测最有价值的特征是多中心病灶(OR=4.381,P=0.004),浸润性癌伴DCIS成分(OR=4.211,P<0.001),较大的病灶最长径(OR=1.796,P=0.019),其回归模型对术中切缘阳性预测诊断的曲线下面积为0.750(表3,图3)。

图3 回归模型对浸润性乳腺癌在保乳术中切缘阳性的预测诊断价值ROC曲线。

表3 回归分析结果显示对保乳术中切缘阳性有预测价值的特征
讨 论
在过去几十年间,乳腺癌的手术方式已发生了革命性的变化。很多权威研究结果[13-18]显示,保乳手术在切缘阴性基础上联合局部放疗,能达到与全乳切除术疗效一致而生活质量显著提高的治疗效果。因此,保乳术已经成为目前早期乳腺癌标准的治疗策略[4]。然而,乳腺癌保乳术后局部复发是影响患者预后的关键临床问题,既往研究显示[5,19-20]保乳术中切缘阳性则是乳腺癌保乳术后局部复发的关键因素。本研究通过对保乳术前乳腺癌影像特征、基本临床病理特征的分析和比较,帮助乳腺科医生对保乳术中切缘状态进行更个性化的术前评估和预测,旨在降低保乳术中切缘阳性率,提高保乳手术成功率及患者的预后。单因素分析结果示MRI特征中病灶最长径,存在多中心病灶,NMLE的病灶类型,和病理特征中的浸润性癌伴DCIS成分,HER2阳性表达是乳腺癌保乳术中切缘阳性的预测因素;而多因素分析结果示,多中心病灶(OR=4.381,P=0.004)、浸润性癌伴DCIS成分(OR=4.211,P=0.000)和较大的病灶最长径(OR=1.796,P=0.019)是预测浸润性乳腺癌保乳术中切缘阳性最有价值的因素。
MRI作为乳腺癌保乳术前评估的重要手段,其在全面评估乳腺癌病变范围[21],发现多中心病灶[11]等方面,要明显优于乳腺X线摄影术和超声检查[22-24]。既往国内外研究也表明[25-28],MRI可以降低乳腺癌保乳术中的切缘阳性率和再次手术率。本研究和既往Bae等[29]、Kang等[30]及Van等[31]研究都显示,在MRI特征中,乳腺癌多中心病灶和MRI测量的病灶大小是浸润性乳腺癌保乳术中切缘阳性的重要预测因素,且多中心病灶是更重要的MRI特征。而且近期一项针对19272例患者的Meta分析结果也显示[32],多中心病灶与保乳术后乳腺癌局部复发风险增加密切相关。依靠MRI较好的软组织分辨率和多序列、多功能成像的优势,使MRI对乳腺癌多中心病灶的检出和诊断,要明显优于钼靶和超声检查[4,11]。所以基于上述研究结果,影像医生在对浸润性乳腺癌保乳术前MRI评估时,要特别注意对多中心病灶的发现、甄别和诊断,以减少这类患者术中切缘阳性的风险,提高保乳手术成功率和预后。
在本研究中,浸润性癌伴DCIS成分这个术后病理特征是另外一个保乳术中切缘阳性的重要预测因素,与既往Kang等[30]及Van等[31]研究结果类似。Bae等[29]研究结果也显示术前穿刺病理的浸润性癌伴DCIS成分是保乳术中切缘阳性的危险因素。虽然通过穿刺或术后病理可以明确诊断浸润性癌伴DCIS,但作为预测保乳术中切缘阳性的术前预测因素,只能依靠术前穿刺病理才有临床应用前景。然而术前穿刺往往都是针对浸润性癌病灶中心区域进行,但实际上DCIS成分却常常出现在浸润性癌周围,所以大大限制了术前穿刺病理在发现浸润性癌伴DCIS的敏感性[31]。已有的研究结果显示MRI对DCIS的检出率可高达92%,是明显优于乳腺X线摄影术[22-23]的影像检查方法,而且MRI还具备更全面、准确评估DCIS病变范围[21,33]的能力。所以如何能依靠MRI征象,帮助乳腺外科医生在保乳术前能更高效地发现并诊断浸润性癌伴DCIS这个术中切缘阳性的重要预测特征,是未来乳腺癌保乳术前MRI评估中一个重要且值得深入研究的临床问题。既往Kuhl等[27]通过MRI引导活检并标记的方法,提高了浸润性癌伴DCIS的诊断率并显著降低了保乳术切缘的阳性率,已经初步展示了术前MRI对浸润性癌伴DCIS准确评估的临床应用价值和前景。
笔者的单因素研究结果显示NMLE的病灶类型,HER2阳性表达是浸润性乳腺癌保乳术中切缘阳性的预测因素,但经多因素分析后,这些因素却没有明显统计学意义。既往也有研究显示HER2阳性是保乳术中切缘阳性的预测因素[34-35]。这些不同的研究结果,分析原因可能与不同研究样本的构成差异有关,如在杨阳等[35]的研究样本中只纳入HER2过表达型(激素受体阴性)病例数仅9例,而本研究中既纳入HER2过表达型,也纳入了Luminal B(HER2阳性)型的HER2阳性病例进行研究。既往Park等[34]和Bae等[29]研究中还发现BPE也是保乳术中切缘阳性的预测因素之一。笔者也研究了同侧和对侧BPE状态对保乳术中切缘阳性预测的价值,但结果显示即使在单因素分析中P值都小于0.1,却都没有统计学差异,在纳入多因素分析后同样没有统计学差异。这些相对矛盾的研究结果,首先可能与目前多数关于BPE研究还是依据BI-RADS分级而进行的四分类定性研究有关,所以在BPE评价过程中就不可避免地存在主观偏倚。其次笔者还发现在不同研究中,对BPE进行统计分析采用的分组方法也有很大差异,如Park等[34]在统计分析时将BPE只分成弱强化型和明显强化型两组;而Bae等[29]依据BPE四分类进行分组分析时没有统计学差异,后将BPE分为轻微强化和其他(轻度、中等、明显强化)两组后,才具有了统计学差异。这些BPE评价的主观偏倚和不同研究者在统计分析时对BPE分组方法的差异,也许是BPE与保乳术中切缘阳性关系研究结果的差异性和不可重复性的重要原因,未来定量化BPE研究可能是克服这些研究差异的重要方法之一[36]。
本研究也存在一定的局限性,如限于回顾性研究的性质,既往不同临床医生在把握保乳手术指针时也可能存在差异,从而可能不可避免地造成部分纳入研究病例的选择偏倚。
总之,术前病灶大小、多中心病灶的MRI特征以及浸润性乳腺癌伴DCIS成分是浸润性乳腺癌在保乳术中出现切缘阳性最有价值的预测因素,这有利于影像和临床医生对乳腺癌做出更准确和个性化的术前评估。

