南蛇藤属植物化学成分及药理作用研究进展
肖本游,王发松,刘 瑶,张昌鹏,肖 强,崔令军
南蛇藤属植物化学成分及药理作用研究进展
肖本游,王发松,刘 瑶,张昌鹏,肖 强,崔令军*
生物资源保护与利用湖北省重点实验室(湖北民族大学),湖北 恩施 445000
南蛇藤属L.植物资源丰富,包含50多个种,在我国分布广泛。该属化学成分多样,主要包括β-二氢沉香呋喃型倍半萜、三萜和黄酮等化合物,药理作用广泛,具有抗肿瘤、抗菌、抗炎、调血脂等作用。但目前关于南蛇藤属植物综述性报道较少,通过对近年来关于南蛇藤属植物化学成分及药理作用的相关研究进行归纳总结,以期为后续深入研究和开发利用南蛇藤属植物提供参考。
南蛇藤属;化学成分;抗肿瘤;抗菌;抗炎;调血脂;β-二氢沉香呋喃型倍半萜;抗肿瘤
南蛇藤属L.系卫矛科(Celastraceae)植物,为藤状灌木。该属植物包含50多个种,分布于世界各地,常见的有灯油藤、独子藤、苦皮藤、显柱南蛇藤等,我国约有30种分布于各地[1]。目前研究发现,南蛇藤属植物萜类成分较为丰富,此外还含有生物碱、黄酮等成分。现代药理研究表明,该属植物具有良好的抗肿瘤、抗炎、抗菌、抗病毒[2]等药理活性。目前,南蛇藤属植物化学成分及药理作用的研究比较多,本文对近年来南蛇藤属植物化学成分及药理活性方面取得的最新研究进展进行归纳总结和简要分析,以期为南蛇藤属植物资源的进一步研究与开发利用提供参考。
1 化学成分
南蛇藤属植物大多含倍半萜、二萜、三萜和黄酮等化合物,其中以倍半萜的种类最为丰富,其构型主要是β-二氢沉香呋喃型倍半萜型。二萜类主要是松香烯型,三萜类主要是齐墩果烷型、乌苏烷型、木栓烷型和羽扇豆烷型;同时还含有脂肪酸、挥发油等物质。
1.1 β-二氢沉香呋喃型倍半萜
2021年Mu等[3]从南蛇藤种子中分离得到29种β-二氢沉香呋喃型倍半萜化合物,其中17种新化合物,12种已知化合物。2021年廖怀玉等[4]从苦皮藤中发现2个β-二氢沉香呋喃型倍半萜新化合物。2021年Chen等[5]从苦皮藤中分离得到3个新化合物。2019年黎汝林[6]从显柱南蛇藤果实中分离得到12个β-二氢沉香呋喃型倍半萜新化合物。β-二氢沉香呋喃型倍半萜是南蛇藤属发现最多的化合物种类,其母核主要为β-二氢沉香呋喃型倍半萜(图1),其取代基位点多,取代基种类也较多,多为羟基、苯甲酰氧基、乙酰氧基、呋喃甲酰氧基等(图2),共同组成了各种不同的结构,具体见表1。
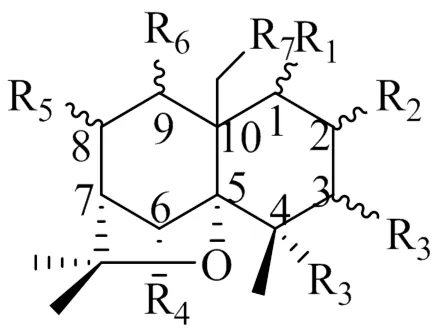
图1 β-二氢沉香呋喃型倍半萜基本母核结构
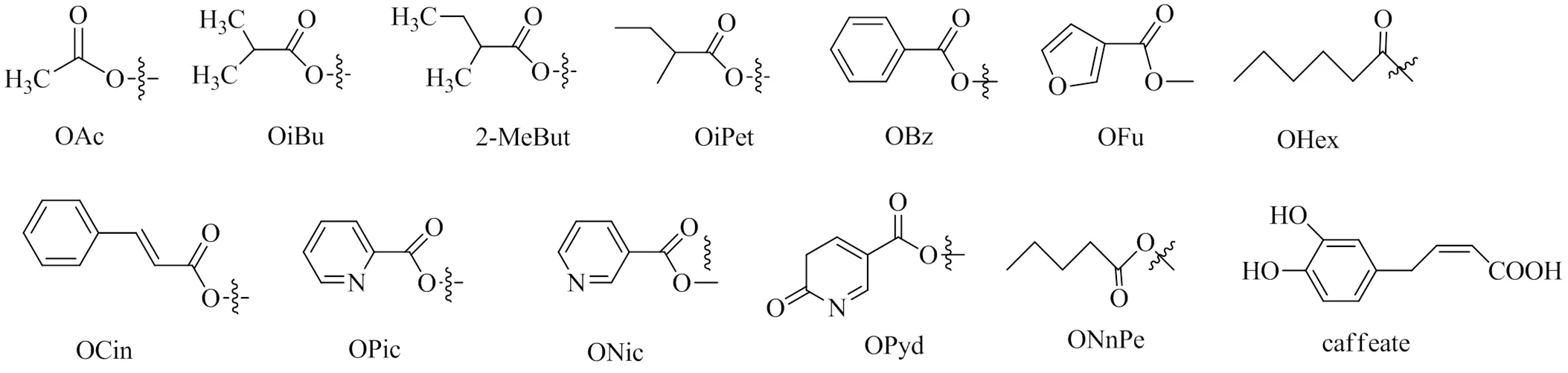
图2 常见取代基
表1 南蛇藤属中的β-二氢沉香呋喃型倍半萜型化合物
Table 1 β-Dihydroagarofuran sesquiterpene from Celastrus
编号取代基文献 R1R2R3R4R5R6R7 1OAc=OHOAcαOAcαOAcOAc3 2αOAcHOAcαOHHHH3 3αOCinHOAcβOAcHHH3 4αOAcβOHOAcαOAcHHH3 5αOAcβOHOHαOAcHHH3 6αOHHOAcαOAcHHH3 7αOAcβOAcOAcαOAcHHH3 8αOAcαOCinHOAcαOAcαOBzH3 9αOAcβOAcHOCinαOHβOBzH3 10αOAcαOAcOAcOAcOAcHH3 11αOAcαOHHOCinβOAcβOBzH3 12αOAcβOHHOAcβOHβOBzH3 13αOAcβOAcHOAcβOHβOBzH3 14αOAcβOAcHOAcαOHexβOBzH3 15βOAcαOAcHOBzHβOBzH3 16αOHβOHHOAcβOHβOBzH3 17αOAcHHOAcαOAcαOBzH3 18αOAcβOAcHOAcβOAcβOAcH3 19αOAcβOAcHOCinβOAcβOAcH3 20αOAcβOAcHOAcβOAcαOBzH3 21αOAcαOCinHOAcαOAcαOBzH3 22βOAcαOAcHONicβOAcβOBzH3 23αOAcHHOAcHβOBzH3
续表1

编号取代基文献 R1R2R3R4R5R6R7 24αOAcHHOBzHβOBzH 3 25αOAcHHOCinHβOBzH 3 26αOAcβOAcHOCinHβOBzH 3 27αOAcHHOAcαOAcβOBzH 3 28OAcOAcOHOHOiPetOBzOAc 4 29OAcOBzOHOHOiBuOBzOAc 4 30OFuOFuOHOHOiBuOBzOAc 5 31OAcOFuOHOAcOiBuOBzOAc 5 32OAcOAcHOAcOiBuOBzOAc 5 33OAcOAcHOAcHOBzH 6 34OAcHHOAcOBzOBzOAc 6 35OCinHHOAcOBzOBzH 6 36OAcOAcHOAcHOCinOBz 6 37OAcHHOAcOMeButOBzOAc 6 38OAcHHOAcHOCinOBz 6 39OAcOBzOHOAcHOCinH 6 40OAcOAcHOAcOHOCinH 6 41OAcOBzHOHHOCinOBz 6 42OAcHHOHHOCinOBz 6 43OAcOHHOAcHOCinOBz 6 44OCinHHHOAcOBzOAc 6 45OBzHOHOCinHOBzH 7 46OAcHOHHOAcOBzOAc 7 47OBzOAcOHOCinHOBzH 7 48OAcOBzHOBzOAcOBzH 8 49OAcOAcHOAcOAcOBzH 8 50OAc=OHOAcOAcOBzH 8 51OAcOAcHOAcHOBzH 8 52OAcOAcHOCinHOBzH 8 53OAcOAcHOAcOHOBzH 8 54OAcOAcHHOCinOBzH 8 55OAcOAcHOAcOAcOBzOAc 8 56OAcOAcHOAcOAcOBzH 8 57OAcOAcHOCinOAcOBzH 8 58OAcOAcHHOAcOBzH 8 59OAcOAcOAcOAc=OOAcOAc 8 60OBzOBzH2-MeButOHOAcH 9 61OAcHHHOBzOBzOCin10 62OAcOAcHHHOBzOCin10 63OCinOHOHOAcOAcOAcOAc10
续表1
续表1

编号取代基文献 R1R2R3R4R5R6R7 107OHHHOAcOAcOBzH17 108OAcOAcHOAc=OOAcOAc17 109OAcOAcOHOAcOAcOBzOAc17 110OAcOAcHHOAcOBzOAc17 111OAcOAcHOAcOAcOBzH18 112OAcOAcHOBzOAcOBzH18 113OAcOAcHOCinOAcOBzH18 114OAcβOAcHOAcOAcOBzH18 115OAc=OHOAcOAcOBzH18 116OAcOAcHOAcHOBzH18 117OAcOAcHOCinHOBzH18 118OAcOAcHOAcOHOBzH18 119OAcOAcHHOAcOBzH18 120OAcαOCinHOAcOAcOBzH18 121OAcOAcHOAcOAcOBzH18 123OAcOAcHOAcOAcOBzH18 124OAcOAcHOAc=OOAcOAc18
1.2 生物碱
生物碱一般是指存在于生物体内的一类含氮有机物,南蛇藤属植物目前发现的生物碱,主要是β-二氢沉香呋喃型倍半萜母核上连有含氮基团(125~148),如α-吡啶甲酰基或β-吡啶甲酰基等,其还有一种特殊的构型,即β-二氢沉香呋喃型倍半萜母核与吡啶环通过二酯键形成大环(149~151),母核见图3,具体化合物见表2。
1.3 二萜
研究发现,二萜类化合物在南蛇藤属植物中的相对较少,目前只有12种,具体见表3,化合物(152~163)结构式见图4。
1.4 三萜
多数三萜是由30个碳原子组成的萜类化合物,南蛇藤属植物中三萜类化合物种类多样,目前已发现大多为五环三萜,如木栓烷型、齐墩果烷型、羽扇豆烷型、达玛烷型、乌苏烷型和何帕烷型等。
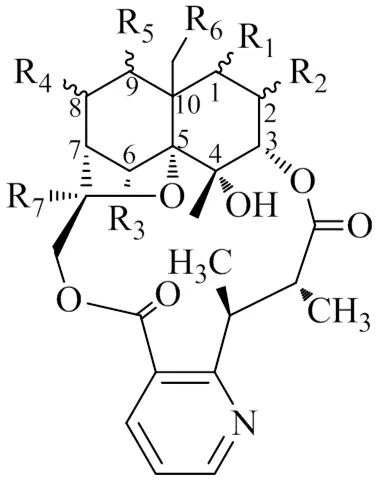
图3 含吡啶环的环形β-二氢沉香呋喃型倍半萜母核
1.4.1 木栓烷型 目前从南蛇藤属中分离鉴定的木栓烷型三萜有56种左右,木栓烷型三萜上的取代位点较多,取代基多以羟基、羰基、羧基最常见。目前研究发现,木栓烷型三萜主要存在于南蛇藤根皮部位。陈铭祥等[22-26]在2013~2020年,从独子藤中根皮陆续分离出27种木栓烷型三萜。王奎武[27]从粉背南蛇藤和短梗南蛇藤根皮中分离得到6种木栓烷型三萜。具体见表4、5和图5。
1.4.2 齐墩果烷型 目前从南蛇藤属植物中分离得到齐墩果烷型三萜大多都是游离态,少见有成酯或成苷的结合态。分析发现,目前的主要研究集中在南蛇藤属植物中小极性部位的分离,少见正丁醇等大极性部位的分离。其齐墩果烷母核上常见羟基、咖啡酰基、甲基、羧基等,具体见表6和图6。
1.4.3 羽扇豆烷型 羽扇豆烷型三萜中的E环为五元环,且在E环的19位上有α-构型取代的异丙基,母核结构见图7。目前从南蛇藤属植物中的灯油藤、粉背南蛇藤、皱叶南蛇藤、短梗南蛇藤、苦皮藤等中分离得到10余种的该构型三萜,具体见图7和表7、8。
表2 南蛇藤属中β-二氢沉香呋喃型生物碱
Table 2 β-Dihydroagarofuran sesquiterpene with pyridine alkaloids from Celastrus
编号取代基 R1R2R3R4R5R6R7文献 125OAc=OHOAcβONicβOBzH 3 126αOAcαOAcHOCinHβONicH 3 125OAc=OHOAcβONicβOBzH 3 126αOAcαOAcHOCinHβONicH 3 127αOAcβOAcHOAcαOAcβONicH 3 128OAcOAcHHOAcOBzONic17 129OAcOAcHHONicOBzH18 130OAcOAcHONicOAcOBzH18 131αOAcαOiBuβOHβOHβONicαOBzOAc19 132αOAcαOFuβOHβOAcαOiBuβONicOiBu19 133αOAcHHHβOBzαONicONic19 134αOAcHHHβOHαOBzONic19 135αOAcHHHβ2-MeButαOBzONic19 136αOAcHHHβOiBuαOBzONic19 137αOAcHHHαOBzαOBzONic19 138αOAcαOAcHHβOAcαOBzOPic19 139αOAcαOiBuβOHβOHβONicαOBzOAc19 140αOAcαOFuβOHβOAcβOiBuβONicOiBu19 141αOAcαOAcHHβOAcαONicONic19 142αOAcαOAcHHβOAcαONicONic19 143αOiBuHHHβOAcαONicONic19 144αOnPeHHHβOAcαOBzONic19 145αOAcαOAcHβOAcαONicαOBzOAc19 146αOHαOAcHβOAcαONicαOBzOAc19 147αOAcHHHβOAcαOBzONic19 148αOAcHHHβOAcαONicOBz19 149OAcONicOAcOiButOAc 20 150OBzOAcOBzOAcOBz 20 151OAcOPydOAcOAcOAc 20
表3 南蛇藤属中二萜类化合物
Table 3 Diterpenoid compound from Celastrus
编号化合物文献 152aculeatusane A21 153ent-kaur-15-en-19,20-olide20 154(–)-20-hydroxykaur-16-en-19-oic acid lactone20 1558β,19-dihydroxy-3-oxopimar-15-ene20 156(+)-7-deoxynimbidiol20 157celahypodiol20 158furreginol20 159suigol20 160△5-nimbidiol20 161celaphanol A20 162celaphanol B20 163nimbidiol20
1.4.4 达玛烷型、乌苏烷型和何帕烷型 目前南蛇藤属植物中分离发现的达玛烷型、乌苏烷型、何帕烷型三萜较少。Wang等[42]从短梗南蛇藤中分离得到3个具有显著抗肿瘤活性的达玛烷型三萜,鲁亚苏[19]从灯油藤中分离得到1个达玛烷型三萜和1个乌苏烷型三萜,Wang等[33]从粉背南蛇藤中分离得到1个何帕烷型三萜。具体见表8、表9和图8。
1.5 黄酮类
黄酮类化合物的基本母核为2-苯基色原酮类化合物,是一类重要的天然有机化合物。南蛇藤属植物中发现的黄酮类不多,多以黄酮苷较常见。具体结构和信息见表10和图9。

图4 南蛇藤中二萜类化合物
表4 南蛇藤属中木栓烷型三萜
Table 4 Friedelane triterpenoid from Celastrus
编号化合物文献 1643-oxo-12α, 28-dihydroxyfriedelan25 1653-oxo-3β-dihydroxyfriedelan-28-oic acid25 1663-oxo-suberane-27, 28-dioic acid25 1673,15-dioxo-12α-hydroxyfriedelan25 1683-oxo-2β-hydroxyfriedelan-29-oic acid22 1693β-hydroxy-27-acetyloxy-suberane-28-acid23 170friedelan-3-one24 1713, 12-dioxofriedelane24 1723-oxo-12α-hydroxyfriedelane24 1733-oxo-30-hydroxyfriedelane24 1743-oxo-friedelan-28-al25 1753-oxo-28-hydroxyfriedelan25 1763-oxo-29-hydroxyfriedelan25 1773-oxo-16α-hydroxyfriedelan25 1783-oxo-7α,26-dihydroxyfriedelan25 1793α-hydroxyfriedelan25 1803, 12-dioxofriedelan-28-al25 1813-oxo-12α,28-dihydroxyfriedelan25 1823-oxo-16α,30β-dihydroxyfriedelan27 1833-oxo-16α,28-dihydroxyfriedelan27 1843, 12-dioxo-12α-hydroxyfriedelan27 1853-oxo-30-methoxyfriedelan28 1863-oxo-30-hydroxyfriedelan29 1873-oxo-11-hydroxyfriedelan25 1883, 12-dioxo-12α-hydroxyfriedelan25 1893-oxo-4α-26-dihydroxyfriedelan25 1903-oxo-4α-methylfriedelan-29-oic acid29 1913, 4-secofriedelan-3, 28-dioic acid25 1922,3-dioxo-6α,10-dihydroxy-24-nor-friedelan-4,7-dien-29-oic acid22 19321-oxo-2α,3α,22β-trihydroxy-29-nor-friedelan-24,2â-lactone22
续表4
编号化合物文献 1942-oxo-3-hydroxy-suberane-3-ene-29-acid23 1953, 4-secofriedelan-3, 28-dioic acid23 1963β, 21β-dihydroxy-30-nor-friedelan-20(29)-en-27-oic acid24 197maytenfolone A28 1982-hydroxy-3-methyl-21-oxo-12, 24-dinor-D: B-friedooleana-1, 3, 530 1963β, 21β-dihydroxy-30-nor-friedelan-20(29)-en-27-oic acid24 199celastrol30 200pristimerin30 20125(9→8)abeo-24-nor-fiedelan-2,3dioxo-1(10),4,6,9(11)-tetraen-29-oic acid31 20225(9→7)abeo-24-nor-fiedelan-2,3dioxo-1,3,5(10),6,8,11-hexaen-29-oic acid31 20325(9→8)abeo-24-nor-fiedelan-8,14-seco-friedelan-2,3-dihydroxy-1,3,5(10),6,8,14(27)-hexa-en-29-oic acid31 20425(9→8),26(13→14)-abeo-24-nor-8,14-seco-fridelan-2,3-dihydroxy-1,3,5(10),6,8-pentaen-29(13)-olide31 205casssinolide29 2063β,21α-dihydroxyglut-5-ene29 2072-methyl- pristimerin29 2085-giutinene-3β,29-diol29 209salaspermic acid22 210orthosphenic acid22 211wilforol B31 212wilforol A31 213Triptohypol C31 214regeol C31 215wilforol E31 216isocelastroline Aα32 217celastroline Aα31 218celastroline Aβ31 219celastroline Bα31 220celastroline Bβ31
表5 南蛇藤属木栓烷型三萜
Table 5 Friedelane triterpenoid from Celastrus
编号取代基文献 R1R2R3R4R5R6R7R8R9 164βOH=OHHHHHCOOHH22 165HβOHHHHOAcCOOHHH23 166H=OHHHHHHH24 167H=O=OHHHHHH24 168H=OHHHHHHH24 169H=OHHHHHHOH24 170H=OHHHHCHOHH25 171H=OαOHHHHOHHH25 172αOHβOHHHHHCOOHHH25 173H=OHHHCOOHCOOHHH25 174H=OαOH=OHHHHH25 175H=OαOHHHHOHHH25 176H=OHHHHOHHH25 177H=OHHHHHOHH25 178H=OHHOHHHHH25 179HαOHHHHHHHH25 180H=O=OHHHCHOHH25 181H=OαOHHHHOHHH26 182H=OHHαOHHHHOH27 183H=OHHαOHHOHHH27 184H=OαOHHHHHHH27 185H=OHHHHHHCH2OCH328 186H=OHHHHHHCH2OH28
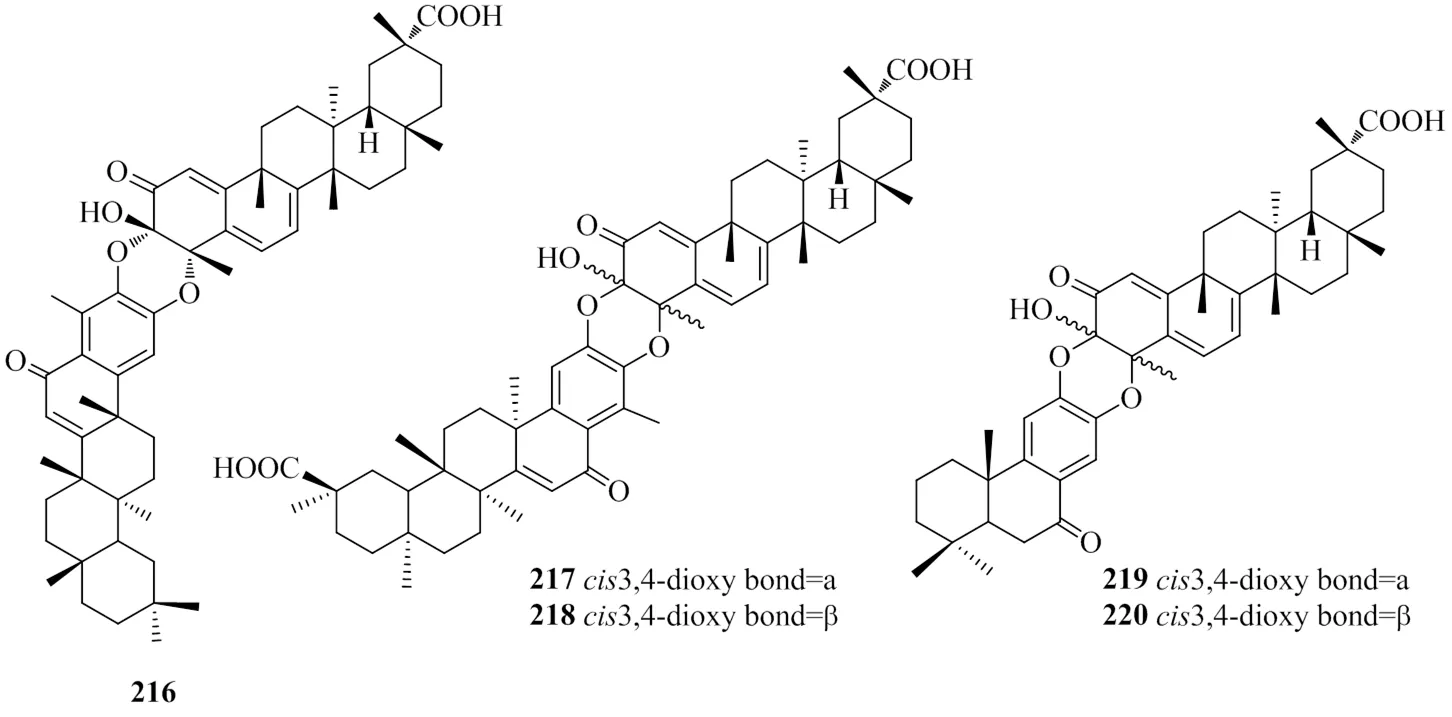
图5 南蛇藤属木栓烷型三萜
1.6 其他类
南蛇藤属植物中还含有一些脂肪酸酯,如二十二烷酸、十二烷酸-1-单甘油酯、十八烷酸-1-单甘油酯等[29]。也常见一些酚酸,如苯甲酸、2-羟基苯甲酸、3,4-二羟基苯甲酸、4-羟基苯甲醛、香草酸等[47]。
表6 南蛇藤属中齐墩果烷型三萜
Table 6 Oleanane triterpenoid from Celastrus
编号化合物文献编号化合物编号 2213β-hydroxyolean-5,12-dien-28-oic acid292349(11),12-oleanadien-3β-ol34 2221β,3β,11β-trihydroxy-olean-12-enyl-3-palmitate29235(3β),olean-12ene-3,23-diol36 22312-oleanaen-3-one292366α-hydroxyolean-12-3-one36 22412-oleanaen-3β,11β-diol29237wilforlide A36 2251β,3β,-dihydroxy-olean-9(11),12-dienyl-3-palmitate29238wilforlide B36 226xyloketal32239(3β,22α)-3,22-dihydroxyolean-12-en-29-oic acid36 22712-oleanaen-3β,6α-diol3324024-hydroxy-3-oxo-12oleanen-28-oic acid37 22812-oleanaen-3β-ol34241erythrodiol38 22912-oleanaen-3β-caffeate342423-oxoolean-12-en-28-oic acid39 230olean-28-al-3β-yl-caffeate352433-oxoolean-24-norolean-12-en-28-oic acid39 231oleanolic acid-3β-caffeate35244oleanolic acid39 2329(11),12-oleanadien-3 -one342453β-hydroxy-2-oxoolean-12-ene-22,29-actone39 2339(11),12-oleanadien-3β-caffeate342463β,22α-dihydroxy-olean-12-en-29-oic acid40

图6 南蛇藤属中齐墩果烷型三萜

图7 羽扇豆烷型结构
2 药理作用
2.1 抗肿瘤
南蛇藤属植物化学成分或有效部位具有抗肿瘤活性。李嘉琪等[48]对用不同浓度的南蛇藤素和环磷酰胺,以及两者联合处理后的乳腺癌细胞进行检测,发现二者分别呈浓度依赖性抑制乳腺癌细胞的增殖、迁移,促进细胞凋亡。联合用药发现,南蛇藤素可增强环磷酰胺的化疗敏感性。褚泽文等[49]对南蛇藤茎提取物28-hydroxy-3-oxoolean-12-en-29-oic acid进行活性研究,发现其对胃癌细胞BGC-823有增殖和诱导凋亡的作用。周元龙等[50]发现南蛇藤根茎醋酸乙酯部位提取物(COE)可能通过抑制Wnt/β-Catenin信号通路,而抑制Hep G2肝癌细胞的增殖和黏附。金凤[51]发现COE可以抑制食管鱗癌干细胞(ECA-109)成球,且随着药物浓度的逐渐増加,细胞球的体积逐渐变小,同时细胞球数目逐渐减少。3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)实验显示COE可以抑制ECA-109细胞的增殖和侵袭。冯俊[52]通过MTT法检测COE对人胶质母细胞瘤U251细胞增殖能力的影响,结果显示COE能呈时间和浓度相关的抑制U251细胞的增殖,并促进凋亡。
表7 南蛇藤属中羽扇豆烷型三萜
Table 7 Lupane triterpenoid from Celastrus
编号化合物文献 2472α-hydroxy-lupeol19 248lupenone29 249lupeol29 250lupeol palmitate29 25129-hydroxy-20(30)-lupen-3-one29 25220(30)-lupene-3β,29-diol34 25320(29)-lupene-1β,3β-diol34 254lup-20(29)en-28-al-3β-yl-caffeate36 255lup-20(29)en-28-ol-3β-yl-caffeate36 256lup-20(29)en-28-oic-3β-yl-caffeate36 25723-hydroxybetulonic acid39 258lup-(20)29-en-2α,3α-diol40 2596β-hydroxy-3-oxolup-20(29)-ene41
表8 南蛇藤属中羽扇豆烷型三萜结构
Table 8 Structure of lupane triterpenoid from Celastrus
编号取代基 R1R2R3R4R5R6R7 247HαOHβOHMeHMeH 248HH=OMeHMeH 249HHOHMeHMeH 250HHcaffeateMeHMeH 251HH=OMeHMeOH 252HHβOHMeHMeOH 253OHHβOHMeHMeH 254HHcaffeateMeHCHOH 255HHcaffeateMeHCOOHH 256HHcaffeateMeHCOOHH 257HH=OCH2OHHCOOHH 258HαOHαOHMeHMeH 259HH=OMeOHMeH
表9 南蛇藤属中达玛烷型、乌苏烷型和何帕烷型三萜
Table 9 The Dammarane,Ursane and Gammacerane Triterpenoid from Celastrus
编号化合物类型来源 2603β, 20(S),24(S)-trihydroxydammar-25-ene-3-caffeate达玛烷42 2613β, 20(S),24(R)-trihydroxydammar-25-ene-3-caffeate达玛烷42 2623β, 20(S),25-trihydroxydammar-23(Z)-ene-3-caffeate达玛烷42 263dammarenediol II 3-caffeate达玛烷19 2643β-trans-(3, 4-dihyoxy-cinnamoyloxy)-11α-meth-oxy-12-ursene乌苏烷型38 265α-amyrin-acetate乌苏烷型19 26612-gammateraen-3β-ol何帕烷33
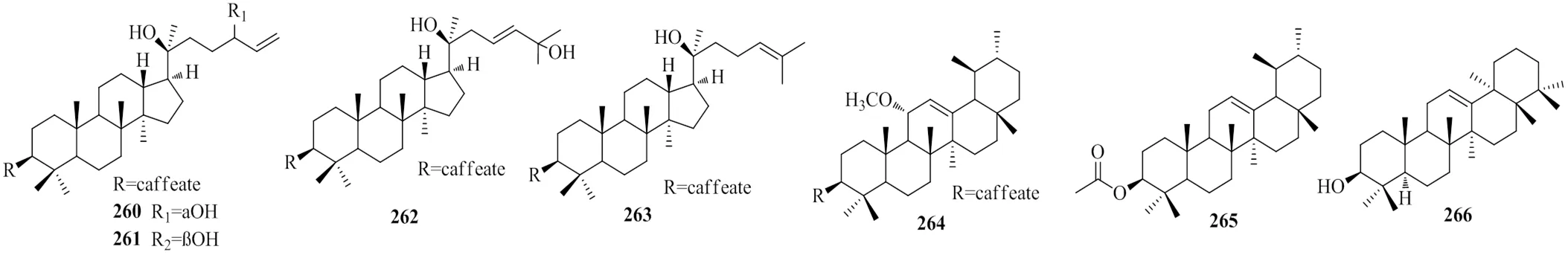
图8 南蛇藤属中达玛烷型、乌苏烷型和何帕烷型三萜结构
表10 南蛇藤属中的黄酮类化合物
Table 10 Flavonoids from Celastrus
编号化合物文献 267daidzein43 2684′-hydroxyflavone-7-O-β-D-glucopyranoside43 269(–)epigallocatehin43 270(–)-gallocatehin43 271kaempferol44 272kaempferol-7-O-α-L-rhamnoside44 273kaempferol-3,7-di-O-α-L-rhamnoside44 274kaempferol-3-O-rutinoside44 275quercetin44 276quercetin-3-O-β-D-glucoside44 277myricetrin44 278emodin-6-O-β-D-glucopyranoside45 279(2S)-7,3′-dimethoxy-6,4′-dihydroxyflavan46 2806,7,3′-trimethoxy-4′-hydroxyflavan46 2816,7-dimethoxy-3′,4′-dihydroxyflavan46 282(2S)-7,3′-dimethoxy-4′-hydroxyflavan46
2.2 抗炎
炎症是由于损伤、过敏原暴露或感染引起的组织局部肿胀的一种状态。陈彦伶等[53]采用MTT法检测苦皮藤各部位不同浓度对类风湿关节炎成纤维样滑膜细胞(HFLS-RA)增殖的影响,结果显示,苦皮藤各部位能抑制HFLS-RA增殖,呈时间和浓度依赖。Kothavade等[54]报道,野生南蛇藤石油醚部位能通过抑制肿瘤坏死因子-α和白介素-6的过量产生,可改善佐剂诱导关节炎大鼠的关节炎进展。Arora等[55]采用2,2-二苯基苦基肼自由基清除试验、Trolox等效抗氧化能力测定、铁还原抗氧化能力测定和脂氧合酶抑制试验等方法,测试了灯油藤Willd.种子水提取物、甲醇提取物和氯仿提取物的抗氧化和抗炎活性。同时分别测定了总酚含量,实验结果表明,氯仿提取物具有最强的抗氧化性能和最高的酚含量,而水提物显示出最大的抗炎活性,精油中鉴定出的主要成分具有强烈的抗氧化性。

图9 南蛇藤属中黄酮类化合物结构
2.3 抗菌、抗疟活性
Vonshak等[56]筛选了28种药用植物对6种真菌(毛癣菌、红色毛癣菌、苏丹白念珠菌、光滑毛癣菌和克鲁塞菌)的抑菌活性,测试结果显示南蛇藤提取物对红色毛癣菌具有一定的抑菌活性。Harish等[57]发现灯油藤乙醇提取物中的皂苷(1 µg/µL)和倍半萜衍生物celapanin(0.5 µg/µL)对金黄色葡萄球菌(22.18±0.30)mm、肺炎克雷伯菌(13.58±0.22)mm和铜绿假单胞菌(13.10±0.29)mm具有较强的抑菌作用。Kandikattu等[58]报道,灯油藤氯仿提取物中的扁蒴藤素(pristimerin)和一种醌型的三萜烯体外条件下具有抗恶性疟原虫活性。
2.4 降血糖和调血脂
南蛇藤叶具有很好的降血糖作用,2014年余晓霞等[44]发现南蛇藤叶具有很好的降血糖作用,其从南蛇藤叶中分离得到7个黄酮类化合物,间接说明南蛇藤叶中的黄酮类化合物可能具有降血糖的作用。
2010年Patil等[59]探究南蛇藤甲醇提取物对实验性高胆固醇血症大鼠的调血脂作用。发现以最佳剂量65 mg/kg的体质量口服南蛇藤甲醇籽提取物,能显著降低高胆固醇血症大鼠的血浆总胆固醇、三酰甘油和低密度脂蛋白水平。
2.5 其他活性
Mu等[3]从南蛇藤种子中分离得到2个β-二氢沉香呋喃型倍半萜,研究发现其在2 μmol/L浓度下表现出超过10倍的耐多药逆转活性。
高磊[18]从独子藤种子中分离得到一系列β-二氢沉香呋喃型倍半萜型,药理活性测试结测试结果表明所有化合物都能延长对秀丽线虫的平均寿命和最长寿命。
3 结语
南蛇藤属植物在我国有30余种,该属植物中含有的化学成分类别较多,如倍半萜、二萜、三萜、黄酮等,早在20世纪70年代就有对该属植物的初步研究,而且现在也有新的化合物被不断发掘出来。其主要为β-二氢沉香呋喃型倍半萜和三萜类,而β-二氢沉香呋喃型倍半萜的取代位点较多,取代基团也较多,所以出新化合物的概率较高。此属植物的早期活性研究大多是抗炎、抗肿瘤、抗菌等,但大都只停留在初步的活性筛选中。近年来研究人员从不同方向探究南蛇藤属植物化学成分的药理活性,如对秀丽线虫寿命的影响、酶抑制活性、抗氧化作用、降血糖活性等,且结果都很乐观,但是活性作用的机制研究还有待进一步的深入。期待能不断发现南蛇藤属植物中新的单体活性成分,不仅要在细胞水平或动物水平进行初步活性研究,更需要结合分子生物学、代谢组学等进行深入研究其药理作用机制及其代谢规律。
利益冲突 所有作者均声明不存在利益冲突
[1] 刘丹, 何毅, 陈孝江, 等. 灰叶南蛇藤的化学成分研究 [J]. 中药材, 2020, 10: 2430-2434.
[2] 赵磊, 贾玲玲, 杨莉, 等. 南蛇藤茎中三萜类成分的分离及含量测定 [J]. 解放军药学学报, 2018, 34(6): 545-547.
[3] Mu H Y, Tang S, Zuo Q,. Dihydro-β-agarofuran-type sesquiterpenoids from the seeds ofand their multidrug resistance reversal activity against the KB/VCR cell line [J]., 2021, 84(3): 588-600.
[4] 廖怀玉, 韩红园, 陈飞, 等. 苦皮藤中两个新的β-二氢沉香呋喃型化合物的NMR数据解析 [J]. 波谱学杂志, 2021, 38(1): 101-109.
[5] Chen L, Chen X, Han H Y,New β-dihydroagarofuran sesquiterpene polyesters isolated from the root bark of[J].2021, 42: 7-76.
[6] 黎汝林. 显柱南蛇藤果实化学成分研究 [D]. 武汉: 华中科技大学, 2019.
[7] Sasikumar P,Sharathna P,Prabha B,. Dihydro-β-agarofuran sesquiterpenoids from the seeds ofWilld. and their α-glucosidase inhibitory activity [J]., 2018, 26: 1-8.
[8] Gao L, Zhang R J, Lan J F,. Β-dihydroagarofuran-type sesquiterpenes from the seeds ofand their lifespan-extending effects on the nematode[J]., 2016, 79(12): 3039-3046.
[9] 王发松, 向家桂, 黄东海, 等. 过山枫根化学成分研究 [J]. 湖北民族学院学报: 自然科学版, 2018, 36(2): 134-136.
[10] Xu J, Xie C F, Jin D Q,. Three new dihydroagarofuran sesquiterpenoids from[J]., 2012, 5(4): 713-716.
[11] 朱靖博, 孙晓昱, 慕岩峰. 苦皮藤β-二氢沉香呋喃多元醇酯类化合物分离及结构解析 [J]. 大连工业大学学报, 2009, 28(3): 169-173.
[12] 张海艳, 王志尧, 常霞, 等. 苦皮藤种子的化学成分分析 [J]. 中国实验方剂学杂志, 2017, 23(16): 57-61.
[13] 朱文丽. 苦皮藤根皮醇提物的化学成分研究 [D]. 郑州: 郑州大学, 2011.
[14] Wei S P, Ji Z Q, Zhang J W. A new insecticidal sesquiterpene ester from[J]., 2009, 14(4): 1396-1403.
[15] 龚雪龙. 苦皮藤根皮的化学成分研究 [D]. 苏州: 苏州大学, 2010.
[16] Ji Z Q, Zhang Q D, Shi B J,. Three new insecticidal sesquiterpene pyridine alkaloids from[J]., 2009, 23(5): 470-478.
[17] Zhang H Y, Zhao T Z, Wei Y,. Two new sesquiterpene polyol esters from the root barks of[J]., 2011, 13(4): 304-311.
[18] 高磊. 独子藤种子和桃枝化学成分及其生物活性研究 [D]. 北京: 中国科学院大学(中国科学院上海药物研究所), 2017.
[19] 鲁亚苏. 灯油藤茎的化学成分研究 [D]. 北京: 中国协和医科大学, 2007.
[20] 向家桂. 两种南蛇藤属植物萜类化学成分研究 [D]. 杭州: 浙江工业大学, 2013.
[21] Chen C Y, Yau L F, Mai Z T,. Aculeatusane A: A new diterpenoid from the whole plants ofMerr [J]., 2020, 40: 72-75.
[22] 陈铭祥, 关睿, 廖泽纯, 等. 独子藤根皮醋酸乙酯部位的化学成分研究[J]. 中草药, 2020, 51(11): 2895-2899.
[23] 陈铭祥, 廖泽纯, 关睿, 等. 独子藤茎醋酸乙酯部位化学成分研究 [J]. 中药材, 2019, 42(2): 315-319.
[24] 陈铭祥, 杨雪梅, 关睿, 等. 独子藤根皮化学成分研究 [J]. 中国药学杂志, 2018, 53(15): 1265-1272.
[25] 陈铭祥, 杨雪梅, 廖泽纯, 等. 独子藤茎脂溶性化学成分研究 [J]. 中国中药杂志, 2018, 43(2): 336-344.
[26] 陈铭祥, 喻文进, 林晓, 等. 独子藤茎的化学成分研究 [J]. 中国药房, 2013, 24(3): 259-261.
[27] 王奎武. 三种卫矛科药用植物的化学成分研究 [D]. 杭州: 浙江大学, 2006.
[28] Kuo Y H, Kuo L M. Antitumour and anti-AIDS triterpenes from[J]., 1997, 44(7): 1275-1281.
[29] 王鸿, 梅建凤, 易喻, 等. 苗药那信论中的一个新三萜成分 [J]. 林产化学与工业, 2007, 27(6): 56-58.
[30] Wang H, Tian X, Ying G Q. A new nortriterpene from the root of[J]., 2010, 93(8): 1628-1633.
[31] Wu J, Zhou Y, Wang L,. Terpenoids from root bark of[J]., 2012, 75: 159-168.
[32] Núñez M J, Ardiles A E, Martínez M L,. Triterpenoids fromand(celastraceae) [J]., 2013, 6(1): 148-151.
[33] Wang K W, Mao J S, Tai Y P,. Novel skeleton terpenes fromwith anti-tumor activities [J]., 2006, 16(8): 2274-2277.
[34] Wang H, Tian X, Chen Y Z. Chemical constituents of the aerial part of[J]., 2002, 49(3): 433-436.
[35] Chen B, Duan H Q, Takaishi Y. Triterpene caffeoyl esters and diterpenes from[J]., 1999, 51(5): 683-687.
[36] Wang K W, Sun H X, Wu B,. Two novel olean triterpenoids from[J]., 2005, 88(5): 990-995.
[37] 李彦涛, 成凤桂. 南蛇藤中一种三萜成分的结构及其DSC研究 [J]. 中南民族大学学报: 自然科学版, 2002, 21(1): 28-31.
[38] Chen H L, Lin K W, Huang A M,. Terpenoids induce cell cycle arrest and apoptosis from the stems ofassociated with reactive oxygen species [J]., 2010, 58(6): 3808-3812.
[39] Li J J, Yang J, Lü F,. Chemical constituents from the stems of[J]., 2012, 10(4): 279-283.
[40] 常睿洁. 皱叶南蛇藤的化学成分研究 [D]. 上海: 上海交通大学, 2012.
[41] 陈佩东, 梁敬钰. 苦皮藤根皮的化学成分研究 [J]. 海峡药学, 2002, 14(4): 33-36.
[42] Wang K W, Sun C R, Wu X D,. Novel bioactive dammarane caffeoyl esters from[J]., 2006, 72(4): 370-372.
[43] 胡新玲, 王奎武. 粉背南蛇藤醋酸乙酯部位中黄酮类成分的研究 [J]. 现代药物与临床, 2011, 26(3): 219-220.
[44] 余晓霞, 张亭亭, 王定勇. 南蛇藤叶降血糖有效部位化学成分研究 [J]. 中药材, 2014, 37(6): 998-1000.
[45] 张扬, 许海燕, 谭俊杰, 等. 南蛇藤化学成分研究 [J]. 中国医药工业杂志, 2010, 41(11): 823-826.
[46] 胡贤卿, 刘庆鑫, 李慧梁, 等. 青江藤中黄烷类化学成分的研究 [J]. 中草药, 2014, 45(15): 2132-2135.
[47] 郭远强. 南蛇藤果实化学成分和药理活性研究 [D]. 沈阳: 沈阳药科大学, 2004.
[48] 李嘉琪, 石艺, 钟燕, 等. 南蛇藤素通过调控PTEN/Akt/Raf-1信号通路增强乳腺癌细胞对环磷酰胺的化疗敏感性 [J/OL]. 今日药学: 1-14 [2021-05-04]. http://kns.cnki.net/kcms/detail/44.1650.R.20210330.1517. 002.html.
[49] 褚泽文, 王海波, 倪腾洋, 等. 南蛇藤茎提取物齐墩果烷型三萜化合物28-hydroxy-3-oxoolean-12-en-29-oic acid对胃癌细胞BGC-823增殖和凋亡的作用[J/OL]. 中华中医药学刊: 1-15[2021-05-04]. http://kns.cnki.net/ kcms/detail/21.1546.R.20210302.1533.002.html.
[50] 周元龙, 赵继森, 杨季红, 等. 南蛇藤提取物抑制HepG2肝癌细胞增殖及黏附作用的实验研究 [J/OL]. 中华中医药学刊: 1-11[2021-05-04]. http://knscnki. net/kcms/detail/21.1546.R.20201109.1424.008.html.
[51] 金凤. 南蛇藤提取物通过DJ-1调控肿瘤干样细胞抑制人食管鳞癌侵袭转移的作用及机制研究 [D]. 扬州: 扬州大学, 2018.
[52] 冯俊. 南蛇藤提取物对人胶质母细胞瘤U251细胞凋亡影响的研究 [D]. 扬州: 扬州大学, 2018.
[53] 陈彦伶, 何金英, 胡成刚, 等. 苦皮藤对类风湿性关节炎成纤维滑膜细胞增殖和相关细胞因子表达的影响 [J]. 中国民族民间医药, 2020, 29(4): 14-20.
[54] Kothavade P S, Bulani V D, Deshpande P S,. The petroleum ether fraction ofWilld. seeds demonstrates anti-arthritic effect in adjuvant-induced arthritis in rats [J]., 2015, 2(3): 183-193.
[55] Arora N, Pandey-Rai S. GC-MS analysis of the essential oil ofWilld. seeds and antioxidant, anti-inflammatory study of its various solvent extracts [J]., 2014, 61: 345-351.
[56] Vonshak A, Barazani O, Sathiyamoorthy P,. Screening South Indian medicinal plants for antifungal activity against cutaneous pathogens [J]., 2003, 17(9): 1123-1125.
[57] Harish B G, Krishna V, Santosh Kumar H S,. Wound healing activity and docking of glycogen-synthase- kinase-3-beta-protein with isolated triterpenoid lupeol in rats [J]., 2008, 15(9): 763-767.
[58] Kandikattu H K, Amruta N, Khanum F,. Phytochemical composition, pharmacological properties, and therapeutic applications of[J]., 2021, 7(1): 107-124.
[59] Patil R H, Prakash K, Maheshwari V L. Hypolipidemic effect ofin experimentally induced hypercholesterolemic wistar rats [J]., 2010, 25(4): 405-410.
Advances on chemical constituents and pharmacological activities of
XIAO Ben-you, WANG Fa-song, LIU Yao, ZHANG Chang-peng, XIAO Qiang, CUI Ling-jun
Key Laboratory of Biological Resources Protection and Utilization of Hubei Province(Hubei Minzu University), Enshi 445000, China
Theplants are abundant, including more than 50 species, which are widely distributed in China. It has a variety of chemical constituents, mainly including β-dihydroagarofuran sesquiterpene, triterpene and flavonoids, and has a wide range of pharmacological effects, including anti-tumor, anti-bacterial, anti-inflammatory, hypolipidemic and other effects. However, at present, there are few reports on theplants. This paper summarizes the related studies on the chemical constituents and pharmacological activities of theplants in recent years, which provide reference for further research and development and utilization of theplants.
L.; chemical constituents; anti-tumor; anti-bacterial; anti-inflammatory; hypolipidemic; β-dihydroagarofuran sesquiterpene; antitumor
R286.2
A
0253 - 2670(2022)06 - 1919 - 14
10.7501/j.issn.0253-2670.2022.06.035
2021-09-06
生物资源保护与利用湖北省重点实验室项目(PT012105);湖北省技术创新专项(重大项目)(2019ACA120);湖北民族大学博士启动基金(MY2017B029)
肖本游(1994—),男,硕士研究生,研究方向为天然产物化学。E-mail: 1287923096@qq.com
崔令军,博士,副教授,主要从事天然产物研究与开发。E-mail: lingjuncui@163.com
[责任编辑 时圣明]
——青蒿素

