PI3K/AKT/mTOR信号通路异常激活导致强直性脊柱炎患者的间充质干细胞自噬减弱
强直性脊柱炎(AS)是一种常见的自身免疫性疾病,我国AS的患病率高达0.2%~0.54%。AS以炎性腰背痛及脊柱关节僵硬为主要临床表现,后期可导致患者丧失劳动能力及生活能力,严重影响患者生活质量。但是,AS的发病机制尚不明确,给临床诊疗带来了极大的困难。
间充质干细胞(MSCs)是一种具有强大免疫调节能力和多向分化潜能的多能干细胞。MSCs既能通过影响体内的免疫调节能力参与炎症反应,又能通过自身的成骨分化能力参与成骨的发生,与AS的发病密切相关。AS患者MSCs成骨分化功能增强而抑制破骨分化的能力减弱,是导致AS异常成骨的关键因素之一。因此,深入研究ASMSCs的功能有助于明确AS的发病机制。肿瘤坏死因子-α(TNF-α)是AS患者体内最重要的炎症因子之一,不但参与炎症反应,还可诱导细胞凋亡、自噬,在AS的发病中扮演着重要的角色。有研究进一步指出,TNF-α可通过调控MSCs的功能参与AS的发病,但具体的调控机制不明。
自噬是细胞内的一种自食现象,具有调节细胞内环境稳态及免疫平衡的作用。研究表明,细胞自噬水平与体内炎症反应及骨代谢密切相关,而MSCs自噬失调与多种自身免疫性疾病的发病密切相关。那么,AS患者MSCs(ASMSCs)是否存在自噬失调并参与AS的发病呢?目前尚不明确。
临近年底,备受关注的《个人所得税专项附加扣除暂行办法》(以下简称《暂行办法》)终于正式亮相,标志着我国综合与分类相结合的个税改革迈出关键一步,释放出更加惠民的积极信号。
本研究拟探讨TNF-α刺激下,ASMSCs与正常人MSCs(HDMSCs)的自噬水平是否存在差异并探究其内在机制,为AS的发病机制及治疗提供新的思路和方法。
但由于越南的文化影响力目前尚处于中等水平,对华交往时仍面临文化逆差的考验;越南的地缘环境也令其对中国文化传播存在一定的警惕和敏感。所以越南在同中国开展文化合作之余常会采取一些人为干预行为以求平衡和自保。如越南社会目前虽已兴起了学中文和来华留学的热潮,但越南政府至今只批准开设一所孔子学院——河内大学孔子学院。该院前后经历了八年多的筹备努力才于2014年正式揭牌。而近年来由于中越间南海争议的表面化,一些中国文化产品也被贴上“政治标签”而遭抵制。如越南通信传媒部还曾要求中部和西原地区的电视台加强捍卫海权的宣传力度,限制播放中国连续剧。
1 资料和方法
1.1 病例纳入
传统语文作业的内容只局限于本学科,与其它学科之间缺乏联系和渗透,使学生形成狭隘封闭的知识观。新课程理念下的初中语文作业设计要淡化学科间界限,把语文学科同其他学科在知识上相关或思考方法上相似的内容综合在一起设计作业,使学生认识到语文学习不仅包括单纯的语文知识的掌握和运用,还有语文学科与其他学科知识进行渗透。
1.2 MSCs的分离、培养和鉴定
按既往报道的方法,经髂后上棘穿刺抽取患者及健康志愿者骨髓,用密度梯度离心法分离MSCs。用含10%胎牛血清(四季青)的DMEM 培养液(Gibco)于25 cm的培养瓶中培养,贴壁后定期换液、传代,将第4代细胞用于实验。用流式细胞学技术检测细胞的表面抗体[CD14-APC、CD29-PE、CD44-FITC、CD45-APC、CD105-FITC 和HLA DR(BD)]。
将MSCs种于6孔板,贴壁培养24 h后,将含有绿色荧光蛋白轻链3B的慢病毒载体(GFP LC3B,吉玛基因)加入MSCs中。再次培养24 h后,更换培养液,加入TNF-α诱导,以不加入TNF-α诱导孔为对照。转染72 h后,通过荧光显微镜观察诱导前后MSCs中GFP-LC3B的表达。自噬越强,细胞中GFP-LC3B荧光点更多更亮。用Image Pro软件计算GFP-LC3B荧光点的数量。
1.3 细胞增殖能力检测
将健康志愿者和患者的第4代MSCs种于96孔板上(5×10/孔),用含10%胎牛血清的DMEM培养,将无细胞孔作为阴性对照。采用CCK-8试剂盒(Dojindo)检测不同时间点HDMSCs和ASMSCs的增殖情况。
1.4 TNF-α诱导自噬
采用SPSS 22.0统计软件进行统计学分析。两组之间比较采用独立样本检验,多组之间比较用方差分析。数据以均数±标准差来表示,<0.05认为差异有统计学意义。
在显微镜下,HDMSCs与ASMSCs均为长梭形贴壁生长的细胞。HDMSCs 与ASMSCs 均持续表达CD29、CD44和CD105,但不表达CD14、CD45和HLADR。在1~7 d的培养过程中,HDMSCs与ASMSCs增殖能力无明显差异(图1)。
1.5 定量PCR(qRT-PCR)
先用TRIzol(Invitrogen)按步骤提取RNA,接着用PrimeScriptRT Master Mix(Takara)试剂盒将RNA转录为cDNA。按步骤设计并合成引物(Invitrogen)(引物序列详见表2),在LightCycler480 PCR System(Roche)上进行qRT-PCR 实验。选取GAPDH 作为内参,目标基因Ct值以GAPDH的Ct值标准化,用2的方法计算基因的相对表达量。qRT-PCR所用引物见表2。

1.6 Western blot
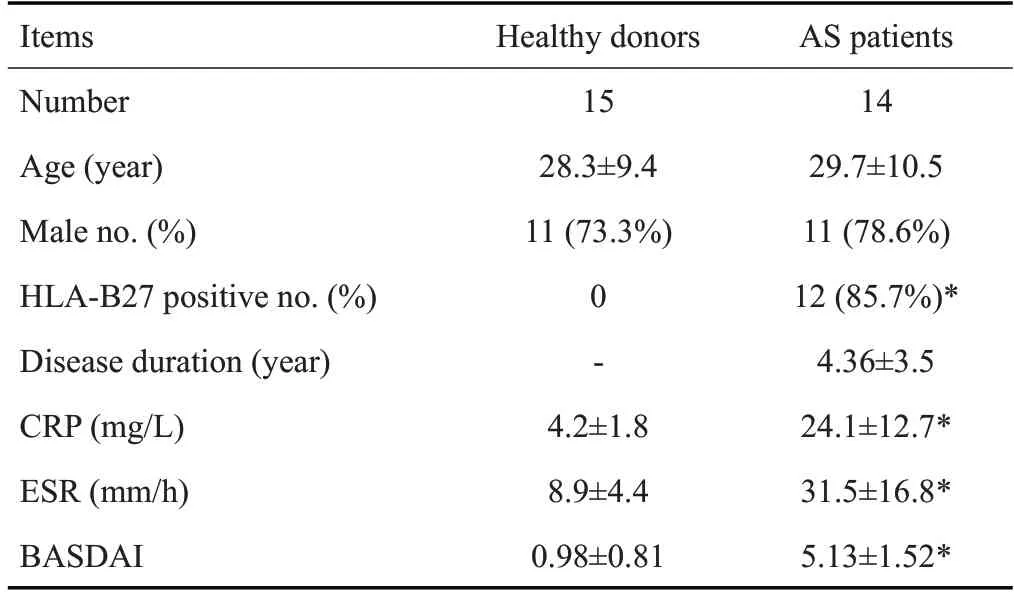
TNF-α 诱导6 h后,ASMSCs中LC3 II/LC3 I的蛋白表达水平明显低于HDMSCs,而P62的表达水平明显高于HDMSCs(图2)。进一步通过荧光显微镜观察,我们发现自噬诱导后ASMSCs的GFP-LC3B荧光斑点明显弱于HDMSCs(图2)。
1.7 绿色荧光蛋白和轻链3B融合蛋白(GFP-LC3B)分析
综上所述,第2代320排螺旋CT扫描技术采用AIDR-3D算法,联合应用自动曝光控制技术,球管旋转时间0.3 s,在不影响肝灌注参数HAF、PVF、PI值的情况下,辐射剂量较第1代320排螺旋CT机明显降低。此外,两者HAF、PVF、PI值相似说明其联合应用不影响肝脏肿瘤的随访观察。
1.8 统计学分析
将HDMSCs及ASMSCs分别种于6孔板(1×10/孔),贴壁培养24 h 后,实验组加入TNF-α(Sigma Aldrich,25 ng/mL)及培养液,对照组单纯加入培养液,诱导6 h后进行后续实验。
2 结果
2.1 ASMSCs与HDMSCs具有相同的形态、表型和增殖能力
药动学 依米珠单抗在每周单次皮下注射0.3~3 mg·kg-1的剂量范围内呈现线性药动学,其推荐用法为前4周每周皮下注射3 mg·kg-1,第5周开始每周皮下注射1.5 mg·kg-1,第5周血浆谷浓度为 (54.6 ± 14.3) μg·mL-1, 后维持在 50 μg·mL-1以上, 最终稳态血浆谷浓度为 (52.8 ± 13.5) μg·mL-1[9]。
选取2017年7月~2020年7月在我院诊断为AS的患者共14例(参照1984年纽约修订版AS诊断标准进行诊断),健康对照组共15例。所有患者均同意参加实验,并签署知情同意书,伦理证明号(LAEC-2021-174)。两组入选病例一般情况见表1。

2.2 TNF-α诱导下,ASMSCs自噬水平低于HDMSCs
按步骤提取蛋白并依次定量、变性,将变性后的蛋白与SDS混合物进行电泳并转至PVDF膜(Millipore)上。将PVDF膜洗涤后封闭1 h,4 ℃下孵育一抗过夜(GAPDH、LC3B、P62、p-PI3K、PI3K、p-AKT、AKT、pmTOR、mTOR,CST),洗膜后室温孵育二抗(Santa Cruz)1.5 h。再次洗膜后加入显影液(Millipore),放入Chem Studio PLUS Motorized 成像系统曝光。Image J软件测量目标蛋白灰度值,将GAPDH设为内参,目标蛋白的相对表达量=目标蛋白灰度值/GAPDH灰度值。
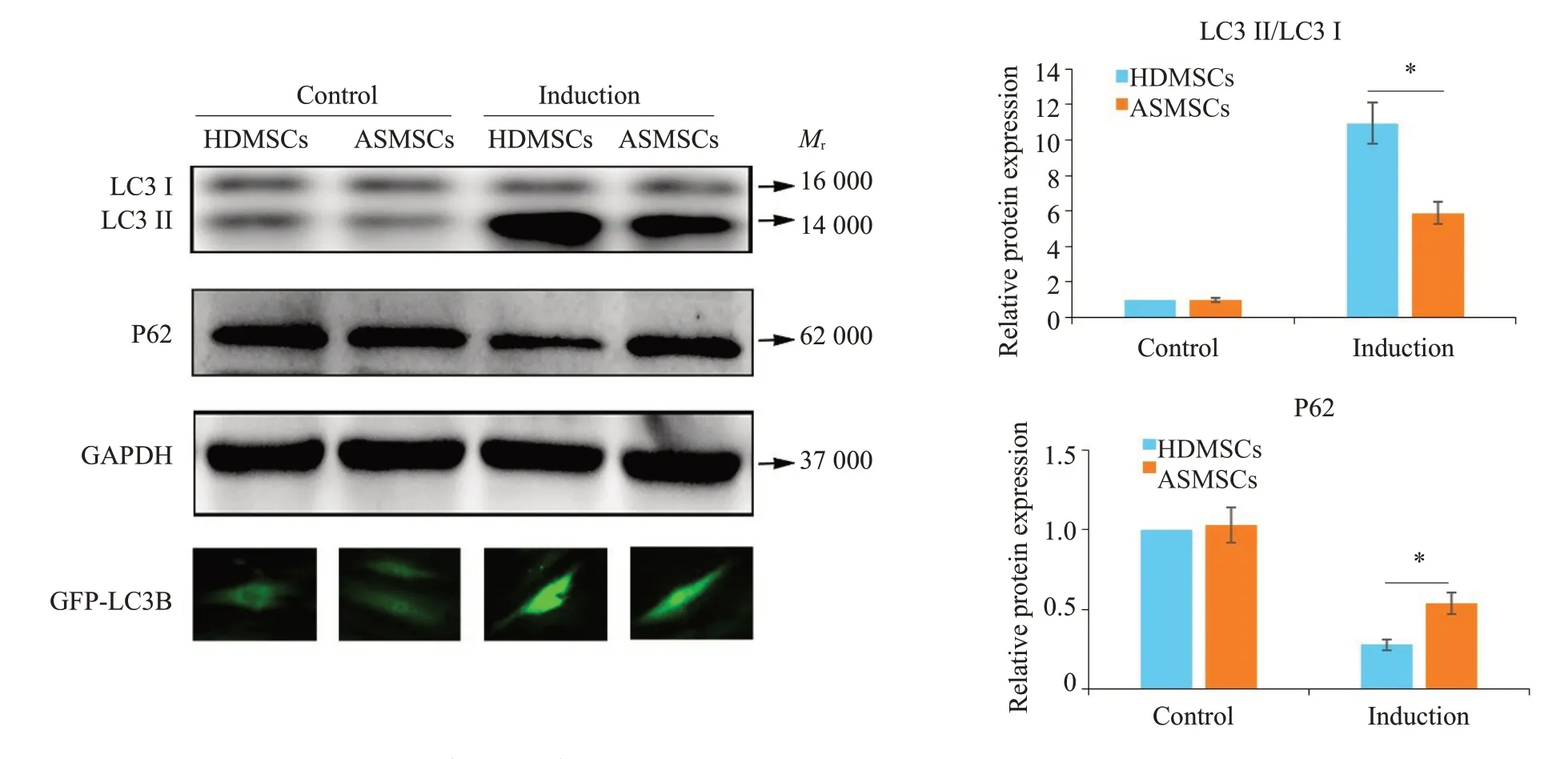
2.3 ASMSCs自噬过程中PI3K/AKT/mTOR信号通道异常激活
尽管自噬过程中ASMSCs 与HDMSCs 的PI3K、AKT 及mTOR 基因表达水平无明显差异(图3A),但ASMSCs 的p-PI3K/PI3K、p-AKT/AKT 及p-mTOR/mTOR蛋白表达水平明显高于HDMSCs(图3B)。
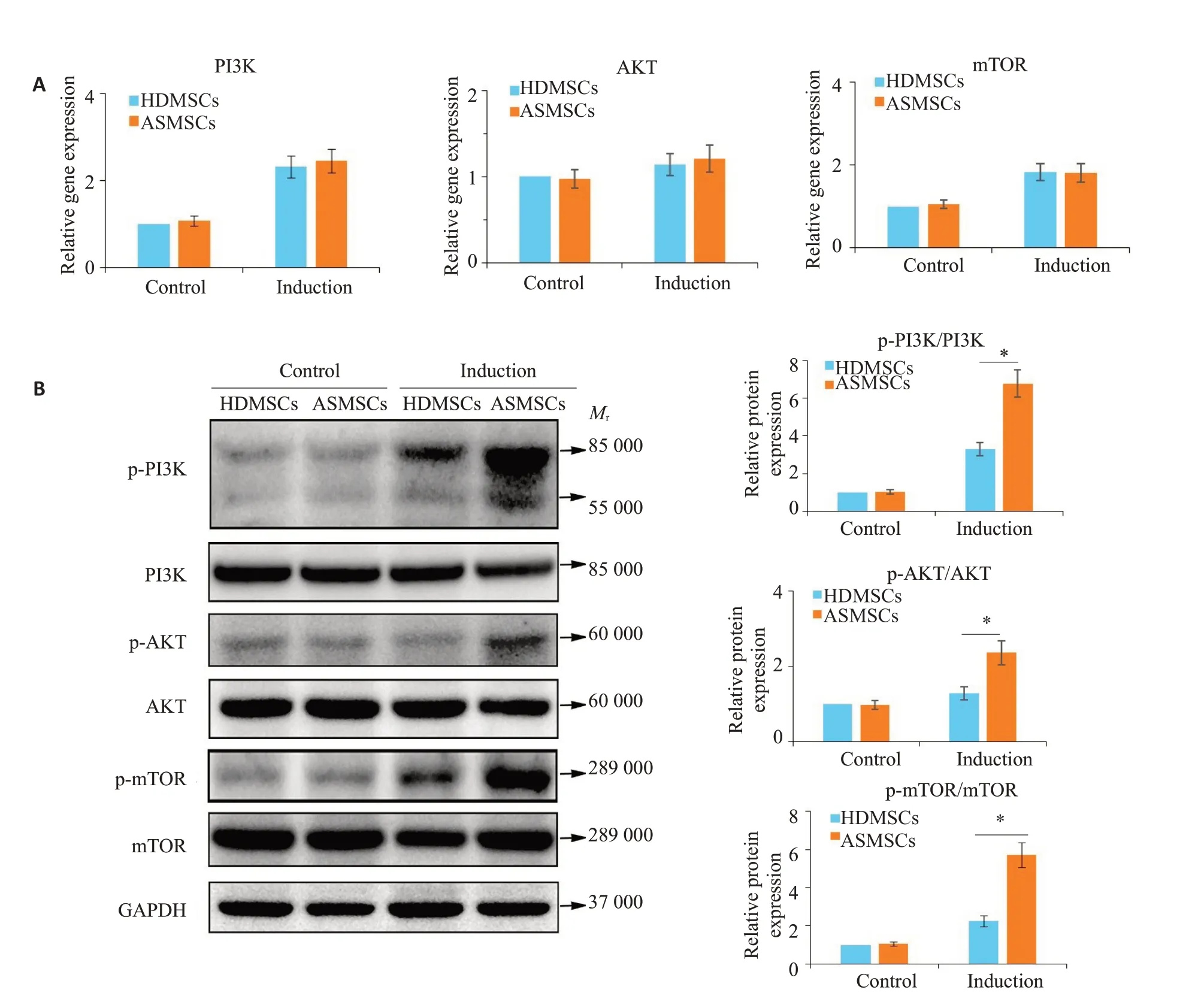
2.4 阻断PI3K/AKT/mTOR信号通路可恢复ASMSCs自噬水平
400 nmol/L的TG100713可有效阻断PI3K的磷酸化(图4A)。阻断PI3K磷酸化后,ASMSCs中p-AKT/AKT、p-mTOR/mTOR、LC3 II/LC3 I及P62的表达恢复至HDMSCs 水平,而GFP-LC3B 荧光斑点强度也与HDMSCs相当(图4B)。

3 讨论
TNF-α是一种多功能细胞因子,广泛参与体内的病理生理过程,如:增殖、分化、凋亡、自噬等。研究表明,TNF-α与AS的发病密切相关。首先,TNF-α在-238,-308,-850,-1031和rs769178位点上的基因多态性与AS的易感性密切相关;其次,AS患者血清及骶髂关节中TNF-α水平明显升高,且血清中TNF-α水平与AS疾病活动度成正相关;此外,TNF-α抑制剂可有效治疗AS。但是,TNF-α参与AS发病的具体机制尚未完全明确。最近多项研究进一步指出,TNF-α可通过调控MSC的功能参与AS的发生发展。TNF-α介导ELMO1的m6A甲基化修饰可诱导AS患者MSC定向迁移;TNF-α可通过自噬调控MSC凋亡,影响MSC的免疫调节能力。我们前期研究表明,激活自噬可提高MSC的抑炎能力,反之亦然。因此,我们推测TNF-α可能通过调控MSC自噬参与AS的发病。
细胞自噬与内环境稳态密切相关,自噬水平异常可诱发炎症反应并参与自身免疫性疾病的发病。B细胞自噬增多而T细胞自噬减少与系统性红斑狼疮体内慢性炎症密切相关;滑膜成纤维细胞自噬增多及成骨细胞/破骨细胞自噬失调参与了类风湿性关节炎的发生发展;肌成纤维细胞自噬水平下降是系统性硬化症的重要发病机制。在本研究中,我们发现TNF-α诱导下ASMSCs的自噬水平明显低于HDMSCs。ASMSCs自噬水平下降可导致其抑炎能力降低、体内炎症水平升高,这可能是AS慢性炎症的发病机制之一。
细胞自噬是一个复杂的病理生理过程,多种细胞因子及信号通路参与其中,PI3K/AKT/mTOR信号通路是其中最重要的调控通路之一。PI3K/AKT/mTOR信号通路激活后,既可直接抑制自噬,又可通过调控P70S6K、AMBRA1、ULK1和BECLIN1等因子的表达抑制自噬小体的形成,负向调控细胞自噬。本研究结果显示,在ASMSCs自噬过程中,PI3K/AKT/mTOR表达明显升高;抑制PI3K磷酸化后,AKT及mTOR的表达及ASMSCs自噬均恢复至HDMSCs水平。说明PI3K/AKT/mTOR信号通路异常激活是导致ASMSCs自噬减弱的关键机制。
该模块可以实现对茶园的环境温湿度、光照强度、土壤含水量及温度的采集,并通过GPRS把采集到的信息实时发送回监控中心。根据茶园信息采集的需求,选择AM2303数字温、湿度传感器检测大气温、湿度,采用数字光强度模块BH1750FVI对光照强度进行检测;选择PH-TW土壤温度传感器采集土壤温度,选择SWR2型土壤水分传感器采集土壤水分含量,以上两个模块都是模拟输出,需要外接一个ADC0832转换成数字信号,输入到单片机进行相应的运算处理。
本研究中,我们发现TNF-α诱导下,PI3K/AKT/mTOR信号通路异常激活是导致ASMSCs自噬减弱的关键。ASMSCs自噬减弱可导致其抑炎能力下降并诱发或加重AS 患者体内慢性炎症。但是,PI3K/AKT/mTOR信号通路异常激活的关键分子究竟是什么?在AS患者体内是否同样存在这种自噬减弱的情况?上述问题仍有待进一步研究。

