茄子根际促生菌筛选鉴定及其促生效应
张芝,张垚,王志刚,徐伟慧
茄子根际促生菌筛选鉴定及其促生效应
张芝1,2,张垚1,2,王志刚1,2,徐伟慧1,2
(齐齐哈尔大学 1. 生命科学与农林学院,2. 黑龙江省农业微生物制剂产业化技术创新中心,黑龙江 齐齐哈尔 161006)
以齐齐哈尔龙江县茄子根际土壤为实验材料,采用稀释平板法筛选根际促生菌(plant growth-promoting rhizobacteria,PGPR),通过16S rRNA核苷酸序列分析鉴定菌种,探究菌株的生理活性,并进行安全性评价;通过浸种和盆栽实验研究菌株对茄子种子萌发和幼苗生长的影响.结果表明,在茄子根际筛选到7株PGPR,其分别属于sp. QJ1,QJ2,QJ4,NQ1△,NQ1,NQ3,sp. NQ5;不同的菌株溶磷、分泌赤霉素和吲哚乙酸(IAA)能力不同;菌株产生铁载体,仅有NQ3菌株具有溶血性.浸种和盆栽实验表明,NQ1△菌悬液显著促进茄子种子的萌发,QJ2菌悬液对茄子幼苗生长有显著的促进作用.综上所述,菌株NQ1△,QJ2可分别作为茄子种子包衣及专用促生肥料的候选菌剂.
茄子;植物根际促生菌;菌种鉴定;促生效应;微生物肥料
茄子(L.)为茄科茄属蔬菜作物,种植面积仅次于马铃薯(L.)和番茄(L.)[1-2].中国是世界上最大的茄子生产大国和消费国,2018年,全世界茄子产量为5 360万t,我国产量达到3 410万t,占世界总产量的63.62%[3].由于人们对茄科作物需求量的增加,大量使用无机化肥成为最直接的增产手段,化学肥料的大量使用导致产品的品质下降、环境污染、土壤质地恶化和土壤板结等大量问题.因此,寻求一种绿色环保、科学高效并且能够减少或代替传统的化学肥料的新型肥料是当代农业生产所必需的.而植物根际蕴藏着丰富的、可利用的微生物资源,合理开发和利用根际微生物资源是生产微生物肥料的有效途径之一[4].
植物根际促生菌(plant growth-promoting rhizobacteria,PGPR)是指以定殖或以自由附着的方式生活在植物根际的一类菌株的总称[5].根际促生菌主要集中在细菌的20多个属,主要包括,,,,,,等[6].PGPR能够改变根际土壤的理化性质,提高根际中对植物生长有利的营养元素的转化[7],也可通过分泌铁载体、有机酸、生物表面活性剂、植物生长激素等,以直接或间接的方式促进或调节植物的生长并起到防治病害的作用[8-9].不同植物根际分离到的促生菌株对相应植物的种子萌发和幼苗生长具有一定的促进作用[10].李青梅[11]等研究发现,经菌剂处理的黄瓜、番茄、茄子、辣椒等4种蔬菜种子的发芽率均高于对照,但对4种蔬菜幼苗根生长的影响因蔬菜种类不同而异.本实验以齐齐哈尔龙江县茄子作物根际土为研究材料,筛选鉴定茄子根际促生菌,研究其分泌激素和溶磷能力及对茄子种子萌发和幼苗的促生效应,为微生物肥料的开发与应用奠定理论基础.
1 材料与方法
1.1 实验材料
供试根际土采集于齐齐哈尔市龙江县的茄子根际,于4 ℃保存待用.
LB培养基(1 L):酵母膏5.0 g,NaCl 8.0 g,蛋白胨10.0 g,琼脂20.0 g,pH7.0.液体培养基不加琼脂.
蒙金娜有机培养基(1 L):葡萄糖10.0 g,MgSO4·7H2O 0.3 g,(NH4)2SO40.5 g,NaCl 0.3 g,FeSO4·7H2O 0.03 g,KCl 0.3 g,MnSO4·H2O 0.03 g,卵磷脂0.2 g,CaCO31.0 g,酵母粉0.5 g,琼脂20.0 g,pH7.0.液体培养基不加琼脂.
PKO培养基(1 L):葡萄糖10.0 g,MgSO4·7H2O 0.3 g,(NH4)2SO40.5 g,NaCl 0.3 g,Ca3(PO4)22.0 g,KCl 0.3 g,MnSO4·H2O 0.03 g,FeSO4·7H2O 0.036 g,琼脂20.0 g,pH7.0.液体培养基不加琼脂.
铬天青(CAS)培养基:每100 mL含20%蔗糖溶液1 mL,10%酸水解酪素3 mL,1 mmol·L-1CaCl2100 μL,1 mmol·L-1MgSO42 mL,琼脂1.8 g,在约60 ℃时缓慢加入磷酸盐缓冲液和CAS染液各5 mL,即得CAS蓝色培养基.
无氮培养基(1 L):蔗糖10 g,KH2PO40.2 g,NaCl 0.12 g,CaCO31.0 g,琼脂20.0 g,MgSO4·7H2O 0.2 g,将pH调至7.2.液体培养基不加琼脂.
1.2 实验方法
1.2.1 菌株的分离与鉴定 称取茄子根际土10.0 g,置于含有玻璃珠和90 mL无菌水的锥形瓶中,在30 ℃、130 r·min-1的摇床条件下充分振荡20 min,取1 mL土壤悬浮液加入盛有9 mL无菌水的试管中,通过系列梯度稀释,取10-4,10-5,10-6,10-7,10-8稀释度的土壤悬浮液各0.2 mL,分别涂布于蒙金娜培养基和固体无氮平板上,每一梯度重复3次.涂布后将平板置于30 ℃恒温培养箱中培养,定期观察菌落大小、颜色等,将有解磷圈和无氮培养基上的单菌落挑出,分别接种到新的蒙金娜培养基和无氮琼脂平板上,反复纯化,将分离纯化得到的菌落接入对应的筛选液体培养基中培养,3 d后取菌液离心,弃上清,沉淀保存于-20 ℃的冰箱中备用.
使用Ezup柱式细菌基因组DNA抽提试剂盒提取菌株的总基因DNA,采用细菌通用引物27F:(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R:(5'-GGTTACCTTGTTACGACTT-3')进行16S rRNA的PCR扩增.PCR反应体系(20 µL):DNA模板0.5 µL,10×Ex Taq buffer 2.0 µL,2.5 mM dNTP Mix 1.6 µL,正向引物(27F)0.8 µL,反向引物(1492R)0.8 µL,5u Ex Taq 0.2 µL,ddH2O 14.1 µL.PCR反应程序:95 ℃ 5 min;95 ℃ 30 s,51/55 ℃ 30 s,72 ℃ 1 min,24个循环,72 ℃ 10 min.测序结果在NCBI的GenBank数据库中进行Blast比对,鉴定菌株种属[12].
1.2.2 菌株溶磷、分泌赤霉素和IAA能力 (1)菌株溶磷能力的测定参考文献[13]的方法.分别将2 µg·mL-1的磷标准液以0.00,0.50,1.00,3.00,5.00,10.00,15.00 mL加入25 mL的比色管中,用超纯水定容至25 mL,得到磷含量分别为0.00,0.04,0.08,0.24,0.40,0.80,1.20 µg·mL-1的标准液.加入2 mL钼锑抗显色剂,室温下反应30 min,测定OD700吸光值,绘制标准曲线.将菌株接于液体PKO培养基中,置于摇床(30 ℃,120 r·min-1)震荡培养,在24,48,72 h分别取菌悬液离心,将1.00 mL上清液置于比色管中,并定容至25 mL,再加入2 mL钼锑抗显色剂,避光反应30 min,测定OD700吸光值,每组3个平行.
(2)赤霉素的测定参考文献[14]的方法.将分析纯赤霉素溶于体积分数为70%的乙醇溶液中,配置成赤霉素标准液100 µg·mL-1,按照一定的浓度梯度进行稀释,取各浓度的赤霉素溶液0.5 mL与4.5 mL的浓硫酸充分混匀,置于冰浴中10 min,充分混匀后用纯净水定容至20 mL,测定412 nm处吸光值,绘制标准曲线.将菌株接种于LB培养基中,置于摇床(30 ℃,120 r·min-1)上振荡培养24 h制备种子液,按1%的接种量将种子液转接LB培养基中,摇床振荡(30 ℃,120 r·min-1)培养,在24,48,72 h分别取菌悬液离心(10 000 r·min-1,10 min),取0.5 mL上清液测定菌株赤霉素浓度,每组设置3个重复,确定各菌株赤霉素的分泌量.
(3)将200 µg·mL-1的IAA标准液梯度稀释为0,25,50,75,100,125,150,175 µg·mL-1,采用Salkowski显色法测定吸光值(OD540),绘制标准曲线.将菌株接于LB液体培养基中,置于摇床(30 ℃,120 r·min-1)培养24 h制作种子液,按1%的接种量将种子液接入含有200 mg·L-1色氨酸的液体LB培养基中,置于摇床培养(30 ℃,120 r·min-1),在24,48,72 h分别取菌悬液离心,5 mL上清液中加入5 mL显色液,并定容至25 mL,避光30 min,测定OD540吸光值,每组3个重复.
1.2.3 菌株产铁载体能力及安全性评价 铁载体的测定参考文献[15]的方法.铁载体检测CAS染液:将0.079 g CAS(铬天青)溶于50 mL去离子水中,再加入10 mL 1 mmol·L-1的FeCl3溶液(含12 mmol·L-1HCl),得溶液A.将0.069 g十六烷基三甲基溴化铵溶于40 mL的去离子水中,得溶液B.将A溶液沿烧杯壁缓缓加入B溶液中,搅拌混匀即得100 mL CAS蓝色检测液.0.1 mol·L-1磷酸盐缓冲液(pH 6.8):每100 mL含Na2HPO4·12H2O 2.427 g,NaH2PO4·2H2O 0.591 g,KH2PO40.075 g,NH4Cl 0.250 g,NaCl 0.125 g,使用时稀释10倍.将CAS培养基在约60 ℃时缓慢加入磷酸盐缓冲液和CAS染液各5 mL,即得CAS蓝色培养基.将菌接于蓝色固体培养基上,倒置培养,如出现透明圈则能产生铁载体.
参考文献[16]的方法检测菌株的溶血性.用无菌接种环蘸取待测菌株,接种于血琼脂平板,置于保温箱35~37 ℃培养18~24 h,观察有无溶血圈产生.
1.2.4 促生菌剂对种子萌发和幼苗的促生效应 选取茄子种子于55~60 ℃的水中浸泡15~20 min,分别将NQ1△,QJ2的菌悬液(OD600=1)稀释20倍,再将茄子种子置于稀释20倍的菌悬液中浸泡12 h.将浸泡后的种子转至铺有2层滤纸的无菌培养皿(直径9 cm)中,每皿放15粒种子,以相同浓度的LB培养基浸种为对照(CK),每个处理3个重复.置于人工气候箱中培养14 d(28 ℃、相对湿度60%),发芽结束后统计种子的发芽率,计算种子的发芽指数、活力指数,测量茄子种子的胚根长.
待茄苗长至3~5片真叶时,将NQ1△,QJ2的菌悬液(OD600=1)稀释20倍对幼苗进行浇灌,每7~10 d浇灌1次,以浇灌相同浓度的LB培养基为对照,实验期间浇灌清水,各处理间保持土壤墒情一致,每个处理重复10株.浇灌7次菌悬液后,测量植株的茎粗、株高和干鲜质量.
1.3 数据处理
采用Microsoft Excel 2019,IBM SPSS Statistics 26.0,Origin 9.0软件进行数据整理、方差分析和作图,采用DNAMAN软件进行供试菌株两两序列间比较.
2 结果与分析
2.1 菌株的16S rRNA序列测定
基于菌株的16S rRNA测序结果和GenBank中已登录的核苷酸序列进行Blast比对,发现菌株QJ1,QJ2,QJ4,NQ1△,NQ1,NQ3,NQ5分别与sp. 210(GQ199718.1)QAZ27(MN099388.1)HNS79(KF933676.1)B19(KU500561.1)BS0669(MK823857.1)BS0713(MK823901.1)sp.(KU372123.1)同源性最高(见表1).因此,将菌株QJ1,QJ2,QJ4,NQ1△,NQ1,NQ3,NQ5分别命名为sp.QJ1,QJ2,QJ4,NQ1△,NQ1,NQ3,sp. NQ5.虽然菌株NQ1,NQ3都属于,但用DNAMAN软件分析二者的序列,发现菌株NQ1和NQ3的相似度为74.73%,说明二者不是同一种菌.
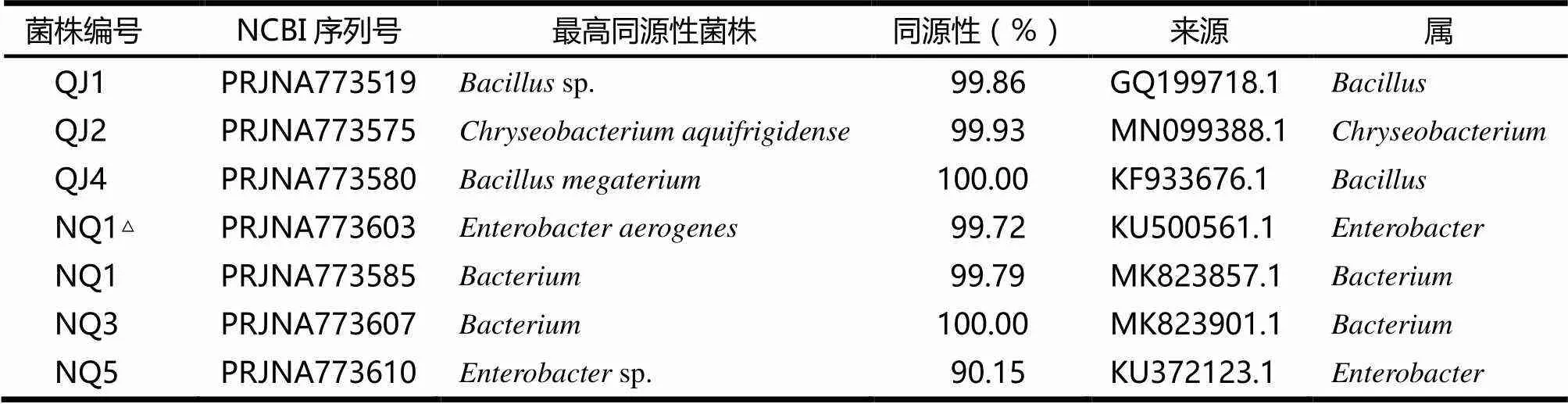
表1 供试菌株16S rRNA序列鉴定
2.2 菌株溶磷、分泌赤霉素和IAA能力
菌株溶磷能力见图1a.由图1a可见,在24 h时,7株供试菌的溶磷浓度在1.46~3.50 mg·L-1之间,菌株NQ1△的溶磷质量浓度最高,为3.50 mg·L-1,与其它菌株之间存在显著性差异;其次是NQ1,QJ1,QJ4.在48 h时,菌株NQ1的溶磷质量浓度最高,为3.82 mg·L-1,与其它菌株之间存在显著性差异;其次是QJ4,NQ3,QJ2.在72 h时,菌株QJ1的溶磷质量浓度最高,为3.94 mg·L-1,与其它菌株之间存在显著性差异;其次是NQ1△,QJ4,QJ2,NQ1.
菌株分泌赤霉素的能力见图1b.由图1b可见,在24 h时,菌株NQ3分泌的赤霉素质量浓度最高,为50.43 mg·L-1,与除NQ1△,NQ5菌株外的其它菌株之间存在显著性差异.在48 h时,菌株QJ1分泌的赤霉素质量浓度最高,为15.43 mg·L-1,与菌株QJ4相比存在显著性差异.在72 h时,菌株QJ1分泌的赤霉素质量浓度最高,为101.86 mg·L-1,与菌株QJ2,QJ4,NQ1△,NQ3,NQ5相比存在显著性差异.
菌株分泌IAA的能力见图1c.由图1c可见,培养24 h时,菌株NQ1△分泌的IAA质量浓度最高,为112.28 mg·L-1,与菌株QJ1,QJ2,QJ4,NQ1相比差异不显著.在48 h时,菌株NQ5分泌的IAA质量浓度最高,为92.28 mg·L-1,与QJ2,NQ1△,NQ1,NQ3之间存在显著差异.在72 h时,QJ2菌株产生的IAA质量浓度最高,为102.28 mg·L-1.而菌株NQ1△,NQ1,NQ3,NQ5此时未检出有IAA分泌,可能是因为在72 h前菌株已进入衰亡期.
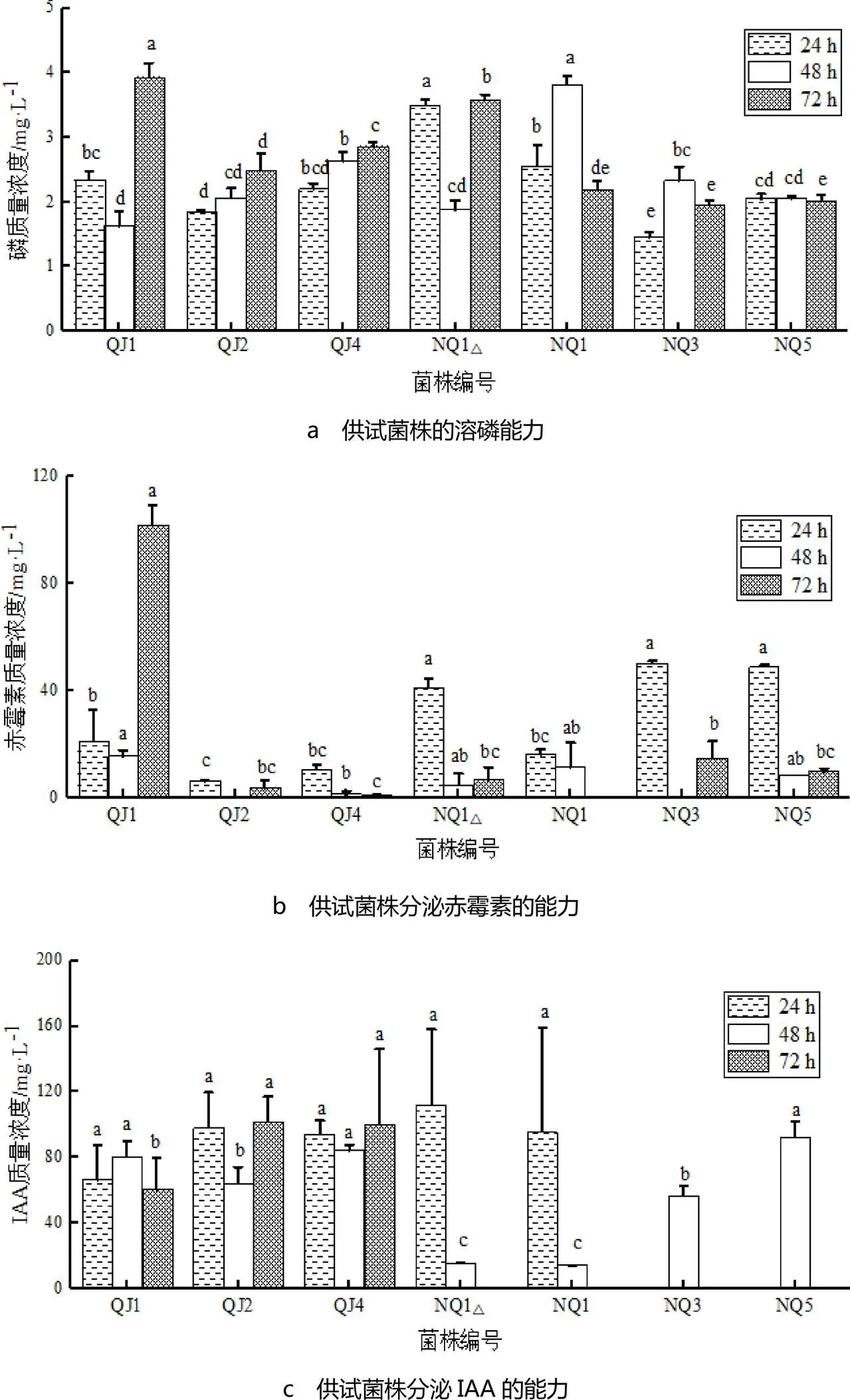
图1 供试菌株溶磷、分泌赤霉素和IAA能力
注:不同小写字母表示处理间差异显著(<0.05),下同.
2.3 铁载体测定及安全性评价
菌株产铁载体能力及溶血性评价情况见表2.由表2可见,在7个菌株中仅NQ3菌株有溶血性,QJ1和QJ2具有产铁载体的能力.
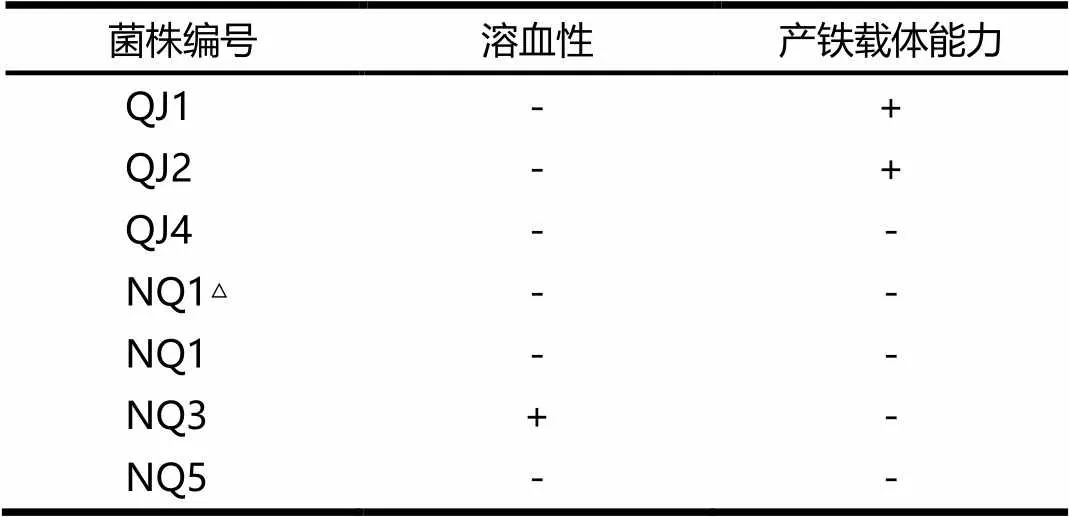
表2 菌株产铁载体能力及溶血性评价
注:“+”表示结果阳性;“-”表示结果阴性.
2.4 NQ1△和QJ2菌悬液对茄子种子萌发的影响
NQ1△和QJ2菌悬液处理对茄子种子萌发的影响见表3.由表3可见,NQ1△菌株处理的种子的活力指数、芽长与对照组之间存在显著差异,分别较对照组增长了90.01%,31.54%,其发芽指数和主根长与对照组比较,分别增加了21.50%,17.20%,但差异不显著.QJ2菌悬液处理后,茄子种子的发芽率、发芽指数、活力指数、芽长均高于对照组,但差异不显著.
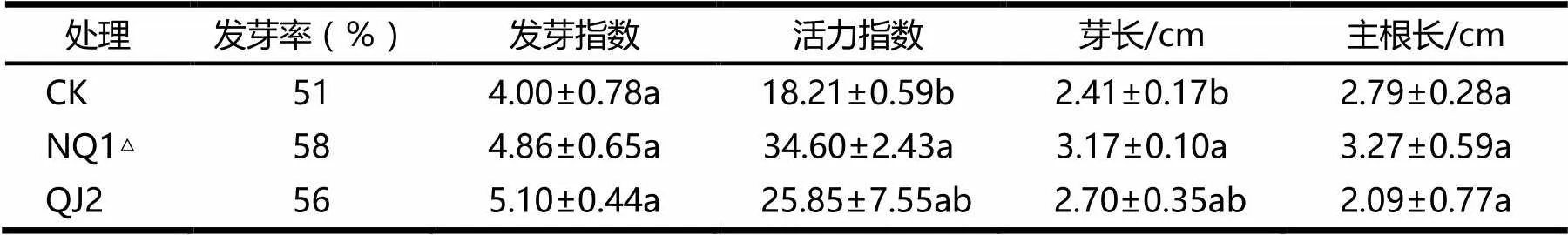
表3 NQ1△和QJ2菌悬液处理对茄子种子萌发的影响
NQ1△,QJ2菌悬液对茄子种子萌发形态的影响见图2.由图2可见,NQ1△菌株对茄子种子的萌发有显著的促进作用,该处理组种子萌发的形态优于对照组.

图2 NQ1△和QJ2菌悬液对茄子种子萌发形态的影响
注:(1),(2),(3)为重复次数.
2.5 促生菌剂对幼苗的促生效应
NQ1△和QJ2菌悬液处理对茄子幼苗的促生效应见表4.由表4可见,QJ2菌悬液处理的幼苗在鲜、干质量和株高方面与对照组之间存在显著性差异,比对照组分别增加了128.70%,110.86%,33.74%,植株茎粗与对照组之间无显著性差异.NQ1△菌株的株高比对照组增长了27.98%,二者之间存在显著性差异.
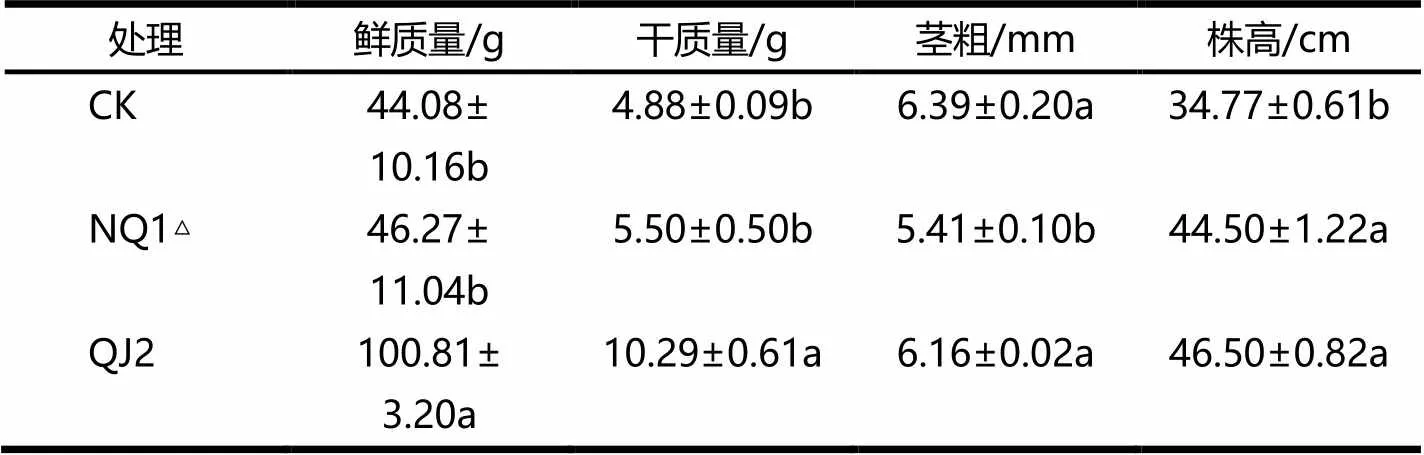
表4 NQ1△和QJ2菌悬液处理对茄子幼苗的促生效应
NQ1△,QJ2菌悬液处理后茄子幼苗形态见图3.由图3可见,QJ2菌悬液对茄子幼苗的生长有良好的促进作用.

图3 NQ1△,QJ2菌悬液处理后茄子幼苗形态
3 讨论与结论
本实验从茄子根际土壤中筛选出7株菌,包括3株解磷菌(QJ1,QJ2,QJ4),4株固氮菌(NQ1△,NQ1,NQ3,NQ5).解磷菌能够在土壤有效磷较少的情况下,将植物难以吸收的磷转化为能够利用的形态,提高土壤中磷的利用率,在溶解难溶性磷为植物的吸收态时,也会增加其体内磷的含量,成为植酸磷[17-18];而固氮菌通过生物固氮来为植物提供氮素或通过磷元素的增溶作用来促进植物的生长,也可改善植物对矿物质的利用率或诱导其产生拮抗物质来促进植株生长[19-20].本实验对所筛选的解磷菌和固氮菌进行溶磷、分泌激素、产铁载体的能力分析.结果表明,供试的解磷菌和固氮菌均有溶磷、分泌赤霉素和IAA的能力,说明一个菌株兼有多种功能.菌株QJ1,QJ2分泌铁载体,NQ3菌株有溶血性.肖坤[21]的实验证明根际解磷菌27B和21A除具有较强的溶解有机磷和无机磷的能力外也具有固氮、产IAA和HCN等多种功能.
植物根际促生菌能够通过分泌植物激素、铁载体和有机酸等方式直接或间接促进植物的生长发育.不同的根际促生菌可能分别作用于植物的不同方面.本研究选取QJ2,NQ1△ 2株菌评估其对茄子种子萌发和幼苗生长的影响.结果表明,菌株NQ1△较QJ2对茄子种子萌发有显著的促进作用,可能与菌株NQ1△分泌较高的赤霉素有关,因为赤霉素通过促进种子内不同酶的合成来调节其营养物质的转化与积聚,打破种子的休眠,提高其萌发率[22-24].盆栽实验表明,菌株QJ2对茄子的促生效果优于菌株NQ1△,原因可能与菌株分泌IAA优于菌株NQ1△,还可能与菌株QJ2产生铁载体有关,通过铁载体的螯合作用,改变土壤中铁的有效性,从而满足植物生长对铁的需求,导致QJ2菌株在盆栽实验中促生效果明显[25].
综上所述,本研究从植物根际筛选出3株解磷菌和4株固氮菌,基于菌株16S rRNA序列同源性分析,将7株菌分别鉴定为sp. QJ1,QJ2,QJ4,NQ1△,NQ1,NQ3,sp. NQ5.且不同菌株具有不同的溶磷、分泌赤霉素和IAA的能力,菌株NQ3具有溶血性,菌株QJ1和QJ2产铁载体;NQ1△菌悬液能促进茄子种子的萌发,QJ2菌悬液对茄子幼苗生长有良好的促进作用.
参考文献:
[1] Xu X,Pan S K,Cheng S F,et al.Genome sequence and analysis of the tuber crop potato[J].Nature,2011,475:189-195.
[2] SatoS,TabataS,HirakawaH,et al.The tomato genome sequence provides insights into fleshy fruit evolution[J].Nature,2012,485(7400):635-641.
[3] 孙婷婷,赵明辉,李淑敏,等.茄子黄萎病研究进展[J].中国瓜菜,2021,34(4):8-14.
[4] 徐伟慧,刘泽平,符春敏,等.根际芽孢杆菌对水稻根系的促生效应[J].河南农业科学,2018,47(4):59-63.
[5] 郭军康,董明芳,丁永祯,等.根际促生菌影响植物吸收和转运重金属的研究进展[J].生态环境学报,2015,24(7):1228-1234.
[6] Gray E J,Smith D L.Intracellular and extracellular PGPR:Commonalities and distinctions in the plant-bacterium signaling processes[J].Soil Biology & Biochemistry,2005,37(3):395-412.
[7] 曾美娟,钟永嘉,刁勇.药用植物根际促生菌促生机理研究进展[J].生物技术通报,2017,33(11):13-18.
[8] 李交昆,余黄,曾伟民,等.根际促生菌强化植物修复重金属污染土壤的研究进展[J].生命科学,2017,29(5):434-442.
[9] 赵静,夏海波,李艳青,等.根际促生菌N对番茄和茄子的促生作用研究[J].北方园艺,2014(4):30-32.
[10] 韩丽珍,刘畅,邓兆辉,等.茶树根际细菌菌株对种子萌发及幼苗生长的促生效应及机制初探[J].种子,2019,38(12):41-47.
[11] 李青梅,陆秀君,马里,等.胶质芽孢杆菌菌剂对四种蔬菜种子发芽及幼苗生长的影响[J].北方园艺,2017(1):10-13.
[12] 霍金柱,陈斌,李莹,等.高效溶栓菌株的筛选鉴定及活性测定[J].西南大学学报(自然科学版),2011,33(6):85-93.
[13] 张芬芬,周晓伦,贺洋洋.一株溶磷促生菌的分离、鉴定及其对玉米幼苗生长的影响[J].广东农业科学,2021,48(5):76-82.
[14] 徐伟慧,吕智航,史一然,等.西瓜复合根际促生菌剂构建与促生效应研究[J].浙江农业学报,2018,30(5):778-786.
[15] 王欢,韩丽珍.4株茶树根际促生菌菌株的鉴定及促生作用[J].微生物学通报,2019,46(3):548-562.
[16] 赵彦华,史杨白,刘国兴,等.一株养殖沙塘鳢肠道溶血性苏云金芽孢杆菌的分离鉴定[J].水产养殖,2021,42(4):16-19.
[17] 贺立虎,李娟丽.解磷菌对油菜品质及土壤理化性质的影响[J].陕西农业科学,2018,64(8):47-50.
[18] Zaidi A,Khan M S,Amil M.Interactive effect of rhizotrophic microorganisms on yield and nutrient uptake of chickpea(L.)[J].European Journal of Agronomy,2003,19(1):15-21.
[19] Dennis P G,Miller A J,Hirsch P R.Are root exudates more important than other sources of rhizodeposits in structuring rhizosphere bacterial communities?[J].FEMS Microbiology Ecology,2010,72(3):313-327.
[20] 杨华,李江,张维,等.施氏假单胞菌在玉米根际的固氮效率和促生效果研究[J].中国农业科技导报,2021,23(4):76-84.
[21] 肖坤,崔延,高丹阳,等.核桃根际解磷细菌的筛选及对核桃促生作用研究[J].河北农业大学学报,2018,41(5):49-54.
[22] 井瑾,王方贞,张瑜,等.干旱胁迫下火棘种子萌发过程及其抗氧化酶活性变化[J].干旱区资源与环境,2017,31(9):135-139.
[23] 李翊华,陈修斌,王燕慧,等.盐胁迫下赤霉素对黄瓜种子萌发及幼苗生长的影响[J].西北农业学报,2014,23(9):207-210.
[24] 杨晓慧,樊帅群,关正,等.不同光照条件下赤霉素处理对阴行草种子萌发抗旱能力的影响[J].北方园艺,2021(15):112-118.
[25] 殷奥杰,王齐,葛淼淼,等.微生物铁载体的应用研究进展[J].环境保护与循环经济,2021,41(7):20-24,69.
Screening,identification and beneficial effects of plant growth-promoting rhizobacteriain the rhizosphere of eggplant
ZHANG Zhi1,2,ZHANG Yao1,2,WANG Zhigang1,2,XU Weihui1,2
(1. School of Life Sciences,Agriculture and Forestry,2. Heilongjiang Provincial Technology Innovation Center of Agromicrobial Preparation Industrialization,Qiqihar University,Qiqihar 161006,China)
Collected and used the rhizosphere soil from eggplant on Longjiang County in Qiqihar as experimental materials.Plant growth-promoting rhizobacteria (PGPR) was screened outusing dilution plate method,and identified by 16S rRNA sequence analysis.The physiological activity of the strains were explored,and conduct safety evaluation.Soaking seed and pot experiments were conducted to evaluate promoting effects of the strains on seed germination and seedling growth of eggplant.The results showed that the seven-PGPR from eggplant rhizosphere were identified,which weresp.QJ1,QJ2,QJ4,NQ1△,NQ1,NQ3andsp.NQ5,respectively.The abilities of dissolving phosphorus,secreting gibberellin and indoleacetic acid (IAA) from seven strains were different.Strains could produce siderophores,and only NQ3 strain had hemolytic activity.Seed soaking and pot experiments showed that bacterium suspension of NQ1△,QJ2 could promote significantly seed germination and seedling growth of eggplant respectively.In conclusion,strains NQ1△ and QJ2 might be candidate agents for seed coating and special promoting growth fertilizer of eggplant,respectively.
eggplant;plant growth-promoting rhizobacteria;identification of strain;promoting effect;microbial fertilizer
Q93
A
10.3969/j.issn.1007-9831.2022.02.012
1007-9831(2022)02-0061-08
2021-10-08
齐齐哈尔大学第三批大学生学术科技创新团队项目(220067);黑龙江省重点研发计划项目(GA21B007);大学生创新创业项目(202010232155,202010232158)
张芝(2001-),女,河南许昌人,在读本科生.E-mail:2297745282@qq.com
徐伟慧(1979-),女,内蒙古赤峰人,教授,博士,从事根际有益微生物的挖掘与利用研究.E-mail:xwh800206@163.com

