广西虫茶毒理学安全性评价研究
温立香,张 芬,袁冬寅,陈家献,彭靖茹,黄寿辉
广西壮族自治区亚热带作物研究所,广西 南宁 530001
虫茶又叫“茶精”,是我国湘桂黔山区特有的一种林业资源昆虫产品,素有茶界“猫屎咖啡”之称,早在宋代医学巨著《太平圣惠方》就多处提到虫茶的药用保健性[1-2]。虫茶是由特定昆虫取食特定植物,在昆虫体内经过特殊的生理生化反应产生的消化发酵物,经筛分、灭菌、干燥等工序加工而成[3],其营养物质丰富,具清热解毒、祛湿健胃、降血糖血脂[4-5]、抗氧化[6]、抑菌抗炎[7-9]和抗肿瘤[10]等功效。虫茶因兼具茶叶与中草药的保健与药用功效,成为热带、亚热带地区一种重要的清凉饮料。鳞翅目许多昆虫都可以用来生产虫茶,目前已知的产茶昆虫有米缟螟、紫斑谷螟、灰直纹螟、化香夜蛾、白条谷螟及弓须夜蛾等[11-12],产茶昆虫和寄食植物不同产生的虫茶不同,按寄食植物主要有三叶虫茶、化香虫茶、老鹰茶虫茶、柳叶虫茶、桑叶虫茶[2,13]及酸枣叶虫茶等,按地域分主要有湖南虫茶、贵州虫茶和广西虫茶等。
广西因地理环境条件特殊且本地有饮凉茶习惯,多地产虫茶,主要分布在三江、龙胜、融安和梧州等地,三江、龙胜一带主要为化香虫茶,融安地区主要为酸枣叶虫茶,梧州一带主要为六堡虫茶。近年来虫茶市场走俏,逐渐成为广西山区群众尤其是少数民族同胞脱贫致富的特色产业之一。然而,虫茶虽已有悠久的饮用历史,但关于其用作食品的安全性问题一直是消费者关注的焦点,因此开展科学的毒理安全性评价对虫茶进一步开发及促进产业健康发展有重要的意义。王芳[14]、杨立昌[15]等对贵州的豹皮樟虫茶、白虫茶,文礼章[16]、易定宏[17]等对湖南的三叶虫茶开展安全性毒理学评价,认为贵州豹皮樟虫茶、白虫茶及湖南三叶虫茶安全无毒,可作为新资源食品进行开发。不同昆虫与寄食植物产生的虫茶不同,目前未见有关于广西虫茶生物安全性的相关研究。本文参照食品安全性毒理学评价程序,以广西融安地区的虫茶为试验材料,分别从急性毒性、致癌、致畸及遗传毒性等方面进行毒理安全性研究,以期为促进特色虫茶进一步开发与产业健康发展提供科学依据。
1 材料与方法
1.1 试验材料
虫茶样品(产自广西融安);SPF级健康昆明种小鼠(实验动物生产许可证号:SCXK(湘)2019-0014,由长沙市天勤生物技术有限公司繁殖,实验动物质量合格证号:1107261911001645、430726201100244242;动物饲料(由长沙市天勤生物技术有限公司和北京科澳协力饲料有限公司生产,生产许可证号和合格证编号分别为:SCXK(湘)2019-0014、1107372000000704,SCXK( 京 )2014-0010、1112621900007994);5种鼠伤寒沙门氏菌组氨酸缺陷型菌株TA97a、TA98、TA100、TA102、TA1535(美国 MOLTOX 公司)。
1.2 试验方法
1.2.1 虫茶的制备
收集寄食植物原料(南酸枣树叶为主)→堆放发酵→引化产茶昆虫蚕食→收集、去杂→高温灭菌、去杂气→干燥→成品。
1.2.2 动物试验
动物试验于广西壮族自治区疾病预防控制中心毒理实验室完成,使用许可证号:SYXK(桂)2016-0002,动物实验室为屏障系统,实验室温度:22 ℃ ~ 25 ℃,相对湿度:55% ~ 70%。
前处理:参照食品安全性毒理学评价程序[18],称取虫茶 50 g,加入 85℃纯水 500 mL浸泡提取30 min,纱布过滤,收集浸泡液;再重复浸泡、提取一次。两次滤液合并,用旋转蒸发仪减压浓缩至50 mL,即得1.0 g/mL(以干品计,下同)的样品提取液,置冰箱保存待用。
急性经口毒性试验:按照GB 15193.3—2014[19]进行;细菌回复突变试验:按照GB 15193.4—2014[20]进行;哺乳动物红细胞微核试验:按照 GB 15193.5—2014[21]进行;小鼠精原细胞染色体畸变试验:按照GB 15193.8—2014[22]进行。
2 结果与分析
2.1 急性经口毒性试验结果
结果如表1。采用最大耐受剂量(MTD)试验法,以 20 000 mg/kg BW 剂量的广西虫茶给予实验动物灌胃后,雌、雄动物均生长良好,体重未受到影响;受试雌、雄小鼠均未出现中毒症状,连续观察14 d无动物死亡现象。试验结束后解剖受试动物,结果显示受试动物主要脏器均未见有明显的异常改变,对照GB 15193.3—2014[19]的急性毒性分级标准,广西虫茶对小鼠的急性经口毒性耐受剂量大于20 g/kg BW,急性经口毒性属无毒级。
表1 小鼠急性毒性试验结果( ±S)Table 1 Results of acute toxicity test in mice(±S)

表1 小鼠急性毒性试验结果( ±S)Table 1 Results of acute toxicity test in mice(±S)
性别 动物数(只)途径 剂量(mg/kg BW) 初始体重(g) 第7天体重(g)第14天体重(g) 死亡数(只) MTD(g/kg BW)雄 10 经口 20 000 20.8 ± 0.7 26.7 ± 0.8 32.1 ± 1.1 0 > 20雌 10 经口 20 000 20.4 ± 0.8 25.1 ± 0.9 29.1 ± 1.2 0 > 20
2.2 细菌回复突变试验结果
细菌回复突变试验(Ames试验)是通过检测受试物对鼠伤寒沙门氏菌的组氨酸营养缺陷型菌株的回复突变遗传毒性效应,来推测其对人体可能的致癌性[23]。本试验中虫茶剂量设置从8 μg/皿依次呈5倍增加,最大增加到5000 μg/皿,最小与最大剂量之间相差625倍,结果显示各剂量组回变菌落数均不存在显著差异(P> 0.05),观察各剂量组平板背景菌苔也未见异常。
表2、表3为两次细菌回复突变试验结果。由各剂量组的回变菌落数统计数据可知:对于选择的5种组氨酸营养缺陷型菌株TA97a、TA98、TA100、TA102、TA1535,无论加入或不加入体外代谢活化系统大鼠肝微粒体酶S-9,受试物各剂量组的回变菌落数都没有超过自发回变菌落数的2倍,各剂量组的回变菌落数间也不存在剂量-反应关系,说明广西虫茶对测试菌株不会诱发基因突变;阳性对照组回变菌落数均远超过自发回变组2倍以上,显示出明显的诱变性。参照GB 15193.4—2014[20],判定广西虫茶诱变试验结果为阴性,对鼠伤寒沙门氏菌组氨酸缺陷型的5种菌株均无直接或间接致突变作用。
表2 第一次细菌回复突变试验结果(±S)Table 2 Results of the first bacterial reverse mutation test(±S)
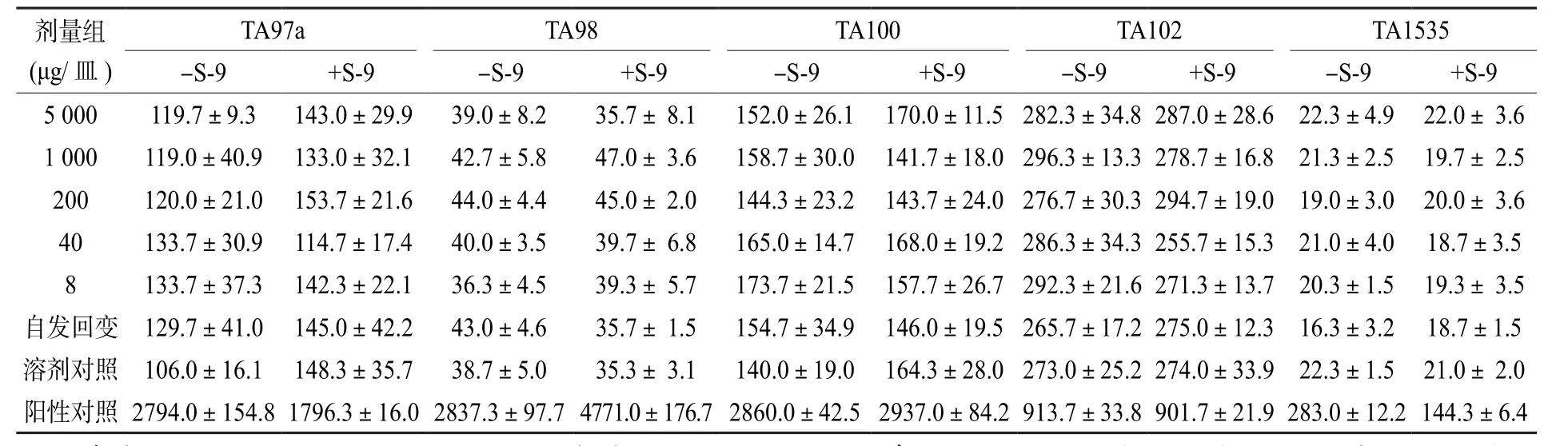
表2 第一次细菌回复突变试验结果(±S)Table 2 Results of the first bacterial reverse mutation test(±S)
注:菌落数结果为3个平皿的均值±标准差;+S-9和-S-9分别表示加和不加代谢活化系统S-9;自发回变对照除不加样品外,其余条件与样品组相同;溶剂对照用灭菌纯水替代样品,其余条件与样品组相同;阳性对照:TA97a+S-9、TA98+S-9、TA100+S-9 采用2-氨基芴(剂量为10 μg/皿);TA98-S-9采用柔毛霉素(剂量为6 μg/皿);TA97a-S-9、TA102-S-9 采用敌克松(剂量为 50 μg/皿);TA100-S-9、TA1535-S-9 采用叠氮钠(剂量为 1.5 μg/皿);TA102+S-9 采用1,8 -二羟基蒽醌(剂量为50 μg/皿);TA1535+S-9采用环磷酰胺(剂量为200 μg/皿)。表3同
T A 9 7 a T A 9 8 T A 1 0 0 T A 1 0 2 T A 1 5 3 5-S-9 +S-9 -S-9 +S-9 -S-9 +S-9 -S-9 +S-9 -S-9 +S-9 5 0 0 0 1 1 9.7±9.3 1 4 3.0±2 9.9 3 9.0±8.2 3 5.7± 8.1 1 5 2.0±2 6.1 1 7 0.0±1 1.5 2 8 2.3±3 4.8 2 8 7.0±2 8.6 2 2.3±4.9 2 2.0± 3.6 1 0 0 0 1 1 9.0±4 0.9 1 3 3.0±3 2.1 4 2.7±5.8 4 7.0± 3.6 1 5 8.7±3 0.0 1 4 1.7±1 8.0 2 9 6.3±1 3.3 2 7 8.7±1 6.8 2 1.3±2.5 1 9.7± 2.5 2 0 0 1 2 0.0±2 1.0 1 5 3.7±2 1.6 4 4.0±4.4 4 5.0± 2.0 1 4 4.3±2 3.2 1 4 3.7±2 4.0 2 7 6.7±3 0.3 2 9 4.7±1 9.0 1 9.0±3.0 2 0.0± 3.6 4 0 1 3 3.7±3 0.9 1 1 4.7±1 7.4 4 0.0±3.5 3 9.7± 6.8 1 6 5.0±1 4.7 1 6 8.0±1 9.2 2 8 6.3±3 4.3 2 5 5.7±1 5.3 2 1.0±4.0 1 8.7±3.5 8 1 3 3.7±3 7.3 1 4 2.3±2 2.1 3 6.3±4.5 3 9.3± 5.7 1 7 3.7±2 1.5 1 5 7.7±2 6.7 2 9 2.3±2 1.6 2 7 1.3±1 3.7 2 0.3±1.5 1 9.3± 3.5自发回变 1 2 9.7±4 1.0 1 4 5.0±4 2.2 4 3.0±4.6 3 5.7± 1.5 1 5 4.7±3 4.9 1 4 6.0±1 9.5 2 6 5.7±1 7.2 2 7 5.0±1 2.3 1 6.3±3.2 1 8.7±1.5溶剂对照 1 0 6.0±1 6.1 1 4 8.3±3 5.7 3 8.7±5.0 3 5.3± 3.1 1 4 0.0±1 9.0 1 6 4.3±2 8.0 2 7 3.0±2 5.2 2 7 4.0±3 3.9 2 2.3±1.5 2 1.0± 2.0阳性对照 2 7 9 4.0±1 5 4.8 1 7 9 6.3±1 6.0 2 8 3 7.3±9 7.7 4 7 7 1.0±1 7 6.7 2 8 6 0.0±4 2.5 2 9 3 7.0±8 4.2 9 1 3.7±3 3.8 9 0 1.7±2 1.9 2 8 3.0±1 2.2 1 4 4.3±6.4剂量组(μ g/皿 )
表3 第二次细菌回复突变试验结果(±S)Table 3 Results of the second bacterial reverse mutation test(±S)
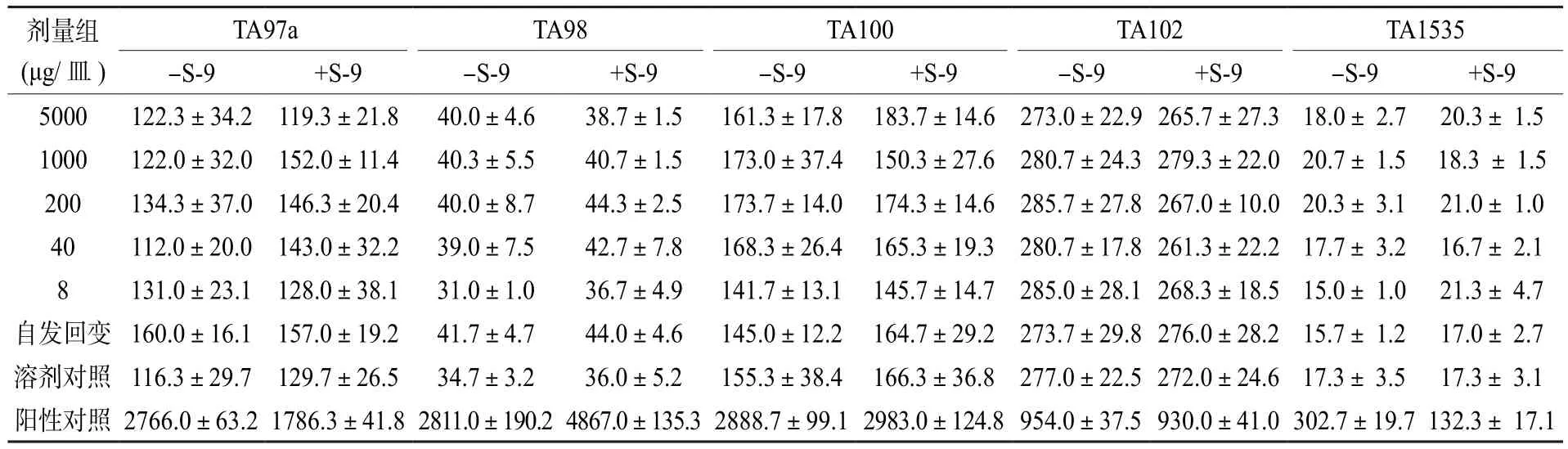
表3 第二次细菌回复突变试验结果(±S)Table 3 Results of the second bacterial reverse mutation test(±S)
TA97a TA98 TA100 TA102 TA1535-S-9 +S-9 -S-9 +S-9 -S-9 +S-9 -S-9 +S-9 -S-9 +S-9 5000 122.3±34.2 119.3±21.8 40.0±4.6 38.7±1.5 161.3±17.8 183.7±14.6 273.0±22.9 265.7±27.3 18.0± 2.7 20.3± 1.5 1000 122.0±32.0 152.0±11.4 40.3±5.5 40.7±1.5 173.0±37.4 150.3±27.6 280.7±24.3 279.3±22.0 20.7± 1.5 18.3 ± 1.5 200 134.3±37.0 146.3±20.4 40.0±8.7 44.3±2.5 173.7±14.0 174.3±14.6 285.7±27.8 267.0±10.0 20.3± 3.1 21.0± 1.0 40 112.0±20.0 143.0±32.2 39.0±7.5 42.7±7.8 168.3±26.4 165.3±19.3 280.7±17.8 261.3±22.2 17.7± 3.2 16.7± 2.1 8 131.0±23.1 128.0±38.1 31.0±1.0 36.7±4.9 141.7±13.1 145.7±14.7 285.0±28.1 268.3±18.5 15.0± 1.0 21.3± 4.7自发回变 160.0±16.1 157.0±19.2 41.7±4.7 44.0±4.6 145.0±12.2 164.7±29.2 273.7±29.8 276.0±28.2 15.7± 1.2 17.0± 2.7溶剂对照 116.3±29.7 129.7±26.5 34.7±3.2 36.0±5.2 155.3±38.4 166.3±36.8 277.0±22.5 272.0±24.6 17.3± 3.5 17.3± 3.1阳性对照 2766.0±63.2 1786.3±41.8 2811.0±190.2 4867.0±135.3 2888.7±99.1 2983.0±124.8 954.0±37.5 930.0±41.0 302.7±19.7 132.3± 17.1剂量组(μg/皿 )
2.3 哺乳动物红细胞微核试验结果
微核是指在细胞有丝分裂后期染色体进入子细胞形成细胞核时,滞留在细胞质中的染色单体或染色体的无着丝点断片等在末期被包含在子细胞的胞质内而形成比主核小的次核(大约为主核的 1/5 ~ 1/20)[24]。微核试验是通过分析哺乳动物骨髓或外周血红细胞,用于检测染色体或有丝分裂器是否损伤的一种遗传毒性试验方法,是国际公认的致突变首选方法。本试验采用间隔24 h两次经口灌胃法进行,由表4受试动物外周血红细胞微核发生率统计结果可知:广西虫茶在 10 000、5 000、2 500 mg/kg BW(即高、中、低)三个剂量下,雌、雄小鼠的微核发生率与阴性对照(纯水)组比较,均无显著性差异(P> 0.05),且各剂量组间的微核发生率也不存在剂量-反应关系和统计学意义;雌、雄试验动物的阳性对照(环磷酰胺)组与阴性对照组比较均存在极显著性差异(P< 0.01);同时高、中、低三个剂量组的PCE/RBC值均不低于阴性对照组的20%,且与阴性对照组比较无显著性差异(P> 0.05)。
表4 哺乳动物外周血红细胞微核发生率结果(±S)Table 4 Results of micronucleus incidence in mammalian peripheral blood erythrocytes(±S)
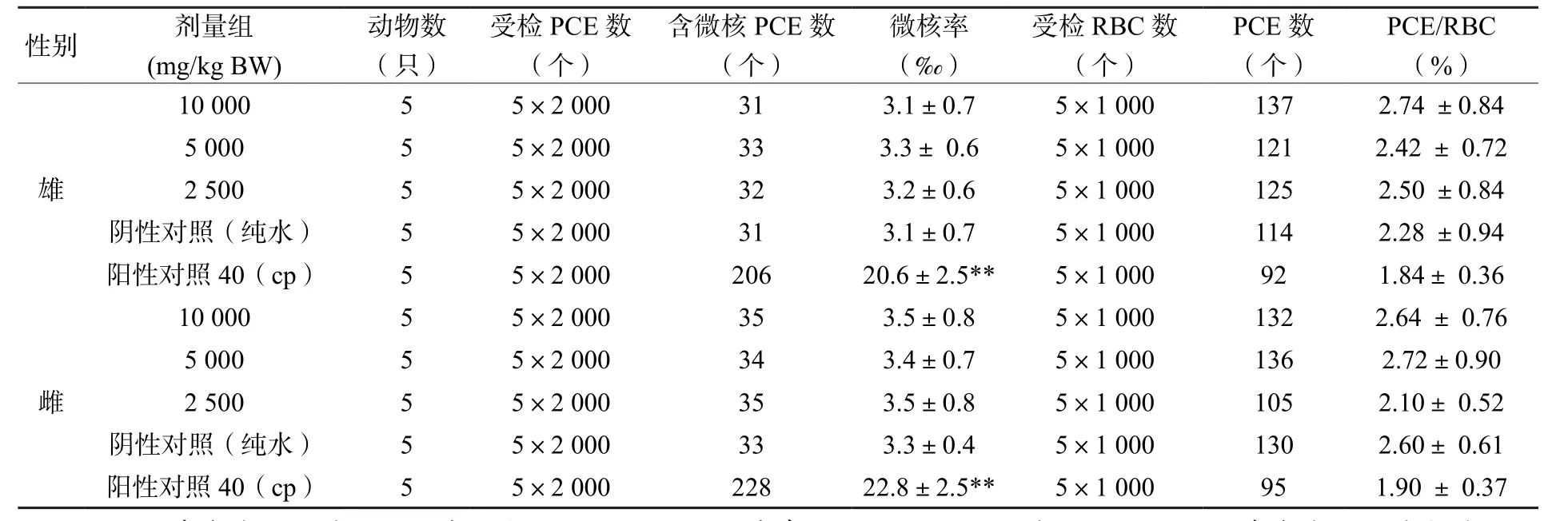
表4 哺乳动物外周血红细胞微核发生率结果(±S)Table 4 Results of micronucleus incidence in mammalian peripheral blood erythrocytes(±S)
注:PCE为嗜多染红细胞,微核率以含微核的PCE千分率表示;RBC为红细胞,PCE/RBC为嗜多染红细胞占总红细胞的比例;**表示与阴性对照组比较,有极显著差异(P < 0.01);cp为环磷酰胺
性别 剂量组(m g/k g B W)动物数(只)受检P C E数(个)含微核P C E数(个)微核率(‰)受检R B C数(个)P C E数(个)P C E/R B C(%)雄1 0 0 0 0 5 5×2 0 0 0 3 1 3.1±0.7 5×1 0 0 0 1 3 7 2.7 4 ±0.8 4 5 0 0 0 5 5×2 0 0 0 3 3 3.3± 0.6 5×1 0 0 0 1 2 1 2.4 2 ± 0.7 2 2 5 0 0 5 5×2 0 0 0 3 2 3.2±0.6 5×1 0 0 0 1 2 5 2.5 0 ±0.8 4阴性对照(纯水) 5 5×2 0 0 0 3 1 3.1±0.7 5×1 0 0 0 1 1 4 2.2 8 ±0.9 4阳性对照 4 0(c p) 5 5×2 0 0 0 2 0 6 2 0.6±2.5** 5×1 0 0 0 9 2 1.8 4± 0.3 6雌1 0 0 0 0 5 5×2 0 0 0 3 5 3.5±0.8 5×1 0 0 0 1 3 2 2.6 4 ± 0.7 6 5 0 0 0 5 5×2 0 0 0 3 4 3.4±0.7 5×1 0 0 0 1 3 6 2.7 2±0.9 0 2 5 0 0 5 5×2 0 0 0 3 5 3.5±0.8 5×1 0 0 0 1 0 5 2.1 0± 0.5 2阴性对照(纯水) 5 5×2 0 0 0 3 3 3.3±0.4 5×1 0 0 0 1 3 0 2.6 0± 0.6 1阳性对照 4 0(c p) 5 5×2 0 0 0 2 2 8 2 2.8±2.5** 5×1 0 0 0 9 5 1.9 0 ± 0.3 7
参照GB 15193.5—2014[21]判定方法,本试验结果表明在剂量范围内广西虫茶不会引起哺乳动物嗜多染红细胞含微核细胞率增加,试验结果为阴性,即广西虫茶对小鼠的外周血红细胞没有损伤和抑制作用,无诱导染色体损伤的能力。
2.4 小鼠精原细胞染色体畸变试验结果
由表5小鼠精原细胞染色体畸变统计结果可 知: 广 西 虫 茶 在 10 000、5 000、2 500 mg/kg BW 3个剂量组下,高、中、低各剂量组的染色体畸变数目、结构改变及畸变细胞率与阴性对照(纯水)组比较,均无显著性差异(P> 0.05),各剂量组间也不存在剂量-反应关系和统计学意义;此外,高、中、低3个剂量组的有丝分裂指数均不低于阴性对照的50%,与阴性对照组比较无显著性差异(P> 0.05),阳性对照(环磷酰胺)组的染色体畸变细胞率与阴性对照组有极显著性差异(P< 0.01)。参照GB 15193.8—2014[22]结果判定方法,本试验中广西虫茶对小鼠精原细胞染色体没有致畸变作用,小鼠精原细胞染色体畸变试验结果为阴性。
表5 小鼠精原细胞染色体畸变结果(±S)Table 5 Results of chromosomal aberration in mouse spermatogonial cells(±S)
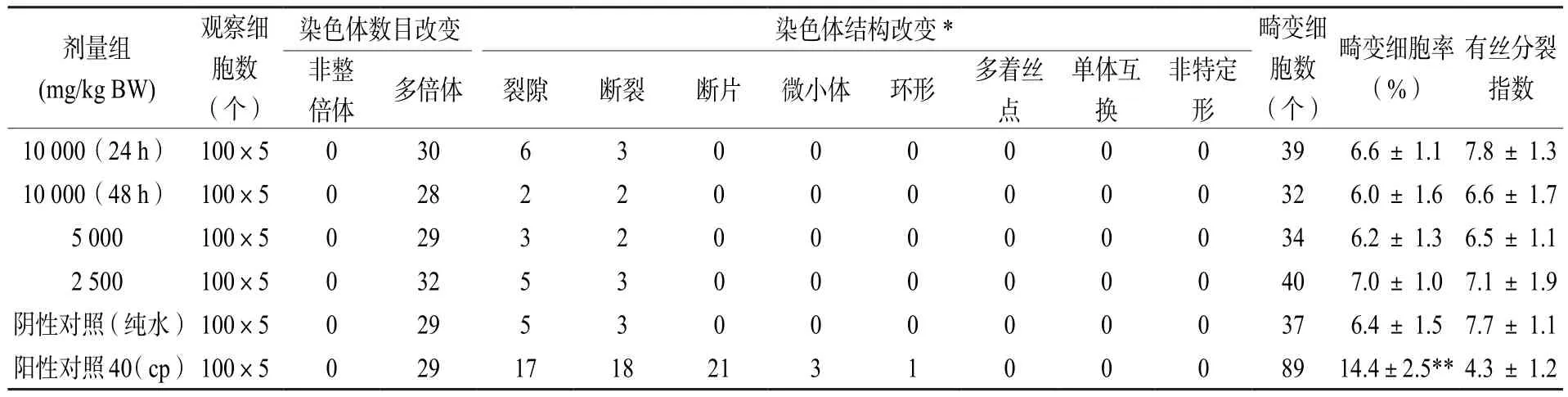
表5 小鼠精原细胞染色体畸变结果(±S)Table 5 Results of chromosomal aberration in mouse spermatogonial cells(±S)
注:每只动物计数100个中期分裂相细胞,观察精原细胞染色体数目和结构改变,另观察1000个精原细胞以确定有丝分裂指数;*结构改变的环形改变包括有着丝点环和无着丝点环,多着丝点为含有两个以上的着丝点;裂隙不计入畸变细胞率,畸变细胞率=(畸变细胞数-裂隙数)/观察细胞数×100;**表示与阴性对照组比较,有极显著差异(P < 0.01)
非特定形10 000(24 h) 100×5 0 30 6 3 0 0 0 0 0 0 39 6.6 ± 1.1 7.8 ± 1.3 10 000(48 h) 100×5 0 28 2 2 0 0 0 0 0 0 32 6.0 ± 1.6 6.6 ± 1.7 5 000 100×5 0 29 3 2 0 0 0 0 0 0 34 6.2 ± 1.3 6.5 ± 1.1 2 500 100×5 0 32 5 3 0 0 0 0 0 0 40 7.0 ± 1.0 7.1 ± 1.9阴性对照(纯水) 100×5 0 29 5 3 0 0 0 0 0 0 37 6.4 ± 1.5 7.7 ± 1.1阳性对照 40(cp) 100×5 0 29 17 18 21 3 1 0 0 0 89 14.4±2.5**4.3 ± 1.2剂量组(mg/kg BW)观察细胞数(个)染色体数目改变 染色体结构改变* 畸变细胞数(个)非整倍体 多倍体 裂隙 断裂 断片 微小体 环形 多着丝点单体互换畸变细胞率(%)有丝分裂指数
3 结论
试验结果表明,以融安地区为代表的广西虫茶对小鼠的急性经口毒性耐受剂量>20 g/kg BW,属无毒级;Ames试验中5 种组氨酸缺陷型鼠伤寒沙门氏菌菌株(TA97a、TA98、TA100、TA102、TA1535)无论加入或不加入 S-9代谢活化系统,结果均为阴性,广西虫茶对鼠伤寒沙门氏菌组氨酸缺陷型的5种菌株均无直接或间接致突变作用;哺乳动物红细胞微核试验与小鼠精原细胞染色体畸变试验中10 000、5 000、2 500 mg/kg BW3 个高、中、低剂量组与阴性对照组比较,均无显著性差异(P> 0.05),结果为阴性,说明广西虫茶没有致突变、致畸变作用,无遗传毒性。

