基于静电层层自组装技术的苦瓜籽油多层乳液的制备及其表征
王惠玲,张 瑞,吴慕慈,杨 宁,叶树芯,帅晓艳,江思佳,李玉保,何静仁,
(1.武汉轻工大学硒科学与现代产业学院,湖北武汉 430023;2.大宗粮油精深加工教育部重点实验室,湖北武汉 430023;3.运鸿集团股份有限公司,湖北武穴 435406)
苦瓜(Momordica charantiaL.),葫芦科(Cucurbitaceae)苦瓜属植物,为一年生或多年生藤本植物,不仅有良好的食用价值,而且有很高的药用价值。苦瓜籽具有抗肥胖[1]、抗癌[2]、抗炎[3]、抗病毒[4]等多种药理作用。苦瓜籽油作为苦瓜籽的副产物,是自然界中为数不多富含α-桐酸的可食用来源之一[5]。研究发现α-桐酸具有降血脂[6]和抗癌[7]等多种生理活性,因此苦瓜籽油具有潜在的药用和保健价值。然而由于苦瓜籽油具有强烈的不良风味和口感,且其极易被氧化、在光和微量金属的催化下极易发生异构化,这些特性限制了苦瓜籽油的应用[8]。因此,基于苦瓜籽油的上述缺点,可选择水包油乳液作为苦瓜籽油的递送体系并对其进行研究。
静电层层自组装技术(Electrostatic Layer by Layer Self-assembly Technique)是指利用表面带有相反电荷的不同电解质间的吸附作用,在经过活化带电荷的基材表面逐层沉积,从而形成特定厚度的多层复合膜[9],具有制备简单、成膜物质丰富、厚度可控、稳定性好等优点。利用该技术制备得的多层乳液由于具有较厚及较致密的界面层,较高的界面电荷密度及良好的界面特性,因而具有较高的乳液稳定性,较长的货架期[10-11]。通过静电层层自组装技术在油滴周围形成更厚的界面层,可作为保护脂溶性功能因子的策略,防止其降解,提高其生物可及性[12]。目前已成功研究了包封ω-3脂肪酸[13]、β-胡萝卜素[14]和维生素E[15]等的多层乳液。
在多层乳液的制备中,常用的带电荷的生物聚合物是大分子物质如蛋白质、多糖等[11]。乳清分离蛋白是奶酪工业的副产物,具有人体所需的全部必需氨基酸,营养价值极高。因此,乳清分离蛋白被广泛应用于食品与药品中,在食品中主要是用作表面活性剂[15]。果胶是一种带负电的聚合电解质,可以同壳聚糖等带正电的聚合电解质相互作用,在油滴表面形成多层界面膜,可以更好的保护油滴[16]。壳寡糖属于阳离子多糖,是一种理想的高分子生物材料,具有较好的生物相容性、可降解性和生物活性[17]。利用静电层层自组装技术将苦瓜籽油进行包埋,既可以掩盖苦瓜籽油不良风味和口感,避免多不饱和脂肪酸被氧化,还具有乳液粒径和天然高分子聚合电解质性质可控制的特点[18]。
本文以乳清分离蛋白(whey protein isolate,WPI)作为乳化剂制备单层乳液,结合苹果果胶(apple pectin,AP)、壳寡糖(chitosan oligosaccharide,CTS),采用静电层层自组装技术制备双层和三层乳液,通过粒径、多分散指数(polydispersity index,PdI)和ζ-电位表征方法,确定乳化剂的用量以及各层乳液制备最佳pH;并对在最优条件下制备的三种乳液进行理化性质表征,以期为苦瓜籽油的开发利用提供新的思路和技术支撑。
1 材料与方法
1.1 材料与仪器
超临界提取苦瓜籽油 江苏高科制药设备有限公司;乳清分离蛋白WPI9410 食品级,蛋白含量89%(湿基)脂肪含量1%(湿基),美国Hilmar公司;苹果果胶APA185 酯化度60.9%,半乳糖醛酸含量>65%,烟台安得利果胶股份有限公司;壳寡糖(分子量≤2000 Da)、14%三氟化硼-甲醇 阿拉丁试剂公司;其他试剂均为国产分析纯。
Ultra-turrax T18型高速分散器 德国IKA公司;ZEN3600纳米激光粒度及电位分析仪 英国马尔文仪器有限公司;IX83全电动倒置显微镜 日本奥林巴斯株式会社;Turbiscan Lab稳定分析仪 法国Formulaction公司;STARTER 3100 pH计 奥豪斯仪器(上海)有限公司;AH-2010型高压均质机ATS工业系统有限公司;PF-101T集热式恒温磁力搅拌器 巩义市英峪予华仪器厂;Discovery DHR-2流变仪 美国TA仪器公司;R3旋转蒸发仪 瑞士Buchi公司;7890A+5975C气相色谱质谱联用仪美国Agilent公司。
1.2 实验方法
1.2.1 苦瓜籽油基本指标测定 相对密度:参照GB/T 5518-2008进行测定;折光指数:参照GB/T 5527-2010进行测定;酸值:参照GB/T 5510-2011进行测定;碘值:参照GB/T 5532-2008进行测定;过氧化值:参照GB 5009.227-2016进行测定;皂化值:参照GB/T 5534-2008进行测定。
1.2.2 水相的制备 参考Ali等[19]的方法略有修改,制备浓度为 1%(w/v)的 WPI磷酸盐缓冲液(pH7.0),制备不同浓度的AP磷酸氢二钠-柠檬酸缓冲溶液(pH4.0)(1.5%~4.5%,w/v),制备不同浓度的CTS溶液(1%~6%,w/v),制备的溶液均在室温下经磁力搅拌4 h,4 ℃冰箱过夜放置待用。
1.2.3 苦瓜籽油单层乳液制备 参考Javier等[20]的方法并稍作修改,制备苦瓜籽油含量为5%(w/w)的苦瓜籽油乳液,将苦瓜籽油加入WPI溶液,用3 mol/L HCl和3 mol/L NaOH调节乳液pH,10000 r/min高速剪切5 min,在一定均质压力下均质一定次数制备得苦瓜籽油单层乳液。以乳液平均粒径、PDI与ζ-电位值为考察指标,通过单因素实验分析均质压力(500、600、700 bar)、均质次数(3、5、7、9 次)与pH(3.0、3.2、3.4、3.6、3.8、4.0、4.2、4.6、5.0、5.6、6.2、7.0)对乳液质量的影响。
1.2.4 苦瓜籽油双层乳液制备 参考Javier等[20]的方法并稍作修改,在磁力搅拌器上,以3 mL/min的滴速将10 mL不同浓度的AP溶液(1.5%~4.5%,w/v)滴入90 mL苦瓜籽油单层乳中,用3 mol/L HCl和3 mol/L NaOH调节乳液pH,再经过8000 r/min,1 min高速剪切制备得苦瓜籽油双层乳液。所得的乳液含有 4.5%(w/w)苦瓜籽油,0.15% (w/v)到 0.45%(w/v)AP。以乳液平均粒径、PDI与ζ-电位为考察指标,通过单因素实验分析 AP浓度(1.5%、2.5%、3.5%、4.5%,w/v)与 pH(3.0、3.2、3.4、3.6、3.8、4.0、4.2、4.4)对乳液质量的影响。
1.2.5 苦瓜籽油三层乳液制备 参考Javier等[20]的方法并稍作修改,在磁力搅拌器上,以3 mL/min的滴速将12 mL不同浓度的CTS溶液(1%~6%,w/v)滴入 96 mL双层乳中,用3 mol/L HCl和 3 mol/L NaOH调节乳液pH,再经过8000 r/min,1 min高速剪切制备得苦瓜籽油三层乳液。所得的乳液含有4.0% (w/w)苦瓜籽油,0.11%(w/v)到 0.67%(w/v)CTS。以乳液平均粒径、PDI与ζ-电位为考察指标,通过单因素实验分析CTS浓度(1%、2%、3%、4%、5%、6%,w/v)与 pH(2、2.2、2.6、3.2)对乳液质量的影响。
1.2.6 乳液平均粒径、PDI及ζ-电位的测定 参考Shi等[21]的方法并略作修改,乳状液粒度通过ZEN3600纳米激光粒度及电位分析仪测定,分散相的折射率和吸收率分别设定为1.475和0.001,连续相的折射率为1.33,测试温度25 ℃。乳状液以1:10的比例用去离子水稀释,测量其电位值。乳状液以1:600的比例用去离子水稀释,测量其平均粒径和PDI。
1.2.7 乳液的微观形态 使用奥林巴斯全电动倒置显微镜IX83,以100放大倍率对乳液进行观察。
1.2.8 乳液静态流变性能测定 参考Niu等[22]的方法并略作修改,采用Discovery DHR-2流变仪对多层乳液静态流变性质进行测定。采用直径为60 mm的平行板,间距设置为1 mm,剪切速率1~100 s-1,应变为0.1%,温度25 ℃。
1.2.9 脂肪酸含量测定
1.2.9.1 乳液破乳 参考武西岳[23]的方法并稍作修改,取乳液10 mL,加入1.0 g无水硫酸钠,适当的振荡混匀,于70 ℃的水浴中超声20 min,6000 r/min离心20 min,分液,可分离得到水相和油相。破乳后,参照1.2.9.1的方法进行甲酯化。
1.2.9.2 脂肪酸甲酯化 参考GB5009.168-2016《食品安全国家标准 食品中脂肪酸的测定》采用14%三氟化硼-甲醇溶液催化油脂甲酯化。
1.2.9.3 GC-MS条件 参考帅晓艳等[24]的方法,气相色谱分析条件:色谱柱为HP-88,100 m× 0.25 mm×0.20 μm;载气为99.999%高纯氮气,恒流模式,柱流速:1 mL/min;进样量 1 μL,不分流;进样口温度为250 ℃;程序升温:150 ℃ 保持 0 min,再以 4 ℃/min升温至 190 ℃,保持 5 min,再以 2 ℃/min升温至230 ℃,保持 10 min。
质谱条件:离子化方式EI+,发射电流200 VA;电子能量70 eV;接口温度250 ℃;离子源温度200 ℃;检测电压350 V。
质谱库:NIST11.L。
1.2.10 乳液物理稳定性测定 用Turbiscan Lab稳定分析仪,分析新鲜制备的乳液在1 h内的稳定性情况。量取大约20 mL乳液置于Turbiscan专用样品瓶中,在25 ℃条件下先每1 min扫描一次,持续10 min后,每5 min扫描一次,持续扫描50 min,观察在此期间乳液的背散射光(ΔBS)变化。用 Turbiscan Lab稳定分析仪,分析各层乳液在14 d内稳定性指数(TSI)的变化,将制备好的乳液取大约20 mL置于Turbiscan专用样品瓶中,与25 ℃温度下存放,每天测量一次TSI值。
1.3 数据处理
每组实验重复三次测定,结果以平均值±标准偏差(means±SD)表示。采用SPSS 19.0统计分析软件进行显著性分析,用LSD和Duncan极差分析结果差异显著性水平(P<0.05)和(P<0.01);用 OriginPro 9.0软件进行作图。
2 结果与分析
2.1 苦瓜籽油理化指标及脂肪酸组成
按照国标相关方法对超临界提取的苦瓜籽油理化指标进行测定,得到结果如表1所示。碘值用于判断食用油的不饱和程度,油脂的碘值越大,说明其不饱和程度越高,脂肪酸的不饱和键也越多,油脂的氧化稳定性就越差,越容易被氧化,而导致油脂腐败变质[25]。由表1所示,苦瓜籽油的碘值为137.646±0.626 g/100 g,表明利用超临界CO2萃取制备的苦瓜籽油中脂肪不饱和度较高。苦瓜籽的过氧化值较高为1.317±0.006 mmol/kg,这可能是因为不饱和脂肪酸极易发生氧化反应而导致的。所得结果与张飞等[5]的测量结果不一致,可能与苦瓜种类、提取方法和放置时间有关[26]。

表1 苦瓜籽油的理化性质Table 1 Physicochemical properties of BGSO
2.2 苦瓜籽油单层乳液制备的单因素实验结果
2.2.1 均质条件对苦瓜籽油单层乳液的影响 由图1可知,在均质次数相同时,相较于500 bar,均质压力为600和700 bar时苦瓜籽油单层乳液的平均粒径极显著减小(P<0.01)。当均质压力为600 bar时,均质次数≥5次时,苦瓜籽油单层乳液的粒径无明显变化。这可能是由于高压均质压力和次数的增加带来强烈的剪切流场,使得乳液获得更有效的乳化[27]。同时,由图1可知,当均质压力为600 bar时,在相同的均质压力下,随着均质次数增加,乳液PDI值呈先减小再增大的趋势,可能是由于均质次数的增加带给乳液的能量过大,从而使乳液产生絮凝聚结等现象[28]。Kuhn等[29]比较了高压均质压力(20和80 MPa)和均质次数(1~7次)对亚麻籽油-乳清分离蛋白乳液稳定性的影响,结果发现增加均质压力和均质次数可以降低液滴大小,然而,在高压(80 MPa)下,均质次数的增加会促进乳液液滴的聚结。

图1 均质条件对苦瓜籽油单层乳液的平均粒径和PDI的影响Fig.1 Effects of homogeneous conditions on mean diameter and polydispersity index of BGSO primary emulsion
不同均质条件下制备的苦瓜籽油单层乳液的ζ-电位变化如图2所示,600 bar均质压力时,均质7次获得乳液的ζ-电位绝对值最大(-23.4±0.7 mV),与均质5次获得乳液的ζ-电位值(-22.3±0.8 mV)无显著差异。ζ-电位的绝对值越小,意味着油滴之间形成的静电排斥力小,可能不足以克服液滴和能垒之间的分子吸引力(即范德华力和疏水吸引力),从而引起乳液发生絮凝、液滴倾向聚集,使乳液分层率增加[30]。因此从节约能源的角度出发,并综合考虑苦瓜籽油单层乳液平均粒径、PDI和ζ-电位,选取均质压力600 bar,均质5次,所制备的乳液粒径为460±3 nm,PDI为0.073±0.004,ζ-电位为-22.3±0.8 mV。

图2 均质条件对苦瓜籽油单层乳液ζ-电位的影响Fig.2 Effect of homogeneous conditions on ζ-potential of BGSO primary emulsion
2.2.2 pH对苦瓜籽油单层乳液的影响 由图3与图4可知,苦瓜籽油单层乳液的粒径、PDI和ζ-电位受pH的影响较大,当pH为4.6左右时,乳液ζ-电位为(-1.0±0.2 mV)趋向于 0 mV,粒径增大,PDI增大,表明当乳液pH接近WPI等电点时,乳液间静电排斥作用减小,乳滴易发生聚集,稳定性降低[31]。当pH小于3.2时,PDI增大,乳液稳定性降低,这可能是因为蛋白质在酸性条件下易变性造成的。综合考虑,在制备苦瓜籽油单层乳时,不调整pH,此时pH为7.0,乳液粒径较小,粒径分布较为均一,ζ-电位绝对值较大,乳液较为稳定。这与林传舟等[9]在用乳清蛋白制备亚麻籽油单层乳液时,选择pH条件为7.0结果相似,pH远离蛋白质等电点,所得乳液较为稳定。

图3 pH对苦瓜籽油单层乳液的ζ-电位的影响Fig.3 Effect of pH on ζ-potential of BGSO primary emulsion

图4 pH对苦瓜籽油单层乳液的平均粒径和PDI的影响Fig.4 Effects of pH on mean diameter and polydispersity index of BGSO primary emulsion
2.3 苦瓜籽油双层乳液的单因素实验结果
2.3.1 AP浓度对苦瓜籽油双层乳液的影响 制备多层乳液时,通常多糖的浓度必须经过优化,使油滴既能产生足够强的空间排斥力和静电排斥力,同时又不促进桥连或耗损絮凝[32]。在制备苦瓜籽油双层乳液时,调整单层乳液pH为4.0,此时苦瓜籽油单层乳液带正电。由图5和图6可知当AP浓度为3.5%(w/v)时,乳液粒径最小(740±47 nm),PDI最小(0.322±0.140),ζ-电位绝对值最大(-12.9±0.7 mV),表明乳滴间的静电排斥力较强,乳液液滴不易相互聚集,此时乳液稳定性最好。当AP浓度大于3.5%(w/v)时,由于阴离子高分子聚电解质过剩,乳液中存在大量未吸附的果胶使得乳液发生损耗絮凝[33],当AP浓度小于3.5%(w/v)时,由于阴离子高分子聚电解质不足,导致两个或多个带正电的液滴共享阴离子果胶分子而引起桥连絮凝[20]。林传舟等[9]在制备亚麻籽油双层乳液时,乳液稳定性随着果胶浓度的逐渐增大,出现聚结-稳定-絮凝现象,说明在制备双层乳液时,果胶浓度过低,乳液易产生桥连絮凝,果胶浓度过高时,易产生损耗絮凝。所以,选择果胶浓度为3.5%(w/v)进行下一步实验。
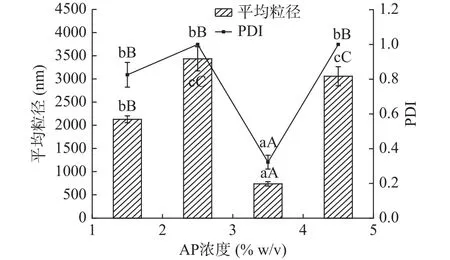
图5 AP浓度对苦瓜籽油双层乳液的平均粒径和PDI的影响Fig.5 Effects of AP concentration on mean diameter and polydispersity index of BGSO secondary emulsion

图6 AP浓度对苦瓜籽油双层乳液ζ-电位的影响Fig.6 Effect of AP concentration on ζ-potential of BGSO secondary emulsion
2.3.2 pH对苦瓜籽油双层乳液的影响 采用静电层层自组装法制备乳液,油滴周围通常会形成多层生物聚合物,多层生物聚合物主要是依赖聚电解质相互之间的静电吸引而形成的,因此pH会影响多层界面的形成、分解和稳定乳液的能力[34]。由图3可知,当pH>5时,单层乳液液滴表面的WPI带负电荷,AP溶液也带负电荷,在这种情况下,两种生物聚合物往往相互竞争油水界面,且彼此之间没有很强的相互作用[35]。调节pH可通过改变生物聚合物的带电荷性质,从而改变两种生物聚合物的竞争或者合作程度,从而可能导致均相(生物聚合物混合)或者非均相(生物聚合物分离)界面的形成[36]。由图3可推测当pH为4.4时,单层乳液带正电荷,由图7和图8可知,当pH为4.4时,苦瓜籽油双层乳液粒径较小,PDI较小,ζ-电位绝对值较大,推测这是由于pH变化,增加了带正电的单层乳液与带负电荷的果胶之间的静电作用力。这可能是由于当pH远离蛋白质等电点时,蛋白质的净电荷和水溶性通常会增加,这可以增加带电荷的多糖的静电吸引或排斥[37]。但当pH小于4.4时,单层乳液ζ-电位增大,表明液滴表面所带正电荷电荷密度增加,此时,AP不足以覆盖单层乳液液滴,两个或多个带正电的液滴共享一个AP分子,此时乳液ζ-电位绝对值减小,易发生静电中和效应,形成桥连结构从而产生聚集。因此,选择pH为4.4为制备的苦瓜籽油双层乳液pH条件,制得的双层乳液粒径为 670±9 nm,PDI为 0.258±0.020,ζ-电位为-19.6±0.9 mV。

图7 pH对苦瓜籽油双层乳液的平均粒径和PDI的影响Fig.7 Effects of pH on mean diameter and polydispersity index of BGSO secondary emulsion

图8 pH对苦瓜籽油双层乳液ζ-电位的影响Fig.8 Effect of pH on ζ-potential of BGSO secondary emulsion
2.4 苦瓜籽油三层乳液制备的单因素实验结果
2.4.1 CTS浓度对苦瓜籽油三层乳液的影响 壳寡糖是自然界唯一带正电荷、阳离子碱性氨基低聚糖[38],由图9和图10可知,当CTS浓度为1%(w/v)时,形成的苦瓜籽油三层乳液ζ-电位仍然为负值(-16.6±0.4 mV),推测此时CTS不足吸附在带负电荷的二层乳液液滴上,维持乳液稳定的静电作用力较小,易产生桥连结构而产生聚集。随着CTS浓度的增大,乳液粒径和PDI呈上升趋势,而ζ-电位值在CTS浓度为 4%(w/v)时为-1.8±0.5 mV,趋近 0 mV,表明此时乳液中静电排斥力较弱。当CTS浓度大于4%(w/v)时,乳液ζ-电位仍然为负值,且乳液多分散系数趋近1,说明乳液粒径分布不均,此时由于CTS浓度过大,CTS的加入增加了乳液体系的黏度,乳液液滴易产生聚集,使得乳液液滴分布不均。综合平均粒径、PDI和ζ-电位结果,选择 CTS 浓度为 2%(w/v),进行下一步研究。

图9 CTS浓度对苦瓜籽油三层乳液的平均粒径和PDI的影响Fig.9 Effect of CTS concentration on mean diameter and polydispersity index of BGSO tertiary emulsion

图10 CTS浓度对苦瓜籽油三层乳液的ζ-电位的影响Fig.10 Effect of CTS concentration on ζ-potential of BGSO tertiary emulsion
2.4.2 pH对苦瓜籽油三层乳液的影响 由图11和图12可知,苦瓜籽油三层乳液的ζ-电位随pH的增大先增大再减小,在pH为3.8附近时,乳液的ζ-电位接近于0 mV,当pH小于3.8时,乳液的ζ-电位为正值,表明此时壳寡糖能吸附在果胶聚电解质层上,当pH大于3.8时,乳液的ζ-电位为负值,这可能是由于pH增大,双层乳液的聚电解质层所带电荷密度增加,使得CTS不能够完全吸附在双层乳液液滴上。当pH为2.2时制备的三层乳液平均粒径比在pH为3.2条件下制备的三层乳液粒径极显著减小(P<0.01),ζ-电位极显著增大(P<0.01)。通过改变pH,直到CTS所带的负电荷占主导地位,当pH为2.2时,乳液ζ-电位为16.3±0.3 mV,粒径为1623±10 nm,PDI为0.480±0.034,说明此时CTS既能为乳液稳定提供静电排斥力,又能提供空间作用力使乳液体系更加稳定[27]。所以选择制备苦瓜籽油三层乳液的pH为2.2。

图11 pH对苦瓜籽油三层乳液ζ-电位的影响Fig.11 Effect of pH on ζ-potential of BGSO tertiary emulsion

图12 pH对苦瓜籽油三层乳液的平均粒径和PDI的影响Fig.12 Effects of pH on mean diameter and polydispersity index of BGSO tertiary emulsion
2.5 苦瓜籽油多层乳液的表征
2.5.1 苦瓜籽油多层乳液的平均粒径、PDI和ζ-电位 由图13可知,苦瓜籽油和WPI溶液在pH为7条件下制备的单层乳液粒径较小,在460 nm左右。将浓度为3.5%(w/v)的AP溶液加入到制备的单层乳液中,将pH调至4.4,此时,单层乳液液滴表面带正电荷,带负电荷的AP吸附到液滴表面,粒径增大至680 nm左右,ζ-电位为负值。通过将浓度为2%(w/v)的CTS溶液加入到制备的双层乳液中,pH调至2.2,制得三层乳液,由于CTS分子所带的电荷为正,双层乳液表面带负电荷,通过静电相互作用,CTS吸附到双层乳液液滴表面,乳液粒径进一步增大,ζ-电位由负值(-19.6±0.9 mV)转变为正值(20.3±0.5 mV),表明聚合电解质已经被吸附到液滴表面。

图13 苦瓜籽油多层乳液的平均粒径、PDI和ζ-电位Fig.13 Mean diameter, polydispersity index and ζ-potential of BGSO multilayer emulsion
2.5.2 苦瓜籽油多层乳液的微观形态 采用静电层层自组装技术制备多层乳液时,需通过仔细控制聚电解质的浓度和环境pH,改变不同界面层的结构和性能,以确保其能够快速和足够吸附在油水界面,以确保几乎没有游离的聚电解质在水相(这可能促进损耗絮凝),得到稳定的多层稳定剂[37],从而使得乳液体系更加稳定。在最优条件下制备的苦瓜籽油多层乳液微观形态结果如图14所示,乳液粒径较小,液滴较为分散,且无明显聚集现象。

图14 苦瓜籽油多层乳液的微观形态(100×)Fig.14 Microscopic morphology of BGSO multilayer emulsion(100×)
2.5.3 苦瓜籽油多层乳液的流变性 由图15可知,各层乳液的黏度和剪切速率成非线性关系,表明乳液为假塑性非牛顿流体[39],随着剪切速率的增加,乳液黏度明显降低。水包油乳剂的流变性质取决于如乳化剂和油相的种类、连续相与分散相的比例、粒径及分布等诸多因素[40]。结果表明苦瓜籽油三层乳液黏度明显高于单层、双层乳液,这可能是由于CTS溶液的黏性使得乳液的黏度增大。双层乳液和单层乳液的黏度随剪切速率的变化趋势基本相似,说明制备双层乳液时,AP和WPI之间产生的正负电荷静电吸引力起主导作用,从而提高界面层的机械强度,使液滴能避免液滴聚结[41]。

图15 苦瓜籽油多层乳液的流变性Fig.15 Rheological property of BGSO multilayer emulsion
2.5.4 苦瓜籽油多层乳液的脂肪酸组成分析 由表2可知,苦瓜籽油中,硬脂酸和α-桐酸含量较高,其相对含量分别高达到33.574%和32.026%,与之前的研究结果具有一定差异[26,42],可能是由于苦瓜品种和油脂提取方法不同所导致。苦瓜籽油单层乳液与苦瓜籽油相比,α-桐酸相对含量极显著降低 (P<0.01),这可能是由于高压均质过程中产热使得α-桐酸氧化导致其含量降低。苦瓜籽油双层乳液和三层乳液中的α-桐酸含量极显著升高(P<0.01),这可能是由于制备条件的不同导致苦瓜籽油中其他成分的损失,造成α-桐酸的相对含量升高。苦瓜籽油各层乳液的亚油酸、CLN-B、CLN-C相对含量,与苦瓜籽油相比都极显著降低(P<0.01),这与廖一等[43]的研究结论相似,可能是由于在乳液制备过程中使用的仪器和制备方式使油脂受到剪切力和摩擦作用,使油脂发生氧化反应。说明苦瓜籽油多层乳液的氧化稳定性需进一步研究。

表2 苦瓜籽油多层乳液的脂肪酸组成Table 2 Fatty acid composition of BGSO multilayer emulsion
2.5.5 苦瓜籽油多层乳液的物理稳定性分析 利用Turbiscan Lab稳定分析仪对样品进行稳定性分析,可通过ΔBS的强度随时间变化曲线,可快速、准确地反映出乳化体系的上浮、沉淀、聚集等动态变化,以及乳化体系的稳定性情况[44]。利用Turbiscan Lab分析仪对新鲜制备的乳液进行扫描1 h,结果见图16,左侧背散射光强度减少,说明底部样品浓度降低出现澄清层;右侧背散射光强度增加,说明样品顶部浓度增加,出现上浮层[44],反映出苦瓜籽油单层乳液、双层乳液和三层乳液的失稳过程都主要是上浮。

图16 苦瓜籽油多层乳液的背散射光(ΔBS)Fig.16 ΔBS of BGSO multilayer emulsion
TSI是用于估计乳化体系物理稳定性的重要参数,可用于比较不同样品的稳定性差异[44]。由图17可看出,在14 d内苦瓜籽油双层乳液和三层乳液的TSI值比苦瓜籽油单层乳液的TSI值小且上升速度慢。说明双层乳液和三层乳液比单层乳液更加稳定,这可能是由于大多数两亲性蛋白质都是小分子,它们形成相对较薄的界面层(几纳米),因此它们只产生非常短的空间排斥力[45],而多糖能够增加油滴间的空间排斥力和静电排斥力,所以在蛋白质包裹的油滴中添加电荷相反的多糖能够增强其对环境应力的抵抗能力[46]。利用静电层层自组装技术,使AP和CTS通过静电相互作用一层一层沉积在液滴表面,使乳滴产生较厚的聚合物层,为乳液提供更大的稳定性[47]。所以苦瓜籽油双层乳液和三层乳液物理稳定性优于单层乳液。

图17 苦瓜籽油多层乳液的稳定性指数(TSI)Fig.17 Turbiscan stability index (TSI) of BGSO multilayer emulsion
3 结论
本研究基于静电层层自组装技术,以苦瓜籽油为油相,用WPI、AP和CTS制备苦瓜籽油多层乳液,用粒径电位对三种乳液进行表征,考察高压均质条件、聚电解质浓度和环境pH对乳液性质的影响,得到制备的苦瓜籽油多层乳液最佳参数如下:将苦瓜籽油和 WPI溶液(1% w/v)混合,pH7.0,经10000 r/min剪切5 min后高压均质600 bar均质5次即得苦瓜籽油单层乳液,单层乳液组成为5%(w/w)苦瓜籽油,0.95% (w/v)WPI;双层乳液在单层乳的基础上添加3.5%(w/v)AP溶液,使得双层乳组成为4.5%(w/w)苦瓜籽油,0.86% (w/v) WPI,0.35% (w/v) AP,调节溶液pH至4.4,8000 r/min剪切1 min即得;三层乳液在双层乳液的基础上添加CTS溶液,使得三层乳液组成为 4% (w/w)苦瓜籽油,0.76% (w/v)WPI,0.31% (w/v)AP,0.22% (w/v)CTS,调节 pH 至 2.2,8000 r/min剪切1 min即得。苦瓜籽油各层乳液具有较小的粒径,较好的分散性。乳液物理稳定性结果表明,苦瓜籽油双层乳液和三层乳液比单层乳液物理稳定性更好。本研究为进一步研究苦瓜籽油多层乳液提供理论基础,对更好发挥苦瓜籽油的功效价值具有参考意义。

