光谱法研究赤藓红和溶菌酶的相互作用
张彦青,刘娜,张丽,付凤艳,张彦,陈灵智,王晓红
(衡水学院 应用化学系,河北 衡水 053000)
赤藓红(erythrosine,简称ETS)是一种人工合成色素,因外观鲜艳、人工成本低、稳定性好的优点,故常被用于食品及调味品的加工与生产,以提高其感官性。但有数据表明,赤藓红色素被大量摄入人体后会危害人体健康[1-2],联合国粮农组织和世界卫生组织规定,人均日允许摄取量不能超过1.25 mg/kg[3]。溶菌酶(lysozyme,简称LYSO)是一种碱性蛋白,由129个氨基酸残基构成,包含6个色氨酸(Trp)残基和3个酪氨酸(Tyr)残基。而食用色素赤藓红经食用后,会与人体中蛋白质结合,将影响LYSO的结构和性能。近年来,赵刚等[4]研究了赤藓红与牛血清白蛋白的相互作用机制及金属离子Cu2+和Zn2+对其的影响。汤小玉等[5]利用同步荧光光谱法对日落黄与人血清蛋白的相互作用机制进行了研究。王新等[6]采用荧光发射光谱与紫外-可见分光光度法等多重光谱技术在模拟条件下研究灿烂甲酚蓝与人血清白蛋白的结合对构象的影响。本文通过光谱法和分子对接技术研究了ETS与 LYSO之间的作用机制,获得了结合参数和热力学参数,为食用合成色素在食品和调味品科学方面的应用提供了一些有价值的信息。因此,研究色素对生物大分子的作用机制,从分子水平上阐明其效应,有助于评价人工合成色素在食品及调味品行业的安全性[7]。
1 实验部分
1.1 仪器
F-7000荧光仪 日本日立公司;HWSY11-K恒温水浴锅 北京市长风仪器仪表公司;SZ-93纯水蒸馏器 上海亚荣生化仪器厂。
1.2 试剂
LYSO浓度配成2.0×10-5mol/L的溶液,纯度≥99%;ETS浓度配成1.0×10-4mol/L的溶液;为维持生理条件下的离子强度,在pH为7.40的Tris-HCl缓冲溶液中添加浓度0.15 mol/L 的NaCl溶液;实验用水为双蒸水。储备液的保存条件:277 K,避光保存。
1.3 实验方法
1.3.1 荧光猝灭法
在一定温度(294,304,308 K)下向10.0 mL比色管中按顺序加入1.0 mL Tris-HCl缓冲溶液、1.0 mL 2.0×10-5mol/L LYSO溶液和不同体积的浓度为1.0×10-4mol/L的ETS溶液后定容,摇匀并恒温30 min。在激发波长为280 nm时,扫描ETS-LYSO体系的荧光光谱图。
1.3.2 三维荧光光谱法
在294 K温度下,取10 mL的比色管2支,均加入1.0 mL 2.0×10-5mol/L的LYSO溶液,加入1.0 mL pH为7.4的Tris-HCl缓冲溶液,向2支比色管中分别加入0,1.0 mL 1.0×10-4mol/L的ETS溶液后定容,2支比色管同时置于294 K温度梯度下30 min,扫描三维荧光光谱。
1.3.3 分子对接
通过搜索蛋白质数据库中的蛋白晶体结构,溶菌酶PDB代码为132L,对溶菌酶的晶体结构进行处理,删除多余的水分子并进行分子力学优化,作为分子对接的受体。获取化合物ETS的分子结构,加氢处理,并采用MOPAC程序[8]优化结构,计算PM3原子电荷。最后,采用AutoDock Tools 1.5.6[9]分别处理ETS和LYSO的结构,然后对接模拟实验利用AutoDock 4.2.6软件处理,得到作用体系的最佳结合构象[10]。
2 结果与讨论
2.1 ETS-LYSO体系的荧光猝灭光谱
激发波长为280 nm时,固定LYSO的浓度,改变ETS的浓度,ETS与LYSO作用的荧光光谱图见图1。

图1 ETS-LYSO的荧光发射光谱(T=294 K)Fig.1 The fluorescence emission spectra of ETS-LYSO system (T=294 K)
由图1可知,随着ETS浓度的增加,LYSO在343 nm处呈现有规律的降低,可见ETS对LYSO有荧光猝灭的作用并生成了稳定的复合物。
通过Stern-Volmer[11]方程,猝灭常数Ksv、猝灭速率常数Kq与温度的相关性判断作用机制:
F0/F=1+Kqτ0[L]=1+Ksv[L]。
(1)
式中:F0、F分别为未加入ETS前和加入ETS后测出的荧光强度;τ0为分子荧光平均寿命,约为10-8s;[L]为加入ETS的浓度。根据[L]与F0/F的数据分别为横、纵坐标作图得到3个温度下的3条直线,直线斜率为Ksv,得到数据结果见表1。

表1 不同温度下ETS-LYSO体系的猝灭反应参数Table 1 The quenching reactive parameters of ETS-LYSO system at different temperatures
由表1可知,3个温度下的线性相关系数r1均大于0.99,说明3个温度下的直线呈良好的线性关系,即ETS-LYSO体系相互作用是单一猝灭;3个温度下的Kq值均大于2×1010L/(mol·s)(最大扩散碰撞猝灭常数),并且ETS-LYSO体系的Kq和Ksv值均随着温度的升高而降低,因此可确定ETS与LYSO体系的猝灭方式为静态猝灭[12]。
用静态猝灭公式lg[(F0-F)/F]=n·lg[L]+lgKa(2),处理计算ETS与LYSO体系的结合常数Ka和结合位点数n,数据见表1。由表1可得n值约为1,说明ETS在与LYSO结合时只有一个结合位点[13],即ETS-LYSO体系形成了1∶1的复合物;Ka值随着温度的上升而趋向减小,即该体系的结合能力降低,且都在104数量级,即该体系的结合能力降低,再一次说明ETS与LYSO相互作用方式为静态猝灭。
2.2 ETS-LYSO 体系的作用力类型
根据Van't Hoff方程,公式RlnK=ΔS-ΔH/T(3),ΔG=-RTlnK=ΔH-TΔS(4),通过计算得到ETS与LYSO体系的热力学参数,结果见表2。

表2 不同温度下ETS-LYSO体系的热力学参数
由表2可知,ΔG<0表明该体系的作用是自发进行的;ΔH<0表明体系复合物的形成过程是放热反应,作用过程存在氢键[14];色素分子与蛋白分子之间存在疏水作用力的论据[15]是ΔS>0,由此推断ETS与LYSO之间作用有氢键和疏水作用力存在。
有文献报道当ΔH<0、ΔS>0时,认为体系间主要作用力类型为静电作用力[16],因此试验了离子强度因素对体系相互作用的影响。即ETS和LYSO的浓度为定值,改变NaCl的浓度,以NaCl的浓度CNaCl、F/F0为横、纵坐标作图,见图2。

图2 ETS-LYSO体系荧光强度随NaCl浓度的变化(T=294 K)Fig.2 The changes in fluorescence intensity of ETS-LYSO system with NaCl concentration (T=294 K)
由图2可知,NaCl的浓度增大时,F/F0的值几乎没有发生变化,证明离子强度的因素对ETS与LYSO的结合无影响,可推断出ETS-LYSO体系在相互作用过程中的静电作用力不是主要作用力[17],再一次说明该体系的结合主要靠氢键和疏水作用力。
2.3 ETS-LYSO体系的三维荧光光谱图
试验考察了LYSO加入ETS前后的三维荧光光谱图,见图3。

(a)LYSO
由图3可知,(a)图为未加入ETS前LYSO在发射波长343 nm处的荧光强度,明显高于(b)图加入ETS后的荧光强度,即加入ETS后,LYSO的荧光强度明显降低,说明ETS对LYSO发生荧光猝灭且程度较大,两者产生了相互作用。
2.4 分子对接
通过分子对接模拟了ETS与LYSO作用的结合模型,结果显示:结合体系的最低结合能ΔG0为-23.19 kJ/mol和通过实验计算得到ΔG=-29.20 kJ/mol之间存在一定误差,原因可能是ETS与LYSO模拟对接过程中排除了溶剂或除氨基酸残基Trp、Tyr之外的受体的刚性[18]。分子对接的能量数据见表3,其中静电能(ΔE3)在分子间相互作用中能占据的比例很小,因此再一次说明结合体系间主要作用力类型不是静电作用。
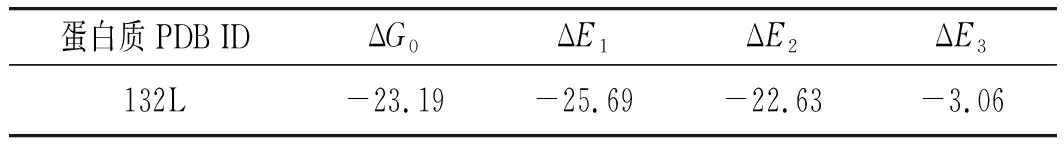
表3 ETS-LYSO体系的对接能量Table 3 The docking energy of ETS-LYSO system kJ/mol
ETS与LYSO的最佳结合模式见图4中(a),ETS与溶菌酶的二维相互作用见图4中(b),显示了ETS结构中的羧基和羰基分别与Arg112和Trg63形成了氢键相互作用,结果表明ETS与LYSO的结合有氢键参与。ETS在LYSO中的结合位置见图4中(c),图4中(d)进一步显示结合位置周围的氨基酸残基,从结果来看,ETS还可以与周围的疏水性氨基酸(Trp62、Ala107、Trp108和Val109)形成疏水作用,增强了分子与分子间的亲和力。根据ETS与溶菌酶的结合模式可以发现,氢键和疏水作用是二者分子识别的关键作用力。Trp62、Trp63和Trp108等氨基酸残基在ETS结合位点附近,可以一定程度上改变溶菌酶中色氨酸附近环境的极性,进而导致溶菌酶的荧光猝灭,与荧光实验所得结论一致。Asp52残基和Glu35残基是LYSO的催化位点,由图4中(d)可以观察到结合位置在催化位点附近,表明ETS与LYSO的结合会影响LYSO的催化位点附近氨基酸残基的微环境,从而对LYSO催化活性产生影响。
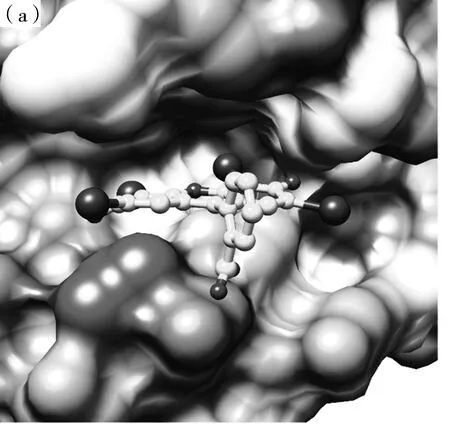
图4 ETS与LYSO的结合模式图Fig.4 The binding pattern diagrams of ETS and LYSO
2.5 ETS-LYSO体系的结合率
为了更深入研究食用色素与蛋白质体系的结合作用,进而通过理论计算体系的色素结合率和蛋白结合率,可以简单预测食用色素进入人体与蛋白质结合后,对蛋白质自身的性能及对人体健康的影响。ETS-LYSO体系的结合率(W)公式如下[19]:

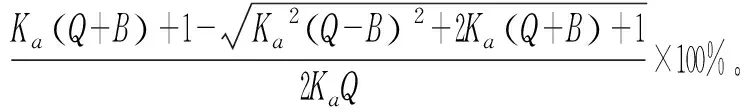
(5)
式中:Q为ETS的总浓度,B为LYSO的总浓度。
蛋白结合率为:
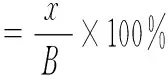

(6)
在温度294,304,308 K下,实验所用LYSO浓度为2.0×10-6mol/L,ETS的浓度在4.0×10-7~10×10-6mol/L范围内,利用表1的Ka值并结合公式(5)和(6),计算不同温度下ETS-LYSO体系的蛋白结合率W(B)分别为57.95%~93.02%(294 K)、40.25%~82.5%(304 K)、13.6%~45.35%(308 K),蛋白游离率分别为42.05%~6.98%(294 K)、59.75%~17.5%(304 K)、86.4%~54.65%(308 K)。ETS-LYSO体系的色素结合率W(Q)为57.95%~18.6%(294 K)、40.25%~16.5%(304 K)、13.6%~9.07%(308 K),色素游离率为42.05%~81.4%(294 K)、59.75%~83.5%(304 K)、86.4%~90.93%(308 K)。以接近人体温度的308 K为例,可以看出在ETS-LYSO体系中随着ETS浓度的增大,色素结合率随之减少,而游离色素含量增加但变化程度不大。这是由于ETS浓度较高时,LYSO与ETS结合没有足够的结合位点,所以游离色素浓度几乎不受结合作用的影响。
结合率研究的结果显示在实验条件下,游离的ETS浓度含量变化较小,说明摄入体内的ETS受到ETS与LYSO结合作用的影响很小,但是游离的LYSO含量会随着结合作用显著降低,同时结合分子对接实验的结论可知ETS与LYSO结合之后会对酶活性产生影响,因此可推测人们摄入ETS之后,会对LYSO的抗炎杀菌功能产生一定影响。因此,在ETS的实际应用中要严格控制摄入剂量,ETS在食品中的合理食用提供了理论指导。
3 结论
本文采用光谱法和分子模拟对接研究了ETS与LYSO之间的相互作用,建立了ETS与LYSO的结合率模型。该方法探究了ETS与LYSO体系的结合率,并且利用结合率模型对LYSO本身抗炎杀菌功能提出了简单的预测,在某些结合参数上可能会有误差,但是该方法简便快速,适用范围较广,为研究食用合成色素类小分子物质对蛋白质分子的性能及人体健康的影响提供了一条新的思路和在食品及调味品中的合理应用提供了理论指导[20]。

