E-Nose结合GC-MS分析两种花椒精油成分及其抑菌活性研究
杜云霄,袁小钧,蔡雪梅,易宇文,邓静,乔明锋*
(1.四川旅游学院 烹饪科学四川省高等学校重点实验室,成都 610100;2.四川轻化工大学 生物工程学院,四川 宜宾 644000)
花椒(Chinese prickly ash)又名山椒、蜀椒等,属芸香科落叶灌木或小乔木,产地广泛,品种繁多[1]。其成熟果皮富含挥发油和脂肪,通常通过水蒸气蒸馏、微波萃取等方法将花椒中的挥发油提取出来。花椒精油因其香味浓郁而持久,可赋予食品特殊风味,所以常用作家庭调味料[2-4]。近几年,食品添加剂的安全问题层出不穷,很多研究者们将目光转移到安全、环保的天然抑菌剂上,尤其是对花椒精油的抗氧化、抑菌、杀虫、抗肿瘤、挥发性特征风味物质的研究,但基于同时使用电子鼻和气质联用分析花椒精油风味及对不同种类花椒精油的抗菌活性和复配使用少有研究[5-10]。
电子鼻(E-nose)是通过模拟人类的嗅觉来实现对检测对象气味的总体评价,相较于其他智能感官仪器及人体感官,其优点在于在响应时间短、线检测分析、检测速度快、重复性好并且能有效避免人为误差[11-12];气相色谱-质谱联用(GC-MS)是通过对混合物的分离、定性和定量检测,实现对气味物质进行差异性分析,广泛应用于肉制品、调味品等领域[13-16]。电子鼻结合气质联用分析食品挥发性风味物质是现代食品风味分析的主要手段之一。
本研究通过电子鼻整体性辨别青花椒精油和红花椒精油的香味差异,利用GC-MS对两种花椒精油中的挥发性化合物进行测定,并作出分析和比较;再通过比较两种抑菌方法对不同花椒精油抑菌效果的影响和采用相同实验方法比较分析不同花椒精油对3种供试菌的抑菌作用,为花椒精油在食品行业的加工安全、保鲜复配应用提供了理论指导。
1 材料与方法
1.1 材料与试剂
青花椒精油和红花椒精油:均采购于昆山晟安生物科技有限公司,源于四川金阳的优质花椒,采用超临界CO2萃取法,无任何添加剂、防腐剂;供试菌种及培养基:金黄色葡萄球菌(S.aureus)、枯草芽孢杆菌(Bacillussubtilis)、大肠杆菌(Escherichiacoli),收藏于四川旅游学院烹饪科学四川省高等学校重点实验室;细菌液体培养基:牛肉膏3 g、蛋白胨10 g、氯化钠5 g、蒸馏水1000 mL、pH 7.2~7.4;细菌固体培养基:营养琼脂33 g、蒸馏水1000 mL、pH 7.2~7.4。
1.2 仪器与设备
FOX4000电子鼻-气味分析仪 法国Alpha MOS公司;Clarus 680+SQ8气相色谱-质谱联用仪 美国PerkinElmer公司;75 μm CAR/PDMS固相微萃取头 美国Supelco公司;LDZX-50FB型立式压力蒸汽灭菌器 上海博迅医疗器械厂;AUW220电子分析天平 日本岛津公司;DL-1可调节式电炉;PYX-DHS-600-BS隔水式电热恒温培养箱;金净双人超净工作台;其他为实验常用仪器设备。
1.3 实验方法
1.3.1 电子鼻分析方法
电子鼻是由18根金属氧化传感器组成,可用于检测花椒风味,每一类或几类敏感性物质可被同一根金属氧化传感器检测到。样品前处理:分别准确称量2.00 g样品A和B,每种共6个样,共计12个样。将样品装于顶空瓶(10 mL)内,然后密封、编号。参数的设置(手动进样):300 s的加热时间(采集时间为120 s,延迟时间为180 s),70 ℃的顶空温度,2000 μL的进样量,150 mL/s的载气流量,2000 μL/s的进样速度。结果分析:每个样品平行检测6次,取最后3次传感器在第120 s时获得的稳定信号进行分析。
1.3.2 气质联用分析方法
顶空条件:取制好的样品,准确称量2.00 g置于15 mL样品瓶中;平衡时间10 min,平衡温度100 ℃;在250 ℃,10 min条件下将萃取头(已老化)插入样品瓶中,萃取50 min,随后进样,解吸10 min。
气相色谱条件:美国PE Elite-5MS气相色谱柱(30 m×0.25 mm×0.25 μm);载气(高纯He),流速1.0 mL/min,不分流进样。升温程序:40 ℃的初始温度,保持2 min;再升温至125 ℃保持2 min,速度为5 ℃/min;最后升温至250 ℃保持4 min,速度为25 ℃/min。
质谱条件:采用全扫描,扫描范围:35~500 m/z;离子源(EI),250 ℃的温度,70 eV的电子轰击能量。
利用NIST谱库和人工解谱对化合物进行检索和确定,再采用峰面积归一化法计算化合物的相对含量。
1.3.3 抑菌活性分析方法
1.3.3.1 菌悬液及含菌平板制备
菌悬液:活化供试菌种,挑取菌苔;含菌平板:将菌悬液与培养基以体积比1∶10充分混合。
1.3.3.2 抑菌圈的测定(滤纸片法和打孔法)
两个样品分别设置3组平行。滤纸片法:将直径为6,15 mm的滤纸圆片用10 μL的花椒精油完全浸透,放置于含菌平板上后,用无菌镊子轻轻按压。在温度37 ℃的恒温箱中培养24 h后,测得数据,最后取平均值。打孔法:在含菌平板上均匀打上直径为10,20 mm的小孔,每孔均用移液枪添加10 μL的花椒精油,37 ℃培养24 h后,测得数据,最后取平均值。
1.3.3.3 MIC及MBC的测定(二倍稀释法)
以50%甲醇做对照实验,每个样重复3次实验。用50%甲醇作为溶剂,制得20,10,5,2.5,1.25,0.63,0.31,0.16 mg/mL浓度的肉汤液体,再向每个肉汤液体中添加50 μL的菌悬液,在温度37 ℃的恒温箱中培养24 h,最后通过肉汤液体的浑浊度判断花椒精油的MIC值(不浑浊的肉汤对应的最小浓度即为MIC值)。用平板划线法将测得的MIC值下的肉汤接种至琼脂平板上,37 ℃培养24 h后,无菌生长的精油溶液浓度则为 MBC值。
1.4 数据处理
数据处理及作图均采用Origin 2019、Excel 2010软件。
2 结果与分析
2.1 花椒精油风味电子鼻分析
采用电子鼻对编号为A、B两种花椒精油样品(A为红花椒精油,B为青花椒精油)进行检测。两种花椒精油电子鼻传感器响应平均值制作的雷达图见图1。
由图1可知,所有传感器对两个样品均有响应且有差异,但风味指纹图谱相似,即总体香味类似。比较发现,LY2型传感器的响应值较低,大部分低于0,说明A、B两样品中不含有毒有害气体或含量极低;两样品在 P30/1及P10/1上的响应值差异较小但响应值较高,说明A、B两样品香味物质种类和相对含量接近且烃类物质含量可能较高;PA/2对A的相应值高于B,说明可能A中醇类及有机胺类物质总含量高于B。
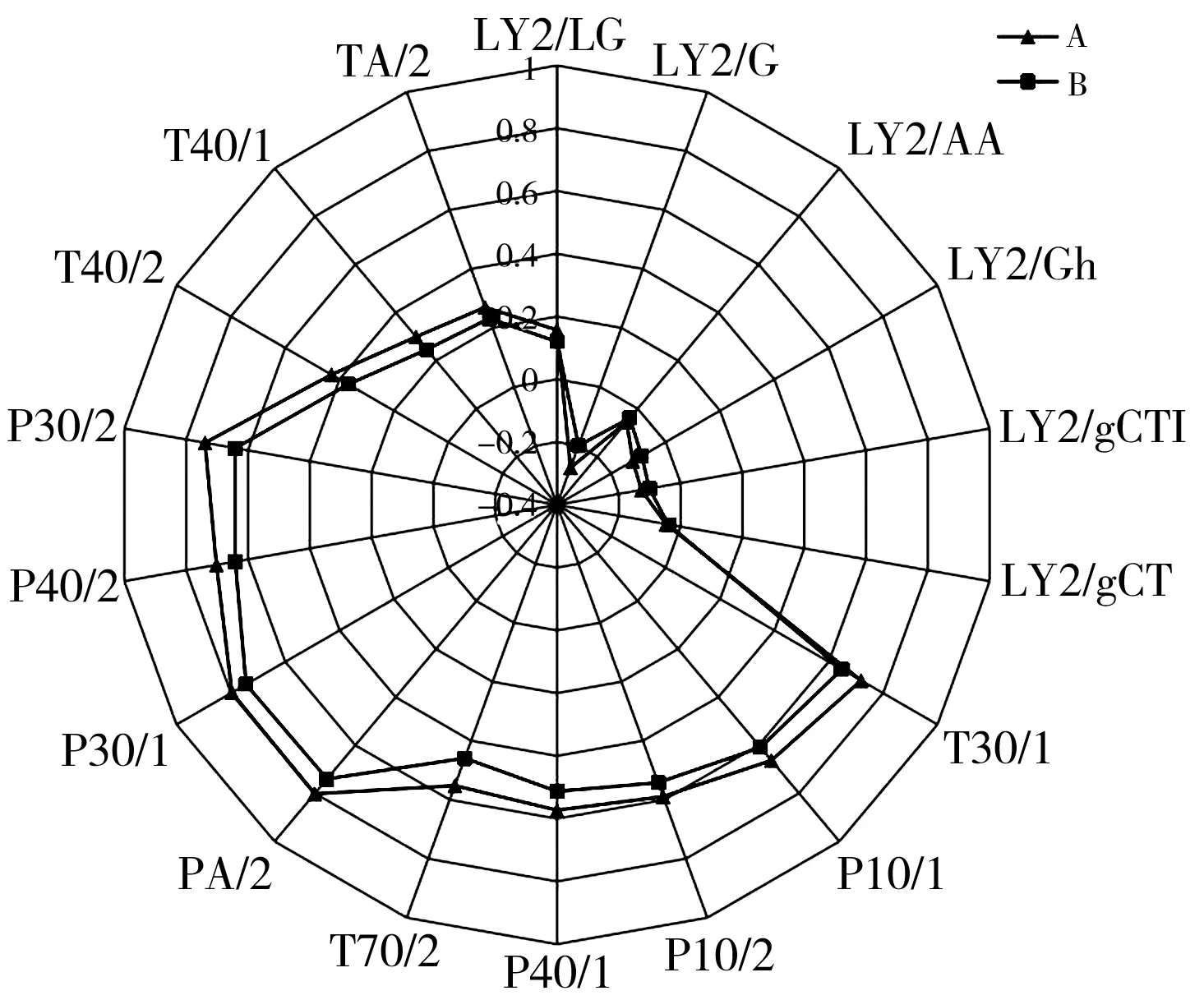
图1 两种花椒精油电子鼻传感器响应值雷达图Fig.1 The electronic nose sensor response value radar map of two kinds of Zanthoxylum bungeanum essential oils
2.2 花椒精油风味GC-MS分析
2.2.1 挥发性成分总离子流图分析
采用HS-SPME收集,通过气质联用仪对两种花椒精油挥发性风味物质进行测定,两种花椒精油挥发性风味物质总离子流图见图2。通过在质谱检索标准库 NIST 14中进行匹配解析,达85%以上匹配度的红花椒有74个成分,占总组分的99.564%,青花椒有65个成分,占总组分的98.944%。为进一步分析各成分的相对质量分数,按峰面积归一化法计算结果,见表1。
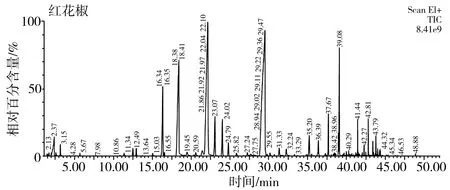
A
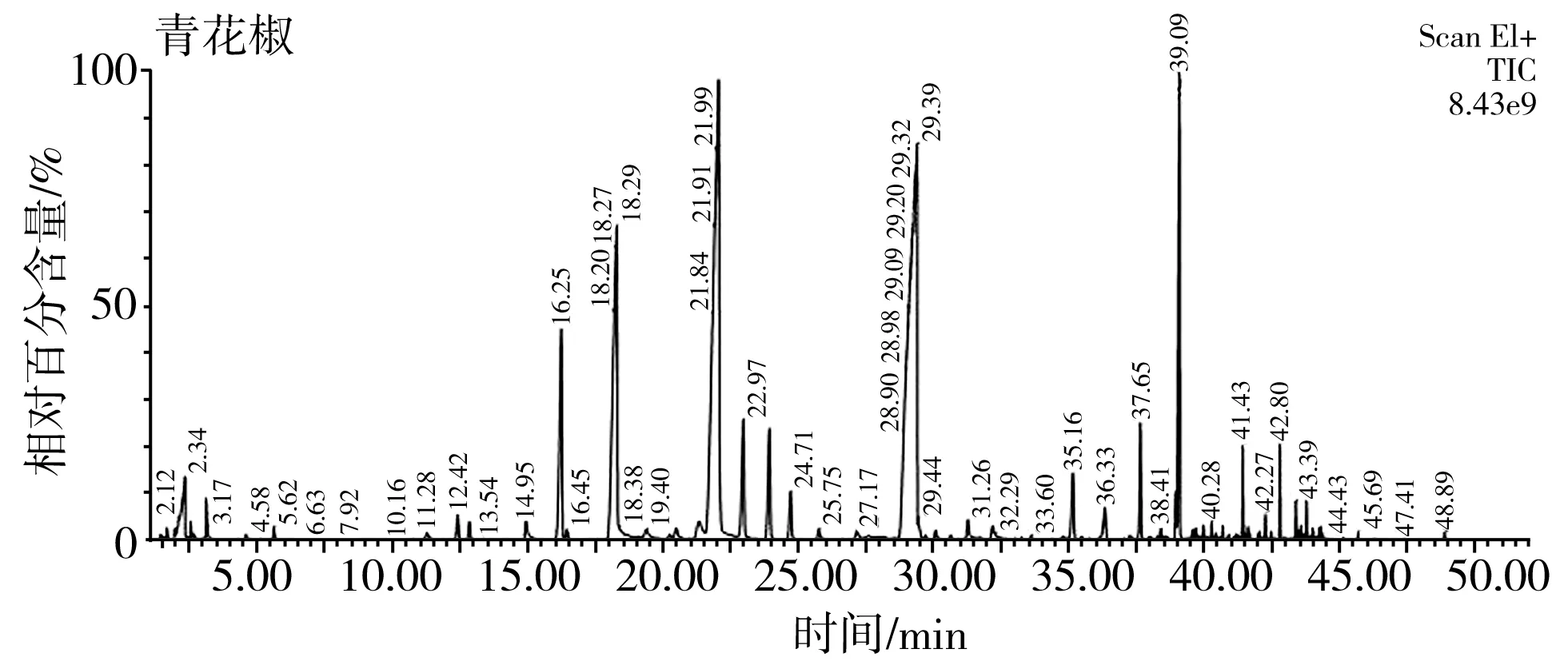
B
2.2.2 挥发性物质GC-MS检测结果分析
两种花椒精油挥发性物质GC-MS检测结果见表1。

表1 两种花椒精油挥发性物质GC-MS检测结果
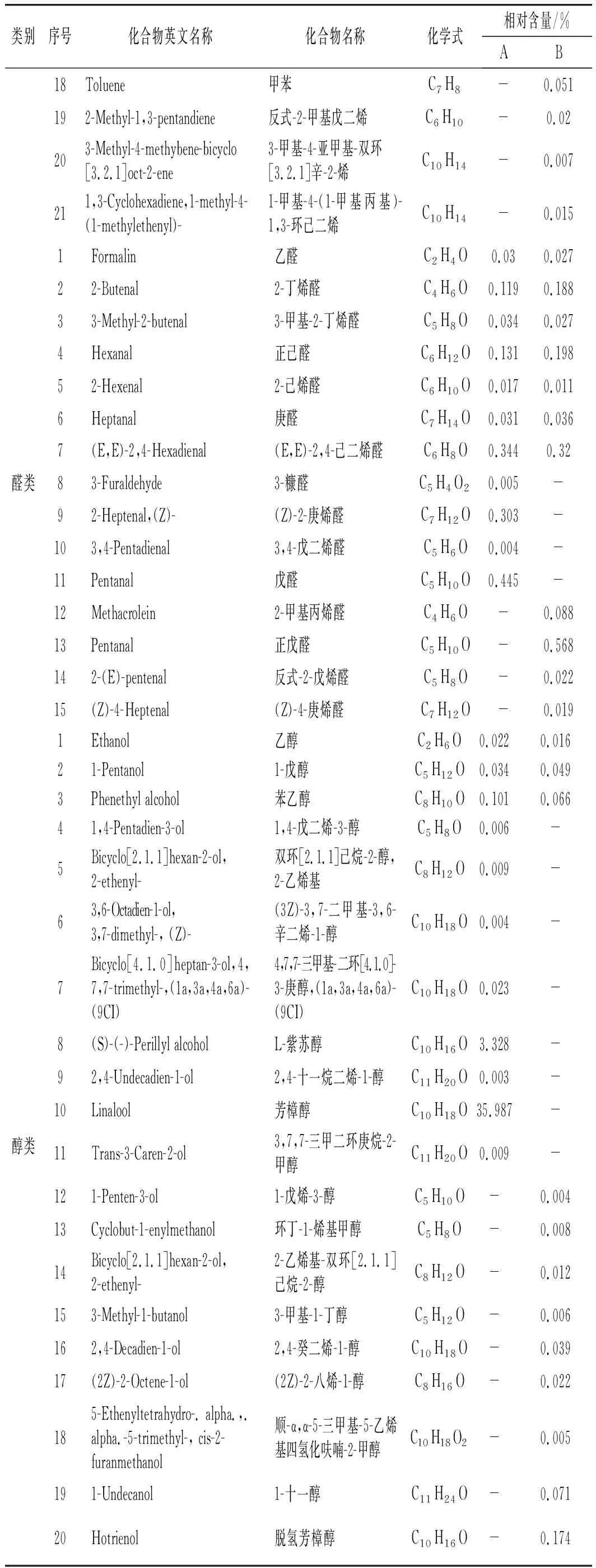
续 表
由表1可知,A、B样品中相同的有28种,其中β-蒎烯、枞油烯、罗勒烯、乙酸、邻异丙基甲苯等为共有物质。芳樟醇和2-氨基苯甲酸-3,7-二甲基-1,6-辛二烯-3-醇酯分别是A、B样品的主要特征性风味物质(A为35.987%,B为33.226%)。枞油烯(26.249%)、β-蒎烯(15.125%)、β-水芹烯(5.762%)是A的次要特征性风味物质,枞油烯(28.945%)、β-蒎烯(14.908%)、萜品烯(7.474%)是B的次要特征性风味物质。β-水芹烯(5.762%)、γ-松油烯(1.439%)、L-紫苏醇(3.328%)、芳樟醇(35.987%)是A中特有的成分物质,2-氨基苯甲酸-3,7-二甲基-1,6-辛二烯-3-醇酯(33.226%)、萜品烯(7.474%)是B中特有的成分物质。
另外,由表1可知,B中的枞油烯和罗勒烯的含量略高于A。据悉,罗勒烯有草香、花香并伴有橙花油气息,常用于多种日化香精配方中,并且罗勒烯具有良好的抑菌作用[17-18],这也可能是使用B作为抑菌剂效果略好于A的原因[19]。其中β-蒎烯和枞油烯是两种精油共有含量较高的物质。β-蒎烯具有抗炎、抑菌、抗氧化的作用,枞油烯具有抗坏血、抗菌、化痰、利肺、镇静的作用[20-22],因此推测花椒精油在食品保鲜的开发利用中有巨大的潜力[23]。
2.2.3 挥发性成分种类及含量差异分析
为了更好比较两种花椒精油挥发性成分的差异,依据化学结构分类统计出两种花椒精油挥发性成分数目和相对百分含量,见表2。萜烯类和醇类物质是A样品的主要挥发性成分,萜烯类和烃类是A样品种类较多的成分;B样品中挥发性物质主要有萜烯类,其次还有其他类(主要是2-氨基苯甲酸-3,7-二甲基-1,6-辛二烯-3-醇酯),醇类、烃类和醛类是B样品种类较多的成分。

表2 两种样品挥发性成分种类与含量Table 2 The types and content of volatile components in the two samples
2.2.4 花椒精油对各供试菌株的抑制活性分析
抑菌圈实验结果见表3。
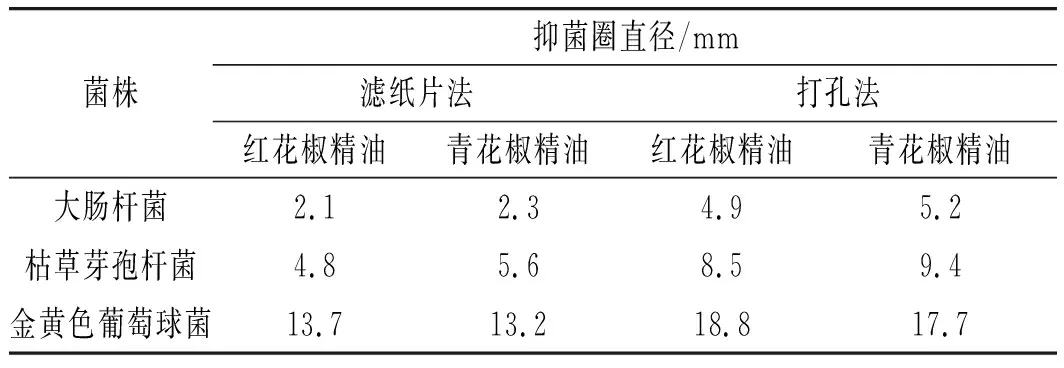
表3 不同实验方法的花椒精油抑菌圈实验结果Table 3 The results of inhibition zone of Zanthoxylum bungeanum essential oils by different experimental methods
由表3可知,打孔法测得的抑菌效果均强于滤纸片法,在两种方法下,对金黄色葡萄球菌的抑制作用均为红花椒精油强于青花椒精油,对大肠杆菌和枯草芽孢杆菌的抑制作用均为红花椒精油弱于青花椒精油,其中,两样品均对金黄色葡萄球菌的抑制作用最显著,对大肠杆菌的抑制作用最弱。
花椒精油具有较强挥发性,采用滤纸片法会使花椒精油更易挥发且不易渗透至培养基,而采用打孔法会使花椒精油充分注入小孔,较易渗透进入培养基作用于供试菌种[24-25]。因此,在实验条件相同时,采用打孔法更能准确、明显地体现花椒精油的抑菌作用。
MIC值及MBC值的测定结果见表4。

表4 二倍稀释法花椒精油抑菌实验结果Table 4 The results of inhibition experiment of Zanthoxylum bungeanum essential oils by double dilution method
由表4可知,对大肠杆菌的抑制作用(对比MIC值):红花椒精油弱于青花椒精油,对枯草芽孢杆菌的抑制作用(对比MBC值):红花椒精油弱于青花椒精油,两样品均对金黄色葡萄球菌的MIC值及MBC值最小,表明在较低浓度下对供试菌有良好的抑制作用,具有较强的抑菌活性。
3 结论
研究表明,通过电子鼻、顶空固相微萃取-气质联用分析,青花椒精油与红花椒精油在香味上不存在明显差异,香气基本一致,挥发性化合物在数量和含量上均以萜烯类为主;两种花椒精油挥发性物质存在不同物质上的差异,大部分相同成分含量差异较小,所以推测在某些方面红花椒精油和青花椒精油可以替代使用或者可以通过复配使其抑菌作用达到较优效果。打孔法和滤纸片法对两种不同花椒精油的抑菌效果差异明显,且采用打孔法更准确;在相同实验条件下,两样品均对金黄色葡萄球菌的抑制作用最好,对大肠杆菌的抑制作用最弱。

