Mimics转染PC12细胞条件的优化
任 静,郝琴琴,成俊丽,李鹏飞
(山西农业大学 生命科学学院,山西 太谷 030801)
将外源基因导入真核细胞内并使其表达的技术称为细胞转染技术,该技术是研究基因表达调控的重要手段。常用的转染方法包括化学转染法,如阳离子脂质体转染、磷酸钙沉淀法等;生物转染法如病毒介导转染;物理转染法如电穿孔法、显微注射法等。根据转染载体不同又可分为病毒载体转染和非病毒载体转染[1]。因细胞类型和试验结果要求的不同,选择转染效率高、细胞毒性小的转染方法至关重要。PC12是源于大鼠肾上腺髓质嗜铬细胞瘤的一种细胞株,可在神经生长因子的诱导下发生形态及生理功能的变化[2],在多种疾病研究中被广泛使用[3]。PC12是一类较难转染的细胞,研究中普遍采用病毒介导转染[4-6],该方法转染效率较高且能够使目的基因在细胞内稳定表达[7],但存在无法携带大片段、具有一定危险性和成本较高等缺点[8]。为解决这些问题,许多研究人员采用非病毒载体作为替代的转染方法以达到瞬时转染PC12细胞的目的,非病毒载体主要包括阳离子聚合物载体和阳离子脂质体载体[9]。因此,在不影响PC12细胞活性及分化能力的基础上,选择合适的转染试剂及最佳转染量,提高PC12细胞的转染效率,是后续研究基因功能的重要前提。
本试验选取了阳离子聚合物转染试剂RFect、D-Portal、TransIntroTMEL和阳离子脂质体转染试剂Lipofectamine 3000、Lipofectamine 2000共5种,通过比较各类转染试剂在相同条件下对PC12转染NC-FAM mimics的效果,选择最佳转染试剂,后续优化转染PC12的最佳NC-FAM mimics转染量,以确定适合PC12细胞的转染试剂及转染条件,旨在为PC12细胞的高效转染奠定理论基础。
1 材料和方法
1.1 材料
大鼠肾上腺髓质嗜铬细胞瘤PC12细胞株购自上海中桥新舟生物科技有限公司。
1.2 主要试剂
FAM标记的microRNA NC mimics由上海吉玛公司合成;RPMI-1640培养基购自HyClone公司;RFect购自常州百代生物科技股份有限公司;D-Portal购自天津美瑞特疫疗科技有限公司;TransIntroTMEL购自北京全式金生物技术有限公司;Lipofectamine 3000、Lipofectamine2000均购自Thermo公司。
1.3 试验方法
1.3.1 PC12细胞培养 以RPMI-1640完全培养液(含10%胎牛血清、1%双抗)于37℃在5%CO2条件下培养PC12细胞,待细胞密度达到80%以上时进行细胞传代,选取处于对数生长期的细胞进行转染。
1.3.2 不同转染试剂转染PC12细胞 用完全培养液调整细胞浓度为5.0×105个/mL,接种至6孔板,并于细胞培养箱中继续培养24 h。按照每种转染试剂说明书的要求进行转染操作(依照说明书中6孔板最大规格添加试剂及样品),转染试剂添加量分别为RFect 10μL、D-Portal 10μL、TransIntroTMEL 12.5μL、Lipofectamine 3000 10μL、Lipofectamine 2000 12.5μL;与之相对应的NC-FAM mimics添加量分别为4、4、3、5、5μg。
1.3.3 不同转染量转染PC12细胞 设置6个NCFAM mimics转染浓度梯度,分别为50、60、70、80、90、100 nmol/L,每组设置3个重复。先用无血清培养基Opti-MEM分别预孵育转染试剂和NCFAM mimics 5 min,再混合孵育20 min后转染PC12细胞。根据转染浓度分别加入6孔板后,添加RPMI-1640培养液至3 mL。细胞培养箱中培养6 h后更换无血清培养基。
1.3.4 转染效率测定及细胞计数 转染后,阳性细胞能够发出绿色荧光,在倒置荧光显微镜下观察每组细胞荧光信号并采集图像。每个试验组中随机选取3个有代表性的视野进行观察计算,采用Image J软件对图像进行处理,统计荧光强度和细胞数量。
1.4 数据处理
数据分析使用GraphPad Prism 9.0软件,采用单因素方差分析(One-Wat ANOVA)进行组间比较。
2 结果与分析
2.1 PC12细胞正常状态下形态特征
荧光显微镜下观察正常状态下PC12细胞形态可知(图1),高分化状态下的PC12细胞为圆形,出现聚集成团生长的现象,且细胞间突触形成网状结构,细胞贴壁状态良好。
2.2 不同转染试剂转染效果及细胞损伤情况
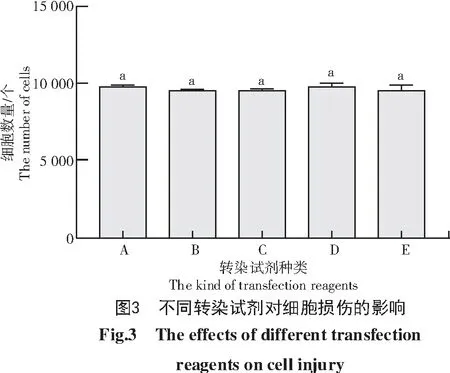
由图2可知,5种转染试剂中RFect荧光强度最低,转染效果最差;D-Portal、Lipofectamine 3000和Lipofectamine 2000转染效果优于RFect,但仍未达到最佳转染效果;TransIntroTMEL转染细胞荧光强度最高,转染效果最好。此外,不同转染试剂对细胞损伤结果如图3所示,5种转染试剂转染PC12细胞后,各组细胞数量无统计学差异,说明本试验选择的5种转染试剂对细胞损伤的影响无明显差别。

2.3 不同NC-FAM mimics转染量转染效果及细胞损伤情况
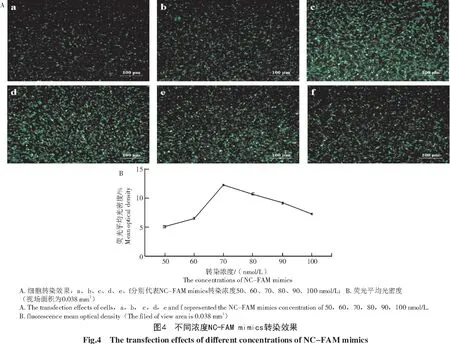
为确定转染PC12细胞的最佳mimics转染量,选择转染效果最好的TransIntroTMEL转染试剂对不同浓度的NC-FAM mimics进行转染,分析每组荧光强度。从图4-A可以看出,当转染量在50~100 nmol/L浓度梯度时,随着NC-FAM mimics转染量的增加,荧光强度呈先增高随后逐渐下降的趋势,转染效果随之先升高随后逐渐降低;进一步分析细胞荧光平均光密度,结果显示(图4-B),平均光密度在转染浓度达到70 nmol/L前逐渐升高,之后逐渐降低。以上结果表明,当NC-FAM mimics浓度为70 nmol/L时,荧光信号最强,转染效果最好。
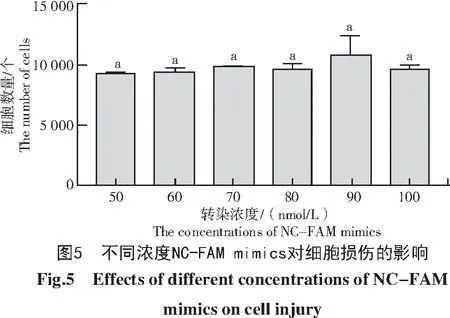
进一步研究不同浓度NC-FAM mimics对细胞损伤的影响,结果发现,不同转染浓度组的细胞数量间无统计学差异(图5),说明本试验选取的6个浓度梯度对细胞损伤的影响无明显差别。
3 结论与讨论
PC12由于细胞体积较小,生长缓慢,未分化状态下不易贴壁,转染较为困难[10-11]。前人采用物理转染法的电穿孔技术对PC12进行转染,转染效率较低,约为10%~20%[12];而生物转染法如慢病毒载体转染,虽能达到较高的转染效率,但是靶向特异性差且操作困难[13]。本试验采用化学转染法,选用了阳离子脂质体(Lipofectamine 3000和Lipofectamine 2000)和阳离子聚合物(RFect、D-Portal和TransIntroTMEL)2类转染试剂,其主要差别在于携带质粒进入细胞的载体不同。已有研究证实,阳离子脂质体和阳离子聚合物转染试剂在PC12细胞中的转染效果均高于物理转染方法和病毒载体转染[14]。本结果发现,阳离子聚合物转染试剂TransIntroTMEL的转染效果最好,可能是由于脂质体会抑制磷酸激酶C、ATP酶等活性[15-16],作为siRNA载体进行转染时会导致脱靶效应[17],此外脂质体进入细胞后易产生细胞毒性[18],而阳离子聚合物是一类线性高分子聚合物,携带大量活性较高的功能基团,能够与细胞膜亲和形成氢键,以传递外源基因[19],产生的细胞毒性较脂质体更小。目前,许多研究者选择缺乏免疫原性、包装核酸方面具有灵活性且更易降解的阳离子聚合物作为载体进行试验。LIU等[20]采用聚乙二醇-聚乙烯亚胺(PEG-PEI)作为载体转染siRNA降低PC12细胞中SNCA的表达,证明PEG-PEI载体具有较高的转染效率及较低的细胞毒性。由于化学转染试剂原料及研发手段的不同,转染同种细胞时选择不同的转染试剂会产生不同的转染效果,因此,对于培养条件严格、转染困难的PC12细胞,必须通过进一步的优化来提高转染效率。
转染效果受到细胞状态、传代次数、转染浓度和质粒大小等的影响,其中转染浓度的影响尤为重要。俞晓炜等[21]用TransIntroTMEL对食管鳞癌细胞进行转染,发现当质粒质量浓度为4 ng/μL时转染效率最高。陈凤婷[22]用TransIntroTMEL对MDAMB-231细胞转染CY 3标记的NC mimics,优化转染条件,发现当NC mimics浓度为40、50、100 nmol/L时,转染效率均可达到80%以上。而本试验中,用TransIntroTMEL转染PC12细胞,最佳的转染浓度为70 nmol/L,与前人研究结果不同,这说明同一转染试剂转染不同类型细胞时,最佳转染浓度存在差异。本试验中设置的不同转染条件之间PC12细胞损伤无明显差异,不同试剂及不同转染浓度对细胞造成的损伤均在试验允许范围内。
本试验选用5种试剂对PC12细胞进行化学转染,结果显示,非脂质体转染试剂TransIntroTMEL的转染效果最好;进一步对NC-FAM mimics转染浓度进行优化,结果表明,转染浓度为70 nmol/L条件下TransIntroTMEL对PC12细胞转染后荧光信号最强,且各浓度处理间的细胞损伤无显著差异,能够在保证细胞存活率的前提下获得较高的转染效率。

