53个猕猴桃品种(品系)亲缘关系的SCoT分析
齐贝贝 王发明 莫权辉 叶开玉 龚弘娟 刘平平 蒋桥生 李洁维


摘 要: 現有主流猕猴桃品种的遗传背景相对单一,亲本来源地理分布狭窄,亲缘关系不清晰。为充分利用杂种优势,该研究以广西植物研究所猕猴桃种质资源圃收集的53个猕猴桃品种(品系)叶片为材料,使用SCoT分子标记进行遗传多样性分析。结果表明:(1)10条引物在53份猕猴桃供试材料中共扩增出110条条带,各引物扩增的条带在8~15条之间,引物平均扩增条带数为11条;其中多态性条带101条,引物平均扩增多态性条带数为10.1条,多态性比例为91.81%。(2)聚类分析显示猕猴桃品种(品系)没有按类型、倍性或选育地等形成明显有规律的聚类关系。但相对来说,同一杂交后代个体之间的亲缘关系比亲本与后代个体之间的亲缘关系更近;芽变品种与原品种并没有表现出特别近的遗传距离,说明芽变材料的突变可能在基因组或染色体层面发生了较大范围的重组、复制或丢失;‘楚红’‘桂红’‘湘吉红’和‘龙藏红’4个红肉品种与‘红阳’亲缘关系明显较远,说明其可能由不同亲本衍生而来;初步验证了 ‘桂海四号’可能为‘Hort16A’亲本之一的推测。
关键词: 猕猴桃品种, 中华猕猴桃, 亲缘关系, SCoT分子标记
中图分类号: Q943,S663.4
文献标识码: A
文章编号: 1000-3142(2022)01-0049-09
收稿日期: 2020-06-17
基金项目: 国家自然科学基金(32060643,32060666);现代农业产业技术体系广西创新团队建设专项(nycytxgxcxtd-13-1);广西科技重大专项(桂科AA17204097-10);广西植物研究所基本业务费(桂植业21008)[Supported by the National Natural Science Foundation of China (32060643, 32060666); Major Projects of Guangxi Innovation Team Building in the State Modern Agricultural Induantry Technology System (nycytxgxcxtd-13-1); Major Projects of Guangxi Science and Technology(AA17204097-10);Fundamental Research Fund of Guangxi Institute of Botany(21008)]。
第一作者: 齐贝贝(1992-),硕士,主要研究方向为果树遗传育种,(E-mail)286871681@qq.com。
*通信作者: 李洁维,研究员,研究方向为果树引种栽培,(E-mail)lijw@gxib.cn。
The SCoT analyses of genetic relationship
of 53 kiwifruit cultivars (lines)
QI Beibei, WANG Faming, MO Quanhui, YE Kaiyu, GONG Hongjuan,
LIU Pingping, JIANG Qiaosheng, LI Jiewei*
( Guangxi Key Laboratory of Functional Phytochemicals Research and Utilization, Guangxi Zhuang Autonomous Region
and Chinese Academy of Sciences, Guangxi Institute of Botany, Guilin 541006, Guangxi, China )
Abstract:
The genetic backgrounds of the popular kiwifruit varieties are relatively homogeneous, the range of geographical distribution of parental origin is narrow, and the genetic relationships are unclear. In order to take full advantage of the heterosis, the leaves of 53 kiwifruit cultivars (lines) from the germplasm resource garden of Guangxi Institute of Botany were collected, and SCoT molecular markers were used to assess genetic diversity and relationship among the 53 kiwifruit cultivars (lines). The results were as follows:(1)Ten informative primers were selected and a total of 110 bands were produced among the cultivars. A range of 8-15 bands were produced by the selected primer, with an average of 11 bands per primer. Among the 110 bands, there were 101 polymorphic bands, which accounted for 91.81%. (2)The phyolgenetic relationships were not exactly consistent with the ecological type, DNA ploidy, and geographical distributing according to the cluster analysis. However, the phyolgenetic relationships among the offspring were closer than the parent-offspring convergence. And the phyolgenetic relationships between the sport mutation lines and theirs original cultivars were not so close as we assumed, which suggests that there may be inappropriate recombination, disturbed replication and/or chromosome loss during the budding processes. The four cultivars ‘Chuhong’ ‘Guihong’ ‘Xiangjihong’ and ‘Longzanghong’ showed relative closer phyolgenetic relationships with the cultivar ‘Hongyang’, which indicates that it may be derived from different parents. Our results provided a primay validation that ‘Guihaia-4’ should be one of the parents of ‘Hort16A’.
Key words: kiwifruit cultivars, Actinidia chinensis, genetic relationship, SCoT molecular marker
猕猴桃是多年生雌雄异株落叶藤本植物,属于猕猴桃科(Actinidiaceae)猕猴桃属(Actinidia Lindl.),最新的分类系统将其划分成包括54种和21个变种在内的75个分类单元(李瑞高等,1998),该分类把中华猕猴桃(A.chinensis var. chinensis)和美味猕猴桃 (A.chinensis var. deliciosa)统一归为中华猕猴桃(A. chinensis)种下的两个变种。猕猴桃因其独特的风味,富含维生素C、膳食纤维、多种矿质营养和具有美容保健等功效而得到广泛青睐,享有“水果之王”的称号(陈清硕,1998)。目前大部分主流商业品种为中华猕猴桃种类。中华猕猴桃种类因其卓越的口感和较好的经济园艺性状而具有重要的育种价值。目前市场上大部分主流品种,除部分软枣类品种外,主要通过野生收集筛选、实生选育或种内杂交而来,亲本来源不清,不利于对品种的保护和利用。
目标起始密码子多态性分子标记(start codon targeted polymorphism,SCoT)是 Collard & Mackill (2009) 在水稻中提出的一种基于 SRAP 的新型目的基因的分子标记技术,该技术兼具了ISSR 和 RAPD 两种标记的优点,以其使用方便、多态性强等特点,广泛用于种质资源遗传多样性与亲缘关系分析、种质鉴定和遗传图谱构建等方面(陈伯伦等,2018;龙治坚等,2015;熊发前等,2009),且在品种鉴别和进化分析上可能更有优势(王发明等,2017)。近年来,SCoT 标记已经广泛应用于龙眼(陈虎等, 2009)、芥蓝(史卫东等, 2015)、猕猴桃(陈伯伦等, 2018)、君迁子(杨婷婷等, 2014) 、梨(和世玉等, 2016)、油菜(张羽等, 2015) 和西瓜(杨静等, 2016)等多种园艺植物,用于鉴定种质资源、分析亲缘系谱、研究群体的遗传多样性、构建遗传连锁图谱以及植物基因定位等研究(陈伯伦等, 2018)。近年来人们也使用各种类型分子标记对猕猴桃品种的遗传多样性进行了研究(贾冰,2005;张安世等,2017,2018;张慧等,2018),但普遍存在使用的品种过少,代表性不强等问题,主要原因是收集的品种资源有限,无法进行较大规模地鉴定和分析现有主流品种的遗传背景及明确其亲缘关系,进而不利于充分利用现有猕猴桃资源。广西植物研究所于1976年开始猕猴桃的分类学研究和野生种质资源和栽培品种的调查、收集和保存,目前已建立了较大规模的猕猴桃种质资源圃(李瑞高等, 2002),收集有40余个种类,60余个国内外栽培品种(品系)。这为开展本研究提供了丰富的实验材料。
本研究针对现有主流猕猴桃品种存在的遗传背景相对单一,亲本来源地理分布狭窄(Li et al., 2010),亲缘关系不清晰,不利于充分利用杂种优势等不足,对广西植物研究所猕猴桃品种资源圃收集的53个猕猴桃类品种(品系)进行遗传多样性评价,明确其亲缘关系,为下一步充分利用各品种的优良园艺性状,通过基因聚合来选育优异猕猴桃品种,为猕猴桃类品种资源的鉴定、利用及杂交育种亲本的选配和品种权的保护等方面提供理论参考依据。
1 材料与方法
1.1 实验材料
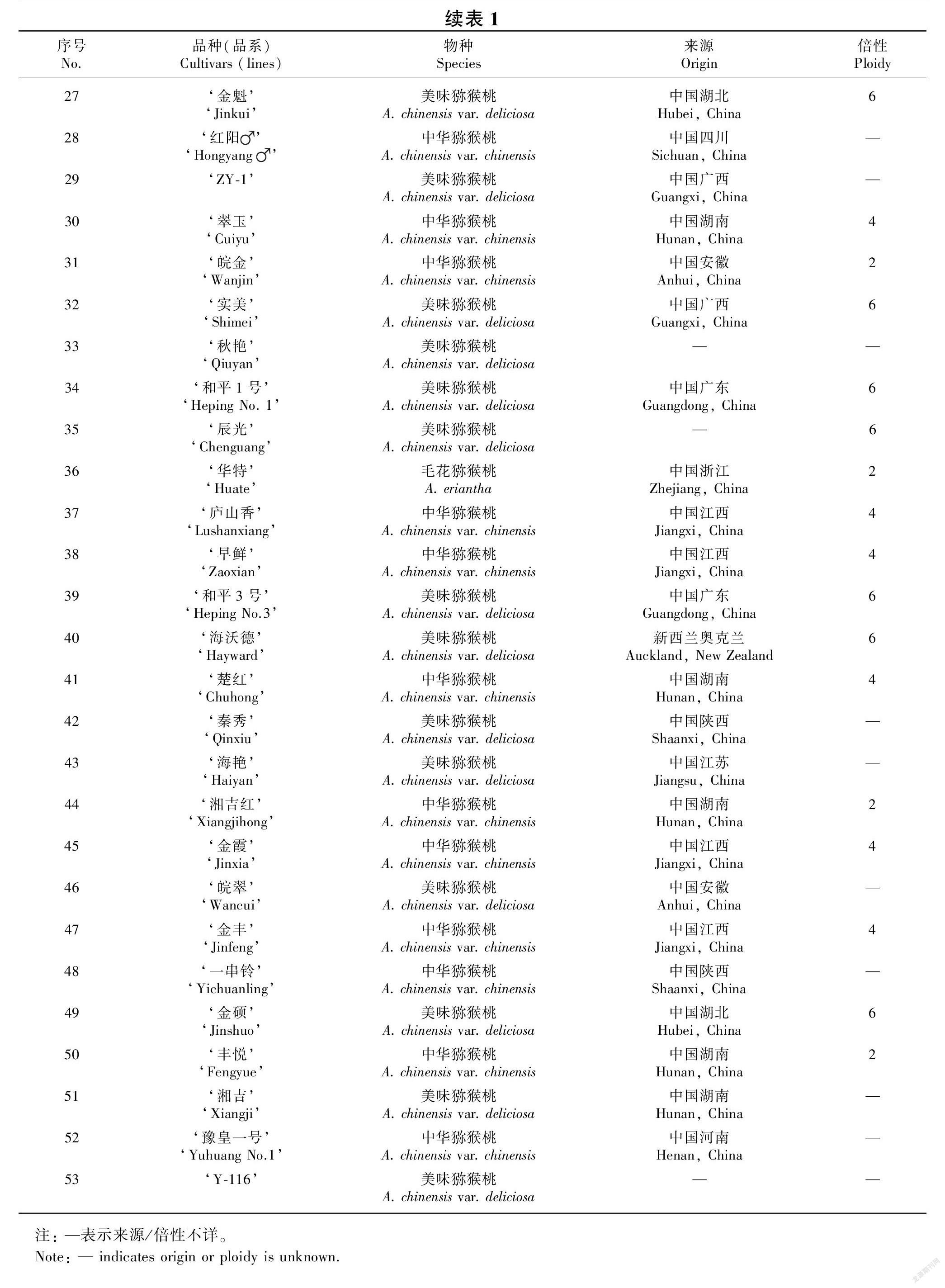
实验材料收集于广西植物研究所猕猴桃种质资源圃,其中包括51个中华类猕猴桃品种/品系[含有28份中华猕猴桃变种(A. chinensis var. chinensis)和23份美味猕猴桃变种 (A. chinensis var. deliciosa]和2个毛花类 (A. eriantha) 品种‘华特’和 ‘桂翡’(表1)。采摘猕猴桃植株一年生枝上的嫩叶,置于硅胶中干燥和保存备用。
1.2 DNA提取
使用植物基因组DNA 提取试剂盒(南京诺唯赞生物科技有限公司)提取53个供试猕猴桃材料的基因组DNA,使用紫外分光光度法和琼脂糖电泳法检测其 DNA 质量,并取一定量DNA 稀释到50 ng·μL-1,用于PCR 扩增,剩余 DNA 于-20 ℃冰箱保存备用。
1.3 引物筛选
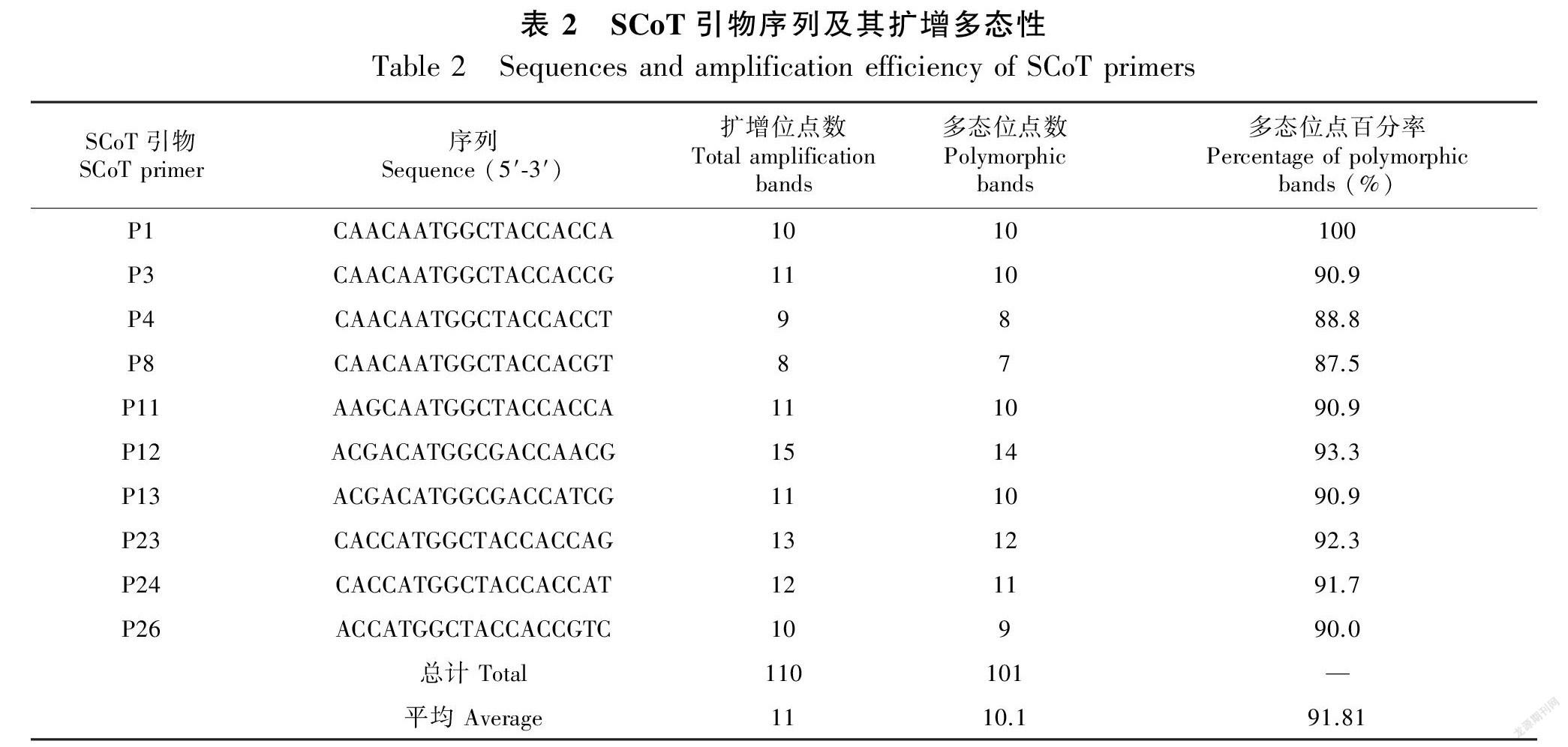
使用的SCoT 引物根据 Collard & Mackill (2009) 公布的 36 條引物序列和 Luo et al. (2011) 公布的40条引物序列进行合成。在Bio-Rad S1000 PCR 仪上对所有引物进行筛选,最终筛选出扩增产物条带清晰、多态性好的10条SCoT引物(表2),用于所有 DNA 样品的扩增。
1.4 PCR反应与检测
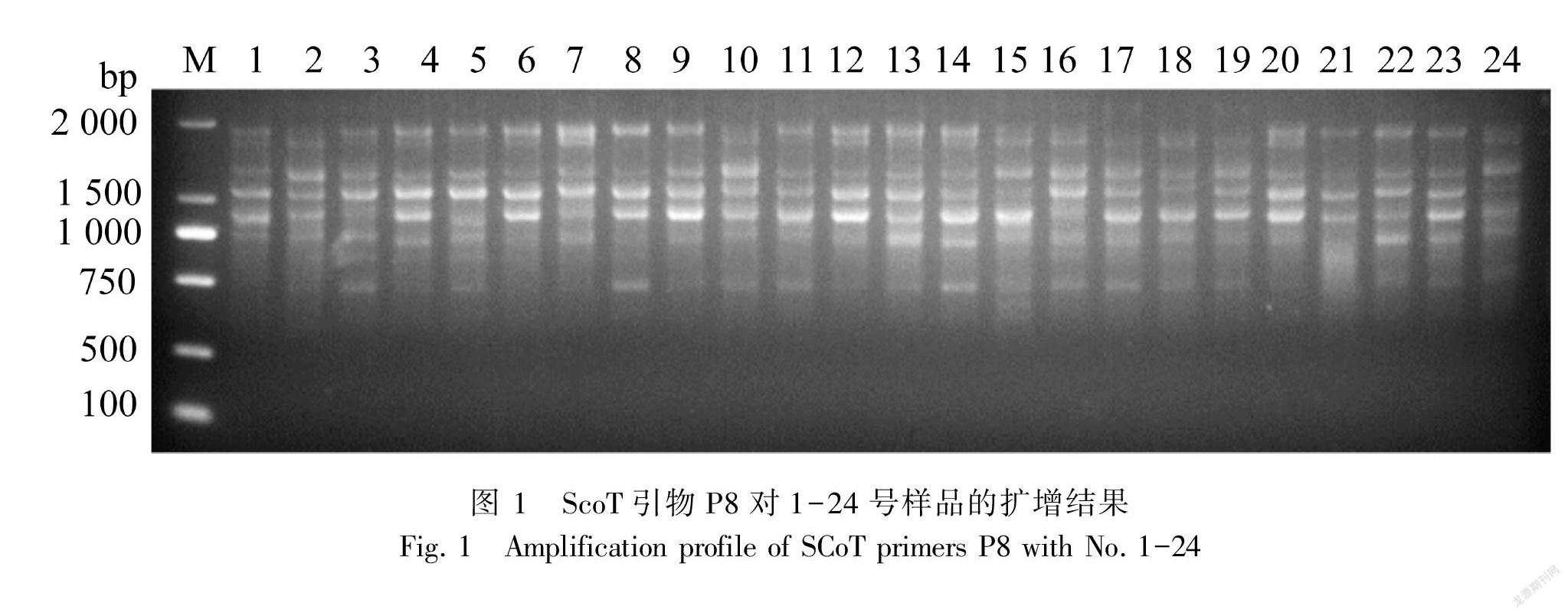
SCoT 引物扩增的20 μL反应体系包括 2×Taq PCR Mix 10 μL,DNA (50 ng·μL-1) 1.0 μL,10 μmol·L-1引物0.6 μL,超纯水8.4 μL。反应程序:94 ℃预变性 5 min; 94 ℃变性 1 min,50 ℃退火1 min, 72 ℃延伸 2 min,循环 35 次;72 ℃延伸8 min。扩增完成后取8 μL扩增产物,使用2%的琼脂糖电泳分离,在凝胶成像仪上观察并拍照保存(图1)。
1.5 数据分析
人工统计SCoT扩增引物在琼脂糖凝胶上同一位置是否出现条带,有记为1,没有记为0。统计数据输入Excel 表格,建立扩增谱带0/1矩阵数据库,使用SPSS 19.0软件进行系统聚类分析。
2 结果与分析
2.1 引物扩增多态性分析
10条引物在53份猕猴桃供试材料中共扩增出条带110条,各引物扩增的条带在8~15条之间,引物平均扩增条带数为11条;其中多态性条带101条,引物平均扩增多态性条带数为10.1条,多态性比例为91.81%(表2)。
2.2 聚类分析
由图2可知,53个猕猴桃品种(品系)之间在阙值22.5和20附近形成明显的聚类关系。以阙值22.5为界,可以把53份材料分成三类,其中‘和平2号’‘和平1号’‘和平3号’‘秋艳’‘秦秀’‘辰光’‘楚红’‘海艳’‘湘吉’‘金玉’‘庐山香’‘早鲜’‘秋香’‘桂翡’‘湘吉红’‘豫黄一号’‘皖翠’‘Y-116’‘金硕’‘海沃德’‘一串铃’‘丰悦’‘金霞’‘金丰’‘米良’‘哑特’‘翠香’‘龙藏红’‘魁蜜’‘西选12号’‘金桃’‘桂红’和‘徐香’聚为一类;‘金魁’‘ZY-1’‘华特’‘红阳’‘红阳’‘金艳’‘红昇’‘桂海四号’‘黄肉红心’‘脐红’‘金农’‘红什2号’‘金阳’‘东红’和‘Hort16A’聚为一类;‘秦星’‘皖金’‘袖珍香’‘翠玉’和‘实美’聚为一类。而使用阙值 20可以进一步把53份猕猴桃材料分成7类,其中‘和平2号’‘和平1号’‘和平3号’‘秋艳’‘秦秀’‘辰光’‘楚红’‘海艳’‘湘吉’‘金玉’‘庐山香’‘早鲜’‘秋香’‘桂翡’聚为一类;‘湘吉红’‘豫黄一号’‘皖翠’‘Y-116’‘金硕’‘海沃德’‘一串铃’‘丰悦’‘金霞’‘金丰’聚为一类;‘米良一号’‘哑特’‘翠香’‘龙藏红’‘魁蜜’‘西选12号’‘金桃’‘桂红’‘徐香’聚为一类;‘金魁’‘ZY-1’和‘华特’聚为一类;‘红阳’‘红阳’‘金艳’‘红昇’‘桂海四号’‘黄肉红心’‘脐红’‘金农’‘红什2号’‘金阳’‘东红’和‘Hort16A’聚为一类;‘秦星’和‘皖金’聚为一类;‘袖珍香’‘翠玉’和‘实美’聚为一类。在以上分类中,种内层次显示,几个来自中国湖北、湖南、江西、陕西等品种的亲缘关系并没有表现出较强的相关性,而是在各自聚类类别中均有存在,可能是因为中华类猕猴桃品种的亲本来源遗传背景狭窄(不同地域育种人员选择相同或相近的育种亲本),或者说明猕猴桃种质资源在不同地域之间存在较广泛的遗传交流,对于是否存在生殖隔离,还有待进一步研究。‘华特’和‘桂翡’作为毛花后代,二者并没有明显的单独聚类,而与中华猕猴桃亲缘关系相对较近,中华猕猴桃的多倍体植株基因组相对更复杂,变异程度更大,因此在使用的标记引物或者产生的多态性位点不够多的情况下,这种情况就很容易出现。要想最大程度地提高品种之间的鉴定效率和分辨率,简化基因组测序应该是一种更有效的方式。
3 讨论与结论
本研究聚类结果显示,猕猴桃品种(品系)没有按类型、倍性或选育地等形成明显有规律的聚类关系,说明中华猕猴桃和美味猕猴桃相互间具有相似的遗传背景。这与Li et al.(2007)将中华猕猴桃和美味猕猴桃统一划分为中华猕猴桃的结果一致。本研究所用材料包含一定数量的红肉猕猴桃,作为一种具有很高开发利用价值的猕猴桃种质资源,很有鉴定和保护的必要性。目前针对红肉品种的“身份”鉴定,部分科研人员意见不统一,有人以在 ‘红阳’品种选育之前少有关于其他红肉品种的报道为由,认为现有红肉品种主要由‘红阳’选育而来。本研究表明红肉品种‘红昇’‘脐红’‘红什2号’‘东红’和红心品系‘黄肉红心’与‘红阳’遗传距离较近。因为‘脐红’为‘红阳’的芽变材料(郁俊谊等,2015),‘红什2号’和‘东红’为‘红阳’的杂交后代(李明章等,2014;钟彩虹等,2016),‘红昇’和‘红阳’均来源于河南伏牛山的实生种子(刘健等,2016),‘黄肉红心’品系来自贵州,但亲本暂时来源不明,可能也是红阳的杂交后代之一。而‘楚红’(钟彩虹等,2005)、‘湘吉红’(裴昌俊等,2011)、‘龙藏红’(韩明丽等,2014)和‘桂红’均是由多个省份野外实生选育而来,与‘红阳’亲缘关系明显较远,说明其可能由不同亲本衍生而来。这说明红肉猕猴桃资源具有丰富的遗传多样性,对更多优质红肉猕猴桃品种的选育十分有利。‘华特’作为毛花猕猴桃的一个品种 (谢鸣等, 2008), ‘桂翡’也是毛花的实生后代(莫权辉等,2016),毛花猕猴桃虽然与中华猕猴桃分属不同种类,但是其种间亲缘关系相对较近(张安世等,2017;谢玥等,2018)。
‘Hort16A’是新西兰选育的优异黄肉猕猴桃品种,曾经为新西兰国际出口主要品种,每年创造出口收益数十亿元(Vanneste et al.,2017)。关于‘Hort16A’的选育亲本,认为是来自北京的猕猴桃母本和来自桂林的猕猴桃父本的杂交后代(Muggleston et al.,1998;Ferguson et al.,1999),我们推测母本之一是来自广西植物研究所的‘桂海四号’,是由于廣西植物研究所自20世纪80年代起就与新西兰HortResearch(现PFR,Plant and Food Research)公司有合作关系。另外我们在‘桂海四号’的实生选育后代中筛选到诸多果型类似‘Hort16A’的后代单株。本研究初步验证了我们的推测,证明了对国内植物资源进行保护的极端重要性。
参考文献:
CHEN BL, ZHANG J, HUANG JK, et al., 2018. Application of SCoT markers on genetic diversity analysis and variation identification of Actinidia [J]. J Agric Biotechnol, 26(1): 77-86. [陈伯伦,张晋,黄继魁,等,2018 . SCoT分子标记在猕猴桃遗传多样性分析与变异鉴定上的应用 [J]. 农业生物技术学报, 26(1): 77-86.]
CHEN H, HE XH, LUO C,et al., 2009. The optimization of SCoT-PCR system of Longan (Dimocarpus longan) [J]. Genom Appl Biol, 28(5):970-974. [陈虎, 何新华, 罗聪, 等, 2009. 龙眼SCoT-PCR反应体系的优化 [J]. 基因组学与应用生物学, 28(5):970-974.]
CHEN QS, 1998. King of fruit—Actinidia [J]. World Agric, (4):31. [陈清硕, 1998. 水果之王——猕猴桃 [J]. 世界农业, (4): 31.]
DENG XX, WANG LR, LI SH, et al., 2019. Retrospection and prospect of fruit breeding for last four decades in China [J]. J Fruit Sci, 36(4): 514-520. [邓秀新, 王力荣, 李绍华, 等, 2019. 果树育种40年回顾与展望 [J]. 果树学报, 36(4): 514-520.]
FERGUSON AR, LOWE R, MCNEILAGE M, 1999. ‘Hort16A’: Un nuova kiwi a polpa gialla dalla Nuova Zelanda. Riv. Frutticolt [J]. Ortofloricolt, 61(12): 24-29.
HAN ML, ZHANG ZY, ZHAO G, et al., 2014. Research advance and prospect of red-fleshed kiwifruit breeding in China [J]. Northern Hortic, (1): 182-187. [韩明丽, 张志友, 赵根, 等, 2014. 我国红果肉猕猴桃育种研究现状与展望 [J]. 北方园艺, (1): 182-187.]
HE SY, NIU JX, MA JJ,2016. Optimization of start codon targeted polymorphism PCR system and identification of bud mutant in ‘Kuerle Xiangli’ [J]. J Fruit Sci, 33(11):1337-1346. [和世玉, 牛建新, 马建江, 2016. 梨SCoT-PCR反应体系的优化及‘库尔勒香梨’营养系变异鉴定 [J]. 果树学报, 33(11): 1337-1346.]
JIA B, 2005. Study on germplasm resources and mutant SCAR marker in Actinidia by RAPD analysis [D]. Hefei: Anhui Angriculture University: 64. [贾兵, 2005. 猕猴桃种质资源RAPD分析及芽变SCAR标记研究 [D]. 合肥: 安徽农业大学: 64.]
LI D, ZHONG C, LIU Y, et al., 2010. Correlation between ploidy level and fruit characters of the main kiwifruit cultivars in China: implication for selection and improvement [J]. New Zeal J Crop Hort, 38(2): 137-145.
LI JQ, LI XW, SOEJARTO D., 2007. Actinidiaceae [M]// WU ZY, RAVEN PH, HONG DY (eds.). Flora of China. Beijing: Science Press;St. Louis: Missouri Botanic Garden Press, 12: 334-360.
LI MZ, DONG GY, ZHENG XQ, et al., 2014. A new red flesh kiwifruit cultivar ‘Hongshi 2’ [J]. Acta Hortic Sin, 41(10): 2153-2154. [李明章, 董官勇, 鄭晓琴, 等, 2014. 红肉猕猴桃新品种‘红什2号’ [J]. 园艺学报, (10): 2153-2154.]
LI RG, LI JW, WANG XG,et al., 2002. Three new varieties of Actinidia Lindl from Guangxi [J]. Guihaia, 22(5):385-387. [李瑞高, 李洁维, 王新桂, 等, 2002. 广西猕猴桃三个新变种 [J]. 广西植物, 22(5):385-387.]
LI RG, LIANG MY, LI JW, et al., 1998. Breeding of kiwifruit ‘Guihai No. 4’ [J]. Guihaia, 18(3): 90-93. [李瑞高, 梁木源, 李洁维, 1998. 中华猕猴桃桂海4号选育研究 [J]. 广西植物, 18(3): 90-93.]
LIU J, WANG YC, WU SQ, et al., 2016. Breeding and cultivation of a new variety of red-fleshed kiwifruit: Hongsheng [J]. Deciduous Fruit, 48(4): 26-29. [刘健, 王彦昌, 吴世权, 等, 2016. 红肉型猕猴桃新品种红昇的选育及栽培技术 [J]. 落叶果树, 48(4): 26-29.]
LONG ZJ, FAN LZ, XU G, et al., 2015, Application advance of SCoT molecular markers in plants [J]. J Plant Genet Resour, 16(2): 336-343. [龙治坚, 范理璋, 徐刚, 等, 2015. SCoT分子标记在植物研究中的应用进展 [J]. 植物遗传资源学报 [J]. 16(2): 336-343. ]
MO QH, LI JW, JIANG QS, et al., 2016. Selection and breeding of a new variety of kiwi fruit that is easy to peel—Guifei [J]. China Fruit, (5): 80-82. [莫权辉, 李洁维, 蒋桥生, 等, 2016. 猕猴桃易剥皮新品种‘桂翡’的选育 [J]. 中国果树, (5): 80-82.]
MUGGLESTON S, MCNEILAGE M, LOWE R, et al., 1998. Breeding new kiwifruit cultivars: the creation of Hort16A and Tomua [J]. Orchardist NZ, 71(8): 38-40.
PEI CJ, LIU SB, XIANG YP, et al., 2011. Breeding and cultivation of a new variety of seedless Actinidia chinensis:Xiangjihong [J]. J Jishou Univ (Nat Sci Ed), 32(6): 87-88. [裴昌俊, 刘世彪, 向远平, 等, 2011. 中华无籽猕猴桃“湘吉红”新品种选育与栽培技术 [J]. 吉首大学学报(自然科学版), 32(6): 87-88.]
SHI WD, JU QQ, ZHANG L,et al., 2015. Analysis on genetic diversity of Chinese flowering cabbage (Brassica campestris L. ssp. chinensis var. utilis Tsen et Le) germplasms based on SCoT markers [J]. J S Agric, 46(8):1350-1355. [史卫东, 琚茜茜, 张力, 等, 2015. 菜心种质资源遗传多样性的SCoT分析 [J]. 南方农业学报, 46(8):1350-1355.]
SUI LY, LIU YF, HUANG HW, 2013. Genetic diversity of red-fleshed kiwifruit germplasm based on fruit traits and AFLP markers [J]. Acta Hortic Sin, 40(5): 859-868. [岁立云, 刘义飞, 黄宏文, 2013. 红肉猕猴桃种质资源果实性状及AFLP遗传多样性分析 [J]. 园艺学报, 40(5): 859-868.]
VANNESTE JL, 2017. The scientific, economic, and social impacts of the New Zealand outbreak of bacterial canker of kiwifruit (Pseudomonas syringae pv. actinidiae) [J]. Ann Rev Phytopathol, 55(1): 377-399.
WANG FM, LI JW, YE KY, et al., 2017. Comparative analysis on the genetic diversity of 41 Vitis germplasm resources by ISSR and SCoT molecular markers [J]. Guihaia, 37(1): 1-8. [王發明, 李洁维, 叶开玉, 等, 2017. 41份葡萄种质遗传多样ISSR和SCoT对比分析 [J]. 广西植物, 37(1): 1-8.]
XIE M, WU YJ, JIANG GH, et al., 2008. A new big fruit Actinidia eriantha benth cultivar ‘White’ [J]. Acta Hortic Sin, (10): 1555-1561. [谢鸣, 吴延军, 蒋桂华, 等, 2008. 大果毛花猕猴桃新品种‘华特’ [J]. 园艺学报, (10): 1555-1561.]
XIE Y, XIA H, LIANG D, et al., 2018. Genetic diversity analysis of 25 Actinidia materials and the establishment of DNA fingerprint [J]. Mol Plant Breed, 16(15): 5001-5007. [谢玥, 夏惠, 梁东, 等, 2018. 25个猕猴桃材料遗传多样性分析及DNA指纹图谱的建立 [J]. 分子植物育种, 16(15): 5001-5007.]
XIONG FQ, TANG RH, CHEN ZL, et al., 2009. SCoT: A novel gene targeted marker technique based on the translation start codon [J]. Mol Plant Breed, 7(3): 635-638. [熊发前, 唐荣华, 陈忠良, 等, 2009. 目标起始密码子多态性(SCoT): 一种基于翻译起始位点的目的基因标记新技术 [J]. 分子植物育种, 7(3): 635-638.]
YANG J, WANG P, SHI L, 2016. The optimization of SCoT-PCR system of Citrullus lanatus var. megulasnemus [J]. Acta Agric Boreal-Occidental Sin, 25(6):889-896. [杨静, 王萍, 石磊, 2016. 籽用西瓜SCoT-PCR反应体系优化及引物筛选 [J]. 西北农业学报, 25(6):889-896.]
YANG TT, YU ZQ, XIA LH,et al., 2014. Cluster analysis based on morphological traits of dateplum(Diospyros lotus)germplasm resources [J]. J Fruit Sci, 31(4):566-573. [杨婷婷, 于泽群, 夏乐晗, 等, 2014. 君迁子(Diospyros lotus)种质资源形态学性状的聚类分析 [J]. 果树学报, 31(4):566-573.]
YU JY, LIU ZD, YAO CC, et al., 2015. A new kiwifruit cultivar ‘Qihong’ [J]. Acta Hortic Sin, 7(42): 1409-1410. [郁俊谊, 刘占德, 姚春潮, 等, 2015. 猕猴桃新品种‘脐红’ [J]. 园艺学报, 7(42): 1409-1410.]
ZHANG AS, HAN CP, QI XJ, et al., 2017. Genetic diversity analysis and fingerprinting construction of cultivars of Actinidia spp. based on ISSR marker [J]. J Plant Genet Resour, 26(3): 19-26. [张安世, 韩臣鹏, 齐秀娟, 等, 2017. 基于ISSR标记的猕猴桃品种遗传多样性分析及指纹图谱构建 [J]. 植物资源与环境学报, 26(3): 19-26.]
ZHANG AS, SI QL, QI XJ, et al., 2018. Genetic diversity and fingerprints of Actinidia germplasm resource based on SRAP markers [J]. J Agr Sci 34(1): 138-144. [张安世, 司清亮, 齐秀娟, 等, 2018. 猕猴桃种质资源的SRAP遗传多样性分析及指纹图谱构建 [J]. 江苏农业学报, 34(1): 138-144.]
ZHANG H, ZHANG SX, WU SH, et al., 2018. Genetic diversity of 33 kiwifruit germplasms based on AFLP markers [J]. J Biol, 35(2): 29-33. [张慧, 张世鑫, 吴绍华, 等, 2018. 猕猴桃属33份种质资源的AFLP遗传多样性分析 [J]. 生物学杂志, 35(2): 29-33.]
ZHANG Y, ZHANG XJ, CHEN J,et al., 2015. Genetic diversity of Brassica napus in resistance to Sclerotinia sclerotiorum based on SCoT markers [J]. J Sichuan Agric Univ, 33(4):351-356. [张羽, 张晓娟, 陈进, 等, 2015. SCoT标记分析抗菌核病油菜资源的遗传多样性 [J]. 四川农业大学学报, 33(4):351-356.]
ZHONG CH, HAN F, LI DW, et al., 2016. Breeding of red-fleshed kiwifruit cultivar ‘Donghong’ [J]. J Fruit Sci, 33(12): 1596-1599. [钟彩虹, 韩飞, 李大卫, 等, 2016. 红心猕猴桃新品种‘东红’的选育 [J]. 果树学报, 33(12): 1596-1599.]
ZHONG CH, WANG ZY, BU FW, 2005. Breeding of a new variety of red-fleshed kiwifruit: Chuhong [J]. Chin Fruits, (2): 58-59. [钟彩虹, 王中炎, 卜范文, 2005. 猕猴桃红心新品种楚红的选育 [J]. 中国果树, (2): 58-59.]
ZHU LW, DING SL, WANG MC, et al., 2001. ‘Wancui’— A new variety of Actinidia deliciosa [J]. Acta Hortic Sin, (1): 86-94. [朱立武, 丁士林, 王謀才, 等, 2001. 美味猕猴桃新品种‘皖翠’ [J]. 园艺学报, (1): 86-94.]
(责任编辑 何永艳)
1118501186385

