miR-149-5p过表达对重症肺炎大鼠肺组织PI3K/Akt/mTOR通路的影响研究
蒋渝 张亮宇 黄薇
重症肺炎在临床上是常见的疾病之一,是指肺部的炎症情况比较严重,可引起全身炎性反应,如果肺炎患者出现严重的低氧血症或急性呼吸衰竭则需要通气支持;或出现低血压、休克等循环衰竭表现和其他器官功能障碍可认定为重症肺炎[1,2]。常见的病因是在伴有心肺基础或附加危险因素上感染肺炎,特殊病原微生物(SARS病毒、禽流感病毒、军团菌等)感染,会增加肺炎的严重程度和死亡风险;临床主要表现有嗜睡、烦躁、呼吸衰竭、精神萎靡、血压下降等,重者会出现昏迷、惊厥、意识障碍、视盘水肿,进而出现脑疝[3]。临床常用的治疗手段为药物治疗,其中主要环节为抗感染治疗,抗生素和给药途径则需参考患者的年龄、吸入史、有无基础疾病、肺炎的严重程度等[4]。重症肺炎的原则在于重视病原学诊断和早采集呼吸道标本,查找病原体的方式有采用血培养、血清检测等途径[5]。在本研究中,主要分析miR-149-5p过表达对重症肺炎大鼠肺组织PI3K/Akt/mTOR通路的影响。
1 材料与方法
1.1 试验动物 选取45只清洁级、SPF级小鼠,雄雌各半,由希百寿药业有限公司提供[动物许可证号:SYXK(豫)2020-0001],鼠龄3~6个月,平均鼠龄(4.5±0.75)个月;体重214~258 g,平均体重(236±11)g;小鼠均在无病原菌的干净笼子里喂养,所饮用的水和食物都要进行过高温以及高压的消毒,饲养温度维持在23℃。本实验经我院伦理委员会批准。
1.2 主要试剂 养血琼脂糖平板(北京泰泽嘉业科技发展有限公司);肺炎克雷伯菌(上海北诺生物科技有限公司);酶联免疫试剂盒(上海晶抗生物工程有限公司);恒温孵育箱(香港友诚生物科技有限公司);胎牛血清(武汉普诺赛生命科技有限公司)。
1.3 方法
1.3.1 建模:随机选取45只大鼠中15只作为对照组,其余大鼠参照吴萍等[6]研究实验中重症肺炎模型建立方法建立重症肺炎大鼠模型,模型构建前1 d,在养血琼脂糖平板上接种肺炎克雷伯菌并放置在37℃恒温培养,次日将菌落收集后并用无菌0.9%氯化钠溶液将其稀释呈1.2×1014CFU/L的混悬液。在大鼠腹腔注射40 mg/kg戊巴比妥钠溶液用于麻醉,颈部备皮消毒,在无菌环境下切开颈部皮肤使上段气管暴露,选用24G的Y型静脉留置针经气管插管,将菌液从留置针白色帽端处注入大鼠体内。将完全稀释好的肺炎克雷伯菌混合液,对过表达组、沉默组大鼠进行缓慢灌注,每只0.3 ml;为降低大鼠肺部刺激,每注射0.05 ml固定竖立左右转动45 s,对照组大鼠灌注等体积0.9%氯化钠溶液。末次灌注结束后让大鼠保持竖立和倒立各2 min,让菌液均匀分布双肺各肺叶,然后缓慢抽出静脉留置针,将伤口缝合并进行局部消毒。
1.3.2 肺组织病理组织学观察评价:选取适当体积的肺组织,经多聚甲醛固定后或石蜡保存,做成组织切片,HE染色后中性树胶,盖玻片封固,显微镜下观察大鼠肺组织上皮细胞。
1.3.3 细胞培养与转染:将大鼠肺组织细胞培养于10%胎牛血清的DMEM培养基中,将其放置于37℃、5%CO2饱和湿度培养箱中培养,2~3 d换液1次,取生长情况良好的对数生长期细胞,接种于6孔细胞板,待细胞融合度达到70%~80%时,可进行后续转染实验。取对数生长期细胞进行实验并根据实验设计分为对照组、上调组和下调组,其中对照组细胞不做任何处理,而对上调组、下调组按照吉凯基因《慢病毒载体使用操作手册》分别进行脂质体转LV-control和LV-miR-145-5p。
1.3.4 3组大鼠肺组织凋亡蛋白表达量评价:采用免疫组织化学法检测Caspase-3、Caspase-8、Caspase-9水平,实验步骤如下:使用PBS代替一抗作为阴性对照组,染色结果采取半定量分析,高倍镜下(×400)每张切片随机选取5个视野,采用同济HMIAS-2000高清晰度彩色医学图文分析系统检测吸光度值,计算平均值。
1.3.5 3组大鼠肺组织中炎性因子水平评价:采用酶联免疫法检测大鼠炎性因子IL-1β、IL-4、IL-6、IL-10水平,实验步骤:将血清样本置于室温后,取出试剂盒,标记酶标板,制作标准品,以1∶2的稀释液稀释样品;在反应孔上依次加入稀释好的待测血清及标准品100 μl/孔,放置37℃恒温孵育箱中湿育2 h;用专用洗涤液将反应板清洗3次后,加入抗体工作液(1∶100倍稀释后)100 μl/孔,置于37℃恒温孵育箱中湿育45 min;继续清洗反应板4次后,在反应孔内加入TMB溶液100 μl/孔,置于37℃恒温孵育箱中湿育45 min后在反应孔内加入终止液100 μl/孔以终止反应,在450 nm波长(参考波长570~630 nm)测定吸光度,颜色反应深浅与IL-1β、IL-4、IL-6、IL-10水平成正比,经绘制标准曲线计算IL-1β、IL-4、IL-6、IL-10水平。
1.3.6 3组大鼠肺组织GSH、ROS及T-AOC含量评价:采用MTT比色法检测GSH、ROS及T-AOC含量,实验步骤:用含10%胎牛血清的培养液配成单个细胞悬液,细胞按7×103个/孔接种于96孔板,每孔体积200 μl,培养2~4 d后,每孔加入MTT继续孵育4 h后停止,弃上清液,悬浮细胞上的培养清液离心后再吸弃,每孔加入150 μl DMSO,振荡12 min,选择570 nm波长,采用酶联免疫检测仪测定各孔光吸收值。
1.3.7 3组大鼠肺组织PI3K/Akt/mTOR通路因子表达量评价:采用实时荧光定量PCR测定3组细胞中PI3K/Akt/mTOR通路因子表达量,cDNA合成反转录体积20 μl,其中4 μl 总RNA,1 μl(0.5 μg)随机引物、0.5 μl(20 U)RNase、2 μl 10 mMdNTP、0.8 μl(15 U)M-mlV反转录10×RT缓冲液3 μl,加灭菌DDW至20 μl,42℃水浴1 h,95℃ 5 min灭活M-mlV逆转录,-30℃冻存备用。PCR反应体系:PCR反应体积20 μl,其中2 μl 10×Buffer,2 μl MgCl2,2 μl dNTP,2 μl cDNA,2 μl引物,2.5U Taq DNA多聚酶,灭菌DDW加至20 μl。PCR反应条件:经95℃预变性10 min;95℃,15 s;60℃,30 s;循环40次。采用2-△△Ct方法计算出细胞中PI3K/Akt/mTOR通路因子Bax、Bcl-2、BDNF、pERK、VGF mRNA表达量。见表1。


表1 引物序列
2 结果
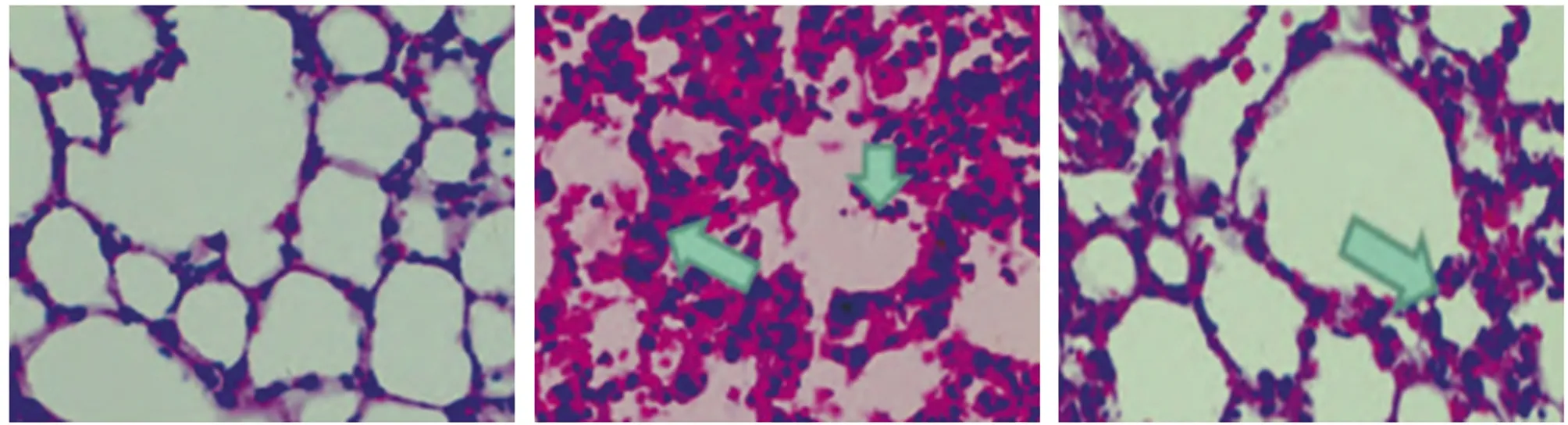
2.1 肺组织病理组织学观察 对照组大鼠肺组织上皮完整,无损伤现象;沉默组大鼠肺组织明显存在炎性因子浸润现象,平滑肌面积及厚度增加,还存在气道上皮组织坏死、脱落,支气管及其周边组织结构混乱,可见其肺损伤程度极其严重;过表达组大鼠肺组织状态较沉默组有显著改善,支气管及其周边组织趋于规整,且炎性细胞浸润的程度降低,平滑肌面积及厚度增厚现象有所改善。见图1。
2.2 3组大鼠肺组织凋亡蛋白表达量比较 过表达组、沉默组Caspase-3、Caspase-8、Caspase-9蛋白表达量均高于对照组,过表达组Caspase-3、Caspase-8、Caspase-9蛋白表达量低于沉默组,差异有统计学意义(P<0.05)。见表2。
2.3 3组大鼠肺组织中炎性因子水平比较 过表达组、沉默组大鼠肺组织中炎性因子水平高于对照组(P<0.05);过表达组大鼠肺组织中炎性因子水平低于沉默组(P<0.05)。见表3。
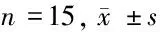
表2 3组大鼠肺组织凋亡蛋白表达量比较
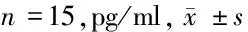
表3 3组大鼠肺组织中炎性因子水平比较
2.4 3组大鼠肺组织GSH、ROS及T-AOC含量比较 过表达组、沉默组GSH、ROS高于对照组,T-AOC含量低于对照组,差异有统计学意义(P<0.05);过表达组GSH、ROS低于沉默组,T-AOC含量高于沉默组,差异有统计学意义(P<0.05)。见表4。
2.5 3组大鼠肺组织PI3K/Akt/mTOR通路因子表达量比较 过表达组Bax mRNA表达量高于对照组,Bcl-2、BDNF、pERK、VGF mRNA表达量低于对照组,沉默组Bax mRNA表达量低于对照组,Bcl-2、BDNF、pERK、VGF mRNA表达量高于对照组,差异有统计学意义(P<0.05);过表达组Bax mRNA表达量高于沉默组,Bcl-2、BDNF、pERK、VGF mRNA表达量低于沉默组,差异有统计学意义(P<0.05)。见表5。
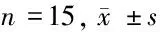
表4 3组大鼠肺组织GSH、ROS及T-AOC含量比较
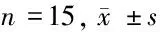
表5 3组大鼠肺组织PI3K/Akt/mTOR通路因子表达量比较
3 讨论
重症肺炎是肺部感染性疾病之一,可引起机体多器官功能障碍,根据其获得环境不同分为重症社区获得性肺炎和重症医院获得性肺炎,两种类型重症肺炎均具有较高的患病率和死亡率[7,8]。目前对于重症肺炎包括依赖抗菌药物、机械通气、液体支持和血液净化等多手段,占用大量的医疗资源,但其病死率仍然较高,故找到其发病机制,对疾病转归、获得早期有效治疗及改善预后都具有较为重要的意义价值[9]。miRNA是一类内源性、序列高保守的单链非编码小RNA,对基因表达具有调控作用[10]。有研究证实miR-149-5p在结肠癌、口腔鳞状癌、肝癌、乳腺癌等疾病的发生发展中起着重要的作用,其表达水平具有特异性[11]。在刘杰等[12]的研究中,miR-149-5p在结肠癌细胞中呈过表达,可抑制结肠癌细胞的增殖,并诱导其凋亡,但在本文研究中过表达miR-149-5p可抑制细胞凋亡,减轻肺组织细胞的损伤程度,也证实miR-149-5p表达具有特异性。
Caspase是一组存在于细胞质中具有类似结构的蛋白酶与真核细胞凋亡有密切关联,在细胞的生长、分化与凋亡等过程中起调节作用[13]。Caspase-3在细胞凋亡中起着不可替代的作用,是细胞凋亡过程中最主要的终末剪切酶,也是CTL细胞杀伤机制的重要组成部分[14]。在曹丽萍等[15]的研究中,抑制Caspase-3蛋白的表达,可减少细胞凋亡,缓解大鼠肺组织损伤程度,与本文研究结果一致。Caspase-8在死亡受体介导的细胞凋亡过程中扮演着重要的角色,是死亡受体介导的凋亡途径中的重要分子,可通过寡聚而自身切割活化,可激活Caspase,产生凋亡效应。Caspase-9与Caspase-8具有相似和不同影响了在Caspase家族起催化作用部位的聚合-裂解,能被用作具有高度选择和合理性的Caspase抑制剂的活性区域具有差异性[16,17]。在本文研究中,过表达组大鼠Caspase-3、Caspase-8、Caspase-9蛋白表达量低于沉默组,说明过表达miR-149-5p,可有效抑制Caspase-3、Caspase-8、Caspase-9表达量,进而抑制细胞凋亡,减轻肺组织的损伤程度。
PI3K/Akt/mTOR通路是经典信号通路之一,主要通路因子有Bax、Bcl-2、BDNF、pERK、VGF等[18]。Bax和Bcl-2是Bcl-2基因家族中细胞凋亡的促进基因,若Bax水平升高可拮抗Bcl-2的保护效应而使细胞趋于死亡;Bcl-2是一种癌基因,具有明显的抑制细胞凋亡的作用,若Bcl-2过表达能增强所观察细胞对大多数细胞毒素的抵抗性[19,20]。在刘月英等[21]的研究中,下调Bax、上调Bcl-2蛋白水平可降低细胞凋亡,与本文研究结果一致。pERK是位于内质网膜上的一种Ⅰ型跨膜蛋白,属于elF2a上游激酶家族中的一种;pERK信号通路的激活发生在内质网应激早期,pERK通过诱导CHOP的表达而促进细胞凋亡。在本文研究中,过表达组Bax mRNA表达量高于沉默组,Bcl-2、BDNF、pERK、VGF mRNA表达量低于沉默组,说明过表达miR-149-5p,可通过作用于PI3K/Akt/mTOR通路,调控Bax、Bcl-2、BDNF、pERK、VGF mRNA表达量,进而抑制细胞凋亡,减轻机体炎性反应和肺组织损伤。
综上所述,过表达miR-149-5p,可通过作用于PI3K/Akt/mTOR通路,调控Bax、Bcl-2、BDNF、pERK、VGF mRNA表达量,减轻炎性反应,抑制细胞凋亡。但因本研究所采用的样本数量有限和研究时间较短,为证实和对比miR-149-5p过表达对重症肺炎大鼠肺组织PI3KAktmTOR通路的影响,还需进一步开展大样本试验证实。

