脑脊液腺苷脱氨酶水平检测在结核性脑膜炎早期诊断中的价值
杨元利,张永峰,李爱芳,杜苏丰,任 斐,党丽云,杨 翰
(西安市胸科医院,陕西 西安 710100)
结核病(Tuberculosis,TB)仍然是全球健康问题的巨大挑战[1]。结核性脑膜炎(Tuberculous meningitis,TBM)是结核病中比较严重的一种,是由结核菌感染引起的脑神经障碍、精神状态改变、脑梗死、持续发热、卒中等一系列改变的疾病,约占全部结核病的1%[2-3]。由于TBM起病隐匿,临床表现无特异性,所以很难被早期诊断。目前诊断主要依靠放射学和脑脊液(Cerebrospinal fluid,CSF)相关实验室检查[4-5]。其中,放射学检查无特异性;涂片抗酸染色快速、可靠,但敏感度不高(约10%~20%);分枝杆菌培养耗时较长,一般需要6周左右[6-7]。CSF分子病原学诊断技术近年来受到关注,但核酸扩增试验(Nucleic acid amplification test,NAAT)可能对菌量小的CSF标本或在有抑制剂(如脑脊液蛋白)存在的情况下会出现假阴性结果[8]。腺苷脱氨酶(Adenosine deaminase,ADA)是一种参与人体内嘌呤代谢、广泛分布于组织体液中的酶,检测所需要时间短、费用低[9]。虽然ADA检测在许多国家得到广泛应用,但对于其在TBM诊断中的有效性和敏感性还没有达成共识。因此,本研究探讨脑脊液(CSF)中腺苷脱氨酶(ADA)水平检测在结核性脑膜炎(TBM)早期诊断中的价值。
1 资料与方法
1.1 一般资料 选取2018年11月至2020年4月于西安市胸科医院住院治疗的疑似TBM患者65例为研究对象,男性33例,女性32例,年龄18~82岁,经抗结核药物治疗时间≤2周。根据确诊结果将所有患者分为TBM组(45例)和非TBM组(20例)。TBM组男性24例,女性21例;平均年龄(40.07±16.70)岁。非TBM组男性10例,女性10例;平均年龄(41.9±14.82)岁。两组患者性别、年龄比较,差异无统计学意义(均P>0.05)。病例纳入标准:TBM组患者符合2010年国际TBM协作组制定的诊断标准[10],包括抗酸染色涂片检查[11]、BACTEC MGIT 960培养和药物敏感性试验[12]、脑脊液GeneXpert MTB/RIF检测阳性。排除标准:年龄<18岁;抗结核治疗时间>2周;人类免疫缺陷病毒阳性。本研究通过西安市胸科医院伦理委员会审批(审批号:R2020-007-01)。
1.2 研究方法 所有患者在住院2周内无菌操作下行腰椎穿刺术,留取脑脊液(CSF)标本1 ml,3000 g离心10 min,采用西门子ADAVIA2400检测ADA水平(过氧化物酶法)。
1.3 观察指标 比较两组患者CSF中ADA水平,评估ADA对TBM的早期诊断价值。
1.4 统计学方法 采用SPSS 22.0统计学软件进行数据分析。非正态分布的计量资料以中位数(四分位数间距)[M(Q1,Q3)]表示,组间比较采用Mann-Whitney检验。采用受试者工作特征(ROC)曲线评估ADA对TBM的早期诊断效能。检验水准α=0.05。
2 结 果
2.1 两组患者基本情况 TBM组患者中,经涂片抗酸染色、Gene xpert MTB/RIF检测、MGIT960分枝杆菌培养阳性,确诊为TBM者24例,另外21例为TBM临床诊断病例;合并淋巴结结核2例,脊柱结核4例,肺结核者43例,另有2例呈耐多药。非TBM组患者中,脑布氏杆菌病1例,癫痫1例,化脓性脑膜炎3例,新型隐球菌性脑膜炎4例,病毒性脑膜炎11例。
2.2 两组患者CSF中ADA水平比较 见图1。TBM组患者CSF中ADA水平在3~26 U/L,中位数(四分位数间距)为8(6,10)U/L。非TBM组患者CSF中ADA水平在0~5 U/L,中位数(四分位数间距)为1(0,2.75)U/L。TBM组患者CSF中ADA水平高于非TBM组(Z=-6.176,P<0.05)。
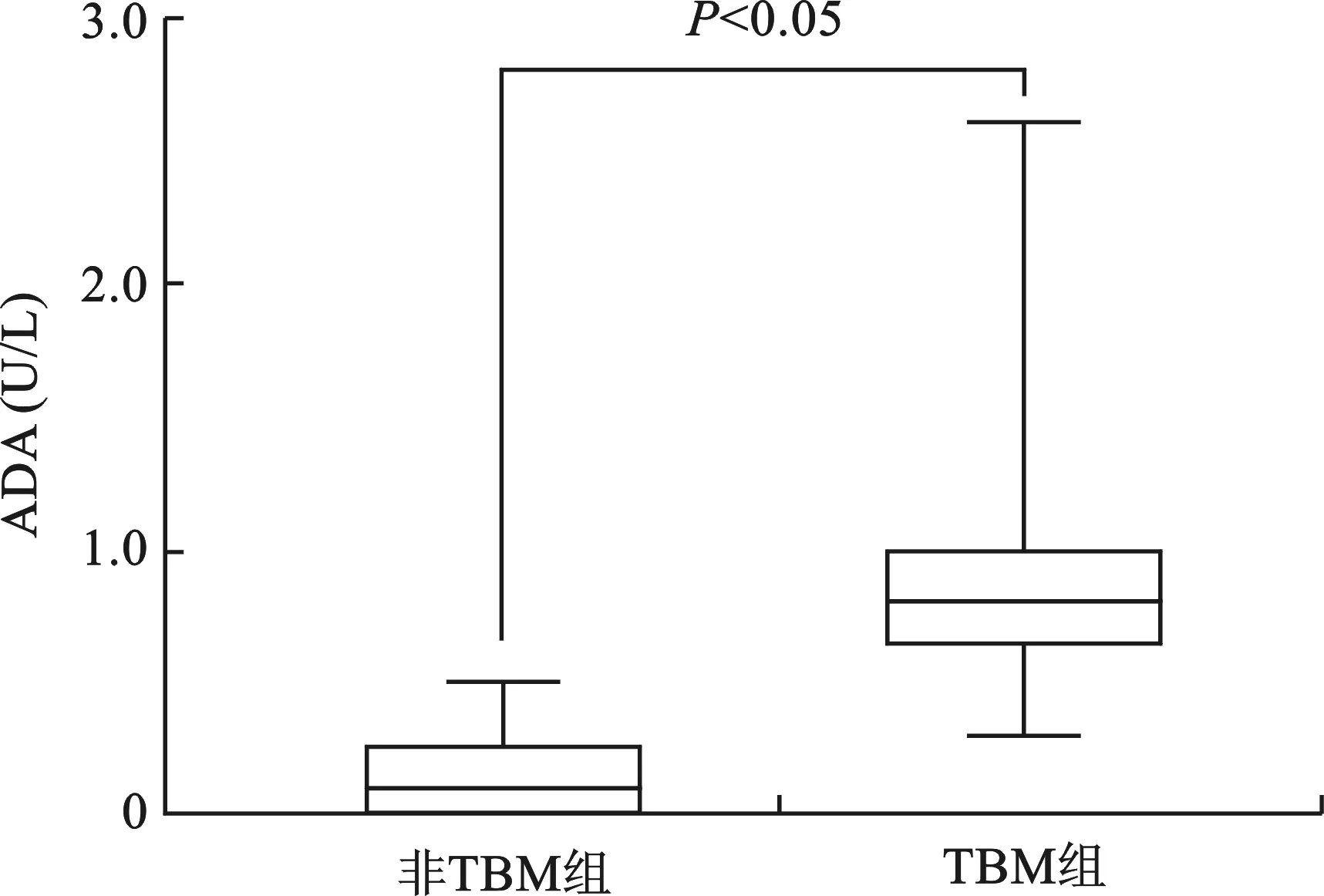
图1 两组患者CSF中ADA水平比较
2.3 ADA对TBM的早期诊断效能 见图2。ROC曲线分析结果显示,当CSF中ADA水平为4.5 U/L时,其诊断TBM的效能最佳,曲线下面积(AUC)为0.98,敏感度为93.33%,特异度为90.00%。
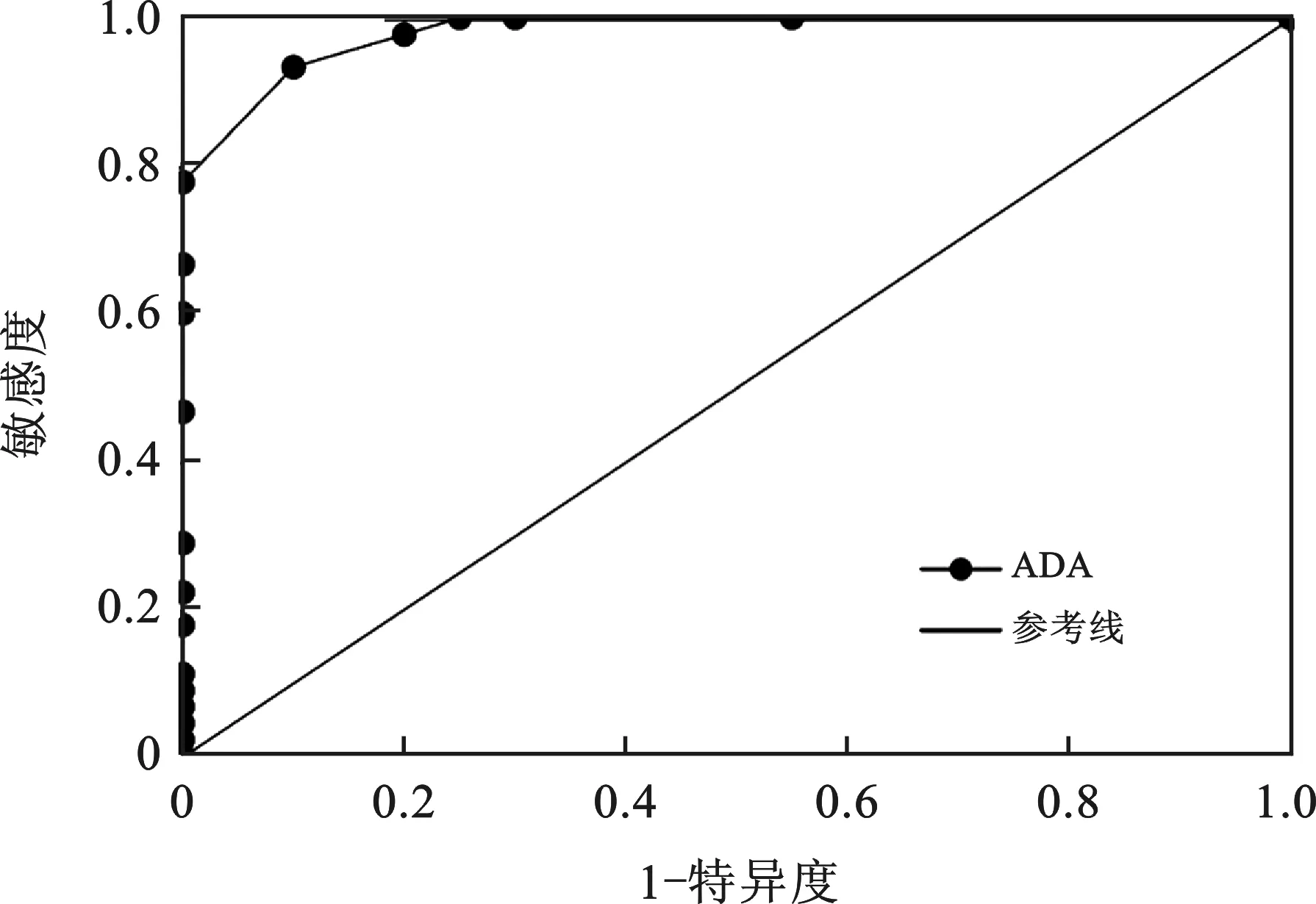
图2 ADA诊断TBM ROC曲线
3 讨 论
结核菌是结核病的病原体,主要影响肺部,同时也可以影响身体的任何其他部位,并导致肺外结核。在所有结核病病例中,TBM是结核病的一种临床形式。与其他结核病不同,中枢神经系统结核被认为是医疗的紧急情况,可以迅速进展,并在几小时或几天内产生严重的不可逆的后遗症,如昏迷、癫痫、脑积水、脑神经麻痹甚至死亡,所以早期诊断TBM是降低患者病死率、致残率的重要因素。
早期诊断TBM的常规方法有CSF常规生化、涂片抗酸染色检测、分枝杆菌培养等。CSF分析显示蛋白升高、葡萄糖降低并伴有淋巴细胞增多,但在疱疹病毒性脑膜炎、隐球菌性脑膜炎、布鲁氏菌病和神经美素患者的CSF分析中也可以出现大致相同的特征,因此很难与这些脑膜炎的病因相鉴别。涂片抗酸染色和分枝杆菌培养具有很好的特异性,分别为90%、97%,前者耗时短,不过灵敏度仅10%~20%[13],也不能区分结核或非结核分枝杆菌[14]。分枝杆菌培养被认为是诊断的金标准,敏感性为45%~70%,但通常需要6周左右。目前新的核酸扩增技术发展迅速,该技术可在几个小时检测完毕,比抗酸染色涂片具有更高的敏感性(62%),比分枝杆菌培养耗时更短,但是该项技术对实验室设备和操作人员素质有更高的要求,检测费用较高。CSF中ADA检测已被认为是鉴别TBM与其他脑膜炎的有用方法。Xu等[15]进行了一项荟萃分析,纳入1986—2006年的10项研究,结果表明CSF中ADA水平诊断TBM的敏感性为79%,特异性为91%。Tuon等[16]对1982—2002年的13项研究的荟萃分析表明,CSF中ADA水平在1~4 U/L时,可帮助排除TBM诊断(敏感度>93%,特异度<80%);ADA水平>8 U/L时,可帮助TBM诊断(敏感度<59%,特异度>95%)。Pormohammad等[17]进一步总结了CSF中ADA水平在TBM诊断中的效能,总体敏感性为89%(84%~92%),特异性为91%(87%~93%),AUC为0.96。Moghtaderi等[18]研究表明,CSF中ADA对TBM的诊断具有92.5%的敏感性和97%的特异性,10.5 U/L的临界值被认为是高度敏感和特异的。在本研究中,TBM组患者CSF中ADA水平高于非TBM组,且当CSF中ADA水平为4.5 U/L时,其诊断TBM的效能最佳,曲线下面积(AUC)为0.98,敏感度为93.33%,特异度为90.00%,证实CSF中ADA水平是诊断TBM的良好指标。与李雪莲等[9]研究结果比较,本研究敏感度较高,原因可能是我们选择治疗史小于2周的病例进行回顾性分析,对脑脊液ADA检测水平影响小。
ADA是重要的免疫调节分子,在免疫系统的成熟和稳态中起着重要的作用[19]。ADA在T淋巴细胞中有更强的活性,可能与T细胞分化、增殖密切相关。它能激活感染期T淋巴细胞和巨噬细胞分泌的腺苷,水解脱氨为肌苷和氨。腺苷起到免疫抑制信号的作用,可以防止过度的炎症反应,许多病理过程中都发现了ADA水平的异常,已被广泛用于诊断胸膜、脑膜和心包结核。然而,CSF中ADA水平升高有时也可见于其他神经系统疾病,如淋巴瘤、结节病、神经布鲁氏菌病、神经巨细胞病毒病、隐球菌脑膜炎、念珠菌性脑膜炎和蛛网膜下腔出血。Fujiwara等[20]报告了1例自身免疫性脑炎患者CSF中ADA水平增高,但与TBM相比,升高的程度一般较轻。在本研究的非TBM组中,有1例ADA水平明显增高的病例,最终诊断为布氏杆菌病脑部侵犯,因此临床诊疗过程需要参考其他指标,如血清布病抗原检测、CSF抗酸染色、分枝杆菌培养以及影像学检查等,以进一步诊断和鉴别诊断。
综上所述,TBM患者CSF中ADA水平升高,在TBM早期诊断中具有较高的敏感性和特异性。腺苷脱氨酶检测技术还具有操作简单、耗时短的优势,可以及时为临床提供有价值的信息。对于疑似TBM患者,建议检测CSF中ADA水平,以早期鉴别TBM与其他病因。

