牛肉红朱橘抗氧化生物合成关键基因的表达特征
李文云, 罗 怿, 王小柯, 柏自琴, 林 乾,李金强
(贵州省农业科学院 果树科学研究所, 贵州 贵阳 550006)
0 引言
【研究意义】牛肉红朱橘(CitrusreticulataBlanco.‘Niurouhong’)(简写为NRH)属于芸香科柑橘属,来自于朱红橘(C.reticulataBlanco.‘Zhuhongju’)(简写为ZHJ)的实生变异,果皮和果肉均为橘红色,由于其艳丽的果色、浓郁的风味和香味等品质特征在当地果品市场具有较强的竞争力[1-2],探索其抗氧化生物活性物质成分形成机理对地方柑橘资源开发利用具有重要意义。【前人研究进展】由于长期的自然选择和人工驯化,柑橘种质资源丰富且遗传背景复杂,均存在一系列复杂的生物学调控,而这些调控往往由多基因控制,对控制果实品质形成的单个基因或单条代谢路径的表达分析已经难以解释其整体品质变化机理,无法满足对柑橘综合品质改良的要求,对整个代谢网络基因表达进行综合分析逐渐成为柑橘分子生物学研究的趋势和热点[3]。随着高通量测序技术和生物信息学的高速发展及其特有的优势,转录组测序(RNA-Seq)为研究复杂生物学通路和性状调控网络机制提供了有力工具[4-5]。随着测序技术以及生物信息学手段的进一步发展和RNA-Seq测序及信息分析成本的降低,RNA-Seq已成为果树学研究领域较成熟也较常规的分子手段之一,结合传统的研究手段,将全面带动品种改良、栽培技术革新等,促进果树产业发展[7]。前期从检测的86种代谢组数据发现,NRH富含类黄酮、类胡萝卜素、挥发性香气成分、柠檬苦素类似物等抗氧化生物活性物质,且在代谢途径间存在协同变化现象[6]。推测可能有共同的结构基因或调控基因直接或间接参与这些产物的代谢过程,从而提升多项品质性状。【研究切入点】然而,结构基因或调控基因参与果实综合品质形成过程并不清晰,引起果实综合品质代谢网络协同变化的分子机理尚不清楚。因此,从整体转录水平上对品质形成相关基因表达特征进行进一步探索,以全面筛选和鉴定果实综合品质形成相关基因。【拟解决的关键问题】应用RNA-Seq转录组测序和生物信息分析技术对NRH和ZHJ成熟果实进行综合评价,利用生物信息学方法,根据末端重复序列进行组装和拼接广泛通用的基因库,将获得的unigene(非重复序列基因)与已知的注释数据库进行比对,按分子功能、细胞组分、参与的生物过程对这些基因进行分类注释,筛选差异基因抗氧化生物活性品质相关基因表达模式,探讨NRH果色、浓郁风味、香气等品质形成机理,揭示NRH品质形成机理,为地方柑橘资源的开发利用提供依据。
1 材料与方法
1.1 试验材料
供试材料为牛肉红朱橘(NRH)和朱红橘(ZHJ)成熟果实,砧木均为枳,均采自贵州省惠水县烂坝林场。肥料种类及施肥方式:采果后萌芽前每株10 kg有机肥和1 kg高氮复合肥混匀沟施;花期叶面喷0.3%的磷酸二氢钾;果实膨大期每株有机肥10 kg和高钾复合肥1kg混合沟施。
1.2 样品采集
采样时选择健康无病虫的3株树,于树冠外围随机采摘外观、色泽、大小均匀的30个果实,带回实验室用蒸馏水清洗果面。随后将果实随机分成3组,设置3次生物学重复,每组10个果实,去皮后将果肉迅速用液氮速冻,置于-80℃超低温冰箱保存待测。
1.3 总RNA提取及转录组测序
将2个样品进行RNA提取(RNAprep Pure Plant Plus Kit (Polysaccharides & Polyphenolics-rich),利用分光光度计(NanoDrop ND-1000)检测RNA浓度,利用Agilent 2100和1%琼脂糖凝胶电泳检测RNA完整性。利用Illumina的NEBNext®UltraTM RNA Library Prep Kit试剂盒进行建库。库检合格后利用Illumina NovaSeq 6000测序仪进行转录组测序,每个品种进行3次转录组重复测序,共获得6个转录组测序样本。
1.4 转录组数据质控
原始数据下机后需进行过滤,去除带接头、低质量和含N(无法确定碱基信息)的reads(序列数据)后得到clean data(净数据),后续的所有分析均是基于clean data进行的高质量分析。利用Trinity软件对clean data进行组装得到Unigenes。
1.5 差异表达基因筛选及功能注释
HISAT2 v2.0.5将配对末端clean reads与参照基因组比对,采用StringTie(1.3.3b)进行新基因预测,featureCounts(1.5.0-p3)用于计算映射每个基因的读数,基因表达量用FPKM(Fragments Per Kilobase of transcript per Million mapped reads)值衡量Unigenes的表达丰度。采用DESeq2进行基因差异表达分析,满足|log2(FoldChange)|>0和padj<0.05表示差异显著。
利用Cluster Profiler对差异基因集进行GO(Gene Ontolog)功能富集分析,KEGG(Kyoto Encyclopedia of Genes and Genomes)通路富集分析等。
2 结果与分析
2.12种柑橘的RNA质量
从表1可知,RNA完整性值为8.80~9.20,RNA质量评价均为A,满足建库测序要求。
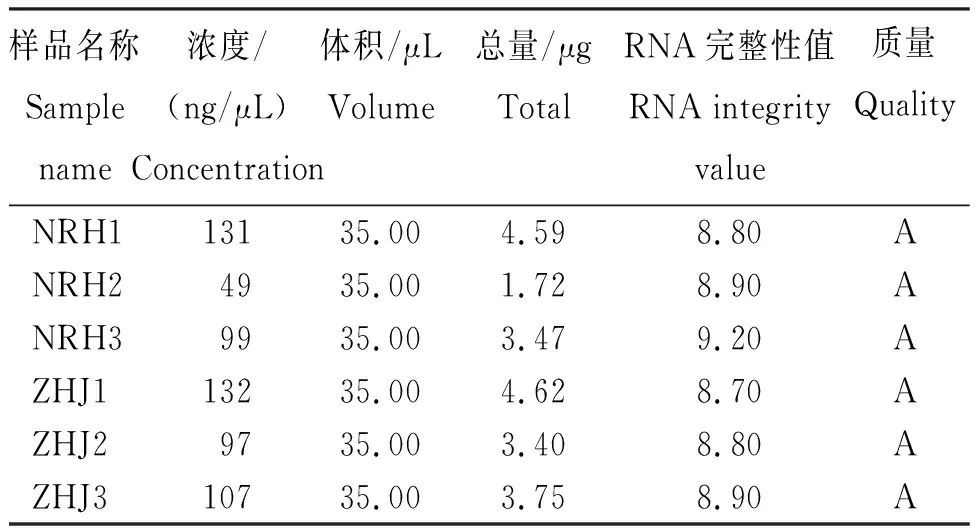
表1 2种柑橘RNA样品的质量和浓度
2.22种柑橘的测序数据
由表2可见,对NRH和ZHJ成熟果实测序后共产生(4.02~4.64)×107个原始数据片段,原始数据经过滤去除低质量数据后净读长数为(3.93~4.49)×107个,总净核苷酸数为(5.89~6.73)×109个,Q20占比为97.88%~98.31%,Q30占比为93.72%~94.33%,GC占比为43.74%~44.29%。
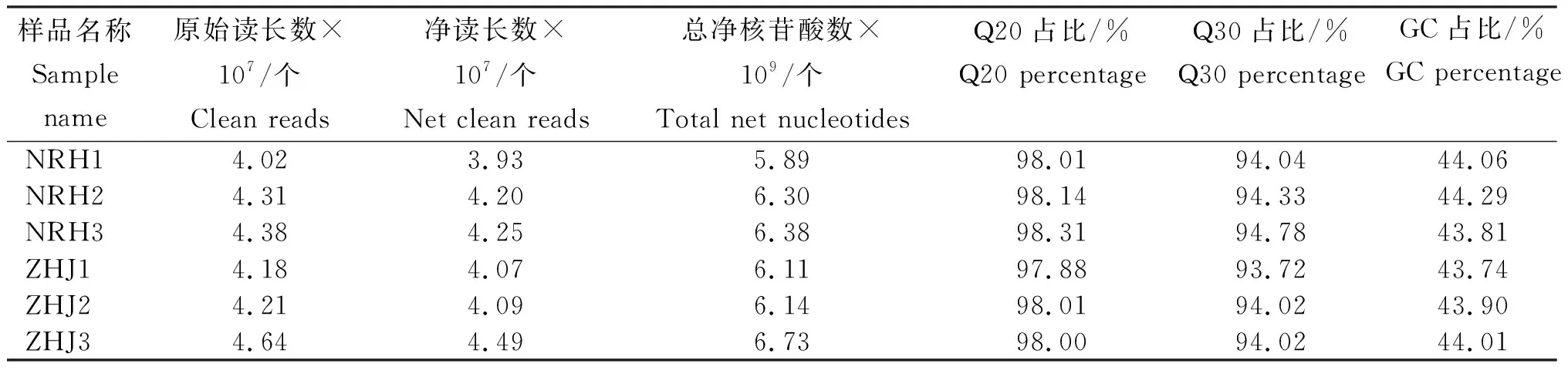
表2 2种柑橘的测序数据
2.32种柑橘的差异表达基因
由图1可见,NRH和ZHJ比较组在阈值为|log2(FoldChange)|>0和padj<0.05时,2个种质共筛选1 282个差异表达基因,其中上调833个,下调449个。
2.4 差异表达基因的GO聚类
GO聚类分析将padj<0.05作为显著性阈值,根据生物过程(BP, Biological Process)细胞组成(CC, Cellular Component)和分子功能(MF, Molecular Function)进行差异富集,由表3可见,仅在CC部分和MF部分富集到9个差异类别,共富集到差异基因279个,其中上调60个,下调219个。
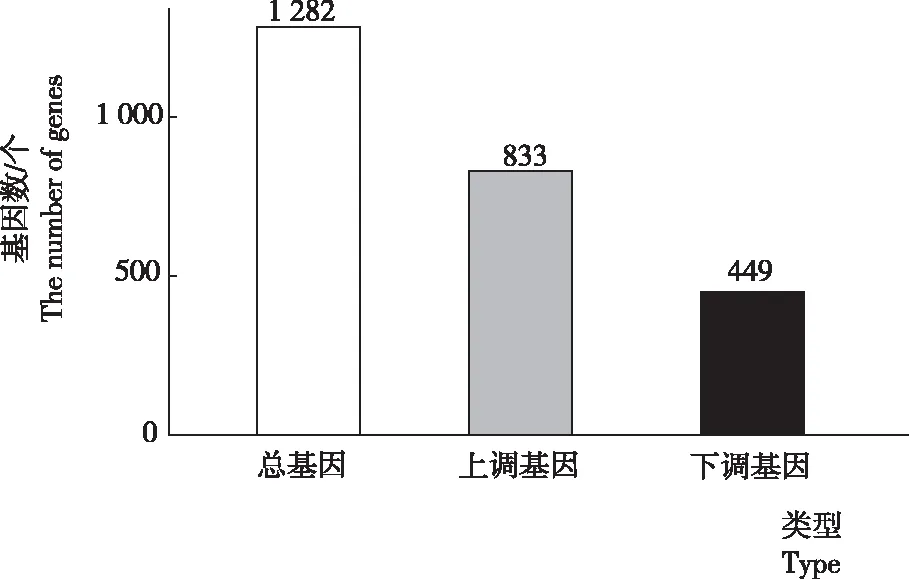
注:数字表示差异基因数目。
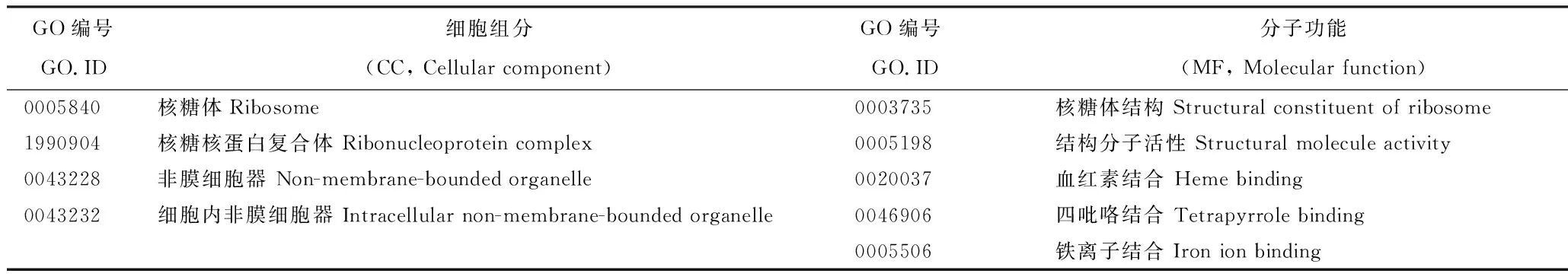
表3 2种柑橘差异基因显著富集的GO类别
在CC部分显著富集4个类别,分别为核糖体(GO:0005840,上调差异基因2个,下调差异基因26个)、核糖核蛋白复合体(GO:1990904,上调差异基因3个,下调差异基因26个)、非膜细胞器(GO:0043228,上调差异基因6个,下调差异基因31个)、细胞内非膜细胞器(GO:0043232,上调差异基因6个,下调差异基因31个)。
在MF部分显著富集5个类别,分别为核糖体结构(GO:0003735,上调差异基因2个,下调差异基因25个)、结构分子活性(GO:0005198,上调差异基因2个,下调差异基因25个)、血红素结合(GO:0020037,上调差异基因14个,下调差异基因19个)、四吡咯结合(GO:0046906,上调差异基因14个,下调差异基因19个)、铁离子结合(GO:0005506,上调差异基因11个,下调差异基因17个)。
2.5 KEGG显著富集
由表4可见,KEGG显著富集的前10个通路(富集基因数156个,其中54个上调,102个下调)依次为核糖体(1个上调,39个下调)、淀粉和蔗糖代谢(13个上调,9个下调)、类胡萝卜素生物合成(4个上调,3个下调)、MAPK信号通路(1个上调,14个下调)、缬氨酸、亮氨酸和异亮氨酸降解(4个上调,5个下调)、植物激素信号转导(7个上调,16个下调)、油菜素类固醇生物合成(2个上调,1个下调)、抗坏血酸和醛酸代谢(1个上调,5个下调)、氨基糖和核苷酸糖代谢(6个上调,7个下调)、苯丙烷生物合成(13个上调,3个下调)。

表4 KEGG显著富集的前10个代谢通路
2.6 差异表达基因鉴定
通过进一步KEGG富集分析发现,NRH抗氧化相关品质形成主要涉及2个相关通路,即类胡萝卜素生物合成和苯丙烷生物合成。2个通路共富集23个基因,相对亲本ZHJ,17个基因(占73.91%)在NRH中表达量上调,6个基因(占26.09%)表达量下调。
2.6.1 类胡萝卜素 KEGG富集分析表明(表5),类胡萝卜素生物合成通路有7个基因被富集,其中有4个基因相对亲本ZHJ,在

表5 类胡萝卜素生物合成通路富集到的差异基因
NRH成熟果实中表达量增加,有3个基因在NRH中表达量下降。
2.6.2 苯丙烷 KEGG富集分析表明(表6),苯丙烷生物合成通路有16个基因被富集,其中有13个基因相对亲本ZHJ,在NRH成熟果实中表达量增加,有3个基因在NRH中表达量下降。

表6 苯丙烷生物合成通路富集到的差异基因
3 讨论
果实不仅是高等植物种子传播和繁殖的重要器官,还是人类膳食结构的重要组成部分。果实成熟是复杂并精密的协同调控过程,涉及物质代谢、能量代谢、信号转导等一系列生理生化过程的相互作用,由此共同促进果形、色泽、大小、风味和质地等感官品质和生化品质的形成[8]。且相关的发育过程依赖于糖基转移酶、氧化酶、水解酶、甲基转移酶、羟化酶的作用[9]。该研究中,对红肉突变体牛肉红朱橘(NRH)和其亲本朱红橘(ZHJ)成熟果实差异基因富集分析与上述观点相符。KEGG富集结果表明,差异表达基因主要富集类胡萝卜素生物合成、苯丙烷生物合成、MAPK信号通路、植物激素信号转导等途径,在琯溪蜜柚(Citrusmaxima)红肉芽变株系果实的富集分析中也得到类似的结果[10]。
柑橘果实成熟后果色由肉眼可见的绿色逐渐转变为黄色、橙黄色、橙红色或红色,果实内部发生类胡萝卜素、花青苷和类黄酮等复杂代谢过程,这些果色主要与类胡萝卜素和类黄酮两大类色素积累密切相关[11]。柑橘果实类胡萝卜素和类黄酮除赋予果实颜色外,还具有重要的抗氧化生物活性,其主要通过有淬灭单线态氧、消除自由基等方式作为抗氧化剂被广泛应用于食品和药品行业[12-13]。柑橘果实颜色形成是复杂的过程,前期研究结果表明NRH橘红色主要来源于类胡萝卜素积累[3]。该研究鉴定出7个与类胡萝卜素代谢相关的基因,其中类胡萝卜素裂解双加氧酶(CCD,Carotenoid Cleavage Dioxygenase)、脱落酸8′-羟化酶(ABAH,Abscisic Acid 8′-Hydroxylase)和番茄红素ε环化酶(LCYE,Lycopene Epsilon Cyclase)等在突变体NRH中表达量增加,9-顺式-环氧类胡萝卜素加氧酶(NCED,9-Cis-Epoxycarotenoid Dioxygenase)、β-胡萝卜素羟化酶(CHYB,β-carotene hydroxylase)和脱落酸8′-羟化酶(ABAH,Abscisic Acid 8′-Hydroxylase)在NRH中表达量下降。这些差异基因大部分与类胡萝卜素的降解存在密切联系,如CCD是类胡萝卜素裂解的关键酶,能够降解玉米黄质或β-隐黄质,产生橙红色色素[14-15];NCED同属于CCD基因家族,能够降解ABA的前体物质9-顺式-环氧类胡萝卜素,是ABA合成的关键酶[16-17];ABAH属于细胞色素氧化酶P450家族成员,是ABA氧化分解的关键酶,能够负调控ABA的积累[18]。
苯丙烷生物合成途径是柑橘次生代谢重要途径,相关化合物除参与植物生长发育和胁迫应答外,还具有重要的生物活性,对人体健康发挥着重要作用。其始于苯丙氨酸,在苯丙氨酸脱氨酶PAL(Phenylalanin Ammonia-Lyase)、肉桂酸-4-羟基化酶(C4H,Cinnamate-4-hydroxylase)、4-香豆酰-Co A连接酶(4CL,4-coumarate CoA ligase)等作用下形成4-香豆酸辅酶A,随后进入类黄酮、花青素、木质素等合成支路,并经过糖基化、酰基化、甲基化等修饰形成稳态的形式存贮[19]。该研究中,苯丙烷生物合成途径富集16个差异基因,其中高于80%基因上调表达,仅20%差异基因下调表达,且大部分差异基因为糖基化、酰基化、甲基化修饰相关基因。如咖啡酸3-O-甲基转移酶(COMT,Caffeic Acid 3-O-Methyltransferase)是木质素生物合成途径重要的甲基转移酶,能够催化咖啡酸、5-羟基阿魏酸、5-羟基松柏醇分别形成阿魏酸、芥子酸和芥子醇[20]。在糖代谢过程中发挥重要作用的β-葡萄糖苷酶(β-glucosidase),能够水解β-D葡萄糖苷键并释放相应的配基[21]。
4 结论
利用RNA-Seq技术时牛肉红朱橘其亲本朱红橘进行转录组测序分析,鉴定出2条与抗氧化密切相关的代谢通路,即类胡萝卜素(7个差异基因)和苯丙烷生物合成途径(16个差异基因),类胡萝卜素和苯丙烷代谢均是复杂的生物过程,涉及结构基因种类和数量繁多,同时还可能受到调控基因的作用,在两者的互相协作下,形成协同调控网络,共同促进NRH橘红色色素形成。

