果树中花色苷的生物合成及其调控机制研究进展
高磊 李慧 郑焕 陶建敏
摘要: 花色苷是一种多酚类水溶性色素,在合成过程中不仅受到多种酶的催化,还受到外界环境因素、内源激素以及多种转录因子的调节。研究果树植物中花色苷的生物合成及其调控机制有利于进一步探索果树植物在自然和应激条件下叶片、花、果实等着色的机制,明确转录因子与结构基因间的互作关系,帮助人们在育种与生产上最大程度地利用花色苷来提高果树植物的抗逆性与产品价值。本文综述了果树中花色苷的生物合成及其调控机制。
关键词: 花色苷;生物合成;分子调控
中图分类号: Q946.83 文献标识码: A 文章编号: 1000-4440(2022)01-0258-10
Abstract: Anthocyanin is a polyphenolic water-soluble pigment. The biosynthesis of anthocyanins is not only catalyzed by a variety of enzymes, but also regulated by external environmental factors, endogenous hormones and transcription factors. Studying the biosynthesis and regulation mechanism of anthocyanins in fruit trees is helpful to further explore the coloring mechanism of leaves, flowers and fruits under natural and stress conditions, clarify the interaction between transcription factors and structural genes, and help people make the most of anthocyanins in breeding and production to improve the stress resistance and product value of fruit trees. This paper reviews the biosynthesis and regulation mechanism of anthocyanins in fruit trees.
Key words: anthocyanins;biosynthesis;molecular regulation
1 花色苷的概念及作用
花色苷是一種极其重要的多酚类水溶性色素,在结构上通过糖苷键将花色素和糖类结合起来,因此可以相对稳定地存在于植物细胞液泡中[1]。它含有一个含氧杂环和两个芳香环,所以本质上是一种黄酮类化合物,但它又和天然的黄酮类化合物有所不同,因其特殊的紫外吸收峰和强烈吸收可见光等特点,人们可以利用高效逆流色谱法对它进行纯化[2]。当前主流的提取花色苷的方法有超声波辅助提取法、微波辅助提取法、超高压辅助提取法等,目前已经有500多种花色苷被人工提取出来,在植物中花色苷主要以锦葵素(Malvidin)、矮牵牛素(Petunidin)、矢车菊素(Cyanidin)、飞燕草素(Delphinidin)、芍药素(Peonidin)、天竺葵素(Pelargonidin)这六种形态存在[2]。
花色苷广泛分布在园艺植物的根、茎、叶、果实、花和种子等器官的细胞的液泡中,不仅可以赋予植物色彩,还在植物体内承担着抵抗不良自然环境(如低温胁迫、病虫侵染、干旱)以及避免光合机构被强光和紫外线破坏等重要作用[3-4]。在人体中它还具有很强的抗氧化、抗炎、调节血脂以及人体胰岛素含量等多种作用,对人体有着重要的保护功效。目前已经被广泛应用到食品加工、医疗和保健品加工等行业中[5-6]。因此研究花色苷的生物合成及其分子调控机制不仅有利于深入了解花色苷的生物合成途径,还有利于了解植物在自然和应激条件下生成花色苷的信号调控与各种基因之间的互作关系。
2 花色苷的生物合成代谢
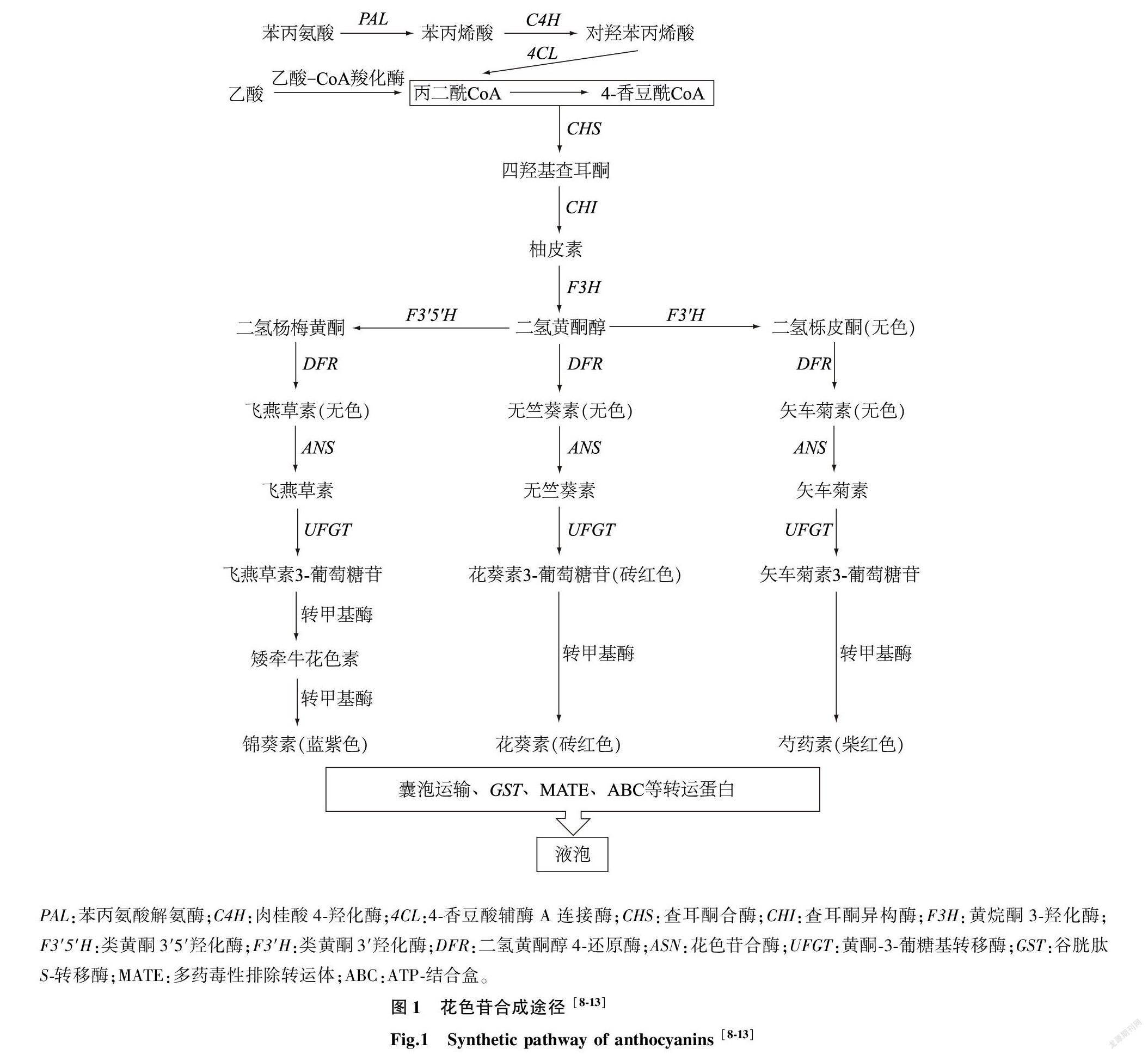
花色苷在植物体内的合成主要由一系列结构基因所调控(图1),这些结构基因通过编码不同功能的酶来参与花色苷的合成。花色苷的生物合成可以大致分为苯丙烷代谢途径、类黄酮代谢途径和花色苷合成修饰途径这三个阶段(图1)[7]。
第一个阶段中以苯丙氨酸和乙酸作为黄酮类物质的直接合成前体,在苯丙氨酸解氨酶(PAL)、肉桂酸-4-羟化酶(C4H)、4-香豆酸辅酶A连接酶(4CL)和乙酸-CoA羧化酶的参与下合成4-香豆酰CoA和丙二酰CoA这两个底物[8]。在第二阶段中上述两个底物首先在查耳酮合酶(CHS)的催化下发生缩合反应,合成四羟基查耳酮,进而在查耳酮异构酶(CHI)催化下生成合成类黄酮的直接前体物质——柚皮素,随后在黄烷酮3-羟化酶(F3H)催化下生成羟基化产物二氢黄酮醇。二氢黄酮醇可以在类黄酮3′5′羟化酶(F3′5′H)、类黄酮3′羟化酶(F3′H)的催化下发生不同程度的羟基化反应,分别合成二氢杨梅黄酮和二氢栎皮酮。第三阶段利用二氢黄酮醇4-还原酶(DFR)的选择性催化特性将上述3种二氢黄酮醇还原为无色且不稳定的花色素,再利用花色苷合酶(ANS)脱水氧化生成有色不稳定的飞燕草素、天竺葵素和矢车菊素这三类花色素[9-11]。然后通过类黄酮-3-葡糖基转移酶(UFGT)将葡萄糖转移到花色素分子的羟基上生成糖苷键,糖基化可显著提高花色素的稳定性,避免花色素向液泡转移的过程中被降解[12]。这三类花色苷随后通过甲基化、酰基化等修饰生成蓝紫色的锦葵素、砖红色的花葵素和紫红色的芍药素。花色苷在内质网中合成后,随即通过囊泡运输与谷胱甘肽S-转移酶(GST)、多药毒性排除转运体(MATE)、ATP-结合盒(ABC) 等转运蛋白运输到液泡中保存[13]。
3 外界环境与植物激素对花色苷生物合成的影响
3.1 外界环境对花色苷合成的影响
花色苷的生物合成会受到外界各种环境因素的影响,其中温度与光照是主要的影响因素[14]。温度可以通过影响花色苷合成相关酶的活性来间接影响花色苷的合成[15-17]。在高温条件下,花色苷合成相关酶的活性下降,抑制了花色苷的合成,同时花色苷稳定性被破坏,最终导致花色苷含量大大降低[18]。例如海棠(Calophyllum inophyllum L.)果实在高温处理后,MpCHS、MpDFR、MpUFGT等结构基因表达量显著降低,花色苷含量降低[19]。在石榴(Punica granatum L.)中比较0 ℃、5 ℃、10 ℃、15 ℃下果肉内花色苷的稳定性,结果显示15 ℃下花色苷的稳定性最差且随着贮存时间的延长含量明显降低[20]。荔枝(Litchi chinensis Sonn.)果皮在高温下会由正常的红色迅速变为褐色,这表明高温会促使花色苷降解,果皮中花色苷合成关键基因LcUFGT的表达也会受高温抑制,阻碍了果皮中花色苷的合成与积累[21]。苹果(Malus domestica)中的热激转录因子MdHSF3b/4a受高温诱导会与转录抑制因子MdBBX24启动子中的热激响应元件HSE特异性结合,并促进其表达,进而抑制花色苷的合成,结果表明高温可以通过刺激转录抑制因子的表达抑制花色苷的合成[22]。
对于大部分果树植物来说,低温往往更有利于花色苷的积累[23]。将秋皇后盆栽葡萄(Vitis vinifera L.)分别在20 ℃和30 ℃下处理,与30 ℃的对照相比20 ℃下果皮中花色苷的积累量以及相关基因的表达量显著提高[24]。海棠叶片在低温诱导下,McbHLH3/33、McMYB10和McTTG1表达量会明显升高,使叶片着色加深[25]。苹果果实经低温处理后转录因子MdMYBA会增强结构基因MdANS启动子的活性,进而促进花色苷的合成[26];低温还可以诱导磷酸化修饰后的MdbHLH3结合在MdBBX20启动子中的低温响应原件(LTR)上[22],促进下游结构基因MdDFR、MdUFGT的表达,进而促使果实着色[27]。低温会影响花色苷的组织特异性积累,如血橙(Citrus sinensis)的果皮與果肉都可以积累花色苷,而紫色柚[Citrus maxima (Burm) Merr.]只能在果皮中积累花色苷[28]。紫色柚果肉的CgRuby1启动子中缺乏E-box元件,不具有感受低温的能力也无法与bHLH结合,故无法在低温下积累花色苷[29-30]。
光照可以通过光质、光照度与光照时间影响花色苷的生物合成[31]。其中光质主要通过UV-B信号通路来参与植物花色苷的合成,波长为280~320 nm的UV-B对花色苷合成的影响最大[32]。HY5与COP1是UV-B信号途径的两个关键光信号转录因子[33],在黑暗下COP1可以将HY5泛素化降解,导致花色苷合成受阻[34]。在光照下,UV-B信号会刺激其光信号受体UVR8由无活性的二聚体构型变为活性的单体构型并形成UVR8-COP1蛋白复合体,解除了COP1对HY5的降解,从而激活花色苷的生物合成[35-36]。血橙与紫色柚在光诱导下,HY5可以直接结合并激活Ruby1启动子的G-box-1(CACGTC)元件,进而积累花色苷[28]。苹果中MdDFR和MdUFGT的启动子中的光响应元件在光下可以与bZIP因子或bHLH结合成光响应复合体,提高果实对光照的敏感性[37]。处于强光下的苹果果实,花色苷合成相关基因的表达量与遮光果实相比明显升高,其中MdMYB1的表达量升高了20~25倍[38]。草莓(Fragaria ananassa Duch.)果实中的FaDFR、FaANS、FaUFGT和FaMYB10等花色苷合成相关基因的表达量与光照度呈正相关,强光下果实中花色苷含量显著增加[39]。在海棠叶片中,随着光照时间的延长,黄酮类物质含量、叶片着色程度以及花色苷合成基因的表达都明显增加[40]。
3.2 植物激素对花色苷合成的影响
激素对植物的生长发育具有显著的调控作用,可以影响植物体中包括花色苷在内的各种次生代谢物质的生成[41-42]。生长素(IAA)主要通过植物体内的ARF-Aux信号通路影响植物的生长发育[43]。其中ARF基因是主要的生长素响应基因,可以对花色苷的生物合成起到明显的抑制作用[44]。 如在苹果中,MdARF13基因可以与MdDFR的启动子结合抑制MdDFR的表达,继而抑制花色苷的生物合成[45]。在苹果上施加生长素类似物2,4-二氯苯氧基乙酸(2,4-D)可以促进ARF基因的表达,抑制MdMYB10和MdbHLH3对结构基因的调控[46]。细胞分裂素对花色苷的影响与生长素相反,它可以促进受糖诱导的尿苷二磷酸葡萄糖焦磷酸化酶(UDP-glucose)基因以及类黄酮-O-葡萄糖基转移酶(UF3GT)基因的表达来促进花色苷的合成[47-48]。用低浓度的细胞分裂素类似物6-苄基腺嘌呤(6-BA)处理美乐葡萄,可以增强VvF3′5′H、VvANS、VvUFGT等基因的表达来合成花色苷[49]。脱落酸(ABA)是植物主要的抗逆激素,可以通过关闭植物气孔、提高根系对水分的吸收能力来帮助植物抵御逆境,同时促进植物中花色苷的生物合成[50-51]。用ABA处理夏黑葡萄可以使果皮中的锦葵素糖苷与矮牵牛素糖苷含量明显增加[52],促进果皮中CHS3和UFGT等结构基因的表达[53-54]。油菜素内酯(BRs)是一种新型的植物内源激素,在提高植物产量,提高抗逆性等方面有重要作用[55]。用BRs处理赤霞珠葡萄可以提高果皮中PAL、UFGT等酶的活性,同时刺激内源ABA的合成促进果皮着色[56];在巨峰葡萄上喷施BRs可以降低高温对葡萄花色苷合成的抑制作用并促进果实着色[57]。茉莉酸(JA)对花色苷的合成也具有促进作用,它可以刺激花色苷合成上游结构基因苯丙氨酸解氨酶(PAL)基因的表达来促进花色苷合成[58]。在美乐葡萄叶面喷施茉莉酸甲酯(MeJ),使果皮中花翠素类花色苷含量显著升高[59]。在苹果中,JA可以诱导MdMYB24L表达,增强下游结构基因MdDFR、MdUFGT的启动子活性来诱导花色苷合成[60]。
4 转录因子及其复合物对花色苷合成与结构基因的影响
4.1 MYB转录因子与结构基因的互作
MYB转录因子广泛存在于高等植物中,是植物中最大的转录因子家族之一,N端存在的高度保守的功能性DNA结合域通常由1~3个的重复序列(R1、R2和R3)组成[61]。这些重复序列由间隔排列的色氨酸残基组成,色氨酸残基在每个重复序列的疏水核中形成簇,并起到稳定DNA结合结构域的作用[62]。
R2R3-MYB转录因子通过刺激花色苷合成途径中重要结构基因的表达或与其他调控基因配合来促进植物体中花色苷的合成[63-64]。例如在猕猴桃(Actinidia chinensis Planch.)中,AcMYB10通过与AcbHLH42互作可以促进其下游结构基因AcLDOX、AcF3GT表达,来促进花色苷的生物合成[65]。在苹果中,MdMYB1可以直接与MdGSTF6的启动子结合促进花色苷向液泡中转移[66]。在葡萄和桃等植物中也已发现R2R3-MYB有类似的作用[67-69]。
R3-MYB在结构上只含有单个R3重复序列且缺乏转录激活域,是花色苷合成途径中重要的转录抑制因子[70]。一方面它通过抑制MBW对花色苷合成结构基因的调控来阻碍花色苷的合成。例如在番茄中,过表达的SlMYB-ATV(R3-MYB)可以与SlAN1和SlJAF13(bHLH)结合,充当MBW的竞争性抑制剂来阻碍花色苷的合成[71]。另一方面,它可以直接抑制结构基因的表达,来抑制花色苷的生成。例如在苹果中,MdMYB16可以与下游结构基因MdANS和MdUFGT的启动子结合,来抑制花色苷的合成[72];MdMYB6可以抑制MdANS和MdGSTF12的表达,还可以减少花色苷合成底物UDP-glu和UDP-gal的量来间接抑制花色苷的合成[73]。此外R3-MYB还通过抑制其他转录因子对结构基因的调节来间接阻碍花色苷的生成。在秋姬李中R3-MYB会抑制其他正调控转录因子如PsMYB10.1和PsbHLH3对花色苷合成基因PsDFR、PsANS的促进效果来阻碍花色苷合成[74]。
MYB转录因子还可以通过突变来影响花色苷的合成。在白色葡萄中,VvMYBA1的启动子中插入了一个反转座子,VvMYBA2蛋白的氨基酸序列上保守性极强的第44位精氨酸突变成了亮氨酸[75-76],mRNA编码区两个核苷酸(C、A)的缺失等[77]。这些突变最终使VvMYBA1/A2无法对VvUFGT进行调控,进而使果肉无法积累花色苷[78-79]。在血橙中,CsRuby1的启动子中插入了一个含有低温响应元件LTR的反转录转座子(Tcs1),使血橙在低温诱导下积累花色苷[28]。
4.2 bHLH转录因子与结构基因的互作
bHLH转录因子是由60个氨基酸组成的螺旋-环-螺旋结构,并且形成了两个不同的功能域[80]。一个是基本的DNA结合域,此结构域赋予其结合DNA的能力,并且可以特异性识别目标基因上的E-box基序(CANNTG),另一个是通过疏水性氨基酸二聚化的HLH区域[81-82]。
在大部分植物中bHLH转录因子往往与MYB互作,在MYB的参与下调控结构基因的表达来影响花色苷的合成。例如苹果中MdbHLH33能够与转录抑制子MdMYB16互作形成异源二聚体,抑制MdMYB16与下游结构基因启动子结合,进而保证花色苷的正常合成[83]。在葡萄中,VvMYC1通过HLH区域形成二聚化结构,与VvMYBA1/A2互作,共同促进VvCHI、VvANR和VvUFGT等基因的表达促进花色苷合成[84]。此外VvMYC1与VvMYBA1组成的转录复合物还可以激活VvMYC1自身启动子的活性产生正反馈调节效应[85]。此外bHLH还可以直接调控结构基因的表达来影响花色苷的生成。在蓝果忍冬(Lonicera caerulea L.)中,LcTT8可以促进下游结构基因LcDFR、LcANS的表达而积累花色苷[86]。在苹果中,MdbHLH3可以直接刺激MdDFR、MdUFGT等结构基因的表达,来促进花色苷的合成与积累[87]。
4.3 WD40转录因子与结构基因的互作
WD40重复序列第一次在异源三聚体G蛋白和CDC4蛋白的Gβ亚基中得到鉴定,长度约为43个氨基酸,包括N端的Gly-His(甘氨酸-組氨酸)和C端的Trp-Asp(色氨酸-天冬氨酸)组成的高度保守的二肽结构,这些保守残基形成的强大氢键网络可以稳定WD40的折叠结构[88-89]。
WD40转录因子可以通过自身40个氨基酸组成的四链反平行β折叠结构直接与其他转录因子互作。例如苹果中的WD40蛋白MdTTG1虽然不能与MYB转录因子相互作用,但是可以与MdbHLH3/33互作来调节花色苷的合成[90]。WD40转录因子也可与MYB和bHLH共同组成MBW转录复合物,在其中承担着稳定复合物结构、提供蛋白质间互作平台的作用[91]。在石榴中,PgTTG1能与PgAn2(MYB)和PgAn1(bHLH)组成MBW复合物来调节PgANS和PgDFR的表达,从而促进花色苷的积累[92-93]。
4.4 MBW转录复合物
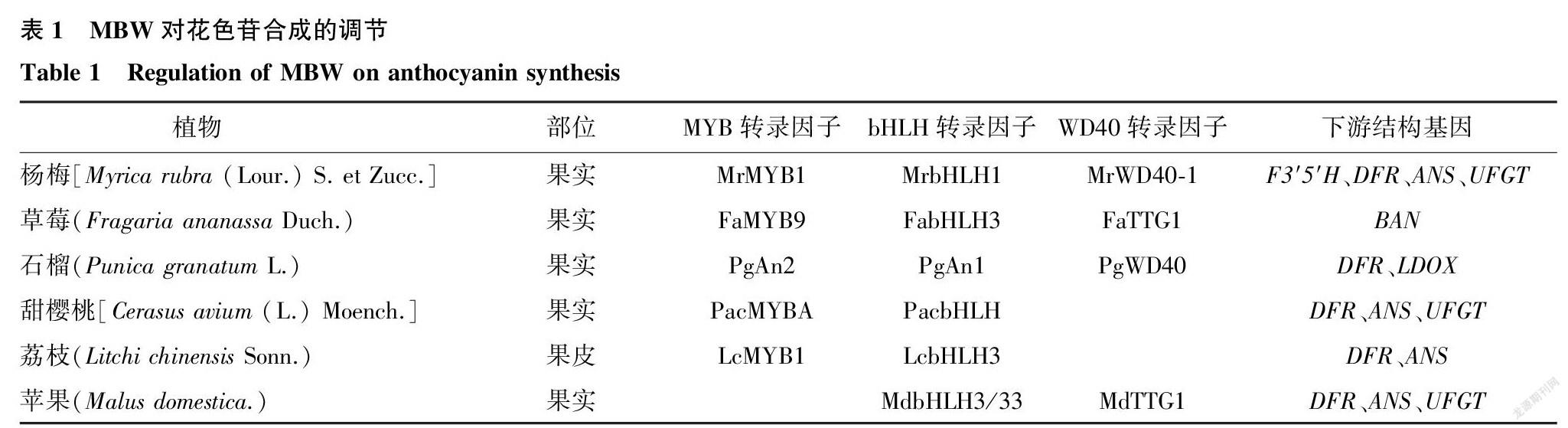
植物中花色苷的生物合成主要受到MBW(MYB-bHLH-WD40)转录复合物的调控(表1)[94]。转录复合物中的各个组分具有不同功能,如转录因子MYB和bHLH通过DNA结合域与下游结构基因的启动子结合来调控基因表达,而WD40蛋白则负责转录复合物结构的稳定[95]。在大部分果树植物中,MBW转录复合物往往通过调控CHS、DFR、ANS和UFGT等花色苷生物合成相关结构基因的表达来参与花色苷的合成。在杨梅[Myrica rubra (Lour.) S. et Zucc.]中,MrMYB1-MrbHLH1-MrWD40-1转录复合物可以促进MrDFR、MrUFGT等结构基因的表达积累花色苷[96]。上述结果在草莓、石榴等果树植物中均已得到验证[93,97-99]。
有时转录因子MYB与bHLH可以组成二元复合物来单独调控花色苷的合成。如杨梅中的MrMYB1与MrbHLH1共表达时可明显提高MrCHS、MrANS、MrUFGT等基因的表达量来促进花色苷合成[100]。在荔枝中,LcMYB1与LcbHLH3组成二元复合物也可以促进下游LcDFR,LcANS等基因的表达来促进果皮着色[101]。在甜樱桃[Cerasus avium (L.) Moench.]中,PacMYBA通过与PacbHLH相互作用,共同激活下游基因PacDFR、PacANS和PacUFGT的表达来提高果实中花色苷的含量[102]。
4.5 其他转录因子与结构基因的互作
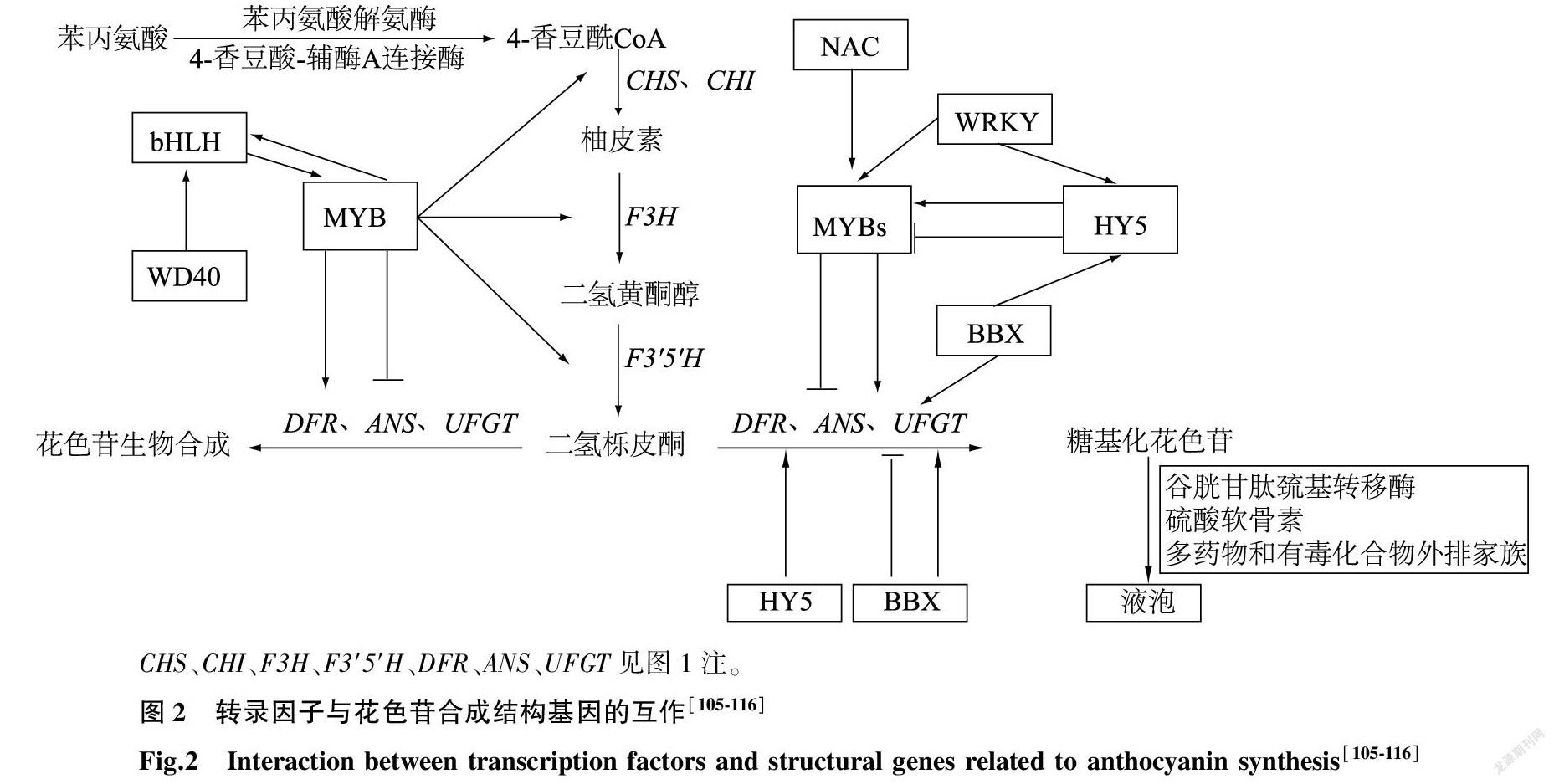
MYB、bHLH、WD40三大转录因子家族是参与花色苷生物合成的主要调节因子,此外其他转录因子如WRKY、HY5、NAC、B-box对花色苷的合成调节也有着不可忽视的作用[103-104]。它们可以通过相互作用组成复合物,调节MYB、bHLH或WD40等转录因子的表达来间接调节花色苷的合成。如苹果中MdWRKY72与MdWRKY11可以与MdHY5启动子中的W-box元件结合来促进MdMYB1的表达,继而促进花色苷积累[105];MdBBX20的G-box结构域可以与MdHY5的b-ZIP结构域相互识别结合形成MdBBX20-MdHY5蛋白复合体,激活MdMYB1启动子的活性来促进下游结构基因的表达[106]。在红肉桃(Amygdalus persica L.)中,NAC转录因子BL与PpNAC1组成的二元复合物可以促进PpMYB10的表达来促进花色苷合成[107]。
WRKY、HY5与NAC等转录因子可以直接与MYB、bHLH或WD40相互作用调控花色苷的合成。例如红皮梨[Pyrus pyrifolia (Burm. F.) Nakai]中PyWRKY26可以直接激活PyMYB114的启动子活性,促进PyMYB114对下游结构基因的调控,进而积累花色苷[108];PyHY5可以直接识别并结合PyMYB10和PyWD40启动子中的G-box序列刺激它们表达,进而促进花色苷的合成[109]。在苹果中,MdbZIP4可以直接结合到MdMYB114的启动子上,促进MdANS、MdUFGT等结构基因的表达而促进花色苷的合成[110];MdWRKY41可以与MdMYB16(R3-MYB)互作来抑制下游MdANS、MdUFGT等基因的表达,进而抑制花色苷的合成[111];MdNAC42/52可以直接激活MdMYB9/10/11的启动子来促进花色苷的合成[112]。
B-box、NAC和WRKY等转录因子可以直接调控结构基因的表达来影响花色苷的合成。苹果中B-box转录因子MdBBX24可以抑制下游结构基因MdDFR、MdANS启动子的顺式作用元件活性来抑制花色苷的合成[22];MdWRKY40可以直接结合MdANS启动子的W-box与MRE元件,促进MdANS的表达而积累花色苷[113];过表达MdNAC42可以使结构基因MdDFR、MdANS、MdUFGT表达量显著提高,促使果色加深[114]。荔枝中LcNAC13会抑制LcCHS、LcCHI、LcDFR和LcMYB1等花色苷合成相关基因的表达而阻碍花色苷的合成[115]。草莓中AP2转录家族中的FaABI4可以直接促进FaCHS和FaUFGT等基因的表达,进而促进草莓中蔗糖與花色苷的积累[116]。因此WRKY、HY5、NAC、B-box等转录因子与MYB、bHLH、WD40三大转录因子家族组成庞大的调控网络来共同调控花色苷合成结构基因的表达,进而参与花色苷的合成调控(图2)。
5 展望
近年来对果树中花色苷的研究已经取得了很大进展,基本阐明了花色苷在果树中的合成途径以及参与的各种结构基因,同时在葡萄、苹果、柑橘等植物中也基本阐明了转录因子与结构基因的各种互作关系。转录因子在花色苷合成的调节中具有重要作用,其中MYB、bHLH、WD40这三大类转录因子家族起主要作用,它们可以单独或组成MBW转录复合物参与合成调节,另外WRKY、HY5、NAC、B-box等转录因子也可以与MYB、bHLH、WD40相互作用参与花色苷的合成。
未来人们可以利用基因编辑技术[117-118]选择性地合成某种花色苷,从而起到定向影响果皮或者花朵着色的效果。例如向某种不含花色苷合成结构基因的植物转入关键基因使其获得新的性状,或者导入外源转录因子基因定向调节内源结构基因的表达和次生代谢物的合成。也可以利用基因敲除技术[119]沉默某一基因的表达来改变植物的花色等。尽管花色苷合成的研究已经取得了诸多的成就,但是像花色苷合成途径在不同的植物组织或器官表达的唯一性、结构基因表达的时间顺序与空间位置、转录因子与结构基因的作用位点等问题还有待探索,相信未来人们可以构建更为清晰的花色苷合成网络,探索合成途径中关键酶的晶体结构,利用基因工程和生物信息学等技术为创造和改变花色提供更为清晰思路和前景。
参考文献:
[1] 张艳艳,黄玉舟,李 丽,等. 花色苷的研究进展[J]. 食品安全导刊,2019(15):155.
[2] 彭祖茂,邓梦雅,严虞虞,等. 植物中花青素含量测定及种类分布研究[J]. 食品研究与开发,2018,39(17):107-111.
[3] 常仁杰,何 勇,朱祝军. 植物花色苷抗逆性作用研究进展[J]. 北方园艺,2013(9):216-219.
[4] HUGHES N M, CONNORS M K, GRACE M H, et al. The same anthocyanins served four different ways: Insights into anthocyanin structure-function relationships from the wintergreen orchid, Tipularia discolor[J]. Plant Science,2020, 303: 110793.
[5] 郭红辉,卫晓怡,凌文华. 花色苷代谢的研究进展[J]. 食品研究与开发,2011,32(5):163-166.
[6] 闫亚美,冯丹萍,陈晓燕,等. 黑果枸杞花色苷的肥胖干预作用研究进展[J]. 食品科学技术学报,2020,38(4):21-26.
[7] 刘晓芬,李 方,殷学仁,等.花青苷生物合成转录调控研究进展[J]. 园艺学报,2013,40(11):2295-2306.
[8] 张 宁,胡宗利,陈绪清,等. 植物花青素代谢途径分析及调控模型建立[J]. 中国生物工程杂志,2008,28(1):97-105.
[9] 赵启明,李 范,李 萍. 花青素生物合成关键酶的研究进展[J]. 生物技术通报,2012(12):25-32.
[10]张 龙,李卫华,姜淑梅,等. 花色素苷生物合成与分子调控研究进展[J]. 园艺学报,2008,35(6):909-916.
[11]王 蕾,韦灵林,徐 虹. 矮牵牛花色素苷合成途径中的关键酶及其转录调控[J]. 细胞生物学杂志,2009,31(5):641-650.
[12]YING-CHANG L I, FENG-YUAN Q I, FAN Y. Research advances of the stability of anthocyanins.[J]. China Condiment,2009,34(11):88-90,111.
[13]李 栋,李 莉,徐艳群,等. 植物中花色苷转运蛋白研究进展[J]. 食品安全质量检测学报,2020,11(3):15-20.
[14]柯 燚,高 飞,金 韬,等. 温度对植物花青素苷合成影响研究进展[J]. 中国农学通报,2015,31(19):101-105.
[15]CANTERO A, BARTHAKUR S, BUSHART T J, et al. Expression profiling of the Arabidopsis anmexin gene family during germination, de-etiolation and abiotic stress[J]. Plant Physiology and Biochemistry,2006,44(1):13-24.
[16]SHENG J J, LI X, HE Y M, et al. Effect of UV-B radiation on anthocyanin anabolism and its molecular mechanism[J]. Plant Physiology Journal,2019,55(7):949-958.
[17]VUKOJA J, PICHLER A, KOPJAR M, et al. Stability of anthocyanins, phenolics and color of tart cherry jams[J]. Foods,2019,8(7):255.
[18]SHAKED-SACHRAY L, WEISS D, REUVENI M, et al. Increased anthocyanin accumulation in aster flowers at elevated temperatures due to magnesium treatment[J]. Physiologia Plantarum,2002, 114(4):559-565.
[19]REHMAN R N U. 溫度变化和发育阶段对海棠中酚类物质及花色苷降解的影响[D]. 陕西:西北农林科技大学,2017.
[20]关晓弯,陈 磊,涂佳丽,等. 石榴果肉PgF3′5′H基因克隆及不同温度处理下的表达分析[J]. 西北植物学报,2016,36(3):435-443.
[21]REHMAN R, YOU Y, LEI Z, et al. High temperature induced anthocyanin inhibition and active degradation in malus profusion[J]. Frontiers in Plant Science,2017,8:1401.
[22]房鸿成. B-box转录因子介导UV-B和温度调控苹果果实着色的机理[D]. 泰安:山东农业大学,2019.
[23]ZHANG K M, TIAN G, LI X H, et al. ROS produced via BsRBOHD plays an important role in low temperature-induced anthocyanin biosynthesis in begonia semperflorens[J]. Russian Journal of Plant Physiology,2020,67(2):250-258.
[24]YAMANE T, JEONG S T, GOTO-YAMAMOTO N, et al. Effects of temperature on anthocyanin biosynthesis in grape berry skins[J]. American Journal of Enology and Viticulture,2006,57(1):54-59.
[25]JI T, HAN Z Y, ZHANG L R, et al. Induction of anthocyanin accumulation in Crabapple (Malus cv.) leaves by low temperatures[J]. Hort Science,2015,50(5):640-649.
[26]BAN Y, HONDA C, HATSUYAMA Y, et al. Isolation and functional analysis of a MYB transcription factor gene that is a key regulator for the development of red coloration in apple skin[J]. Plant & Cell Physiology,2007,48(7):958.
[27]XIE X B, LI S, ZHANG R F, et al. The bHLH transcription factor MdbHLH3 promotes anthocyanin accumulation and fruit colouration in response to low temperature in apples[J]. Plant, Cell & Environment,2012,35(11):1884-1897.
[28]HUANG D, YUAN Y, TANG Z, et al. Retrotransposon promoter of Ruby1 controls both light-and cold-induced accumulation of anthocyanins in blood orange[J]. Plant, Cell & Environment,2019,42(11):3092-3104.
[29]BUTELLI E, LICCIARDELLO C, ZHANG Y, et al. Retrotransposons control fruit-specific, cold-dependent accumulation of anthocyanins in blood oranges[J]. Plant Cell,2012,24(3):1242-1255.
[30]HUANG D, WANG X, TANG Z Z, et al. Subfunctionalization of the Ruby2-Ruby1 gene cluster during the domestication of citrus[J]. Nature Plants,2018,4(11):930-941.
[31]李天來,王 峰,王秀杰,等. 光对园艺植物花青素生物合成的调控作用[J]. 中国农业科学,2020,53(23):188-201.
[32]宋 哲,李天忠,徐贵轩,等. 光质对‘红富士’苹果果实着色的影响[J]. 生态学报,2009,29(5):2304-2311.
[33]DI W, HU Q, YAN Z, et al. Structural basis of ultraviolet-B perception by UVR8[J]. Nature,2012,484(7393):214-219.
[34]LI Y Y, MAO K, ZHAO C, et al. MdCOP1 Ubiquitin E3 ligases interact with MdMYB1 to regulate light-induced anthocyanin biosynthesis and red fruit coloration in apple[J]. Plant Physiology,2012,160(2):1011-1022.
[35]HUANG X, OUYANG X, YANG P, et al. Arabidopsis FHY3 and HY5 positively mediate induction of COP1 transcription in response to photomorphogenic UV-B Light[J]. Plant Cell,2012,24(11):4590-4606.
[36]XI H. UVR8 mutations affect UV-B light perception, UVR8 monomerization and UVR8-COP1 association[J]. PLoS Genetic,2014,10:55.
[37]MENG R, WANG Y, ZHANG B, et al. Anthocyanin biosynthesis in the apple skin of ‘Granny Smith’ after bag removal[J]. Food Science,2015,22:240-245.
[38]TAKOS A M, FELIX W J, JACOB S R, et al. Light-induced expression of a MYB gene regulates anthocyanin biosynthesis in red apples[J]. Plant Physiology,2018,142(3):1216-1232.
[39]邵婉璐,李月灵,高 松,等. 光照度对成熟红颜草莓果实着色和花青素生物合成的影响及可能的分子机制[J]. 植物研究,2018(5):661-668.
[40]LU Y F, ZHANG M L, MENG X N, et al. Photoperiod and shading regulate coloration and anthocyanin accumulation in the leaves of malus crabapples[J]. Plant Cell Tissue & Organ Culture An International Journal on in Vitro Culture of Higher Plants,2015, 121:619-632.
[41]汤 红,李 娜,曾教科,等. 植物激素调控果实色泽形成的分子机制研究进展[J]. 分子植物育种,2019,17(8):2705-2711.
[42]JEONG S T, GOTO-YAMAMOTO N, KOBAYASHI S, et al. Effects of plant hormones and shading on the accumulation of anthocyanins and the expression of anthocyanin biosynthetic genes in grape berry skins[J]. Plant Ence,2004,167(2):247-252.
[43]WANG Y C, WANG N, XU H F, et al. Auxin regulates anthocyanin biosynthesis through the Aux/IAA-ARF signaling pathway in apple.[J]. Horticulture Research,2018,1(5):59.
[44]GUIFOYLE T J, VLMASOV T, HAGEN G. The ARF family of transcription factors and their role in plant hormone-responsive transcription[J]. Cell Mol Life Sci,1998,54(7):619-627.
[45]JI X H, WANG Y T, ZHANG R. Effect of auxin, cytokinin and nitrogen on anthocyanin biosynthesis in callus cultures of red-fleshed apple[J]. Plant Cell,Tissue and Organ Culture (PCTOC),2015,120(1):325-337.
[46]SUPRASANNA P, RAO K V, REDDY G M. Anthocyanin synthesis during embryogenesis in vitro[J]. Plant Cell,1990,5(14):335-339.
[47]DAS P K, DONG H S, CHOI S B, et al. Cytokinins enhance sugar-induced anthocyanin biosynthesis in Arabidopsis[J]. Molecules & Cells,2012,34(1):93-101.
[48]VERSLUES, PAUL E. ABA and cytokinins: challenge and opportunity for plant stress research[J]. Plant Molecular Biology,2016,91(6):629-640.
[49]柳巧禛,席 奔,孫艳丽,等. 外源6-BA对葡萄果实花色苷含量及相关基因表达的影响[J].西北农林科技大学学报,2019,47(2):112-118.
[50]BULGAKOV V P, WU H C, JINN T L. Coordination of ABA and chaperone signaling in plant stress responses[J]. Trends in Plant Science,2019,24(7):636-651.
[51]于 淼,刘海峰,王 军. ABA对葡萄花色苷合成相关基因表达的影响[J]. 果树学报,2012,29(1):29-35.
[52]HIRATSUKA S, ONODERA H, KAWAI Y, et al. ABA and sugar effects on anthocyanin formation in grape berry cultured in vitro[J]. Scientia Horticulturae,2001,90(1/2):121-130.
[53]JIA H F, CHAI Y M, LI C L, et al. Abscisic acid plays an important role in the regulation of strawberry fruit ripening[J]. Plant Physiology,2011,157(1):188-199.
[54]COOMBE B G, HALE C R. The hormone content of ripening grape berries and the effects of growth substance treatments[J]. Plant Physiology,1973,51(4):629-34.
[55]肖瑞雪,郭丽丽,贾琦石,等. 油菜素内酯调控植物生长发育及产量品质研究进展[J]. 江苏农业科学,2019,47(10):16-21.
[56]马立娜,惠竹梅,霍珊珊,等. 油菜素内酯和脱落酸调控葡萄果实花色苷合成的研究[J]. 果树学报,2012,29(5):820-836.
[57]张睿佳,李 瑛,虞秀明,等. 高温胁迫与外源油菜素内酯对‘巨峰’葡萄叶片光合生理和果实品质的影响[J]. 果树学报,2015,32(4):72-78.
[58]肖永英,甘立军,夏 凯. 茉莉酸酯类和6-BA对葡萄果实品质的影响[J]. 江苏农业科学,2008(6):153-155.
[59]赵婉珍. 叶面喷施茉莉酸甲酯对美乐酿酒葡萄花色苷含量及合成酶的影响[D]. 兰州:甘肃农业大学,2017.
[60]WANG Y, LIU W, JIANG H, et al. The R2R3-MYB transcription factor MdMYB24-like is involved in methyl jasmonate-induced anthocyanin biosynthesis in apple[J]. Plant Physiology & Biochemistry,2019,139:273-282.
[61]DU H, ZHANG L, LIU L, et al. Biochemical and molecular characterization of plant MYB transcription factor family[J]. Biochemistry Biokhimiia,2009,74(1):1-11.
[62]ISHII S. Myb: structure and regulation of activity[J]. Tanpakushitsu Kakusan Koso Protein Nucleic Acid Enzyme,1996,41(8):1320-1327.
[63]ZIMMERMANN I M, HEIM M A, WEISSHAAR B, et al. Comprehensive identification of Arabidopsis thaliana MYB transcription factors interacting with R/B-like BHLH proteins[J]. Plant Journal,2010,40(1):22-34.
[64]LIN-WANG K, BOLITHO K, GRAFTON K, et al. An R2R3 MYB transcription factor associated with regulation of the anthocyanin biosynthetic pathway in Rosaceae[J]. Bmc Plant Biology,2010,10(1):50.
[65]余 敏. 獼猴桃花青苷着色——MYB调节基因的鉴定及其功能解析[D]. 北京:中国科学院大学,2020.
[66]JIANG S, CHEN M, HE N, et al. MdGSTF6, activated by MdMYB1, plays an essential role in anthocyanin accumulation in apple[J]. Horticulture Research,2019,6(1):40.
[67]牛铁泉,董燕梅,刘海霞,等. 葡萄果实MYBA1与UFGT、DFR的作用机制[J]. 中国农业科学,2018,51(12):149-158.
[68]GAO Y L, XIE L F, MA Y Y, et al. PpMYB15 and PpMYBF1 transcription factors are involved in regulating flavonol biosynthesis in peach fruit[J]. Journal of Agricultural & Food Chemistry,2018,67(2):644-652.
[69]董金皋,樊锦涛,蒋琛茜,等. 拟南芥R2R3-MYB家族22亚族的结构与功能分析[J]. 遗传,2014(10):985-994.
[70]HONG G Z, XI B, ZHU Y,et al. A single-repeat R3-MYB transcription factor MYBC1 negatively regulates freezing tolerance in Arabidopsis[J].Biochemical and Biophysical Research Communications,2010,394(4):1018-1023.
[71]SARA C, PIERDOMENICO P, SILVIA G. The atroviolacea gene encodes an R3-MYB protein repressing anthocyanin synthesis in tomato plants[J]. Frontiers in Plant Science, 2018,9:830.
[72]XU H, ZOU Q, YANG G, et al. MdMYB6 regulates anthocyanin formation in apple both through direct inhibition of the biosynthesis pathway and through substrate removal[J]. Horticulture Research,2020,7(72):3434.
[73]GAO J J, SHEN X F, ZHEN Z, et al. The myb transcription factor MdMYB6 suppresses anthocyanin biosynthesis in transgenic Arabidopsis[J]. Plant Cell Tissue & Organ Culture,2011,106(2):235-242.
[74]方智振,姜翠翠,周丹蓉,等. ‘秋姬李’PsMYB18基因克隆与功能分析[J]. 果树学报,2019,36(7):15-23.
[75]BOSS P K, DAVIES C, ROBINSON S P. Expression of anthocyanin biosynthesis pathway genes in red and white grapes[J]. Plant Molecular Biology,1996,32(3):565-569.
[76]CARRASCO D, LORENZIS G D, MAGHRADZE D, et al. Allelic variation in the VvMYBA1 and VvMYBA2 domestication genes in natural grapevine populations (Vitis vinifera subsp. sylvestris)[J]. Plant Systematics & Evolution,2015,301:1613-1624 .
[77]KOBAYASHI S, ISHIMARU M, DING C K, et al. Comparison of UDP-glucose:flavonoid 3-O-glucosyltransferase (UFGT) gene sequences between white grapes (Vitis vinifera) and their sports with red skin[J]. Plant Science,2001,160(3):543-550.
[78]WALKER A R, LEE E, BOGS J, et al. White grapes arose through the mutation of two similar and adjacent regulatory genes[J]. Plant Journal,2010,49(5):772-785.
[79]KOBAYASHI S. Retrotransposon-induced mutations in grape skin color[J]. Science,2004,304(5673):982.
[80]SPELT C. Anthocyanin1 of petunia encodes a basic helix-loop-helix protein that directly activates transcription of structural anthocyanin genes[J]. The Plont Cell,2000,12(9):1619-1632.
[81]ROBINSON K A, KOEPKE J I, MURTAZA K, et al. A network of yeast basic helix-loop-helix interactions[J]. Nucleic Acids Research,2000,28(22):4460-4466.
[82]MUHAMMAD, WASEEM, NING, et al. Overexpression of a basic helix-loop-helix transcription factor gene, SlbHLH22, promotes early flowering and accelerates fruit ripening in tomato (Solanum lycopersicum L.)[J]. Planta,2019,250:173-185.
[83]許海峰. bHLH33与MYB抑制子参与苹果花青苷生物合成的分子机理[D]. 山东:山东农业大学,2020.
[84]HICHRI I, HEPPEL S C, PILLET J, et al. The basic helix-loop-helix transcription factor MYC1 is involved in the regulation of the flavonoid biosynthesis pathway in grapevine[J]. Molecular Plant,2010,3(3):509-523.
[85]杨鹏程,周 波,李玉花. 植物花青素合成相关的bHLH转录因子[J]. 植物生理学报,2012,48(8):747-758.
[86]刘化禹. 蓝果忍冬花色苷合成bHLH转录因子筛选及LcTT8功能验证[D]. 哈尔滨:东北农业大学,2019.
[87]ESPLEY R V, HELLENS R P, PUTTERILL J, et al. Red colouration in apple fruit is due to the activity of the MYB transcription factor, MdMYB10[J]. Plant J,2010,49(3):414-427.
[88]CHAO X, MIN J. Structure and function of WD40 domain proteins[J]. Protein & Cell,2011,2(3):202-214.
[89]ZENG J, MA W, LU M, et al. Cloning and bioinformatics analysis of WD40 transcription factor RroTTG1 in rosa roxburghii tratt[J]. Molecular Plant Breeding,2019,17 (22 ):7331-7337.
[90]AN X H, YI T, CHEN K Q, et al. The apple WD40 protein MdTTG1 interacts with bHLH but not MYB proteins to regulate anthocyanin accumulation.[J]. Journal of Plant Physiology,2012,169(7):710-717.
[91]STRYGINA K V, KHLESTKINA E K. Structural and functional organization and evolution of the WD40 genes involved in the regulation of flavonoid biosynthesis in the triticeae tribe[J]. Russian Journal of Genetics,2019,55(11):1398-1405.
[92]ROUHOLAMIN S, ZAHEDI B, NAZARIAN-FIROUZABADI F, et al. Expression analysis of anthocyanin biosynthesis key regulatory genes involved in pomegranate (Punica granatum L.)[J]. Scientia Horticulturae,2015,186:84-88.
[93]ZAHAR B S, SYLVIE J, TALIA N H. A pomegranate (Punica granatum L.) WD40-repeat gene is a functional homologue of Arabidopsis TTG1 and is involved in the regulation of anthocyanin biosynthesis during pomegranate fruit development[J]. Planta,2011,234(5):865-881.
[94]LI S, REVIEW C A I. Transcriptional control of flavonoid biosynthesis: fine-tuning of the MYB-bHLH-WD40 (MBW) complex[J]. Plant signaling & behavior,2014,9(1):e27522.
[95]NOCKER S V, LUDWIG P. The WD-repeat protein superfamily in Arabidopsis: conservation and divergence in structure and function[J]. Bmc Genomics,2003,4(1):50.
[96]LIU X, HAO F C, ZHANG M, et al. The MrWD40-1 gene of chinese Bayberry (Myrica rubra) interacts with MYB and bHLH to enhance anthocyanin accumulation[J]. Plant Molecular Biology Reporter,2013,31(6):1474-1484.
[97]GU Z, ZHU J, HAO Q, et al. A Novel R2R3-MYB transcription factor contributes to petal blotch formation by regulating organ-specific expression of PsCHS in tree peony (Paeonia suffruticosa)[J]. Plant and Cell Physiology,2019,3:599-611.
[98]王懷琴. 丹参中调控丹酚酸B生物合成的MYB-bHLH-WD40三元复合体的鉴定[D]. 西安:陕西师范大学,2017.
[99]YAMAGISH M, SHIMOYAMADA Y, NAKATSUKA T, et al. Two R2R3-MYB genes, homologs of petunia AN2, regulate anthocyanin biosyntheses in flower tepals, tepal spots and leaves of asiatic hybrid lily[J]. Plant and Cell Physiology,2010,51(3):463-474.
[100]刘晓芬. MYB-bHLH-WD40对杨梅花青苷生物合成的转录调控机制[D]. 杭州:浙江大学,2013.
[101]LAI B, DU L N, RUI L, et al. Two LcbHLH transcription factors interacting with LcMYB1 in regulating late structural genes of anthocyanin biosynthesis in nicotiana and litchi chinensis during anthocyanin accumulation[J]. Frontiers in Plant Science,2016,7:166.
[102]SHEN X, KAI Z, LIU L, et al. A role for PacMYBA in ABA-regulated anthocyanin biosynthesis in Red-colored sweet cherry cv. Hong Deng (Prunus avium L.)[J]. Plant and Cell Physiology,2014,55(5):862-880.
[103]徐 僡,郑远静,高方平,等. 花色苷的生物合成及其影响因素研究进展[J]. 江苏农业学报,2019,35(5):1246-1253.
[104]刘闯萍,王 军. 葡萄花色苷的生物合成[J]. 植物生理学报, 2008, 44(2):363-377.
[105]HU J, FANG H, WANG J, et al. Ultraviolet B-induced MdWRKY72 expression promotes anthocyanin synthesis in apple[J]. Plant Science,2020,292:110377.
[106]FANG H, DONG Y, YUE X, et al. The B-box zinc finger protein MdBBX20 integrates anthocyanin accumulation in response to ultraviolet radiation and low temperature[J]. Plant Cell and Environment,2019,42(7):2090-2104.
[107]ZHOU H, WANG K L, WANG H L,et al. Molecular genetics of blood-fleshed peach reveals activation of anthocyanin biosynthesis by NAC transcription factors[J]. The Plant Journal,2015,82(1):105-121.
[108]LI C, WU J, HU K D, et al. PyWRKY26 and PybHLH3 cotargeted the PyMYB114 promoter to regulate anthocyanin biosynthesis and transport in red-skinned pears[J]. Horticulture Research,2020,7:37.
[109]WANG Y, ZHANG X, ZHAO Y, et al. Transcription factor PyHY5 binds to the promoters of PyWD40 and PyMYB10 and regulates its expression in red pear ′Yunhongli No. 1′[J]. Plant Physiology and Biochemistry,2020,154:665-674.
[110]JIANG S, SUN Q, ZHANG T, et al. MdMYB114 regulates anthocyanin biosynthesis and functions downstream of MdbZIP4-like in apple fruit[J]. Journal of Plant Physiology,2020,257:153353.
[111]MAO Z, JIANG H, WANG S, et al. The MdHY5-MdWRKY41-MdMYB transcription factor cascade regulates the anthocyanin and proanthocyanidin biosynthesis in red-fleshed apple[J]. Plant Science,2021,306:110848.
[112]SUN Q, JIANG S, ZHANG T, et al. Apple NAC transcription factor MdNAC52 regulates biosynthesis of anthocyanin and proanthocyanidin through MdMYB9 and MdMYB11[J]. Plant Science,2019,289: 110286.
[113]ZHANG T, XU H, YANG G, et al. Molecular mechanism of MYB111 and WRKY40 involved in anthocyanin biosynthesis in red-fleshed apple callus[J]. Plant Cell,Tissue and Organ Culture (PCTOC),2019,139(3):467-478.
[114]ZHANG S, CHEN Y, ZHAO L, et al. A novel NAC transcription factor, MdNAC42, regulates anthocyanin accumulation in red-fleshed apple by interacting with MdMYB10[J]. Tree Physiology,2020,40(3):413-423.
[115]JIANG G X, LI Z W, SONG Y B, et al. LcNAC13 Physically interacts with LcR1MYB1 to coregulate anthocyanin biosynthesis-related genes during litchi fruit ripening[J]. Biomolecules,2019,9(4),135.
[116]賈海锋,刘众杰,赵鹏程,等. 转录因子ABI4调控草莓果实成熟的分子机制[J]. 南京农业大学学报,2015,38(6):908-914.
[117]易 勇,郑 瑞,杨 波,等. 水稻锌指蛋白基因CRISPR/Cas9突变体的构建及突变分析[J].南方农业学报,2020,51(11):2607-2613.
[118]范德佳,陈士强,王建华,等. 利用CRISPR/Cas技术改良作物抗病性的研究进展[J].江苏农业学报,2020,36(5):1312-1321.
[119]李星坤,潘 慧,李 攀,等.基于CRISPR/Cas9系统的拟南芥ugt84a1/ugt84a2双突变体制作及突变位点分析[J].江苏农业科学,2020,48(20):49-55.
(责任编辑:蒋永忠)
1582501186394

