葡萄糖添加对不同演替阶段森林土壤微生物及酶化学计量特征的影响
王润超, 陈佳瑞, 王国梁
(1.西北农林科技大学 水土保持研究所, 陕西 杨凌712100; 2.中国科学院 水利部 水土保持研究所, 陕西 杨凌712100)
近些年随着现代技术手段的发展与相关学科的发展,对森林根系活动和根际微区域的认识不断深入,根际研究得到了进步和发展。众所周知,根际在化学、物理和生物学上都是复杂的[1],植物可以通过根系主动或被动地向周围土壤释放一系列化合物,即根系分泌物,根系分泌物由低分子量 (糖、有机酸和氨基酸)和高分子(蛋白质、黏液等)等有机物质组成[2],它们主动或被动地从根细胞中向周围土壤释放,这些渗出物中低分子化合物对微生物至关重要[3],因为它们不需要合成胞外酶就能被吸收,所以这些化合物是土壤异养生物的有效碳源[4],而且根系分泌物对土壤微生物区系组成和活性影响的研究由于根系分泌物中含有复杂的有机化合物混合物而变得复杂[5]。因此森林根系分泌物对所在根际微区域内的根系-土壤-微生物的影响成为了全球生态系统碳氮循环研究过程中一个重要环节[6],亟待我们研究其中的机理[7]。
目前,在根系分泌物对森林生态系统的激发效应和碳氮循环方面已有研究,但根系分泌物中单个组分在多大程度上影响驱动土壤物质循环和微生物群落变化的生物和非生物过程目前仍不清楚[8]。此外,有关森林根系分泌物研究大都仅关注了根系碳源输入,而忽略了根系分泌物中碳源浓度梯度变化对森林生态系统土壤养分循环的影响,这种忽略将极大地限制对森林根系-土壤-微生物互作机制的深入认识[9]。因此开展根系分泌物碳源浓度梯度变化对森林土壤微生物及酶化学计量特征的影响成为一个十分重要但又极度缺乏的研究课题,尤其在不同森林生态系统中。
黄土高原地处黄河中游,位于我国由东南湿润、半湿润气候向干旱、半干旱气候过渡的中间地带,该地区面临退化生态系统植被恢复的问题[10]。加速黄土高原地区森林生态系统的恢复与重建,对改善西北地区生态环境具有极其重要的意义。因此本研究以黄土高原不同森林生态系统土壤为研究对象,通过人工添加不同浓度的葡萄糖于山杨、油松和辽东栎土壤中,研究不同森林生态系统中酶化学计量对根系分泌物中糖类的响应机制,为更加科学阐明土壤碳输入增加对生态系统的影响提供理论支持。
1 研究区域与研究方法
1.1 研究区概况
实验样地位于陕西省宜川县铁龙湾村,属于黄土丘陵区。该地属于暖温带半湿润易旱气候区[11],全年气候变化受制于季风环流,夏季炎热多雨,降水量312.3 mm,7月最高气温29.7℃,1月最低气温-6.4℃。山杨林和辽东栎林为当地原始自然植被,油松林为人工林,1963年植造。土壤主要以灰褐色森林土为主。
1.2 研究方法
1.2.1 土壤采样 每种林地中设置5块立地条件相同的样方,大小为20 m×10 m,相同植物样地内样方至少相距20 m。在每个样方内使用土钻“S”型随机取10~15个位点的0—20 cm土层土壤,放入自封袋中,做好标记后放入低温(4℃左右)冰箱中,尽快运回实验室进行试验。回到实验室后将新鲜土壤样品过2 mm筛,立即进行室内培养试验。每种植物土壤分别称取80 g土放入500 ml梅森瓶中,每个土样设置3个重复,每个培养瓶土壤水分含量保持在最大田间持水量的60 %,培养温度为25℃。试验共4个处理,分别添加葡萄糖为0.1,0.5,1 g/kg干土,分别表示为C0.1,C0.5,C1,以及无添加物的对照处理(CK)。每隔7 d添加一次葡萄糖,对照组添加等量蒸馏水,培养35 d后进行破坏性取样。
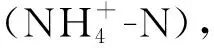
1.2.3 微生物生物量测定 微生物量碳(MBC)和微生物氮(MBN)用氯仿熏蒸提取法测定。每种浓度下均称取四份土壤样品,每份2.5 g,其中2份用40 ml 0.5 mol/L的K2SO4溶液萃取,另外2份样品在真空干燥器中用氯仿避光熏蒸24 h,采用与未熏蒸样品相同的提取过程。用总有机碳分析仪测定浸提液中的总溶解有机碳和总溶解氮。微生物量碳和氮值乘以转换系数(kC=0.38,kN=0.45)。土壤微生物量磷(MBP)通过氯仿熏蒸提取法测定。称取四份土壤样品,每份土壤样品2.5 g,其中2份直接用50 ml的0.5 mol/L的NaHCO3(pH=8.5,用NaOH调节)提取,另外两份熏蒸过程与上述MBC和MBN一致,并用紫外分光光度计测定浸提液中的总溶解磷(kP转换系数为0.4)。MBC,MBN和MBP均为熏蒸样品和未熏蒸样品的差值。
1.2.4 酶测定 称取3 g鲜土置于125 ml pH=8.2 Tris-HCl溶液中,并用磁选搅拌器搅拌5 min,充分混匀浆水,边搅拌边将150 μl土壤悬浮液和50 μl底物溶液加入到96微孔培养板中;阴性对照为150 μl Tris-HCl和50 μl底物溶液;标准微孔为50 μl 10 μmol/L的4-甲基伞形酮(MUB)或7-氨基-4-甲基香豆素(AMC)和150 μl Tris-HCl缓冲液;淬火微孔为50 μl标准物质和150 μl土壤悬浮液;空白微孔加入50 μl不同酶底物溶液和150 μl Tris-HCl的缓冲液。用German[13]的方法计算酶活性,分别将加完溶液的微孔板放在25℃温度下培养0.5 h(AP),2 h(LAP和BG)和4 h(NAG)。培养结束后,加入10 μl lmol/LNaOH终止反应,使用多功能酶标仪测定荧光值,激发波长为365 nm,发射波长为450 nm。
1.2.5 数据分析 利用SPSS 24.0和Excel软件进行数据处理和统计分析,对同一植被类型不同处理下、同一浓度不同植被类型下各土壤指标进行单因素方差分析((one-way ANOVA)并采用最小显著性差异法(LSD)进行多重比较;使用Canoco 5.0进行冗余分析(RDA),揭示各土壤因子对土壤酶及其化学计量的影响。所有图形均使用Origin 9.0进行绘制。
2 结果与分析
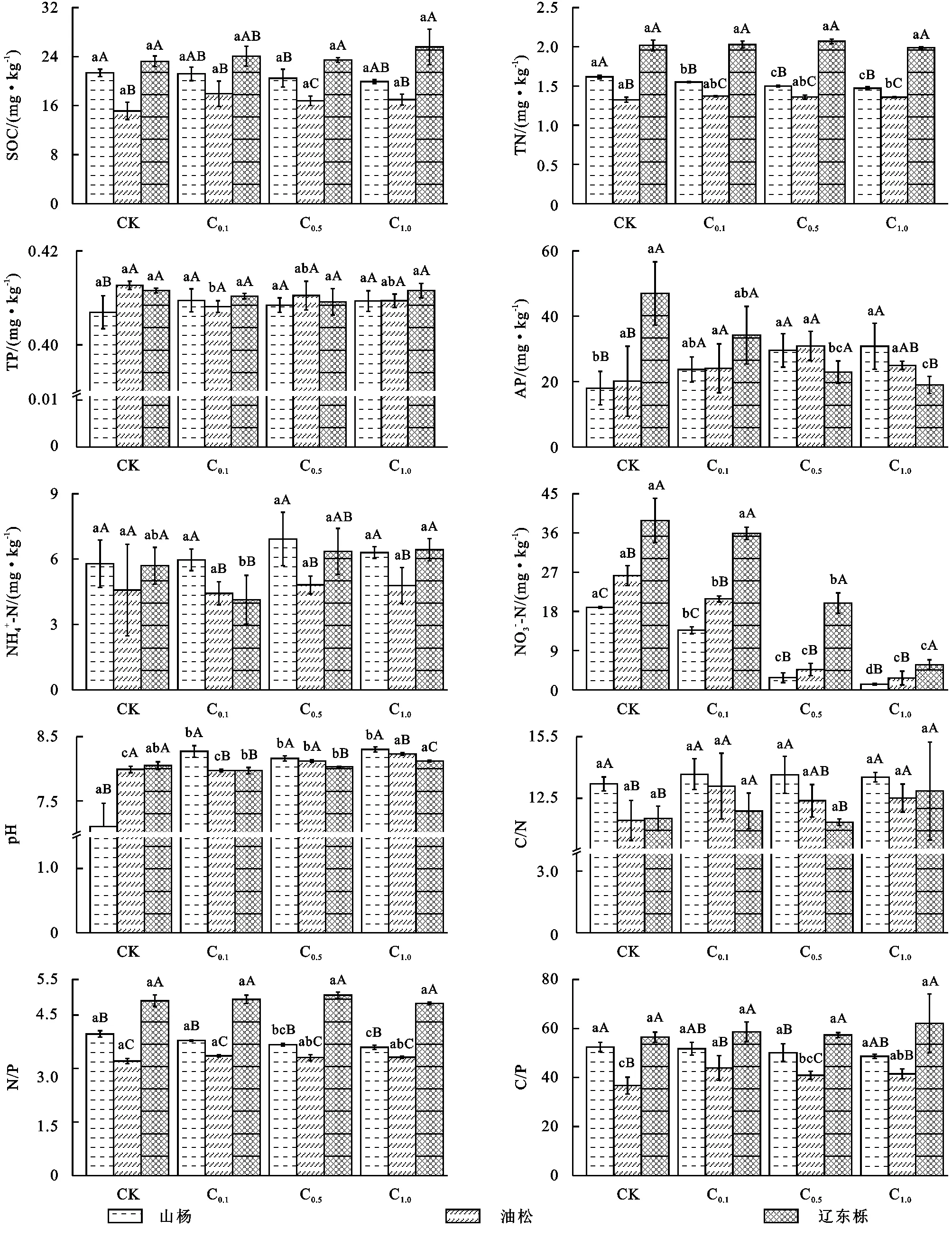
2.1 葡萄糖添加对不同演替阶段森林土壤理化性质的影响


2.2 葡萄糖添加对不同演替阶段森林土壤微生物量及化学计量特征的影响
葡萄糖添加显著改变了不同演替阶段森林土壤微生物量C,N,P及其化学计量(图2)。随着森林演替,山杨林和辽东栎林微生物碳(MBC)和微生物氮(MBN)的值显著大于油松林,均为先减小后增加。随着森林演替,山杨林和辽东栎林微生物碳(MBC)和微生物氮(MBN)的值显著大于油松林,均为先减小后增加。MBN,MBP含量为辽东栎林显著大于山杨林,大于油松林。MBC,MBC/MBP含量为山杨林显著大于辽东栎林,辽东栎林显著大于油松林。MBC/MBN含量为山杨林大于油松林和辽东栎林,MBN/MBP则与此完全相反。
注:图中数值为平均值±标准误差,不同小写字母代表不同浓度相同植物间的显著差异,不同大写字母代表不同植物相同浓度间的显著差异,下同。
随着葡萄糖浓度的增加,3种植物MBC和MBN均呈增加趋势,山杨林MBC在C1增幅最大为14.9%,油松林在C0.5增幅最大为28%,辽东栎林在C0.1增幅最大为30%。3种森林土壤MBN均在26.2~40.2之间波动。山杨林的MBC/MBN先增加后减小,油松林与之相反,辽东栎林则一直增加。
山杨林的MBC/MBN与MNC/MBP显著大于油松林和辽东栎林。沿葡萄糖浓度梯度山杨林的MBN/MBP一直增加,油松林为先减少后增加,辽东栎林则为先增加后减小。
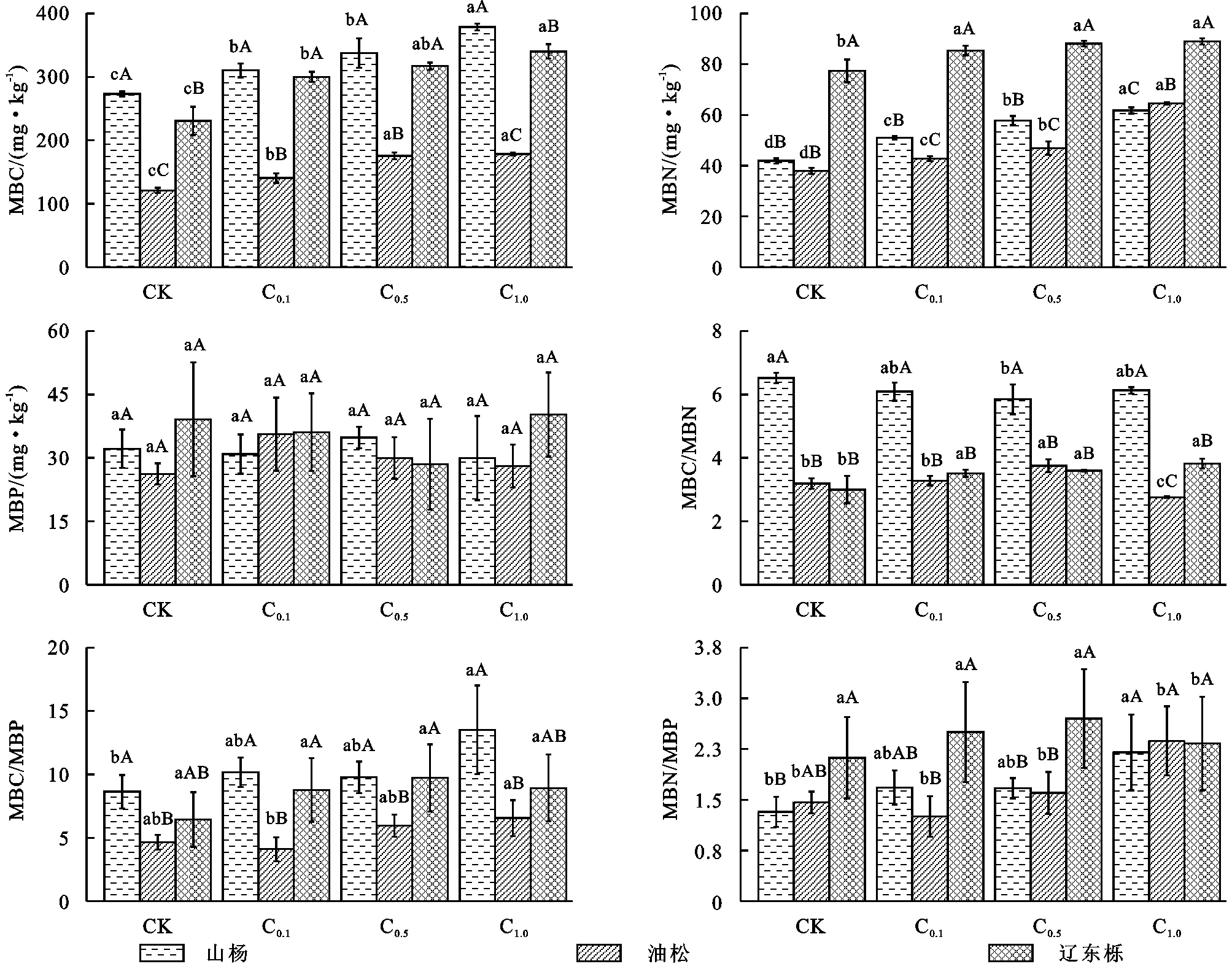
图2 微生物量及化学计量随葡萄糖浓度增加的变化
2.3 葡萄糖添加对不同演替阶段森林土壤酶活性及其化学计量特征的影响
由图3看出,演替不同阶段的林地BG,LAP,NAG,BG/(LAP+NAG)、BG/AP、(LAP+NAG)/AP含量均为辽东栎林大于山杨林,大于油松林。而AP含量则为山杨林大于辽东栎林,大于油松林。随葡萄糖浓度的增加,山杨林AP和NAG活性先减小后增加,BG和LAP活性均呈持续下降。油松林AP和NAG活性先增加后减小,BG活性呈波动趋势,LAP活性先减小后增加。辽东栎林AP,BG,LAP和NAG活性均先增加后减小,且辽东栎林4种酶活性均显著高于其他两种植物。BG/(LAP+NAG)中,山杨林持续减少,油松林先增加后减少,辽东栎林为一定范围内波动。BG/AP中山杨林和辽东栎林均为持续下降,油松林在一定范围内波动。辽东栎林BG/(LAP+NAG),BG/AP显著高于其他油松林和山杨林。山杨林和辽东栎林的(LAP+NAG)/AP均先增加后减小,油松林则为先减小后增大。在对土壤酶活性数据进行标准化处理后,辽东栎林lnBG/ln(LAP+NAG),lnBG/lnAP在各个浓度均显著大于油松林与山杨林。
2.4 土壤微生物量、酶与影响因子之间的关系
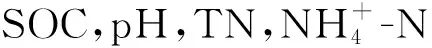
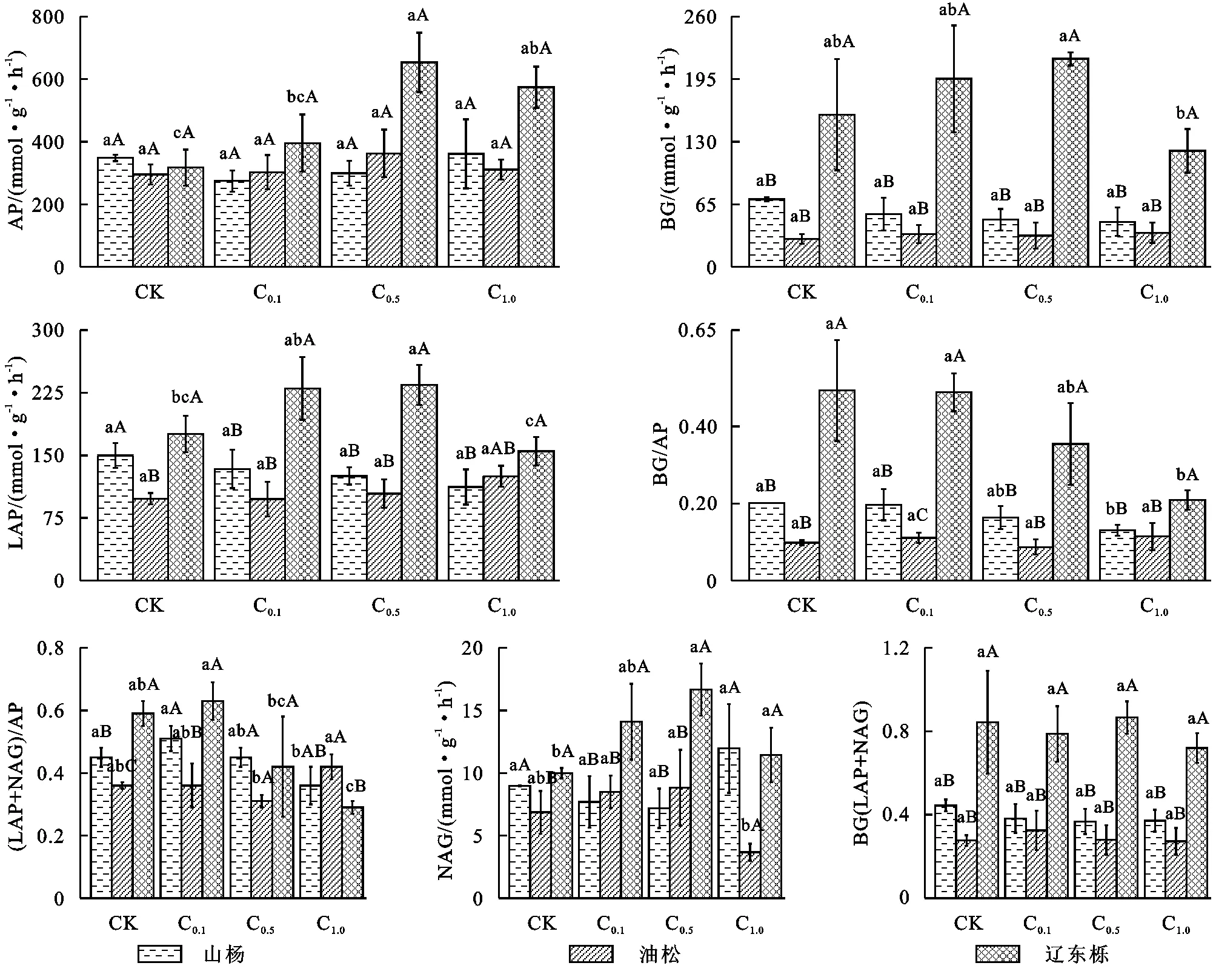
图3 土壤酶活性及化学计量随葡萄糖浓度增加的变化
3 讨 论
3.1 葡萄糖对土壤理化性质、微生物量及土壤酶活性的影响


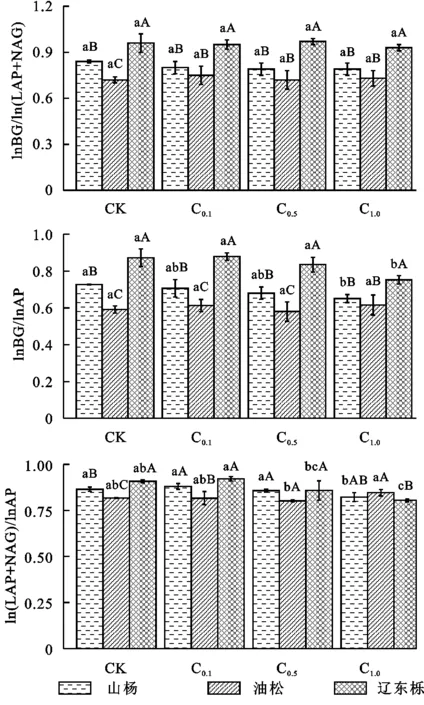
图4 土壤酶化学计量随葡萄糖浓度增加的变化
细胞外酶化学计量学(酶的相对丰度)反映了微生物对养分的需求和环境对养分的供给[18],在生态系统的生物地球化学平衡过程中起着关键作用。然而,不同土壤养分对酶活性的影响仍有争议,本试验中3种林分土壤酶活性与CK相比,均随葡萄糖浓度增加而升高。根系分泌物C源输入中小分子化合物为易于土壤微生物直接利用的含碳有机物,C源添加改变了土壤C/N与N/P,研究结果表明C源输入改变土壤养分的有效性,进而调节微生物的生理代谢,并最终反映在生态酶的表达中。土壤养分状况影响生态酶的产生和活性这可以用“资源配置理论”解释[19],即资源的可获得性调节微生物和植物合成和分泌生态酶。

图5 土壤酶及微生物量与各因子之间的关系
3.2 葡萄糖对不同森林生态系统土壤酶化学计量特征及微生物养分限制的影响
在本研究中,RDA结果表明,土壤酶、微生物量及其化学计量比分别与AP,TN,AMN有着显著性正相关关系,此外与土壤SOC和MBC呈显著正相关,说明不同林地在P元素水平一致的情况下,SOC,TN的变化显著影响土壤酶活性。随着葡萄糖浓度增加,土壤MBC含量增加,土壤酶C/P比值增加,土壤N和P的有效性改变,土壤微生物会增加参与N和P循环的酶的产生,以满足他们对这些营养元素的需求[20]。在各葡萄糖浓度,辽东栎林和山杨林土壤N/P及土壤酶N/P均显著大于油松林土壤,说明油松林比山杨林和辽东栎林具有更强的N显著。此外,3种林地土壤酶活性中,辽东栎林在C0.5的N/P减小的幅度最大,为35%,且AP活性在C0.5,C1增加最多,说明高浓度葡萄糖加剧了辽东栎林土壤的P限制。此外,随葡萄糖浓度增加,辽东栎林微生物增加量显著大于山杨林与辽东栎林,微生物的增加也加剧了P限制。这与Ren等[21]研究结果一致,P是一种“岩石衍生”元素,很难从大气中大量获取。碱性土壤中植物的消耗以及钙和镁离子的吸附导致植被演替过程中磷的生物利用度显著下降[22],从而导致P限制。
土壤pH值也与土壤生态酶活性和化学计量显著相关,因为每种土壤生态酶都有自己的最佳pH值[23]。在本研究中,土壤pH值与AP呈负相关,但与土壤C/P和N/P呈正相关。低pH值条件会增强P的地球化学吸附并阻止P在土壤中的迁移[24],导致土壤P的有效性下降。这种现象最终刺激土壤微生物响应磷的需求而合成更多的AP酶[20]。然而,土壤pH值与BG和NAG+LAP呈负相关,这与Xu等获得的结果相反。这些差异可能是由于两项研究之间的土壤pH值范围差异引起的。例如,在我们的研究中,高浓度葡萄糖添加均增加了3种林分土壤pH值,使得pH值的范围在7.42~8.41,在Xu等的研究中,pH值的范围为5.43~6.93。总而言之,外源性碳添加对生态酶活性和化学计量的影响是通过影响土壤物理性质,间接影响植物和微生物的细胞代谢以及间接调节环境养分利用率来实现的。
本文研究发现,葡萄糖显著影响了3种植物土壤酶化学计量C/N和N/P与土壤C/P和N/P,这与前人的研究一致[25]。添加葡萄糖能使微生物数量增加,微生物量数量与葡萄糖浓度呈正比,土壤酶活性化学计量会随土壤和微生物量化学计量的变化而发生变化。这说明土壤胞外酶活性并不是处于动态平衡状态之中,而是依赖于土壤和微生物生物量的化学计量。因此,葡萄糖影响不同演替阶段的植物土壤酶活性化学计量是通过土壤-微生物反馈与土壤养分循环共同影响。
4 结 论
总之,葡萄糖添加处理促进了3种林分土壤激发效应而降低了土壤TN含量,且增加了油松林的N限制和辽东栎林的P限制。因此植物根系分泌物中碳的输入可能降低了森林土壤养分活性,增加微生物数量的同时,增加土壤N,P元素的限制,进而影响根际土壤有机质分解和养分代谢等过程。但需要说明的是,我们的研究中模拟根系分泌物葡萄糖添加处理时间仅持续35 d,为进一步探究根系分泌物碳输入对森林演替过程的长期影响,需要我们进一步深入开展根系分泌物对森林生态系统根际范围内的长期野外碳原位添加的研究。

