T2/FLAIR错配征的定量参数在评价较低级别胶质瘤分子分型的诊断价值
王瀚苇,吴 昊,田 静,张俊峰,钟 鹏,陈立朝,王舒楠
2/FLAIR错配征的定量参数在评价较低级别胶质瘤分子分型的诊断价值
王瀚苇1,2,吴 昊1,2,田 静1,2,张俊峰1,2,钟 鹏3,陈立朝4,王舒楠1,2*
1.陆军军医大学大坪医院 放射科,重庆 400042;2.重庆市影像学与核医学临床研究中心,重庆 400042;3.陆军军医大学大坪医院 病理科,重庆 400042;4.陆军军医大学大坪医院神经外科,重庆 400042
本文回顾性分析19例经病理证实为WHO II-III级且具有2/FLAIR错配征的脑胶质瘤患者.从患者的影像数据中提取肿瘤区整体特征和错配区影像参数进行定量分析,探讨2/FLAIR错配征在评价异柠檬酸脱氢酶(IDH)突变伴1p/19q未联合缺失型(IDHMUT/1p/19q+)较低级别胶质瘤(LGG)的诊断效能.本研究表明,整体及部分2/FLAIR错配征可作为预测IDHMUT/1p/19q+LGG的影像标志物.肿瘤区整体影像特征联合错配区定量参数有助于提高对IDHMUT/1p/19q+LGG的诊断效能.
磁共振成像(MRI);2/FLAIR错配征;分子分型;较低级别胶质瘤;定量参数
引 言
胶质瘤是颅内最常见的原发性肿瘤.随着2016年世界卫生组织(world health organization,WHO)对中枢神经系统肿瘤分类的更新,分子分型特征被引入胶质瘤的诊断标准[1],传统的组织病理学分类已转变为以分子特征为主的分子病理学分类.针对胶质瘤的分级,2016年WHO中枢神经系统肿瘤分类依然根据胶质瘤的恶性程度将其分为4级.癌症基因图谱(the cancer genome atlas,TCGA)数据库基于WHO II-III级胶质瘤的全基因组分子数据分析表明,WHO II-III级胶质瘤因其生物学基础与WHO IV级胶质瘤不同,可将其定义为较低级别胶质瘤(lower-grade gliomas,LGG)[2].目前,异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)突变、1p/19q缺失、O6-甲基鸟嘌呤-DNA甲基转移酶(O6-methylguanine-DNA methyltransferase,MGMT)甲基化、地中海贫血伴智力低下综合征X连锁(-thalassemia mental retardation X-linked,ATRX)缺失在临床中广泛应用,并作为指导胶质瘤治疗和预后评估的重要依据.利用IDH与1p/19q可以将LGG分为3个类别:IDH突变伴1p/19q未联合缺失型(IDH-mutant and 1p/19q non-codeleted,IDHMUT/1p/19q+)、IDH突变伴1p/19q联合缺失型(IDH-mutant and 1p/19q co-deleted,IDHMUT/1p/19q-)以及IDH野生型(IDH-wildtype,IDHWT)[2].如何利用影像学手段准确预测胶质瘤的分子分型是近年来研究的热点.2/FLAIR错配征作为一种易于观测且观察者间具有较高一致性的影像学特征,被证明能有效预测LGG分子分型.Patel等[3]首次将2/FLAIR错配征定义为胶质瘤组织存在特定的T2WI高信号区域,该区域大部分信号能被FLAIR序列有效抑制,周边可见FLAIR高信号环的一种磁共振征象,并提出2/FLAIR错配征在预测IDHMUT/1p/19q+LGG中具有高度特异性.随后,Broen等[4]证实2/FLAIR错配征可作为预测IDH突变型星形细胞瘤的高度特异性影像标志物.尽管2/FLAIR错配征具有较高的特异性,但敏感性较低,不少研究[5-7]报道了该征象在预测LGG分子分型中存在较高的假阳性.同时,对2/FLAIR错配征的图像识别标准也存在争议,多数研究者认为错配征应包含整个瘤体,且信号均匀[3,8-12].而Throckmorton等[13]研究发现部分错配征对IDH突变型星形细胞瘤同样具有较高的预测价值.目前,国内对2/FLAIR错配征的相关研究甚少,并且部分错配征是否对IDHMUT/1p/19q+LGG具有预测价值尚未得到验证.
本研究拟通过回顾性分析具有2/FLAIR错配征的LGG影像数据,探讨2/FLAIR错配征在预测LGG分子分型中的诊断价值,并提取肿瘤区整体特征(如瘤周水肿、肿瘤边缘、强化)和错配区影像参数(如相对错配面积、2/FLAIR错配率)进行定量分析,进一步明确错配征的图像识别标准,提高该磁共振征象在预测LGG分子亚型中的诊断效能.
1 材料与方法
1.1 临床资料与分组标准
回顾性分析2017年1月~2020年10月之间在大坪医院经术后病理证实为WHO II-III级且具有整体或部分2/FLAIR错配征(整个瘤体或瘤体部分区域在T2WI呈高信号,FLAIR呈相对低信号,错配区域不包括明显囊变、坏死及水肿)的19例LGG患者临床及影像资料,此19例LGG患者自125例病理证实为WHO II-III级的胶质瘤患者中筛选出来.所有患者均为首诊,术前未接受过任何治疗,磁共振图像质量满足评估要求.本研究经本院伦理委员会机构审查和批准.
根据2016年WHO中枢神经系统肿瘤分类方法,引入IDH及1p/19q作为重要的分类标准[1].依据分子分型特征将19例患者分为两组,其中分子诊断为IDHMUT/1p/19q+LGG归类于阳性组(=9);分子诊断为IDHMUT/1p/19q-或IDHWTLGG归类于假阳性组(=10).
1.2 图像采集及影像数据分析
所有患者均采用Siemens Verio 3.0T超导型磁共振扫描仪和8通道头颅线圈.
常规MRI扫描包括:(1)快速小角度激发1加权(fast low angle shot1-weighted,FLASH-T1WI)序列,脉冲重复时间(repetition time,TR)=250 ms,回波时间(time of echo,TE)=2.7 ms,矩阵=320×256,层厚=5 mm,视野(field of view,FOV)=230 mm×230 mm,翻转角为90˚);(2)快速自旋回波2加权(turbo spin echo2-weighted,TSE-T2WI)序列,TR=4 900 ms,TE=100 ms,矩阵=320×320,层厚=5 mm,FOV=230 mm×230 mm,翻转角为150˚;(3)2加权液体衰减反转恢复(2-weighted fluid attenuation inversion recovery,FLAIR)序列,TR=8 000 ms,TE=94 ms,矩阵=256×256,层厚=5mm,FOV=230 mm×230 mm,反转时间为2 371ms,翻转角为150˚.
增强扫描使用造影剂钆喷替酸葡甲胺(Gd-DTPA),经静脉团注,剂量为0.2 mL/kg,流速为3 mL/s,扫描参数同T1WI一致.
原始图像导入Siemens Syngo工作站,由两名神经放射学医师在对分组、组织学及分子检测结果未知的情况下独立对肿瘤区及错配区进行图像分析.对瘤周水肿、肿瘤边缘及强化特征进行分析.水肿定义为在T2WI及FLAIR上呈高信号,增强扫描无强化.肿瘤边缘以清楚、模糊区分.强化定义为注射造影剂后肿瘤错配区域对造影剂的摄取.对错配区影像特征进行定量分析,取肿瘤最大层面对错配区及整体肿瘤区进行面积勾画,错配区面积与整体肿瘤区面积的比值定义为相对错配面积.采用热点法在肿瘤的最大层面,放置至少3个圆形感兴趣区域(region of interest,ROI)于常规序列(T2WI、FLAIR)的错配区,ROI大小为5~15 mm².ROI的放置要避免大血管、脑膜、明显的出血、囊变、坏死及水肿区域.同时在常规序列(T2WI、FLAIR)的对侧正常的半卵圆中心放置ROI,将其值作为参考基准.常规序列(T2WI、FLAIR)错配征区域信号值与对侧正常的半卵圆中心信号值的比值为相对信号值(2、FLAIR).使用以下等式计算2/FLAIR错配率:
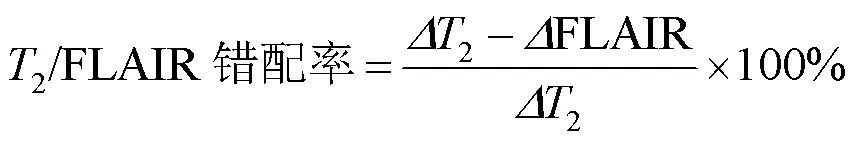
1.3 统计学分析
采用IBM SPSS 26.0统计软件对数据进行分析.定量参数表示为均数±标准差.观察者之间的一致性采用Kappa检验:Kappa值>0.6定义为一致性较高,0.41~0.6定义为中度一致性,Kappa值≤0.4定义为一致性差.Fisher确切概率法用于分析阳性组及假阳性组中肿瘤区整体特征的统计学差异.独立样本检验用于分析阳性组与假阳性组之间错配区定量参数的统计学差异.对差异有统计学意义的定量参数绘制受试者工作曲线(receiver operating characteristic curve,ROC)评价错配区定量参数对IDHMUT/1p/19q+LGG的诊断效能,得到相应的敏感度、特异度及曲线下面积(area under curve,AUC).
<0.05表示差异有统计学意义.
2 结果与讨论
2.1 研究样本一般临床资料描述
具有2/FLAIR错配征(图1、图2)的19例LGG患者一般临床资料统计如表1所示,其中男性13例、女性6例,年龄为(41.00±13.14)岁.其中9例IDHMUT/1p/19q+、9例IDHMUT/1p/19q-、1例IDHWT;WHO II级15例、WHO III级4例.
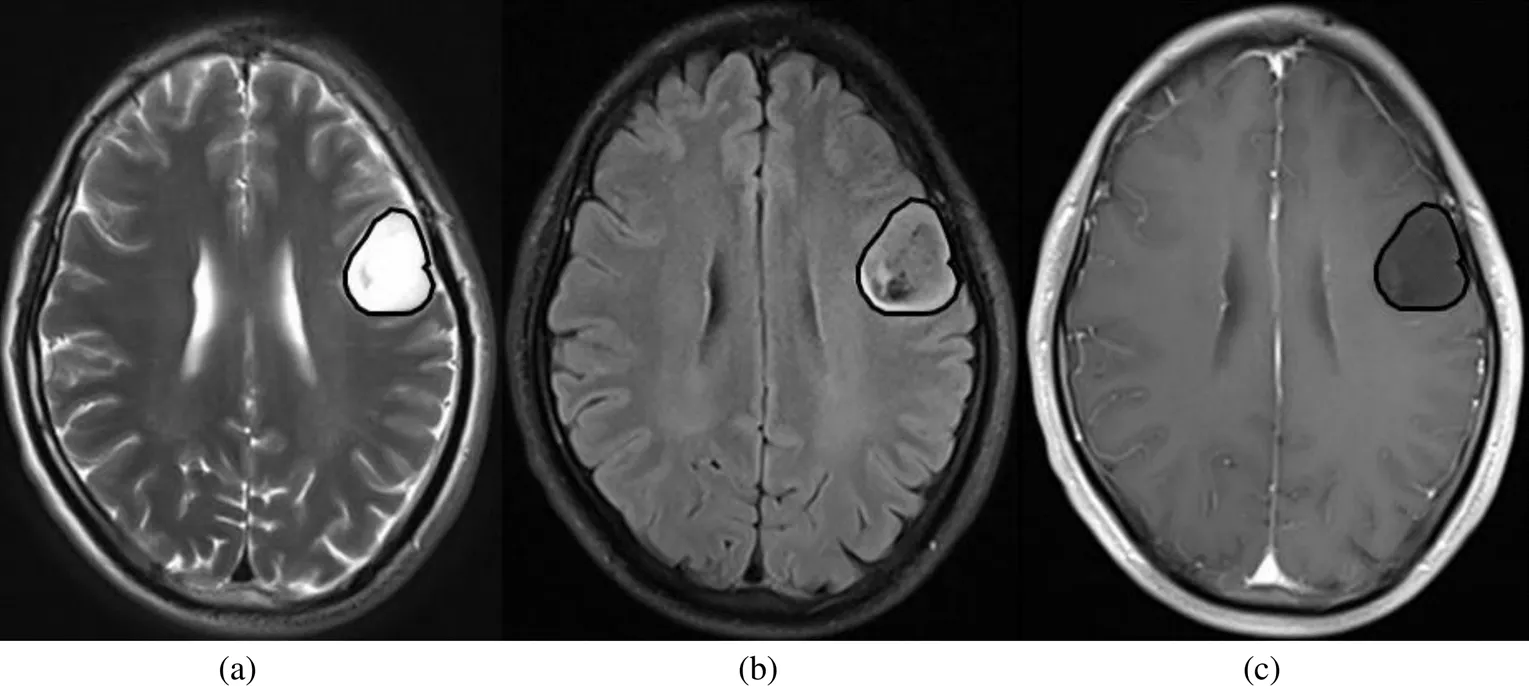
图1 整体T2/FLAIR错配征的ROI勾画,左侧额叶弥漫性星形细胞瘤IDHMUT/1p/19q+,WHO II级.(a)轴位T2WI,病变呈高信号,边界清晰,周围脑组织未见明显水肿;(b)轴位FLAIR,除边缘高信号环外,大部分瘤区与T2WI比呈相对低信号;(c) 轴位T1增强,病变未见明显强化

图2 部分T2/FLAIR错配征的ROI勾画,左侧颞顶岛叶少突胶质细胞瘤IDHMUT/1p/19q-,WHO II级.(a)轴位T2WI,病变呈混杂信号,边界欠清,周围脑组织见少许水肿.瘤体部分区域呈高信号;(b)轴位FLAIR,病变以混杂信号为主.部分区域呈相对低信号(除外明显囊变、坏死及水肿);(c)轴位T1增强,错配区域病变未见明显强化
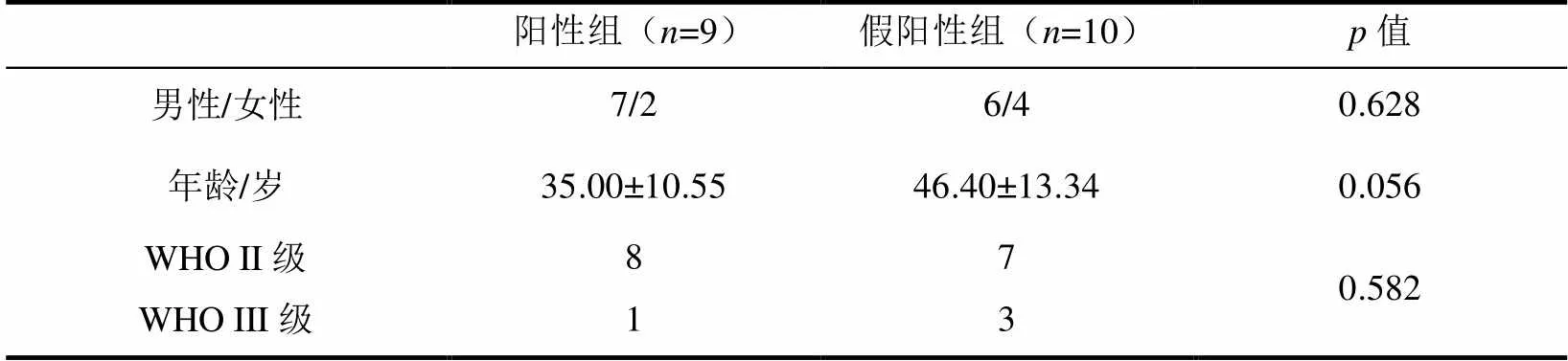
表1 19例具有错配征的患者一般临床资料
2.2 阳性组与假阳性组肿瘤区整体特征及错配区定量参数比较
两名医师对常规磁共振图像独立评估显示,所提取的影像特征具有较高的观察者间一致性,Kappa值为0.776~0.855(<0.05).假阳性组10例(100%)出现瘤周水肿,较阳性组5例(55.6%)更多见,差异有统计学意义(<0.05).两组在肿瘤边缘情况及有无强化方面的差异无统计学意义(>0.05)(表2).

表2 阳性组与假阳性组肿瘤区整体特征比较
阳性组最大层面相对错配面积(0.64±0.29 cm2)大于假阳性组(0.25±0.21 cm2),差异有统计学意义(<0.05).阳性组2/FLAIR错配率(60.92%±9.98%)大于假阳性组(51.72%±7.56%),差异具有统计学意义(<0.05)(图3).

图3 阳性组与假阳性组错配区定量参数比较.*p<0.05,**p<0.01
2.3 定量参数的诊断效能分析
ROC曲线分析显示,相对错配面积诊断IDHMUT/1p/19q+LGG的阈值为23.71%,其敏感度、特异度及AUC分别为88.89%、80.0%及0.878.2/FLAIR错配率诊断IDHMUT/1p/19q+LGG的阈值为55.99%,其敏感度、特异度及AUC分别为66.67%、80.0%及0.756.相对错配面积、2/FLAIR错配率联合诊断IDHMUT/1p/19q+LGG的特异度最高为100%,其敏感度与AUC分别为77.78%、0.878(图4).

图4 错配区定量参数预测IDHMUT/1p/19q+ LGG的ROC曲线
2.4 讨论
LGG包括星形细胞瘤及少突胶质细胞瘤,IDH突变伴1p/19q未联合缺失被认为是星形细胞瘤的特征分子标志,而1p/19q联合缺失被作为少突胶质细胞瘤的特征性标志物.这些分子分型特征更能够反映LGG的生物学及临床特征,例如在预后评估中,IDHMUT/1p/19q+LGG较IDHMUT/1p/19q-LGG的预后差,但优于IDHWTLGG[2].因此,在术前评估胶质瘤的分子分型能指导患者的个体化治疗.本研究结果显示,整体及部分2/FLAIR错配征也可作为预测IDHMUT/1p/19q+LGG的影像标志物.既往大多数研究对2/FLAIR错配征采用严格的定义标准,即整个瘤体在2WI上呈几乎同质的高信号,而在FLAIR上呈相对低信号,外周可见高信号环.整个瘤体的错配征对IDHMUT/1p/19q+LGG具有较高的特异度,但是如此严格的2/FLAIR错配征并非在每例IDH突变型星形细胞瘤中表现,具有敏感度低的缺陷.本研究引入部分错配征作为定义标准之一,发现部分错配征能够预测 IDHMUT/1p/19q+LGG,这与Throckmorton等[13]的研究结果一致.这一定义的应用能够增加错配征的敏感度,提高术前初步判别分子分型的能力.
在19例具有2/FLAIR错配征的LGG患者中,10例出现假阳性2/FLAIR错配征的情况.先前有研究报道,2/FLAIR错配征在除IDH突变型星形细胞瘤以外的胶质瘤中存在假阳性的情况,例如,在毛索样星形细胞瘤、H3 K27M突变弥漫中线胶质瘤及含有MYB重排的低级星形细胞瘤的儿童患者中存在假阳性[5];在几例少突胶质细胞瘤成人患者中也存在假阳性[5,9].假阳性2/FLAIR错配征出现的原因尚不清楚,本研究中的假阳性是否与使用部分错配征作为定义标准,或是否与肿瘤的病理组织结构有关,有待进一步探讨.此外,2/FLAIR错配征作为LGG的影像标志物得到大量研究证实,但极少研究探讨了2/FLAIR错配征在IDH突变型胶质母细胞瘤中的表征状况,仅仅报道了两例IDH突变型胶质母细胞瘤具有2/FLAIR错配征[13,14].有学者提出,2/FLAIR错配征可能对IDH突变型胶质母细胞瘤具有一定预测价值,因此在研究错配征时,不应完全将胶质母细胞瘤排除在外[13].并且,IDH突变型胶质母细胞瘤也被称为继发性胶质母细胞瘤,常从弥漫性星形细胞瘤或间变性星形细胞瘤进展而来.2/FLAIR错配征可能反映肿瘤的演变情况[13].2/FLAIR错配征是否也能作为IDH突变型胶质母细胞瘤的影像学标志物,未来需要更多研究进行探讨.
常规MRI广泛应用于临床实践中,尽管其对胶质瘤的功能状态评价具有局限性,但是常规影像特征对胶质瘤的诊断价值不可忽略.已有研究表明,通过测量胶质瘤在常规磁共振图像的形态学指标,能在一定程度上获取胶质母细胞瘤不同特征分子的表达[15].从伦勃朗视觉感受图像(VASARI)特征集中提取的常规MRI特征以及2/FLAIR错配征,能对弥漫性低级别胶质瘤的1p/19q缺失状态进行预测[16].本研究分析阳性组与假阳性组的肿瘤整体影像特征发现,在肿瘤区提取的瘤周水肿特征有助于区分两组,而肿瘤边缘及强化特征对两组鉴别意义不大.本研究中,对肿瘤整体影像特征的提取均基于两位影像医师的定性诊断,这一过程常耗费大量时间.而胶质瘤自动分割算法能快速对大量数据进行处理,并且有助于提高医师对胶质瘤分析的准确性[17].进一步提取错配区定量影像特征分析,阳性组的LGG表现出更高的2/FLAIR错配率以及更大的相对错配面积.其中当相对错配面积大于23.71%时,对IDHMUT/1p/19q+LGG诊断具有敏感度高(88.89%)的特点,这一定量影像特征有助于改善2/FLAIR错配征对IDHMUT/1p/19q+LGG诊断时敏感性较低的缺点.Lasocki等[18]认为,相对错配面积大于50%是预测1p/19q状态的最佳阈值,并且特异度达100%.而在本研究中,仅以大于23.71%的相对错配面积诊断IDHMUT/1p/19q+LGG的特异度稍差(80.0%).但联合其他定量参数有助于改善这一缺陷.与相对错配面积比较,联合相对错配面积及2/FLAIR错配率能够提高诊断特异度,但两者的诊断效能无明显统计学差异(>0.05).本研究对肿瘤错配区在FLAIR序列上的信号衰减率进行定量分析,发现2/FLAIR错配率大于55.99%时,对IDHMUT/1p/19q+LGG诊断效能较高.
本研究也存在一定的不足,首先,本研究为单中心研究,样本量小.尽管2/FLAIR错配征对IDHMUT/1p/19q+LGG的诊断具有较高的特异度,但并非所有的IDHMUT/1p/19q+LGG具有这一征象,这也是造成本研究样本量小的一个因素.其次,未能对错配征的病理组织学进行深入探讨.在未来的研究中,有必要进行多中心、大样本研究,联合功能MRI技术探究错配征的影像及其与病理学的关系.
3 结论
本研究显示,整体及部分2/FLAIR错配征都可作为预测IDHMUT/1p/19q+LGG的影像标志物.肿瘤区整体影像特征联合错配区定量参数有助于提高对IDHMUT/1p/19q+LGG的诊断效能,对LGG的治疗及预后评估具有指导意义.
感谢国家自然科学基金青年科学基金(81701661)对本研究的支持.
无
[1] LOUIS D N, PERRY A, REIFENBERGER G, et al.The 2016 world health organization classification of tumors of the central nervous system: a summary[J].Acta Neuropathol, 2016, 131(6): 803-820.
[2] BRAT D J, VERHAAK R G, ALDAPE K D, et al.Comprehensive, integrative genomic analysis of diffuse lower-grade gliomas[J].N Engl J Med, 2015, 372(26): 2481-2498.
[3] PATEL S H, POISSON L M, BRAT D J, et al.2-FLAIR mismatch, an imaging biomarker for IDH and 1p/19q status in lower-grade gliomas: A TCGA/TCIA project[J].Clin Cancer Res, 2017, 23(20): 6078-6085.
[4] BROEN M P G, SMITS M, WIJNENGA M M J, et al.The2-FLAIR mismatch sign as an imaging marker for non-enhancing IDH-mutant, 1p/19q-intact lower-grade glioma: a validation study[J].Neuro Oncol, 2018, 20(10): 1393-1399.
[5] JOHNSON D R, KAUFMANN T J, PATEL S H, et al.There is an exception to every rule-2-FLAIR mismatch sign in gliomas[J].Neuroradiology, 2019, 61(2): 225-227.
[6] JURATLI T A, TUMMALA S S, RIEDL A, et al.Radiographic assessment of contrast enhancement and2/FLAIR mismatch sign in lower grade gliomas: correlation with molecular groups[J].J Neurooncol, 2019, 141(2): 327-335.
[7] LEE M K, PARK J E, JO Y, et al.Advanced imaging parameters improve the prediction of diffuse lower-grade gliomas subtype, IDH mutant with no 1p19q codeletion: added value to the2/FLAIR mismatch sign[J].Eur Radiol, 2020, 30(2): 844-854.
[8] FOLTYN M, NIETO TABORDA K N, NEUBERGER U, et al.2/FLAIR-mismatch sign for noninvasive detection of IDH-mutant 1p/19q non-codeleted gliomas: validity and pathophysiology[J].Neurooncol Adv, 2020, 2(1): vdaa004.
[9] DEGUCHI S, OISHI T, MITSUYA K, et al.Clinicopathological analysis of2-FLAIR mismatch sign in lower-grade gliomas[J].Sci Rep, 2020, 10(1): 10113.
[10] ALIOTTA E, DUTTA S W, FENG X, et al.Automated apparent diffusion coefficient analysis for genotype prediction in lower grade glioma: association with the2-FLAIR mismatch sign[J].J Neurooncol, 2020, 149(2): 325-335.
[11] FUJITA Y, NAGASHIMA H, TANAKA K, et al.The histopathologic and radiologic features of2-FLAIR mismatch sign in IDH-mutant 1p/19q non-codeleted astrocytomas[J].World Neurosurg, 2021, 149: e253-e260.
[12] BATCHALA P P, MUTTIKKAL T J E, DONAHUE J H, et al.Neuroimaging-based classification algorithm for predicting 1p/19q-codeletion status in IDH-mutant lower grade gliomas[J].AJNR Am J Neuroradiol, 2019, 40(3): 426-432.
[13] THROCKMORTON P, GRABER J J.2-FLAIR mismatch in isocitrate dehydrogenase mutant astrocytomas: Variability and evolution[J].Neurology, 2020, 95(11): e1582-e1589.
[14] CORELL A, FERREYRA VEGA S, HOEFLING N, et al.The clinical significance of the2-FLAIR mismatch sign in grade II and III gliomas: a population-based study[J].BMC Cancer, 2020, 20(1): 450.
[15] MA Y, GUO H, WANG Q S, et al.Correlations between morphological characteristics and expression levels of specific molecular biomarkers in glioblastoma[J].Chinese J Magn Reson, 2018, 35(1):22-30.
马芸, 郭虹, 王秋实, 等.基于影像的形态学特征与胶质母细胞瘤特征分子表达的相关性研究[J].波谱学杂志, 2018, 35(1): 22-30.
[16] PAN T, SU C Q, ZHANG X, et al.Application of conventional MRI features in predicting the 1p/19q status in diffuse lower grade gliomas[J].Journal of Clinical Radiology, 2020, 39(6): 1189-1194.潘婷, 苏春秋, 张璇, 等.常规MRI特征在预测弥漫性低级别胶质瘤1p/19q缺失状态的应用价值[J].临床放射学杂志, 2020, 39(6): 1189-1194.
[17] GONG J C, WANG Y, WANG Y J.A method for segmentation of glioma on multimodal magnetic resonance images based on wavelet fusion and deep learning[J].Chinese J Magn Reson, 2020, 37(2): 131-143.
宫进昌, 王宇, 王远军.结合小波融合和深度学习的脑胶质瘤自动分割[J].波谱学杂志, 2020, 37(2): 131-143.
[18] LASOCKI A, GAILLARD F, GORELIK A, et al.MRI features can predict 1p/19q status in intracranial gliomas[J].AJNR Am J Neuroradiol, 2018, 39(4): 687-692.
The Diagnostic Value of Quantitative Parameters of2/FLAIR Mismatch Sign in Evaluating the Molecular Typing of Lower-grade Gliomas
1,2,1,2,1,2,1,2,3,4,1,2*
1.Department of Radiology, Daping Hospital, Army Medical University, Chongqing 400042, China; 2.Chongqing Clinical Research Centre of Imaging and Nuclear Medicine, Chongqing 400042, China; 3.Department of Pathology, Daping Hospital, Army Medical University, Chongqing 400042, China; 4.Department of Neurosurgery, Daping Hospital, Army Medical University, Chongqing 400042, China
This paper performeda retrospective analysis of 19 patients diagnosed with pathologically-verified WHO II-III grade glioma with2/FLAIR mismatch sign.We extracted the overall characteristics of the tumor area and the image parameters of the mismatch regions from the patients’ imaging data for quantitative analysis.Afterward, we investigated how2/FLAIR mismatch sign affected the diagnostic efficacy for isocitrate dehydrogenase (IDH)-mutant and 1p/19q non-codeleted (IDHMUT/1p/19q+) lower-grade gliomas (LGG).This study showed that the overall and partial2/FLAIR mismatch sign can be used as an imaging marker to predict IDHMUT/1p/19q+LGG.The overall imaging characteristics of the tumor area combined with the quantitative parameters of the mismatch regions can improve the diagnostic efficacy for IDHMUT/1p/19q+LGG.
magnetic resonance imaging (MRI),2/FLAIR mismatch sign, molecular typing, lower-grade gliomas, quantitative parameters
O482.53
A
10.11938/cjmr20212899
2021-03-23;
2021-06-29
国家自然科学基金青年科学基金资助项目(81701661).
* Tel: 023-68757623, E-mail: wangshunan@tmmu.edu.cn.

