特发性炎症性肌病合并间质性肺炎患者病死的影响因素分析
蔡慧,叶绿,龙小琴,蒋峰
特发性炎症性肌病(IIM)是一组自身免疫结缔组织病,可引起血清肌酶增高、肌电图异常及肌无力等临床表现或症状[1]。IIM受累部位除了皮肤与肌肉外,又以肺部受累最常见,临床研究发现间质性肺炎在IIM患者中的发生率高达74.82%,可作为该病的一种首发症状[2]。IIM合并间质性肺炎发病的相关机制目前仍未明确,既往认为其与IIM炎症反应、肌炎特异性抗体、T细胞和B细胞等免疫细胞激活等因素有关[3]。IIM合并间质性肺炎发病早期症状不明显,确诊后多存在肺纤维化情况,极易诱发肺部感染,治疗较为棘手且预后不佳,一些患者病情进展迅速但极难预测,是IIM病死的主要原因之一[4]。既往发现IIM患者病死的危险因素包含疾病活动度、合并间质性肺炎进展、肺部感染及CD3+CD4+T细胞计数等[5-6],但目前国内关于IIM合并间质性肺炎患者病死的影响因素研究仍然较少。本文收集233例IIM合并间质性肺炎患者的临床资料,分析IIM合并间质性肺炎患者病死的影响因素,现报道如下。
1 资料与方法
1.1 一般资料 回顾性收集2011年1月至2020年12月浙江省湖州市第三人民医院及浙江大学医学院附属第二医院收治的IIM合并间质性肺炎患者233例。纳入标准:(1)年龄≥18岁;(2)符合Bohan和Peter提出的皮肌炎或多发性肌炎诊断标准[7];(3)间质性肺炎诊断标准:有不明原因呛咳、轻微运动有Velcro啰音或呼吸短促,并经高分辨率CT诊断符合典型的间质性改变(如肺实变、蜂窝状改变、磨玻璃密度影及条索影等)。排除标准:(1)恶性肿瘤患者;(2)肺气肿及肺结核患者;(3)合并糖尿病、终末期肾病及脑卒中等严重疾病;(4)住院期间病死及因车祸等意外事件死亡;(5)临床资料不全者。本研究已获得医院伦理委员会批准。
1.2 方法 采用Microsoft Excel软件收集所有入选患者的性别、年龄、病程、肌炎活动度评分(MYOACT)、肺部感染情况、间质性肺炎分类、实验室指标、糖皮质激素日最高剂量以及随访生存情况等,并建立数据库。其中,MYOACT从皮肤黏膜、肌肉、胃肠道及心血管等7个方面进行评价,共26个项目,总活动度评分0~10分,得分与肌炎活动度呈正比[8],MYOACT为患者入院后首次评估结果。间质性肺炎分类:由治疗前高分辨率CT确定,分为寻常型间质性肺炎(UIP)、非特异型间质性肺炎(NSIP)、急性间质性肺炎(AIP)以及机化性肺炎(COP)等。实验室指标包含外周血白蛋白(ALB)、红细胞沉降率(ESR)、血小板计数(PLT)、淋巴细胞绝对数(ALC)、乳酸脱氢酶(LD)、C-反应蛋白(CRP)、血小板与淋巴细胞比值(PLR)、中性粒细胞与淋巴细胞比值(NLR)、单核细胞与淋巴细胞比值(MLR)以及IIM自身抗体等,均为入院后首次检测结果。糖皮质激素日最高剂量为住院期间每天最大用药剂量,本研究采用强的松等效剂量表示。随访生存情况根据患者出院后电话随访及病历记录确定。
1.3 统计方法 采用SPSS 26.0统计软件进行分析,计量资料以均数±标准差或中位数表示,采用Kaplan-Meier法分析患者生存情况,采用单因素COX回归模型分析可能影响IIM合并间质性肺炎患者病死的指标,并将单因素分析P<0.1的指标纳入多因素COX回归模型进一步分析病死的独立影响因素;采用Nomogram模型分析危险因素的预测价值。P<0.05为差异有统计学意义。
2 结果
2.1 入选患者的临床资料及随访结局入选的233例IIM合并间质性肺炎患者中,男63例,女170例;年龄31~74岁,平均(53.2±12.7)岁;IIM病程1~9个月,中位病程3个月;IIM亚型:皮肌炎195例,多发性肌炎38例;MYOACT评分2~9分,中位评分6分;肺部感染:有83例,无150例;间质性肺炎类型:NSIP 148例,COP 39例,AIP 27例,UIP 19例;住院期间糖皮质激素日最高剂量10~1150 mg/d,中位数134 mg/d(强的松等效剂量)。截止至2021年9月,患者出院后随访时间为9~43个月,中位随访时间14个月;随访期间病死68例(29.18%),病死情况见图1。
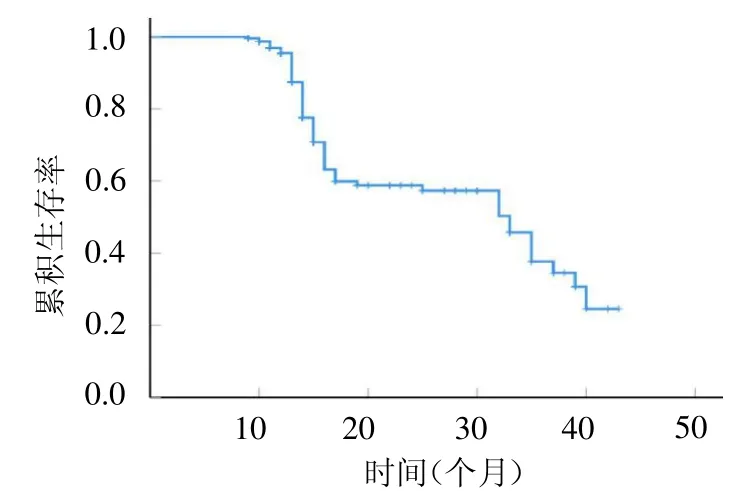
图1 IIM合并间质性肺炎患者随访期间病死情况
2.2 IIM合并间质性肺炎病死的单因素分析 以患者病死(否=0,是=1)及其时间作为因变量,将可能导致患者病死的变量进行赋值,见表1;单因素COX回归分析结果显示肺部感染、AIP、低ALB、高MLR、抗MDA5抗体阳性及糖皮质激素日最高剂量是导致患者病死的影响因素(均P<0.05)。见表2。

表1 变量赋值表
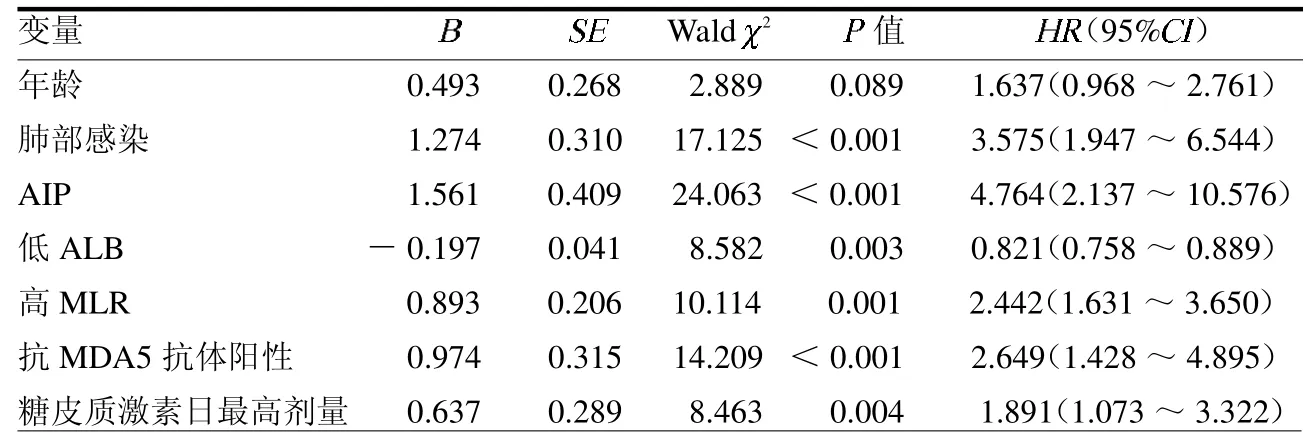
表2 单因素COX回归分析
2.3 IIM合并间质性肺炎病死的多因素分析 多因素COX回归分析结果显示肺部感染、AIP、低ALB、高MLR及抗MDA5抗体阳性是IIM合并间质性肺炎病死的独立影响因素(均P<0.05),见表3。
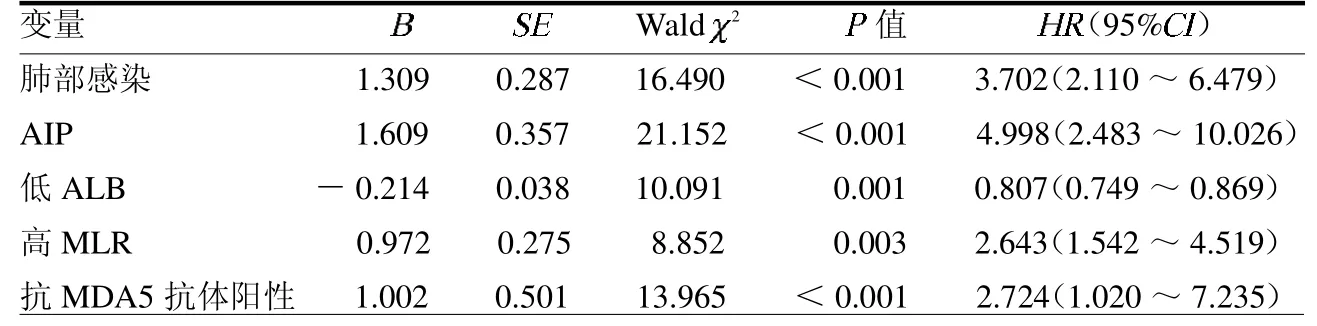
表3 多因素COX回归分析
2.4 危险因素用于预测IIM合并间质性肺炎病死的价值 基于COX回归模型建立IIM合并间质性肺炎患者出院后不同时间生存概率的Nomogram图,Nomogram图预测IIM合并间质性肺炎病死的一致性指数(C-index)为0.74(95%CI:0.69~0.83)。见图2。

图2 患者出院后不同时间生存概率预测Nomogram图
3 讨论
间质性肺炎在IIM患者中较为常见,虽然目前医学技术水平已明显提高,但遗憾的是仍缺乏治疗肺纤维化进展的特效药物,再加上病情进展快及诊断延迟等因素,患者的长期生存率依然偏低[9]。因此,早期识别IIM合并间质性肺炎的危险因素对预测预后及指导临床治疗十分重要。
本研究结果显示AIP、存在肺部感染及低ALB是IIM合并间质性肺炎病死的独立危险因素(均P<0.05)。梁文芳等[9]研究也证实,皮肌炎合并间质性肺炎患者中,AIP与肺部感染者的预后相对更差。其中,AIP通常为肺部急性损伤性病变,病情发展相对于其他间质性肺炎更迅速,而且临床中一般难以及时发现,治疗较为棘手,病死风险更大。同时,IIM合并间质性肺炎患者机体免疫力下降易出现肺部感染,还可能存在食管受累、呼吸功能不全及免疫抑制药物使用等诱发肺部感染的因素[10]。肺部感染的存在使间质性肺炎病情加重,增加了呼吸衰竭等致命并发症的发生风险,因此患者若存在肺部感染,其病死率也会更高。此外,ALB由肝实质细胞合成,对缓解内皮细胞凋亡及血小板凝集具有重要作用,而且其氨基酸还有助于组织修补;有研究表明低蛋白血症与IIM合并间质性肺炎密切相关[11],由于大量炎症因子的产生导致肝细胞ALB合成被抑制,ALB对机体的保护性机制削弱,导致肺间质纤维化加重,进而影响预后。
MLR是反映全身炎症状态的重要参数,其在多种疾病的诊断、治疗及预后评估中发挥了很大作用。国外研究表明,系统性自身免疫性风湿病患者中MLR均明显增大,提示失衡的单核细胞与淋巴细胞可促进此类疾病的发生及发展[12]。同时,单核细胞、巨噬细胞及淋巴细胞对白细胞介素-6及肿瘤坏死因子-等的产生具有调节作用,IIM患者体内肿瘤坏死因子、白细胞介素-1、白细胞介素-6以及白细胞介素-8水平明显增高,而且能较好的体现疾病活动程度;这说明MLR增高是IIM合并间质性肺炎患者炎症细胞因子作用下的结果。同时,CD16+单核细胞内的Toll样受体表达差异还与间质性肺炎的存在具有相关性。本研究结果显示高MLR是IIM合并间质性肺炎病死的独立危险因素(P<0.05),可能与MLR受机体细胞因子及T细胞亚群影响有关,进而影响预后。
Fujiki等[13]研究证实,部分皮肌炎合并间质性肺炎患者血清中抗MDA5抗体呈阳性,这说明皮肤或肺上皮细胞受病毒感染后可诱导抗MDA5抗体的出现,进而促发自身抗体依赖的细胞毒作用而损伤组织。皮肌炎抗MDA5抗体阳性患者通常表现为间质性肺炎病情快速进展,而且此类患者恶性肿瘤的发生风险明显增高,再加上由于其临床症状偏少,很容易耽误最佳治疗时机[13-14]。同时,组织病理学及既往临床中发现,IIM合并间质性肺炎抗MDA5抗体阳性患者皮肤血管病变程度通常更严重,比其他类型间质性肺炎进展速度快,而且使用免疫抑制剂通常难以获得理想的治疗效果[4]。本研究结果发现抗MDA5抗体阳性是IIM合并间质性肺炎病死的独立危险因素(P<0.05),与Li等[15]和金颖昭等[16]学者研究结果一致。
此外,根据影响因素模型建立Nomogram图可能在临床中更具应用价值,但国内仅有的少量相关研究[9,16]除了分析影响因素外均未进一步采用图示化方法表达统计模型,不便于临床应用。本研究通过将上述5种IIM合并间质性肺炎病死的独立危险因素构建了可视化的Nomogram图,其预测患者病死的C-index为0.74,提示该模型的预测精度较好。
综上所述,肺部感染、AIP、低ALB、高MLR及抗MDA5抗体阳性是IIM合并间质性肺炎患者病死的独立影响因素,基于上述指标构建的Nomogram图有助于更好地评估患者预后,并及时采取针对性的治疗策略。

