刺激响应性共聚物修饰金纳米棒的制备及其抗肿瘤性能
郭 敏, 侯光晖, 胥伟军, 钱军民
(西安交通大学金属材料强度国家重点实验室,西安 710049)
化疗是临床肿瘤治疗的基本手段之一,但其存在剂量依赖性的毒副作用和耐药性等问题[1]。近年来,光热疗法(PTT)、光动力疗法和免疫疗法等治疗模式方兴未艾[2-5]。然而,肿瘤存在多样性、异质性和转移性等特点,单一治疗模式难以彻底治愈肿瘤。因此,基于不同治疗模式的联合治疗已成为肿瘤基础研究和临床治疗的主流方向。
PTT 是一种激光热疗抗肿瘤技术,具有特异性高、疗效好、副作用小等优点,但也存在肿瘤组织中热分布不均匀的问题,难以完全清除肿瘤[3],而化疗能有效克服这一缺点。PTT 的热效应可改善肿瘤血管通透性,促进药物扩散,实现小剂量药物的高效治疗[6,7]。因此,PTT 与化疗联合是一种很有开发前景的抗癌方法。在目前开发的光热材料中,金纳米棒(GNR)因具有毒性小、光热转换效率高等优点而备受青睐[6,8,9]。因此,将GNR 与化疗药物联合治疗有望取得“1+1>2”的协同治疗效果。然而,GNR 用于联合治疗存在3 大缺点:(1)光滑表面导致载药能力低;(2)GNR 制备过程中表面残留的表面活性剂十六烷基三甲基溴化铵(CTAB)有明显的细胞毒性[10,11];(3)在盐溶液中,GNR 表面的CTAB 双分子层易被破坏,导致GNR 聚集析出。
为解决上述问题,研究者已开发出多种GNR 表面改性方法,实现肿瘤的光热-化疗联合治疗。例如,利用介孔SiO2[12,13]或氧化石墨烯[14]修饰GNR,可增强载药能力;通过在GNR 表面修饰离子型聚合物,可经静电作用吸附药物[15,16]。然而,这些物理方式装载的药物在载体上稳定性差,在体内循环时易发生过早释放,难以有效到达肿瘤。相比之下,通过环境敏感的化学键偶联药物是一种理想的药物装载方式,既可防止过早释放又能响应肿瘤微环境释放药物。嵌段共聚物因具有分子结构设计灵活和易功能化等优点,已被开发用于药物/基因传递[17,18]。然而,由嵌段共聚物和GNR 构建纳米偶联物用于肿瘤光热-化疗联合治疗的研究很少。
基于此,本文以1-叔丁氧基羰基-2-丙烯酰肼(Boc-AH)、N-(3,4-二羟基苯乙基)丙烯酰胺(AD)和聚乙二醇甲醚丙烯酸酯(mPEGA)为单体,利用可逆加成-断裂链转移(RAFT)聚合方法及脱除保护基团过程,合成了一种具有仿贻贝黏性的聚乙二醇(PEG)化嵌段共聚物,即聚丙烯酰肼-聚N-(3,4-二羟基苯乙基)丙烯酰胺-聚单甲氧基聚乙二醇丙烯酸酯(PAH-b-PAD-b-PmPEGA,缩写为HDP)。该共聚物可通过其多巴胺结构中的邻苯二酚基偶联于GNR 表面(HDP-GNR),再经其酰肼基团与化疗药物阿霉素(DOX)中羰基形成酸敏感的腙键装载DOX,获得纳米药物(HDP-GNR-DOX),可实现乳腺癌的光热-化疗联合治疗。该纳米药物具有PEG 外壳,既可防止颗粒聚集又可使纳米体系稳定悬浮于水性体系中。纳米药物经胞吞作用进入肿瘤细胞后,可响应其酸性环境使腙键断裂,释放DOX;在近红外(NIR)光照射下,可实现光热-化疗联合治疗。该纳米体系的理化特性研究和体外细胞学评价表明,该纳米体系在肿瘤光热-化疗联合治疗中显现出巨大的潜力。
1 实验部分
1.1 原料和试剂
聚乙二醇单甲醚(mPEG,Mw=2×103)、三氟乙酸(TFA)、2,2'-偶氮异丁腈(AIBN):分析纯,阿拉丁试剂(上海)有限公司;高糖培养基(DMEM)、青霉素/链霉素、胎牛血清(FBS)和胰蛋白酶(质量浓度为2.5 g/L):生化级,美国Hyclone 公司;阿霉素盐酸盐(DOX·HCl):分析纯,大连美仑生物技术有限公司;4',6-二氨基-2-苯基吲哚(DAPI)、钙黄绿素AM/PI 染色试剂盒和3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四唑溴化铵(MTT):生化级,上海碧云天生物技术有限公司;其他试剂:分析纯,国药化学试剂有限公司(中国西安);人乳腺癌细胞(MCF-7):西安交通大学医学中心。
1.2 测试与表征
通过核磁共振波谱仪(瑞士Bruker 公司AVANCE Ⅲ 600 MHz 型)检测产物的化学结构;用傅里叶变换红外光谱仪(日本Shimadzu IR 公司 Prestige-21 型)验证HDP-GNR 的合成;利用分光光度计(中国北京普析通用仪器有限责任公司TU-1810 型)表征GNR 经聚合物修饰前后的紫外-可见吸收(UV-Vis)光谱;通过透射电子显微镜(TEM,日本JEOL 公司JEM-2 100 Plus 型)观察纳米颗粒的形貌;利用纳米激光粒度仪(英国Malvern公司Zetasizer Nano-ZS90 型)测量纳米颗粒的Zeta 电位和流体力学尺寸,其原理是动态光散射(DLS)法;利用电感耦合等离子体质谱(ICP-MS,德国Spectro 公司Arcos 型)测定细胞内的金含量;利用红外热像仪(美国FLIR 公司E60 型)监测温度。
1.3 实验步骤
1.3.2 HDP-GNR-DOX 的合成 首先,采用种子介导生长法制备表面包覆有CTAB 的GNR (CTAB-GNR)[22]。然后,在50 mL HDP 溶液(1 mg/mL)中加10 mL GNR 悬液(200 μg/mL),反应24 h 后离心收集HDP-GNR。接着,将4 mL DOX 溶液(0.5 mg/mL)加入50 mL HDP-GNR 悬液(Au 的质量浓度为30 μg/mL)中,25 ℃搅拌24 h。最后,经离心、洗涤得到HDP-GNR-DOX,其结构式见图1。
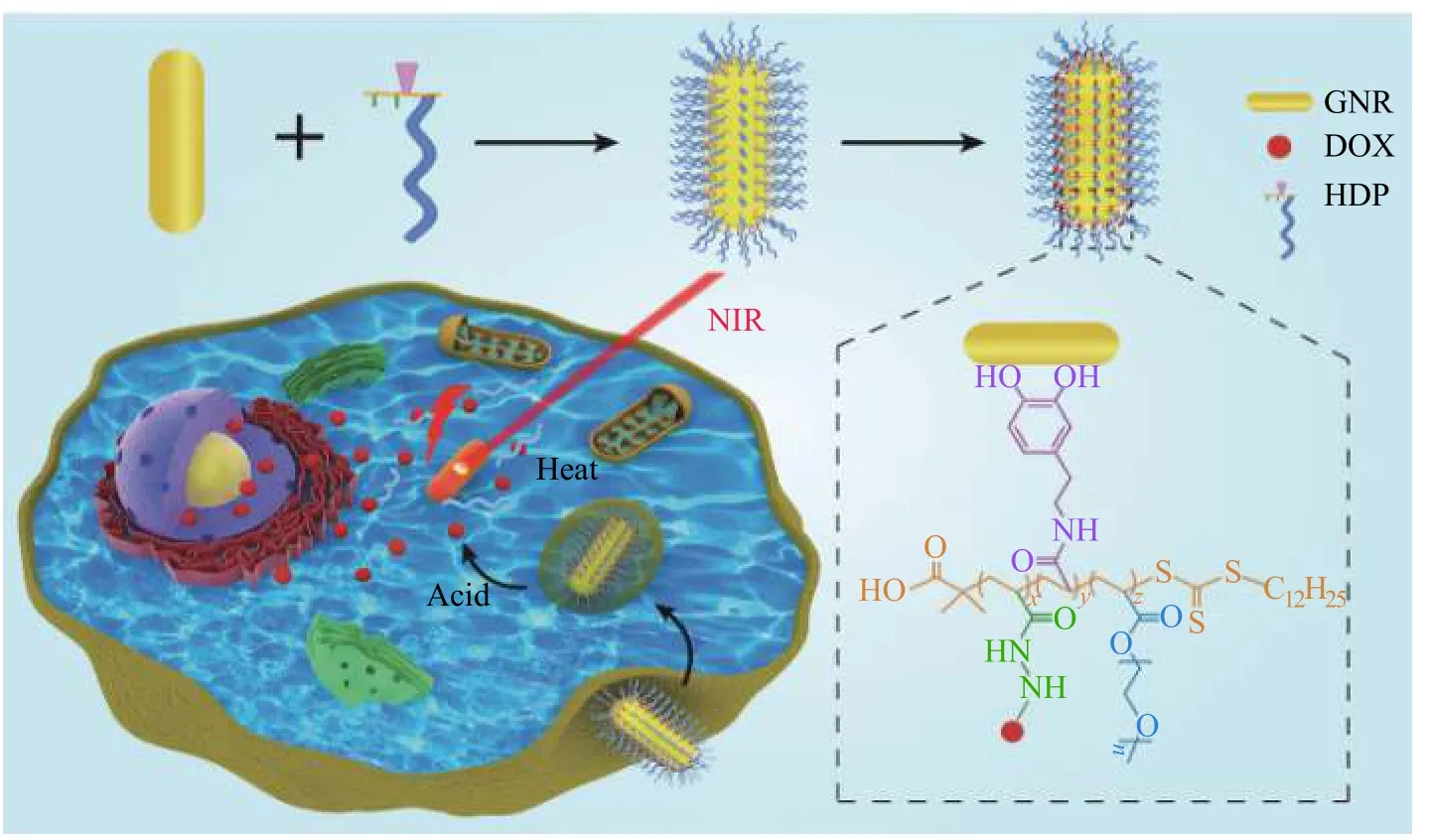
图1 HDP-GNR-DOX 纳米药物的制备及其在细胞中的运输示意图Fig. 1 Schemic diagram of preparation and intracellular transport of HDP-GNR-DOX nanodrug
1.3.3 稳定性及体外药物释放行为 将HDP-GNR-DOX 和CTAB-GNR 分别分散于于水和磷酸盐缓冲液(PBS)(10 mmol/L,pH=7.4)中,在预设时间测试样品的UV-Vis 吸收光谱。
将HDP-GNR-DOX 放入透析袋(截留分子量为1 000)中,然后置于pH 分别为5.0、6.5 或7.4 的PBS 中。定期取2.0 mL 透析液检测DOX 的荧光强度(激发波长(λex)为488 nm,发射波长(λem)为 580 nm),根据DOX的荧光标准曲线计算药物释药量。
1.3.4 光热转换研究 为探究HDP 修饰和DOX 装载对GNR 光热性能的影响,分别将1.0 mL 金含量相同的CTAB-GNR、HDP-GNR 和HDP-GNR-DOX 悬液加入离心管中,在功率为2.0 W/cm2的NIR 光下照射10 min,用红外热像仪监测温度。为研究金的质量浓度(ρ(Au))对光热性能的影响,将1.0 mL 的HDP-GNR-DOX 悬液(ρ(Au)分别为20、30、40、50 μg /mL)经NIR 光(2.0 W/cm2)照射10 min,监测温度变化。为探究NIR 光功率对光热性能的影响,将ρ(Au)为20 μg/mL 的HDP-GNR-DOX 悬液经不同NIR 光功率(1.0、2.0 W/cm2和3.5 W/cm2)照射10 min,记录温度变化。为检测光稳定性,对HDP-GNR-DOX 悬液进行3 次加热冷却循环(Au 的质量浓度为20 μg /mL,NIR 光的功率为2.0 W/cm2)实验。
1.3.5 细胞培养 MCF-7 用含有 FBS(体积分数为10%)和青霉素/链霉素(体积分数为1%)的DMEM 培养,培养环境为37 ℃,CO2体积分数为5%。
1.3.6 体外细胞摄取研究 将细胞接种于24 孔板(每孔5×104个细胞)中,培养24 h 后用HDP-GNR-DOX 或等物质的量游离DOX 处理,然后继续培养1、4、12 h,经DAPI 染色后用激光共聚焦显微镜(德国Leica 公司TCS SP8 STED 3X 型)观察。
将细胞接种于6 孔板(每孔5×105个细胞)中,用HDP-GNR-DOX 或等物质的量的游离DOX 处理1、4、12 h 后离心收集细胞。用流式细胞仪(FACS Canto II 型)定量测定细胞内DOX 的荧光强度。
将HDP-GNR-DOX 与细胞共孵育4、12 h 后,制作TEM 样品。利用透射电子显微镜(日本Hitachi 公司H7650 型)观察细胞内GNR 的含量和分布。
1.3.7 体外抗癌效果 采用MTT 法检测细胞毒性。将细胞接种于96 孔板(每孔1×104个细胞)中,经不同质量浓度的纳米颗粒处理后,用酶标仪检测490 nm 处吸光度。将细胞接种于24 孔板(每孔5×104个细胞)中,分别用不同纳米颗粒处理后进行钙黄绿素AM/PI 染色,用激光共聚焦显微镜观察结果评价细胞凋亡/坏死,将细胞接种于6 孔板(每孔5×105个细胞)中,经不同纳米颗粒处理后进行Annexin V-EGFP/PI 染色,用流式细胞仪评估细胞凋亡情况。
3) 焊缝XRD物相分析和断口EDS能谱扫描表明焊缝中含有大量的脆性相Mg2Al3、Mg17Al12,大量的脆性相决定了断口形貌图中断裂面主要以解理断裂为主,有少量的韧窝存在,脆性相的存在严重降低了接头质量。
2 结果与讨论
2.1 HDP-GNR-DOX 的表征
图2 为合成HDP 时不同阶段产物的1H-NMR 谱图。在图2(a)中,1.62(γ)、1.24(α)、1.06(α)和0.85(α)处的特征峰归属于DACT 上的质子,3.45(ε)、1.83~2.27(δ,ε)和1.42(β)处的特征峰归属于Boc-AH 上的质子,表明P(Boc-AH)成功合成。在图2(b)中出现了多巴胺结构中质子的特征峰(6.31~6.72(ι), 2.89(θ)和2.74(η)),表明AD 段成功合成。在图2(c)中出现了PEG 中亚甲基质子信号(4.23(κ), 3.52(κ))和甲氧基的质子信号(3.25(λ)),证实P(Boc-AH)-b-PAD-b-PmPEGA 成功合成。在图2(d)中,Boc 基团的质子信号(1.42(γ))强度显著降低,同时出现了酰肼基团的质子信号(3.68~4.03(β)),表明Boc 基团有效脱除。以上结果证实HDP 成功合成。
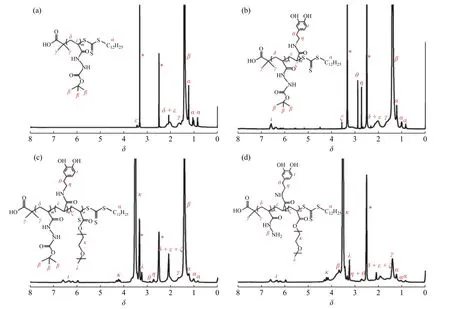
图2 样品的1H-NMR 谱图Fig. 2 1H-NMR spectra of samples
利用FT-IR 光谱验证HDP 在GNR 表面的修饰,结果见图3(a)。与CTAB-GNR 相比,HDP-GNR 的FTIR 谱图中出现了HDP 的2 个特征吸收峰(1 648、1 087 cm−1),表明GNR 已被HDP 成功修饰。UV-Vis 谱图(图3(b))显示,GNR 经HDP 修饰后,其纵向等离子体共振(LSPR)吸收峰从804 nm 红移至814 nm,这可能是少量GNR 聚集所致。相比之下,DOX 装载不影响LSPR 吸收峰位置。荧光法测得纳米药物中DOX 的质量分数约为8.1%。研究表明,纳米粒子在体内的行为取决于其粒径、电荷、形貌等性质[23,24]。纳米药物的流体力学粒径和Zeta 电位如图3(c)所示,可以看出GNR 粒径呈双峰分布,这是因为GNR 具有2 种不同的平动扩散系数和转动扩散系数[25,26]。通常,大尺寸峰反映GNR 的真实流体力学粒径,而小尺寸峰则代表粒子的旋转扩散。经HDP 表面修饰和DOX 装载后,GNR 平均粒径从24.6 nm 依次增加至31.3 nm 和33.9 nm。同时,Zeta 电位从36.8 mV 降至−14.4 mV(图3(d))。这些结果表明,GNR 表面的CTAB 已被HDP 取代。
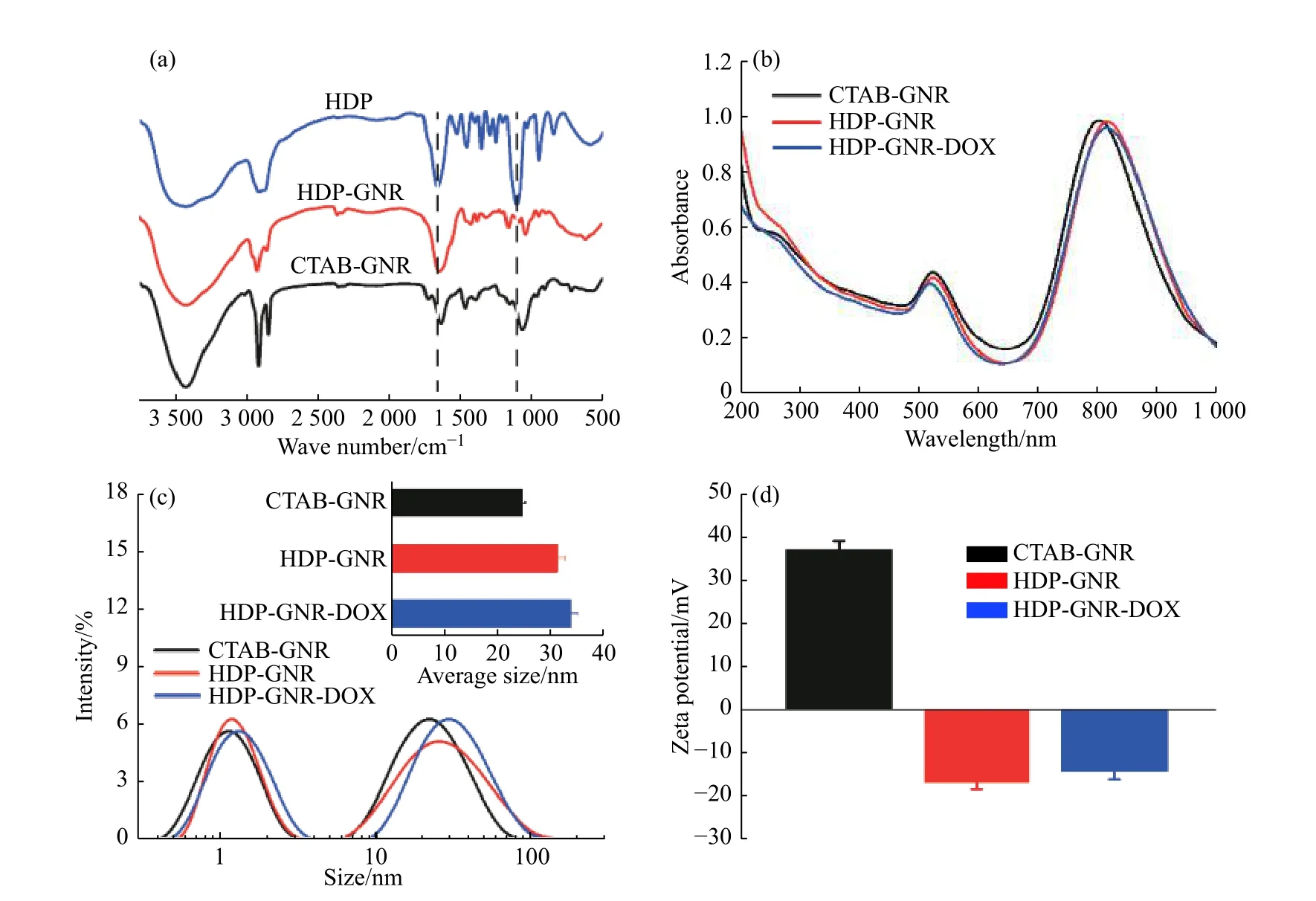
图3 样品的(a) FT-IR 谱图、(b) UV-Vis 吸收光谱、(c)流体力学粒径和(d) Zeta 电位Fig. 3 (a) FT-IR spectra, (b) UV-Vis spectra, (c) hydrodynamic sizes and (d) Zeta potentials of samples
图4 给出了GNR 修饰前后的结构和形貌,可以看出,与未修饰的GNR 相比,HDP 修饰后GNR表面出现了厚度约为4.5 nm 的聚合物层,直接证实HDP 成功修饰于GNR 表面。

图4 (a) CTAB-GNR 和(b) HDP-GNR 的TEM 图像Fig. 4 TEM images of (a) CTAB-GNR and (b) HDP-GNR
2.2 稳定性及体外药物释放行为
纳米颗粒在生理条件下呈现良好的稳定性是其应用于生物医学领域的前提。研究表明,GNR 聚集会引起长径比改变,导致LSPR 吸收峰和溶液颜色随之改变。从CTAB-GNR 和HDP-GNR-DOX 在PBS 和水中的UV-Vis 吸收光谱和宏观照片(图5(a))可以看出,CTAB-GNR 在水中呈紫红色,而在PBS 溶液中变为无色;相应地,两者的UV-Vis 光谱截然不同。这些结果表明,CTAB-GNR 在PBS 中不稳定。这可能是由于盐溶液中离子破坏了GNR 表面活性剂CTAB 双分子层结构,导致GNR 聚集。而HDP-GNR-DOX 在PBS 和水介质中均呈透亮的紫红色,UV-Vis 吸收光谱亦无明显差异,表明该纳米药物具有良好的悬浮稳定性。
图5(b)所示为纳米药物在不同pH 环境中释放DOX 的动力学曲线。很明显,DOX 释放量呈现pH 依赖性。当pH=7.4 时,5 d 内仅释放12%的DOX,而当pH=5.0 时,DOX 释放速率显著加快,24 h 内释放量已达55%,5 d 时释放量达到72%。上述结果表明,纳米药物既能在正常生理pH 下保持稳定,又能在肿瘤细胞的酸性环境中快速释放DOX,起到提高疗效和降低毒副作用的效果。

图5 (a)CTAB-GNR 和HDP-GNR-DOX 在PBS 和水中的UV-Vis 吸收光谱和照片;(b)HDP-GNR-DOX 释放DOX 的动力学曲线Fig. 5 (a) UV-Vis spectra and photographs of CTAB-GNR and HDP-GNR-DOX in water and PBS;(b) Release profiles of DOX from HDPGNR-DOX
2.3 光热转换能力
HDP-GNR-DOX 的光热转换能力如图6 所示。图6 可知,表面修饰和DOX 装载对GNR 光热转换能力的影响有限(图6(a))。在2.0 W/cm2的808 nm NIR 光辐照5 min 后,体系温度升高约30 ℃。HDP-GNRDOX 的光热转换能力与其质量浓度和NIR 光强呈正相关性(图6(b)和6(c))。此外,HDP-GNR-DOX 展现出优异的光热稳定性(图6(d)),3 次光照-冷却循环中的最高温度基本不变。
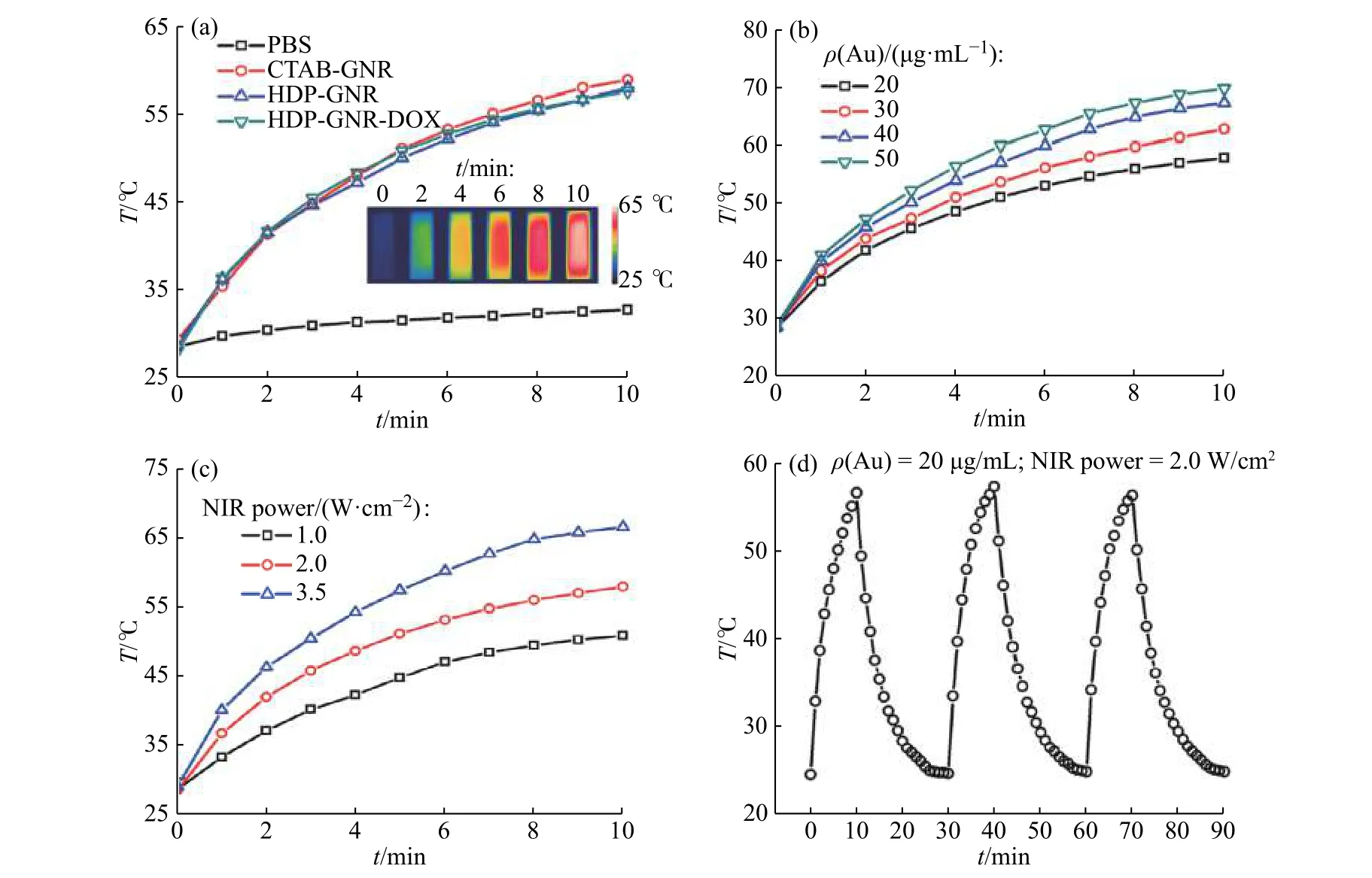
图6 (a)样品的光热性能;(b) HDP-GNR-DOX 浓度和(c) NIR 光功率对光热效果的影响;(d) HDP-GNR-DOX 光热性能的稳定性Fig. 6 (a) Photothermal performance of samples; Effects of (b) HDP-GNR-DOX concentration and (c) NIR power on photothermal performance; (d)Photothermal stability of HDP-GNR-DOX
2.4 细胞对纳米药物的摄取
利用透射电镜、流式细胞术和激光共聚焦显微镜研究了纳米药物被细胞摄取及细胞内分布情况。由图7(a)可以看出,纳米药物可经胞吞作用进入细胞,并有效转运至细胞质;随孵育时间延长,细胞对纳米药物的摄取量明显增加。这一结果被流式细胞术的定量检测结果(图7(b))和激光共聚焦显微镜定性表征(图8(a)和图8(b))证实。同时,流式细胞术结果和激光共聚焦显微镜照片表明,游离DOX 进入细胞的速率比HDPGNR-DOX 更快,在本研究的观察时间点,游离DOX 的荧光主要位于细胞核,而HDP-GNR-DOX 的荧光主要分布于细胞质。这是因为游离DOX 经扩散作用直接进入细胞,比纳米药物进入细胞的胞吞作用更加高效[27]。
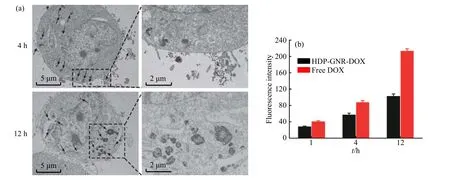
图7 HDP-GNR-DOX 处理MCF-7 的(a)TEM 图像和(b)细胞内荧光强度Fig. 7 (a) TEM images and (b) fluorescence intensity of MCF-7 treated with HDP-GNR-DOX
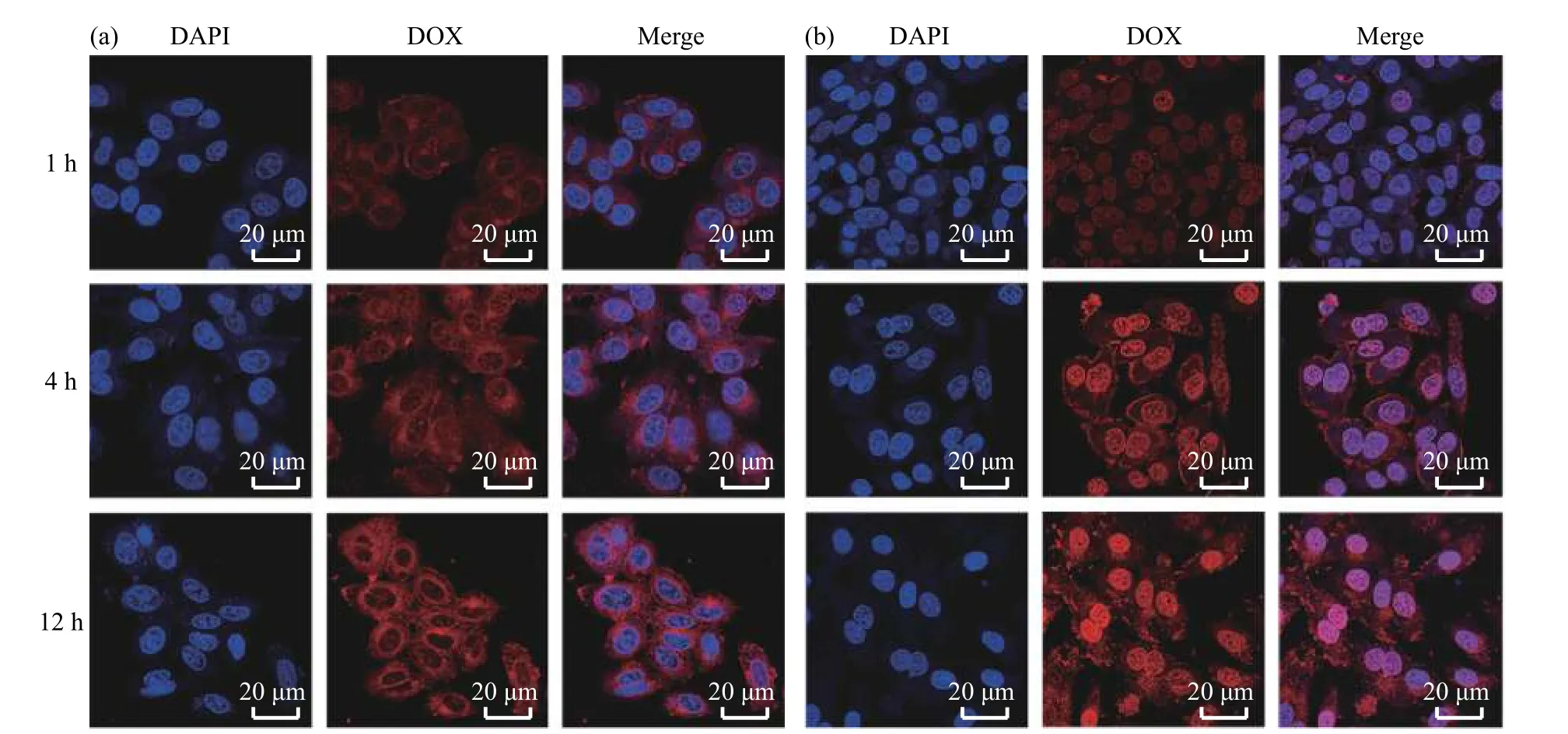
图8 (a)HDP-GNR-DOX 和(b)游离DOX 处理MCF-7 不同时间后DOX 的细胞内分布Fig. 8 Intracellular distribution of DOX in MCF-7 incubated with (a) HDP-GNR-DOX and (b) free DOX
2.5 细胞相容性
HDP-GNR 的细胞毒性如图9(a)所示。当ρ(Au)>5 μg/ mL 时,CTAB-GNR 处理的细胞活性开始明显下降,而当ρ(Au)=40 μg/ mL 时,细胞成活率低于30%,表明CTAB-GNR 具有明显的细胞毒性,主要归因于CTAB 的细胞毒性。相比之下,HDP-GNR 细胞存活率仍高于80%,说明HDP-GNR 细胞相容性优异。

图9 (a) HDP-GNR 的细胞毒性;(b)不同制剂处理MCF-7后的细胞活力;(c)光热化疗(HDP-GNR-DOX + NIR)联合疗效与单纯PTT(HDP-GNR + NIR)和单纯化疗(HDP-GNR-DOX)叠加疗效的比较Fig. 9 (a) Cytotoxicity of HDP-GNR; (b) Viability of MCF-7 treated with different formulations; (c) Comparison of combined efficacy of photothermal chemotherapy (HDPGNR-DOX + NIR) and additive efficacy of single PTT((HDPGNR + NIR) and chemotherapy (HDP-GNR-DOX)
2.6 体外联合治疗
不同制剂处理MCF-7 后的细胞活力如图9(b)所示。由图可以看出,在每种制剂中,细胞存活率均表现出浓度依赖性;游离DOX+NIR 组的细胞存活率与游离DOX 组的相当,说明功率为2.0 W/cm2的NIR 光辐照对细胞活性影响很小。在相同功率NIR 光照射下,HDP-GNR 组细胞毒性明显,表明其光热效应能有效杀死细胞。HDP-GNR-DOX+NIR组的细胞存活率最低,表明联合治疗效果比单一治疗好。为探究HDP-GNR-DOX 中两种治疗模式是否存在协同效应,考察了不同剂量下联合治疗(HDPGNR-DOX+NIR)与单纯PTT(HDP-GNR+NIR)和单纯化疗(HDP-GNR-DOX)叠加效果的差异(图9(c))。结果表明,当ρ(Au)<20 μg/mL 时,前者的细胞杀伤效果显著好于后者,表明HDP-GNR-DOX 中两种治疗方式具有协同抗肿瘤效果。当ρ(Au)>20 μg/mL时,协同效率与叠加效率差异减小,这可能是由于药物质量浓度较大时,单一治疗模式已具有较强的肿瘤细胞杀伤力,掩盖了协同治疗的效果。其协同机制可能是HDP-GNR+NIR 治疗中的高热效应加速了DOX 扩散并增加了癌细胞对DOX 的敏感性[7,18]。
不同剂型对MCF-7 的毒性如图10(a)所示。HDP-GNR 组细胞死亡不明显,说明其细胞毒性可忽略;游离DOX 组仅有小部分细胞死亡;HDPGNR+NIR 组则出现明显的活/死细胞分界线,NIR光辐照区域显示出微弱绿色荧光,表明细胞几乎全部死亡,证明HDP-GNR+NIR 效果优异;HDP-GNRDOX+NIR 组除了NIR 光照射区域展现出更彻底的细胞消融,非辐照区域也出现了明显的死亡细胞。这些结果进一步证实HDP-GNR-DOX 组在肿瘤光热-化疗联合治疗中的优异效果。
随后对不同制剂处理后的MCF-7 进行Annexin V-EGFP/PI 染色,经流式细胞术评估细胞凋亡情况。如图10(b)所示,HDP-GNR 组的细胞凋亡率极低,再次证实纳米载体优异的细胞相容性。而HDP-GNR-DOX +NIR 组细胞凋亡率显著高于单一的化疗(游离DOX 和HDP-GNR-DOX)或HDP-GNR + NIR 治疗组,证实HDPGNR-DOX 在NIR 光照射下能高效诱导MCF-7 凋亡。
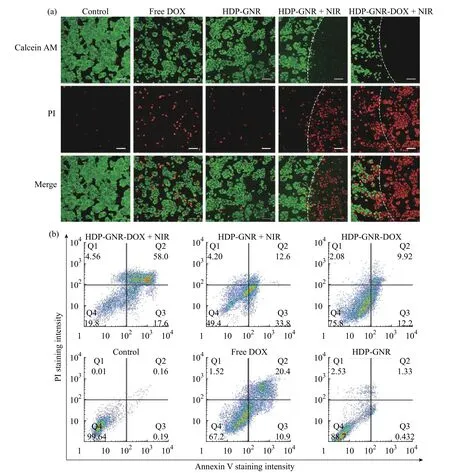
图10 不同剂型对MCF-7 的(a)毒性和(b)凋亡的影响Fig. 10 (a) Fluorescence images and (b) apoptosis of MCF-7 treated with different formulations
3 结 论
(1)成功合成了具有仿贻贝黏附性和能经腙键装载DOX 的三嵌段共聚物。
(2)共聚物可经邻苯二酚基和Au 配位作用修饰于GNR 表面,其DOX 的载药率达8.1%。
(3)该纳米药物在模拟的生理pH 下稳定性良好,可实现光热-化疗协同杀伤乳腺癌细胞的目的。

