利用流式影像术(FlowCAM)分析淡水浮游藻类群落特征
——以北京城区主要河流为例
王珊珊,万 峻,马 丁,董晓伟
北京欧仕科技有限公司,北京 100083
浮游藻类作为水生态系统中重要的初级生产者,其光合作用产生的能量支撑着水生态系统的正常运转。 作为其他生物的直接或间接食物来源,浮游藻类的盛衰直接影响着整个河流生态系统的生产力[1-3]。 另外,浮游藻类对水环境的变化十分敏感,其种类组成和数量变化可在一定程度上反映水环境的变化趋势[4-5],已被广泛用于各类水域的水环境评价[6-7]。 而对浮游藻类的研究、开发和利用都离不开对其种类和数量的准确鉴定,其中,最传统和应用最广的方法是根据藻类的形态特征,利用光学显微镜直接进行物种鉴定和计数[8-9]。 但这需要复杂的人工操作和专业的生物学分类知识,费时费力,极易因观察者的主观判断而造成误差,尤其是当研究区域较大、时效性要求较高时,容易引发样品分析滞后,无法及时准确地反映水体实际状况。 为了更好地研究和利用藻类资源,人们开始寻求和开发更加简便的检测方法,流式影像术(Flow Cytometer and Microscope,FlowCAM)就属于近年发展起来的浮游藻类新型观测方法。 该方法已在欧洲、美国等地的海洋生态系统研究及监测中得到了广泛应用[10-11],但在我国水生态领域的应用还比较滞后,只有少数学者利用FlowCAM 检测了海洋浮游藻类并建立了图谱库[12-13]。 FlowCAM 将流式细胞分析技术与显微成像技术相结合,对通过流通池的每个颗粒进行连续拍摄和计数,可以直观地展示样品中颗粒的图片,并利用专业软件对其结果进行查看、筛选、分类等,对浮游藻类鉴定、物种多样性研究有着重要意义。
城市河流是重要的水生态系统之一,在缓解城市热岛效应、维持城市生态多样性、保障城市给排水等方面发挥着重要的作用。 目前,我国对淡水浮游藻类的研究主要集中在一些重要的河流和湖泊,对北京市主要河流中浮游藻类群落特征的研究较少,仅限于城区的部分河段或者单条河流。因此,本研究利用FlowCAM 对北京城区主要河流中的浮游藻类进行了检测,分析北京城区主要河流中浮游藻类的粒径组成和群落分布特征,以期为北京市河流水质监测与评价提供基础数据和科学依据,为浮游藻类检测提供准确、高效的检测方法。
1 材料与方法
1.1 研究区概况及采样站位设置
北运河水系共有干流和一级支流14 条,总长290 km,较大的支流有温榆河、北沙河、清河、坝河、通惠河、凉水河等。 北运河水系周边是北京市人口最集中、产业最密集、城市化水平最高的区域[14]。 该区域夏季炎热多雨,冬季寒冷干燥,气温季节变化很大。 本研究于2020 年6—7 月(夏季)、10 月(秋季)对北运河水系22 个站位进行了采样调查,站位分布如图1 所示。 使用玻璃采水器在水面以下0.5~1 m 处采集水样1 L,置于样品瓶中。 将水样带回实验室后,加入体积分数为40%的甲醛溶液,用量为水样体积的4%。
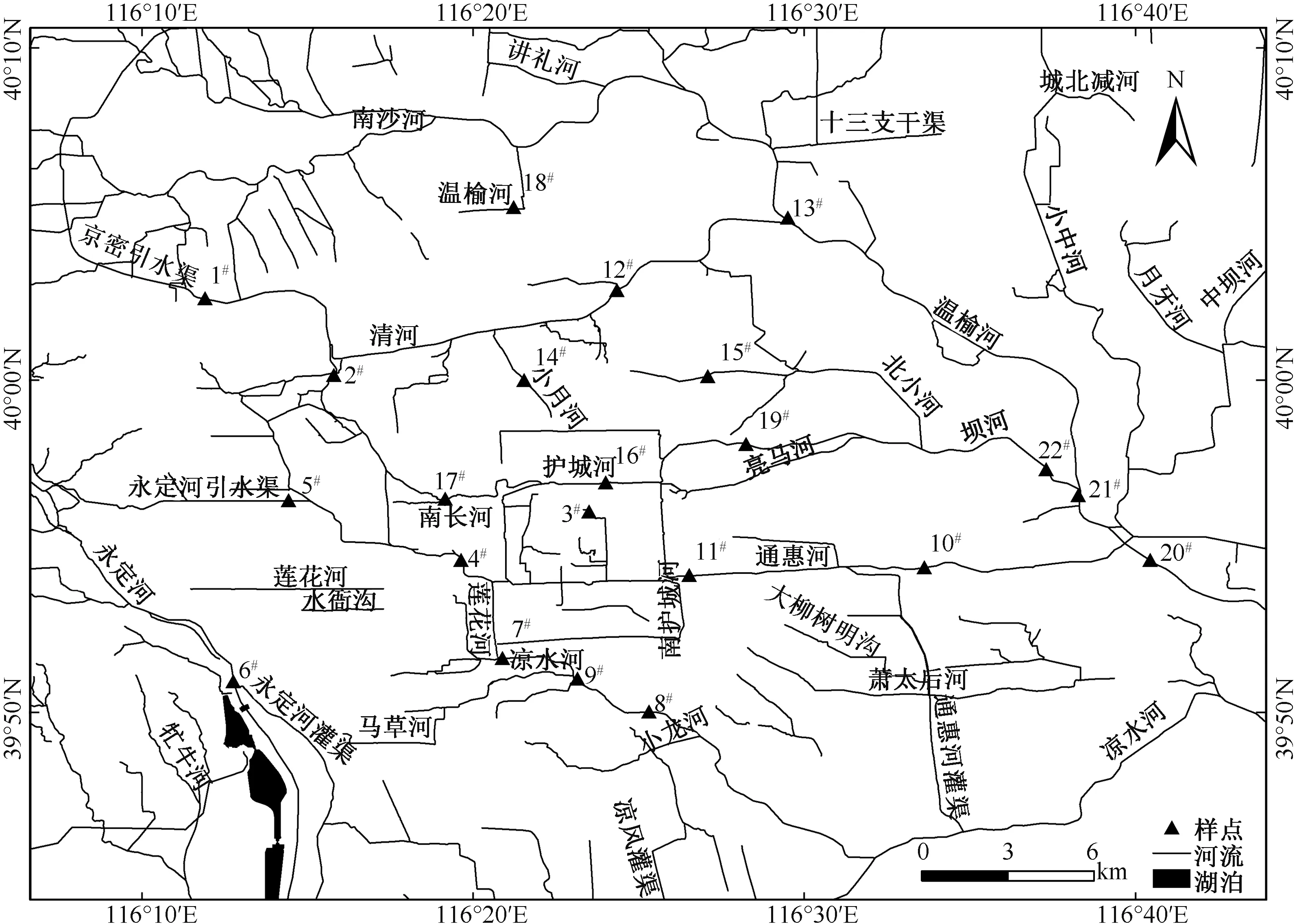
图1 采样站位分布Fig.1 Distribution of the sampling stations
1.2 FlowCAM 的原理及检测方法
如图2 所示,FlowCAM 主要由流控系统、光学系统和电学系统3 个子系统构成。 其中,流控系统主要包括流通池、注射器等,光学系统包括物镜、荧光检测器、激光器等光学部件,电学系统主要控制整个设备的运转、获取图像信号和完成数据处理等。 FlowCAM 包含荧光触发和自动成像两种工作模式,本研究主要应用自动成像模式。
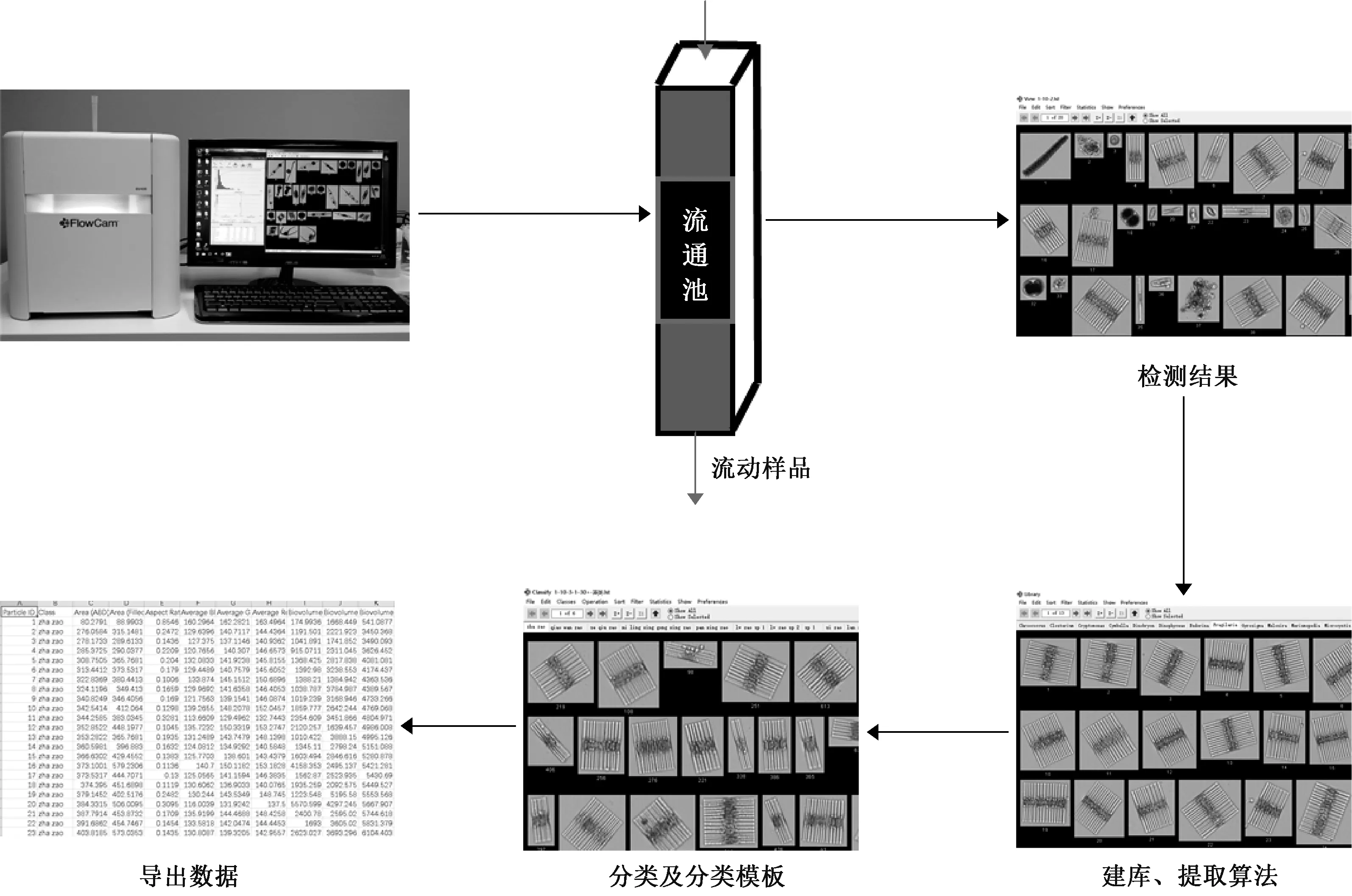
图2 FlowCAM 原理和样品检测流程Fig.2 FlowCAM principle and sample testing process
FlowCAM 工作流程:①根据流通池的大小规格,利用对应目数的筛绢对样品进行过滤,将过滤后的样品放置在不同倍镜下检测,检测范围为5~600 μm。 ②在自动成像模式下,将样品以预设的速度导入流通池,按照预先设定的时间间隔抓拍、保存流动颗粒的图像,直接给出样品中颗粒物的总浓度和每个颗粒的42 个形态学参数。 ③利用FlowCAM 配置的Visual Spreadsheet 软件处理数据,快速筛选出样品中的同种藻类,保存为数据库并提取筛选算法。 将筛选算法加载到分类模板中,保存模板以供重复使用。 最后,导出分类数据。
每个样品至少计数3 次,若同一样品的3 次计数结果与平均值之差不大于±15%,即视为有效结果,取其平均值。 藻类物种鉴定主要参考《中国淡水藻类——系统、分类及生态》[15]、《中国常见淡水浮游藻类图谱》[16]、《中国内陆水域常见藻类图谱》[17]等。
1.3 数据处理与分析
Visual Spreadsheet 软件可以自动计算每种藻类的数量、长度、宽度、直径、面积等统计学参数,并导出到Excel 中,利用Excel 软件进行数据处理和图表绘制。 FlowCAM 以1 个群体的剪贴图像为1 个细胞,因此,单一细胞个体(如针杆藻、小环藻等)的细胞丰度按软件给出的细胞数量直接计数;规则团块(如栅藻、盘星藻等)则根据其细胞数量倍数特性进行计数;丝状藻体(如鱼腥藻、直链藻等)以20 μm 为一个计数单位进行计数;不规则团状藻体(如微囊藻等)以每个藻体的平均面积和浓度进行换算,具体换算方式见公式(1)。
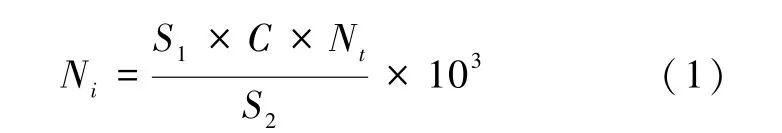
式中:Ni为藻类物种i的细胞丰度,cells/L;S1为藻类物种i群体的平均面积,即图3 中的“Area(ABD)”,μm2;C为藻类物种i群体的浓度,即图3 中的“Particles/ml”,cells/mL;S2为选取的藻类物种i的总面积,μm2;Nt为选取的藻类物种i的总个数。 图3 中的数据是由Visual Spreadsheet软件直接导出到Excel 中得到的。
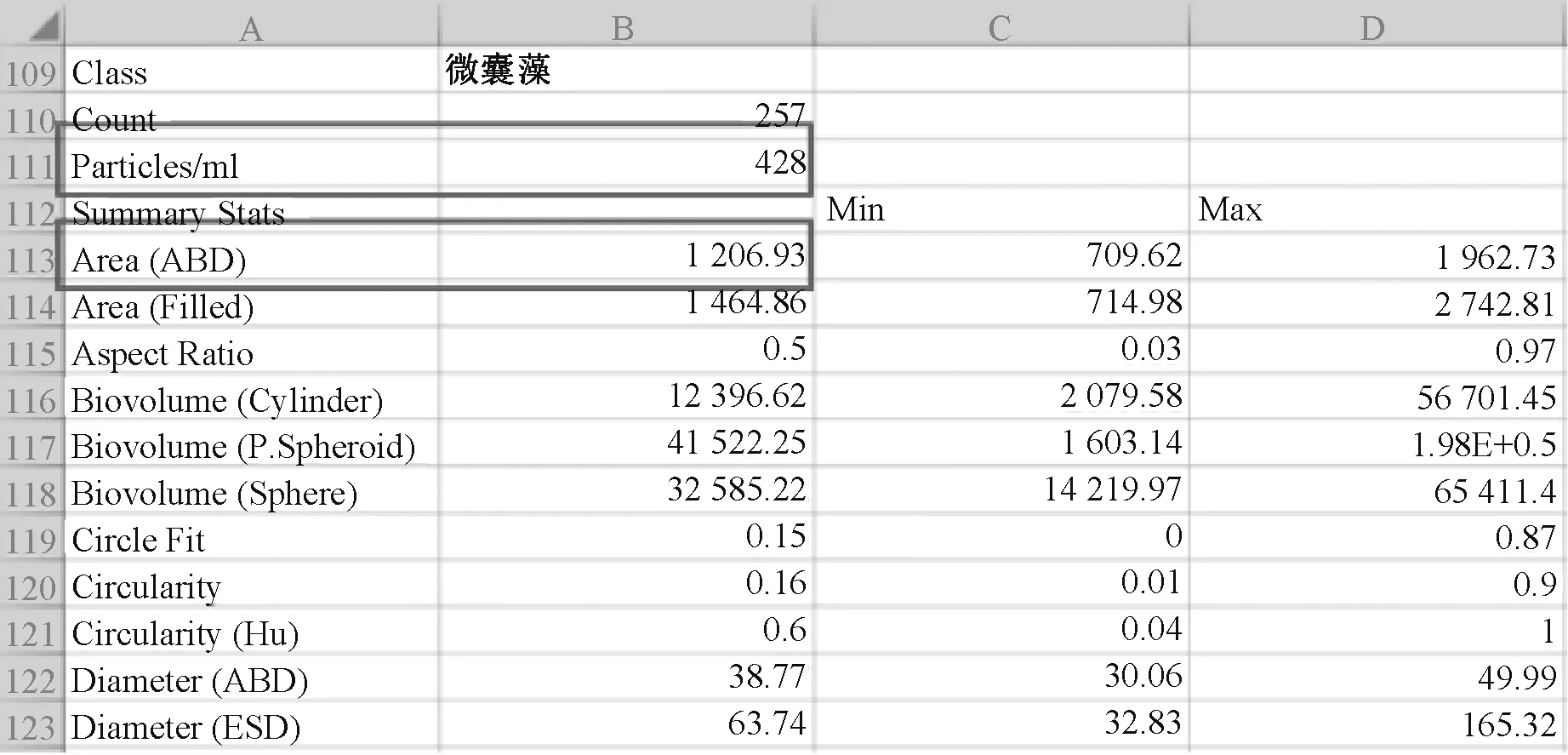
图3 Visual Spreadsheet 软件中微囊藻各参数的分类统计信息Fig.3 Classified statistics of Microcystis parameters in Visual Spreadsheet
优势属是根据物种出现的概率来确定的,用相对丰度表示:

式中:P为相对丰度;Ni为藻类物种i的细胞丰度;N为样品中全部藻类物种丰度之和。
2 结果分析
2.1 浮游藻类细胞丰度分布特征
对比分析22 个采样站位夏、秋季节浮游藻类的细胞丰度(图4)可以发现,其存在着明显的时空差异特征。 从季节上看,夏季浮游藻类的细胞丰度整体上要高于秋季。 其中:夏季浮游藻类的细胞丰度范围为 4. 69 × 105~3. 35×107cells/L,平均值为5. 80×106cells/L;秋季浮游藻类的细胞丰度范围为2.60×105~2.74×107cells/L,平均值为3.78×106cells/L。 从空间上看,夏、秋季节浮游藻类细胞丰度的最大值均出现在21#(温榆河大桥)采样站位,最低值分别出现在9#(南护城河)、14#(小月河)采样站位。
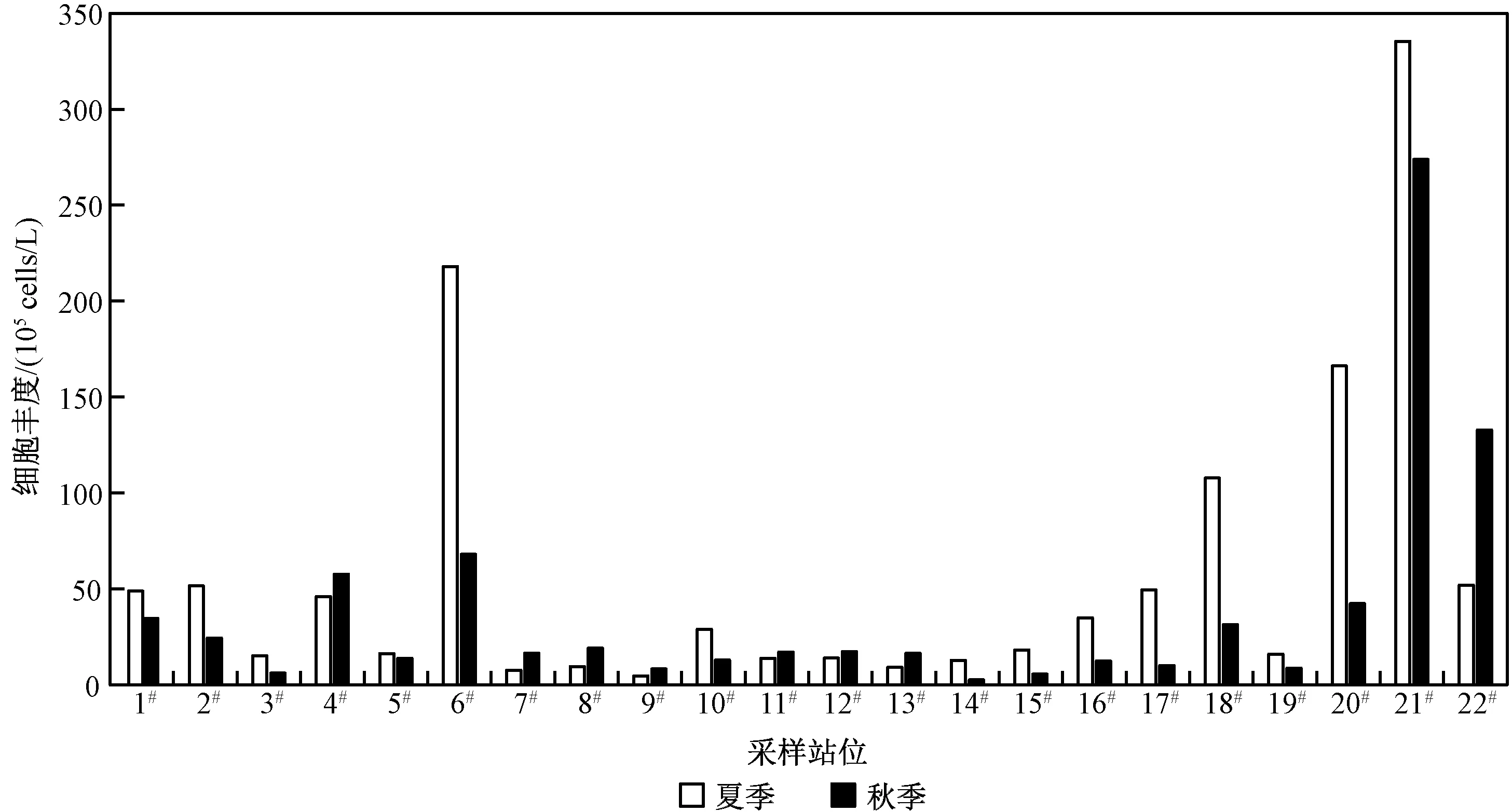
图4 2020 年夏秋季北京城区主要河流浮游藻类细胞丰度分布特征Fig.4 Distribution characteristics of phytoplankton abundance in major rivers of Beijing in summer and autumn of 2020
为了验证使用FlowCAM 检测细胞丰度时的准确性,选择8 个站位的秋季样品进行显微镜检测对比分析,结果如图5 所示。 8 个采样站位的秋季样品中,利用FlowCAM 检测出的浮游藻类细胞丰度介于7.19×105~3.39×107cells/L,平均值为8.91×106cells/L,最高值出现在21#(温榆河大桥)采样站位,最低值出现在3#(什刹海银锭桥)采样站位。 利用显微镜检测出的浮游藻类细胞丰度最大值为20#(北运河)采样站位的3.46×106cells/L,最小值为19#(坝河)采样站位的2.45×105cells/L,平均值为1.55×106cells/L。 两种检测方法相比,使用FlowCAM 得到的细胞丰度整体上要高于显微镜检测法。
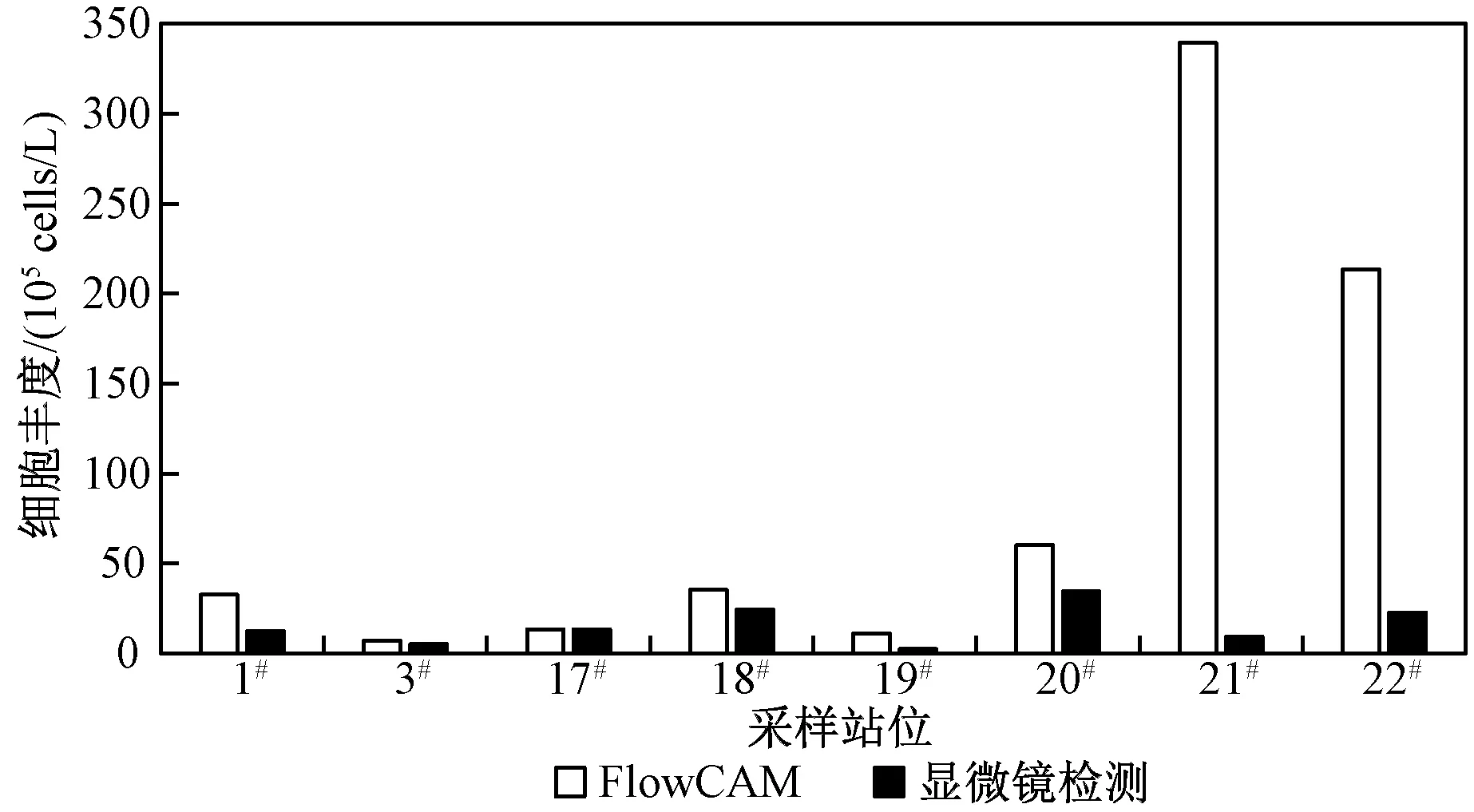
图5 两种方法下的浮游藻类细胞丰度对比Fig.5 Comparison of phytoplankton abundance under the two methods
2.2 浮游藻类粒径组成
按照粒径大小,浮游藻类一般可以分为微微型浮游藻类(Picophytoplankton,<2 μm)、微型浮游藻类(Nanophytoplankton,2~20 μm)、小型浮游藻类(Microphytoplankton,20~200 μm)和中型浮游藻 类(Mesoplankton,200 ~ 2 000 μm)。 利 用Visual Spreadsheet 软件按粒径大小对检测结果进行分级,结果如图6 所示。 此次采集的夏、秋两个季节的样品中,均未检测到中型浮游藻类。 小型浮游藻类的图像较为清晰,建库和自动分类效果较好,物种类别基本可以鉴定到属,部分藻类的建库图片如图7 所示。 微型浮游藻类颗粒较小,图像模糊,自动分类效果很差,多数需要人工挑选,每个样品检测一次所需时间约为8 h,耗时耗力且很难鉴定到种或属。 因此,本研究仅对粒径>20 μm 的小型浮游藻类进行物种鉴定和数量统计,对粒径<20 μm 的微型浮游藻类只做数量统计,不做物种鉴定。
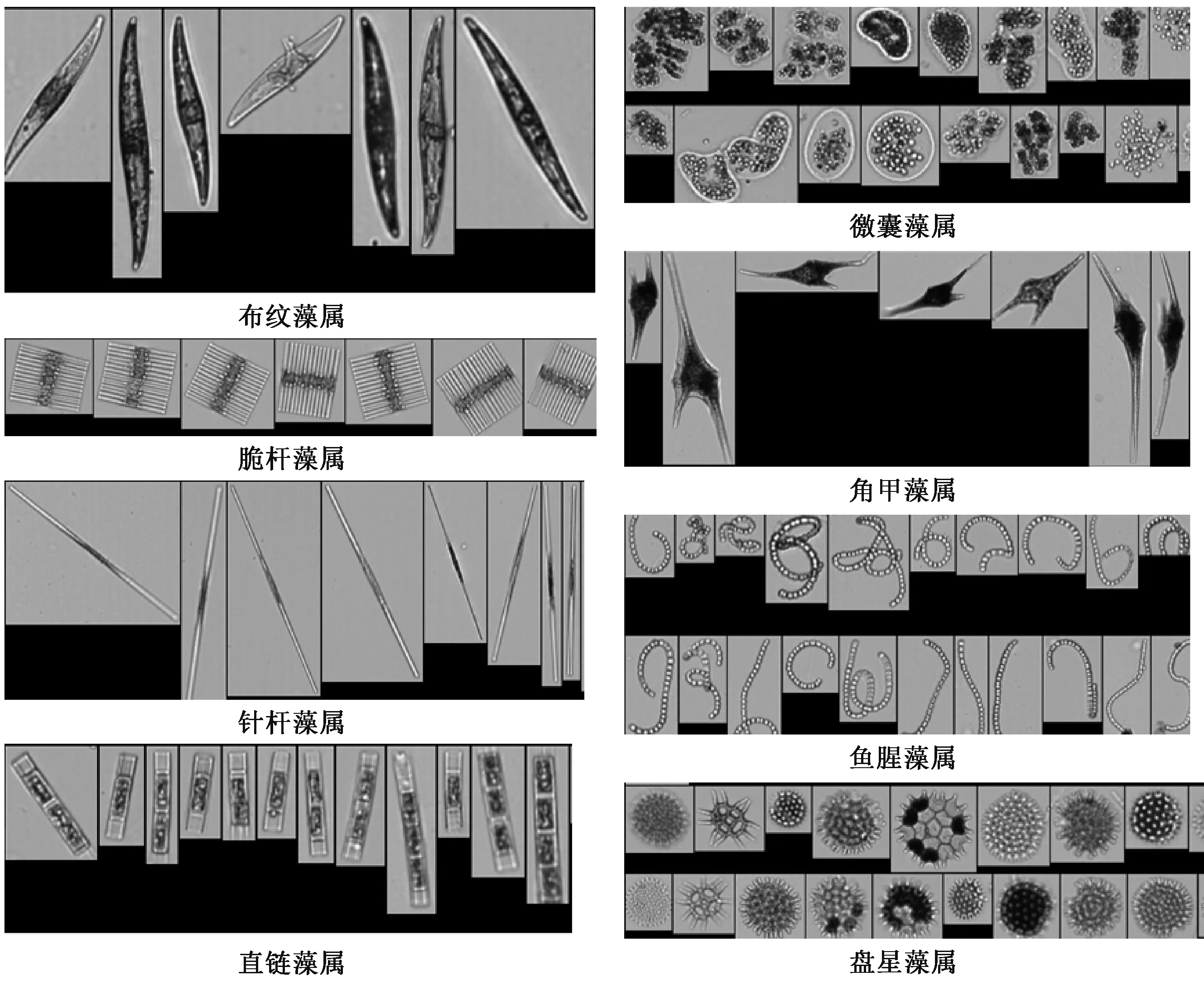
图7 部分小型藻类建库图片Fig.7 Some pictures of microphytoplankton for database construction
结果显示,22 个采样站位夏、秋季节的浮游藻类在粒径组成上存在着明显的时空差异(图8)。
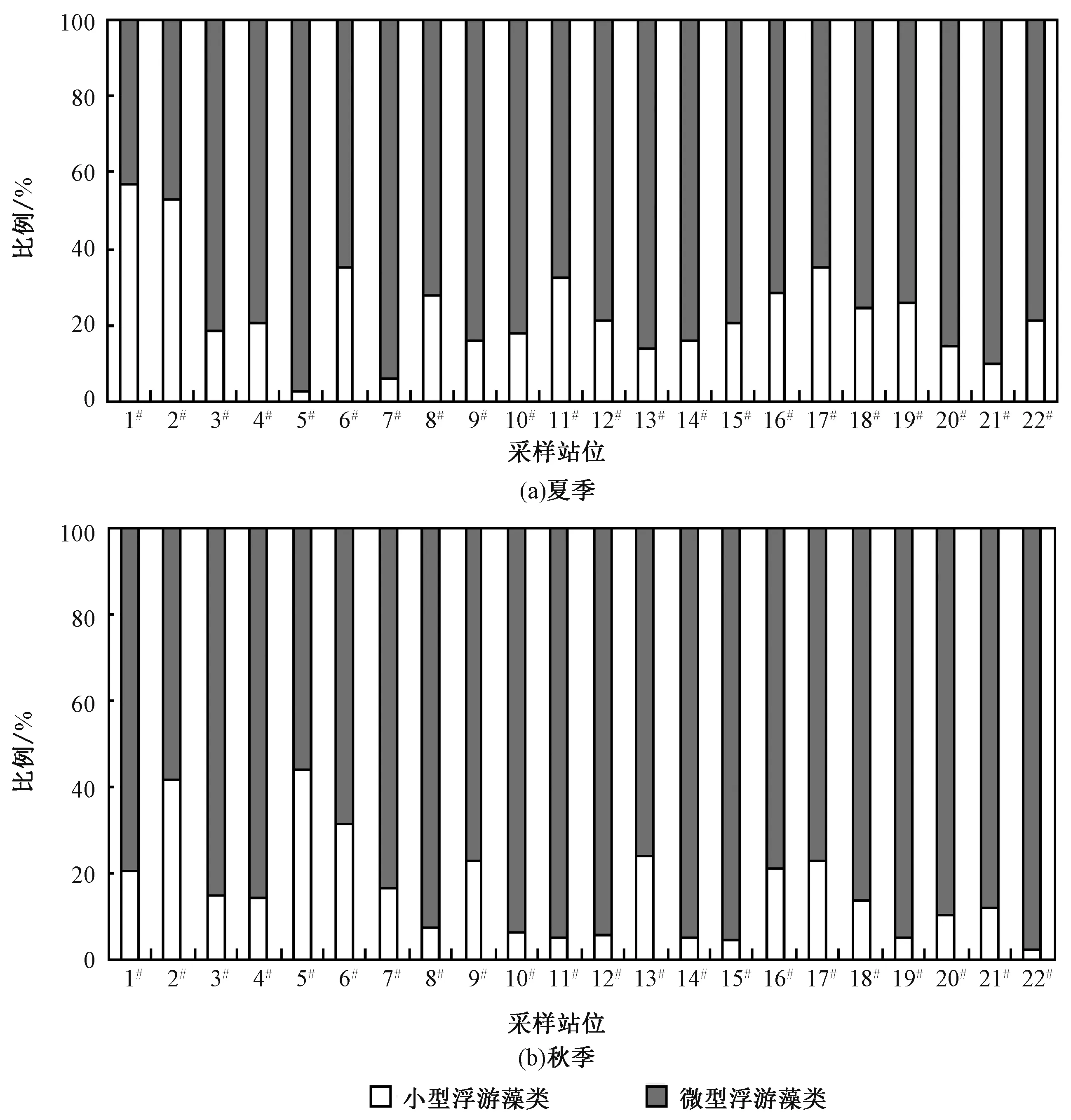
图8 2020 年夏秋季北京城区主要河流浮游藻类的组成Fig.8 Composition of phytoplankton in major rivers of Beijing in summer and autumn of 2020
从图8 可以明显看出,随着季节的变化,多数站位小型浮游藻类所占比例明显降低。 在夏季,各采样站位小型浮游藻类所占比例的范围为3.11%~56.91%,平均值为23.66%。 其中:小型浮游藻类占优势地位的站位为1#(京密引水渠向山路)和2#(京密引水渠入昆明湖)采样站位,所占比例分别为56.91%和53.17%;占比较少的站位为5#(永定河引水渠)和7#(凉水河上段)采样站位,所占比例分别为3.13%和6.19%。 在秋季,各采样站位小型浮游藻类所占比例的范围为2. 53%~44. 28%,平均值为16. 02%。 其中:小型浮游藻类占比较多的站位为5#(永定河引水渠)和2#(京密引水渠入昆明湖)采样站位,所占比例分别为44. 28%和41. 74%;占比较少的站位为8#(凉水河中段)、10#(通惠河)、11#(通惠河上段)、12#(清河立水桥)、14#(小月河)、15#(北小河)、19#(坝河)和22#(坝河金榆路)采样站位,所占比例均少于10%。
2.3 小型浮游藻类物种组成
夏季小型浮游藻类主要由硅藻、绿藻、蓝藻、甲藻、金藻和隐藻组成,共鉴定出37 个属,包括硅藻18 个属、绿藻10 个属、蓝藻5 个属、甲藻2 个属、金藻1 个属、隐藻1 个属[图9(a)]。 硅藻和绿藻是研究区夏季小型浮游藻类的主要类群,占物种数的比例分别为48.65%和27.03%。 秋季小型浮游藻类主要由硅藻、绿藻、蓝藻和甲藻组成,共鉴定出21 个属,包括硅藻9 个属、绿藻7 个属、蓝藻4 个属、甲藻1 个属[图9(b)]。 硅藻和绿藻是研究区秋季浮游藻类的主要类群,占总物种数的比例分别为42.86%和33.33%。
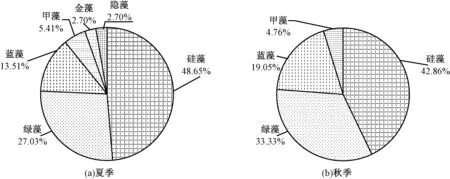
图9 2020 年北京城区主要河流小型浮游藻类物种组成及所占比例Fig.9 Species composition and proportion of microphytoplankton in major rivers of Beijing in 2020
2.4 小型浮游藻类优势属组成及分布特征
各个采样站位小型浮游藻类优势属(相对丰度>5%)的组成与分布如图10 所示。 多数站位的优势属占小型浮游藻类总物种丰度的80%以上,基本可以代表该站位的小型浮游藻类物种组成和季节变动情况。
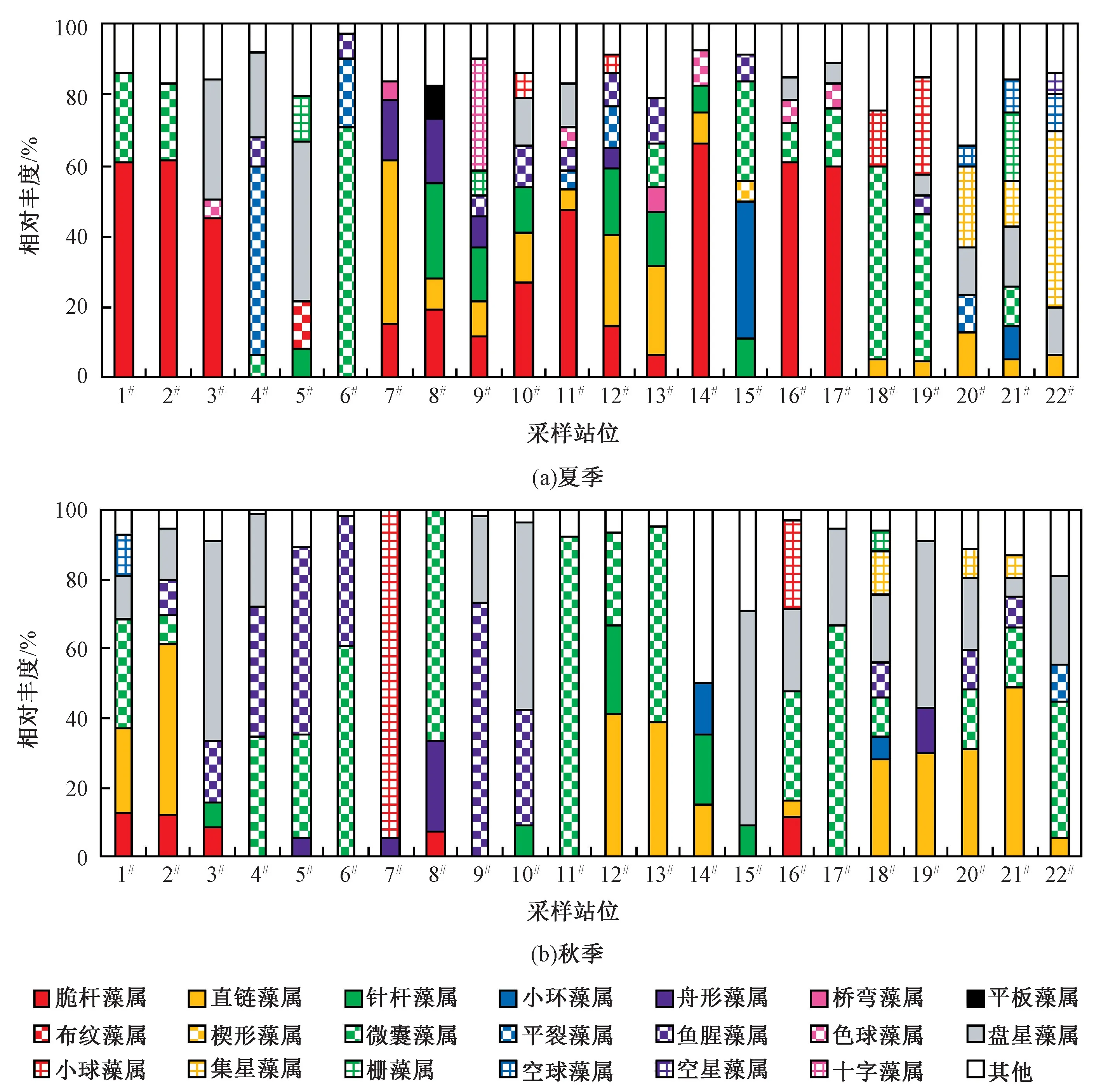
图10 2020 年夏秋季北京城区主要河流小型浮游藻类优势种的分布Fig.10 Distribution of dominant species of planktonic algae in major rivers of Beijing in summer and autumn of 2020
从季节上看,多数站位夏季优势属的个数要明显高于秋季。 在夏季,多数站位以硅藻门脆杆藻属、直链藻属、针杆藻属、小环藻属和舟形藻属为主。 其中:4#(西护城河起点)、6#(永定河卢沟新桥)和18#(温榆河)采样站位以蓝藻门囊藻属、平裂藻属和鱼腥藻属为主;5#(永定河引水渠)、21#(温榆河大桥)和22#(坝河金榆路)采样站位以绿藻门盘星藻属和集星藻属为主。 在秋季,多数站位的优势属转变为以蓝藻门微囊藻属和鱼腥藻属为主。 其中:3#(什刹海银定桥)、7#(凉水河上段)、10#(通惠河)和15#(北小河)采样站位以绿藻门盘星藻属和小球藻属为主;硅藻门占优势地位的站位仅包括2#(京密引水渠入昆明湖)、12#(清河立水桥)和14#(小月河)采样站位。 因此,随着季节的变动,小型浮游藻类优势属的物种组成由夏季的以硅藻为主转变为秋季的以蓝藻或蓝藻-绿藻为主。
3 讨论
3.1 影响浮游藻类分布的因素
浮游藻类既受到各种环境因素的影响,又能反映出各种环境因子的变动趋势。 一直以来,如何准确检测出浮游藻类的物种组成和丰度都是水生态研究中的关键内容之一。 在本研究中,各采样站位的浮游藻类细胞丰度存在着较大的空间差异,这可能与采样站位的地理位置有关。 夏、秋季节浮游藻类细胞丰度的最大值均出现在21#(温榆河大桥)采样站位,最低值分别出现在9#(南护城河)、14#(小月河)采样站位。 从地理位置上看,南护城河和小月河均位于人员密集的城市中心,受到更多人类活动的影响,而温榆河大桥位置较偏僻,人为影响较少,生态环境较好。 同时,位置较为偏僻的18#(温榆河)、20#(北运河)和22#(坝河金榆路)采样站位的浮游藻类细胞丰度均较高。 一般而言,当水体受到污染时,营养盐水平会升高,导致耐受污染的某一种藻类大量繁殖,如引发水华的微囊藻,进而导致浮游藻类其他物种减少[18-19]。 另外,有研究表明,水体营养盐水平对浮游藻类的个体大小也有明显影响[20]。 一般认为,随着水体富营养化水平的升高,生长周期短的微型浮游藻类更占优势。 例如,在本研究中,1#(京密引水渠向山路)和2#(京密引水渠入昆明湖)采样站位属于饮用水水源地,其水体较清洁,营养盐水平较低,所含浮游藻类体型较大、丰度较低。
随着季节的变化,藻类群落中的不同物种会出现明显的更替,其中,温度是水环境中影响藻类生长极为重要的因素。 从季节上看,从夏季到秋季,藻类物种数量会明显减少。 这种分布规律主要与水温的变动有关:水温越低越不利于其生长代谢,出现的种类越少;只有温度适宜,藻类才会大量出现[21-23]。 在本研究中,藻类总物种数在水温较低的10 月较小,而在水温较高的7 月较大。由图10 可知,北京地区主要河流的优势种群主要为硅藻、绿藻和蓝藻,这一研究结果与之前关于北运河浮游藻类的研究结果一致[24-25]。 城市河流浮游藻类的种类组成和分布不仅仅受水文、温度、光照等环境因素的综合影响,更受到人类活动的影响。 已有研究表明[26-27],在未受污染的河流中,硅藻为主要浮游藻类种群;在河流受到人为污染以后,蓝藻、绿藻的种类会增多。 在本研究中,受污染较少的京密引水渠同样以硅藻为优势种。
3.2 FlowCAM 与传统检测方法的比较分析
FlowCAM 自动成像模式和显微镜检测法的分类原理相同,均是根据待鉴定物种的形态学特征进行计数和鉴定。 区别在于显微镜检测法均以人工操作为主,而FlowCAM 将待测样品状态由静置变为流动,根据流动速率实时拍照,实现了对样品的自动计数,并根据获得的图片进行后续的分类鉴定。 这一操作不仅大大缩短了样品鉴定的时间,还增大了所检测样品的体积。 在本研究中,FlowCAM 的检测速度一般设置为 0.5 ~2 mL/min,根据样品浓度和所选用倍镜的不同,可以灵活调控,一般计数一个样品只需要几分钟。另外,利用显微镜进行样品检测前,需要先对样品进行浓缩处理,浓缩过程至少需要48 h,且在移除样品上清液时很可能会导致浮游植物的损失[28]。FlowCAM 可以检测到的颗粒浓度范围较广,一般来说,低于10 万个/mL 的样品均可直接进样,而不需要进行浓缩、稀释等前处理,因此,可直接对采集到的新鲜样品进行检测,省略添加固定剂、浓缩等步骤,不仅节约时间,还可以保证样品的真实性,避免样品保存过程中的破损和分解。 这可能就是本研究中采用FlowCAM 检测出的浮游藻类细胞丰度整体要高于显微镜检测法的原因。
但与显微镜检测相比,FlowCAM 检测的分辨率会有所下降。 一是因为在FlowCAM 检测过程中,样品是流动的,且焦距固定,这就无法保证所有颗粒都得到很好的对焦,可能会有一小部分颗粒因对焦不清晰而导致图像模糊,进而导致分类结果不准确。 二是因为FlowCAM 检测的样品颗粒是多维度的,同一物种拍出的图片会有不同的形态特征,这就增加了建库分类的难度。 显微镜分析只允许在水平面上进行,其样品是固定的,同时分析人员可以通过人为改变焦距来更好地检查生物体的细节。 因此,显微镜处理通常可将浮游藻类鉴定到种或属水平,而FlowCAM 对粒径在20 μm 以上的小型浮游藻类可以鉴定到属的水平,对粒径在20 μm 以下的微型浮游藻类只能提供较低分辨率的图像,分类效果较差。
3.3 FlowCAM 的应用广泛性及不足
FlowCAM 由 美 国 Yokogawa Fluid Imaging Technology 公司研发。 该方法首先综合利用流式细胞仪和显微成像技术进行细胞识别和计数,之后利用处理软件实现颗粒筛选和自动分类。 该处理软件属于显微图像辅助处理系统,可以快速地从图像数据中集中提取大量信息[29]。 将FlowCAM 与新颖的机器学习算法相结合,可以同时识别和计算成像颗粒的长度、宽度、面积等多个指标,从而对浮游植物的各个特征进行快速而准确的估计。 因此,FlowCAM 大大减少了处理浮游植物样本的时间,并增加了所检测样品的体积,在水生态环境监测和研究中具有很大的应用空间。实际上,很多研究和监测并不需要精确知道水样中每一个物种是如何分布和变化的,例如对有害藻华等的监测,只需要测定其类群总量,或不同群落的物种丰度变动趋势。 研究人员曾在墨西哥湾通过FlowCAM 检测到有害浮游藻类物种的细胞丰度在不断增加,为几次藻类大量繁殖提供了早期预警[10]。 因此,可以利用FlowCAM 监测河流浮游藻类优势种的变动,以此反映城市河流的污染状况,为河流治理提供数据支撑。
以生物个体大小为基础的粒径方法,能够克服物种分类方法的局限,使生物群落、生态系统研究摆脱物种间复杂关系的阻拌。 许多研究表明,浮游藻类的新陈代谢、光合作用、能量利用等生理特性都与其粒径大小和分布有关[20]。 粒径的改变同样可以反映出周围环境的变化,如藻华的生成、光照和营养盐等的变化。 在富营养化程度较高的水体,藻类粒径往往较大[30]。 目前主要的浮游藻类粒径测量方法为显微测微计法、叶绿素a粒级分离法等。 其中,显微测微计法是测量浮游藻类粒径的经典和基准方法,以目镜测微尺为标尺测量细胞的长、宽、高等线性参数,然后根据相关几何公式计算细胞的体积,并将体积折算为球体的个体等效直径。 然而许多浮游藻类的细胞形状很不规则,计算细胞体积时很难选取到合适的计算公式,需要测量足够多数量的细胞才能得到具有统计意义的粒径数据。 因此,这种方法虽然可以直观地测算出细胞粒径的大小和分布情况,但是测量过程耗时较长且存在较大的误差。 叶绿素a 粒级分离法虽然简单、易操作,但用网筛和滤膜进行粒级分离时,势必会造成很大的误差。FlowCAM 的应用可使这些问题迎刃而解。
但FlowCAM 在分类方面也有一些不足之处,比如对20 μm 以下的微型浮游藻类的拍摄效果较差,图像分辨率较低,很难实现自动分类,且每一个样品的分类时间达8 h 以上,很难鉴别到种或属,存在很大的误差。 FlowCAM 的自动分类功能在实际应用中还只是半自动分类,仍然需要一定程度的人工辅助,同时需要使用者根据实际情况建立适用于该水体的藻类信息数据库,方可实现部分藻类的自动分类。 虽然目前FlowCAM 还没有完全解决需要人工辅助分类鉴定的问题,但是研究人员已经在尝试开发可达到自动分类水平的新方法,以推动FlowCAM 在浮游藻类分类鉴定方面获得新的突破。
4 结论
1)2020 年夏秋季,北京城区主要河流22 个站位的浮游藻类细胞丰度存在着明显的时空差异,夏季整体高于秋季。 在粒径组成上,以微型浮游藻类和小型浮游藻类为主,且随着季节的变动,多数站位的小型浮游藻类占比明显降低。 在物种组成上,小型浮游藻类以蓝藻、绿藻和硅藻为主。随着季节的变化,不同采样站位小型浮游藻类群落中的优势物种存在着明显的更替,优势属的物种组成由夏季的以硅藻为主转变为秋季的以蓝藻或蓝藻-绿藻为主。
2)利用FlowCAM 可以快速完成对浮游藻类的计数、粒径分级和对小型浮游藻类的识别鉴定。与显微镜检测法相比,FlowCAM 减少了样品前处理的时间,增加了所测量样品的体积,在细胞计数上有明显优势。 FlowCAM 对粒径在20 μm 以上的小型浮游藻类可以鉴定到属水平,但对粒径在20 μm 以下的微型浮游藻类只能提供较低分辨率的图像,分类效果较差。
3)FlowCAM 在水生态环境监测和研究中具有很大的应用空间,但在浮游藻类分类方面还存在很多不足,需进一步优化提升。

