高热稳定性α-氧化铁的宏量制备及其电化学性能研究
路 正,陈昆峰,薛冬峰
(1.山东大学晶体材料国家重点实验室,山东济南 250100;2.中国科学院深圳先进技术研究院,多尺度晶体材料研究中心;3.中国科学院深圳理工大学)
赤铁矿(α-Fe2O3)作为一种n型半导体[1],具有2.2 eV的低带隙、无毒、高耐腐蚀性和可见光吸收等特点[2],被广泛应用于染料、传感器、废水处理和锂离子电池等领域[3-6],并且长期以来被认为是一种有前途的光催化剂[7-8]。由于氧化铁广泛的应用前景,研究人员合成了棒状[9-10]、线状[11-12]、鼓状[13]、花状[14]、管状[15]及片状[16-17]等颗粒状的α-Fe2O3。其中,片状α-Fe2O3具有独特的性质,探究如何对其进行设计使之成为具有特殊物理和化学效应的功能材料已经成为人们深入研究的课题。云母结构的六边形片状α-Fe2O3晶体具有高反射率、高折射率、高取向性等特点,并且片状α-Fe2O3晶体有深黑色、淡红色、棕色和灰色等多种色调,常被用作油漆、染料、塑料以及化妆品等的添加剂。当今世界全球变暖、海平面上升、冰川融化,碳中和已经成为全球的共识,锂电池在中国实现“双碳”的国家战略中具有重要的地位,过渡金属氧化物由于具有较高的理论比容量、丰富的资源和较低的成本被认为是最具潜力的负极材料之一。α-Fe2O3由于其较高的比容量,近些年来受到广泛关注。
WANG等[18]通过对Fe(OH)xOy进行水热处理合成了各种形状(片状、多面体、假立方体和花生状)的α-Fe2O3颗粒,其表观颜色随着其颗粒大小和形状的变化而变化,拉曼光谱表征结果表明α-Fe2O3颗粒的振动频率随着其颗粒尺寸的减小而减小。HANG等[19]通过水热法制备了不同形状和尺寸的α-Fe2O3材料,研究了α-Fe2O3颗粒的结构和形貌对其电化学特性的影响,结果表明氧化铁颗粒的形状显著影响α-Fe2O3/C复合电极的氧化还原反应速率和放电容量,其中立方形状的α-Fe2O3表现出最高的放电容量。MANSOUR等[20]分别在水中和多元醇中沉淀制得不同尺寸的α-Fe2O3纳米粒子,发现在水中沉淀合成样品的平均颗粒尺寸约为36 nm,在多元醇中合成样品的平均颗粒尺寸约为54 nm。此外,光学性质测试结果表明在水中沉淀合成的α-Fe2O3带隙能量(2.07 eV)高于在多元醇中合成的α-Fe2O3带隙能量(1.97 eV)。ZENG等[21]采用无模板水热法合成了直径约为30 nm、长度可达500 nm的均匀α-Fe2O3介孔材料,并且研究了带隙、放电容量与α-Fe2O3纳米棒尺寸的关系。HUANG等[22]重点研究了不同结构氧化铁的电化学性质,如赤铁矿(α-Fe2O3)、四方纤铁矿(β-FeOOH)、具有独特结构的Fe2O3·2FeOOH·2.6H2O以及不同晶体尺寸和形态的高铁酸盐。电化学测试结果表明,纳米级尺寸的赤铁矿通常比微米级尺寸的赤铁矿具有更高的容量;在不同的晶体结构中,赤铁矿和四方纤铁矿都优于高铁酸盐,尽管后者的晶体尺寸最小。
目前已有通过调整FeCl3溶液与NaOH溶液的混合工艺获得不同尺寸α-Fe2O3的报道[23],但是对于通过不同混合工艺获得片状α-Fe2O3的电化学性能、表观颜色与粒子大小的关系的研究还存在不足。笔者研究了片状α-Fe2O3的合成条件与电化学储锂及表观颜色之间的关系,以助于发掘α-Fe2O3在电化学、陶瓷釉料和颜料等方面的应用潜力。
1 实验部分
1.1 试剂与仪器
试剂:六水合三氯化铁(FeCl3·6H2O,AR),氢氧化钠(NaOH,AR),无水乙醇(CH3CH2OH,AR),聚偏氟乙烯(PVDF,AR),N-甲基吡咯烷酮(NMP,AR),金属锂(Li,纯度为99.9%)。
仪器:CHI660E型电化学工作站;CT3001A型充放电仪;Smart Lab 9KW型X射线衍射仪(XRD);JSM-6700F型扫描电子显微镜(SEM);岛津UV2600型紫外-可见分光光度计;岛津IRAffinity-1S型红外光谱仪(FT-IR)。
1.2 实验方法
分别配制2 mol/L的FeCl3·6H2O溶液和6、8、12 mol/L的NaOH溶液。将50 mL浓度为2 mol/L FeCl3·6H2O溶液滴加至50 mL正在充分搅拌的NaOH溶液中(称为R-mixing);将50 mL NaOH溶液滴加至50 mL正在充分搅拌的FeCl3·6H2O溶液中(称为N-mixing)。将上述混合溶液继续搅拌20min,然后加入到聚四氟乙烯内衬的不锈钢反应釜中,放入预热至180℃的保温箱中水热处理2 h。水热反应结束后,待产物自然冷却至室温后离心分离,移出上清液,将沉淀物分别用去离子水和无水乙醇各洗涤数次,在60℃干燥6 h,即可得到质量为6 g左右并且具有不同颜色的Fe2O3样品。
1.3 电池制备
将α-Fe2O3、乙炔黑、PVDF以质量比为8∶1∶1混合,加入NMP研磨30 min,然后涂覆在Cu箔上,真空干燥12 h。在充有氩气的手套箱中将Li/α-Fe2O3组装成2032纽扣电池。将玻璃微纤维隔膜置于电极和锂片之间,并用溶解于体积比为1∶1的碳酸二甲酯(DMC)和碳酸乙烯酯(EC)的1 mol/L液体电解质LiPF6完全润湿隔膜。最后在1~3 V(vs.Li/Li+)对Li/α-Fe2O3电池进行测试。
2 结果与讨论
2.1 XRD分析
FeCl3和NaOH以不同浓度和不同顺序加料,水热反应2 h得到6种产物,样品XRD谱图见图1。从图1看出,6个产物的XRD峰与标准PDF卡片(JCPDS,33-0664)完全吻合,并且没有多余的杂质峰,说明α-Fe2O3纯度较高;当NaOH溶液浓度较低时,制备的α-Fe2O3XRD峰强度较低,说明结晶性较差。
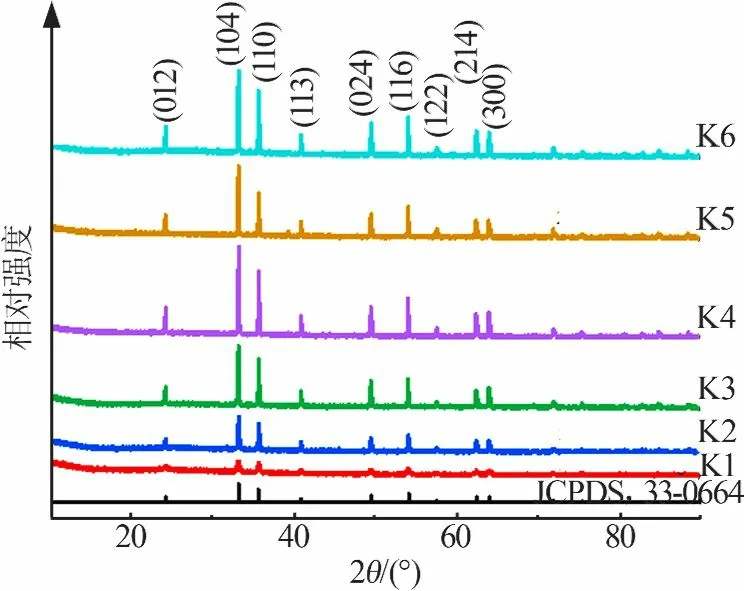
图1 FeCl3和NaOH以不同浓度和不同顺序加料合成α-Fe2O3的XRD谱图Fig.1 XRDpatternsofα-Fe2O3 synthesized in different FeCl3 and NaOH concentration and adding sequence
样品的XRD峰变宽主要受微晶尺寸和内部应变的影响。根据Scherrer公式可近似评估样品的微晶尺寸(Dc)[24]。

式中:K为形状因子(取0.9);γ为波长(0.154 18 nm);β为半峰宽(FWHM);θ为衍射角。选择(104)面计算α-Fe2O3微晶尺寸(结果见表1)。结果表明,随着NaOH浓度升高,(104)面衍射峰强度升高、半峰宽变窄,α-Fe2O3微晶尺寸增加、结晶性增强。
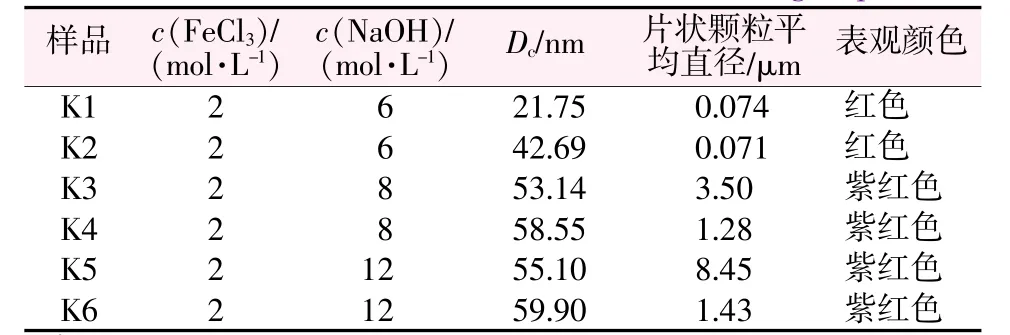
表1 FeCl3和NaOH以不同浓度和不同顺序加料合成α-Fe2O3的微晶尺寸、片状颗粒平均尺寸及表观颜色Table 1 Size and color ofα-Fe2O3 particles synthesized in different FeCl3 and NaOH concentration and adding sequence
2.2 SEM和颜色分析
图2为FeCl3和NaOH以不同浓度和不同顺序加料合成α-Fe2O3的SEM照片。从图2看出,由不同浓度的NaOH溶液以及不同原料滴加顺序制备的α-Fe2O3均为片状结构,并且片状α-Fe2O3的平均直径随着NaOH溶液浓度的升高而增加(见表1),颜色也由红色逐渐变为更深的紫红色(见图3),由此可以推断片状α-Fe2O3的带隙随着颗粒尺寸的变化而变化。根据表1可以看出,片状α-Fe2O3的平均直径与NaOH和FeCl3溶液的滴加顺序有关,R-mixing所得片状α-Fe2O3的平均直径要大于N-mixing所得片状α-Fe2O3的平均直径。将K3、K4、K5、K6样品在空气中加热到1 000℃保温1 h,其表观颜色(见图4)依然保持图3中的颜色不变,验证了合成的大尺寸α-Fe2O3具有高热稳定性。

图2 FeCl3和NaOH以不同浓度和不同顺序加料合成α-Fe2O3的SEM照片Fig.2 SEMimagesofα-Fe2O3 synthesized at different FeCl3 and NaOH concentration and adding sequence

图3 FeCl3和NaOH以不同浓度和不同顺序加料合成α-Fe2O3的颜色变化Fig.3 Color ofα-Fe2O3 synthesized with different FeCl3 and NaOH concentration and adding sequence

图4 α-Fe2O3高温处理后的颜色变化Fig.4 The color change ofα-Fe2O3 after treatment at high temperature
2.3 紫外-可见吸收光谱分析
图5为FeCl3和NaOH以不同浓度和不同顺序加料合成α-Fe2O3的紫外-可见吸收光谱(UV-Vis)图。从图5看出,K1、K2在400~570 nm处有较高的吸收率,在570~800 nm处吸收率下降,与其鲜艳的红色对应。对于尺寸较大的片状固体,其近乎平坦的吸收率曲线解释了样品的紫红色,因为大部分入射光被材料吸收。
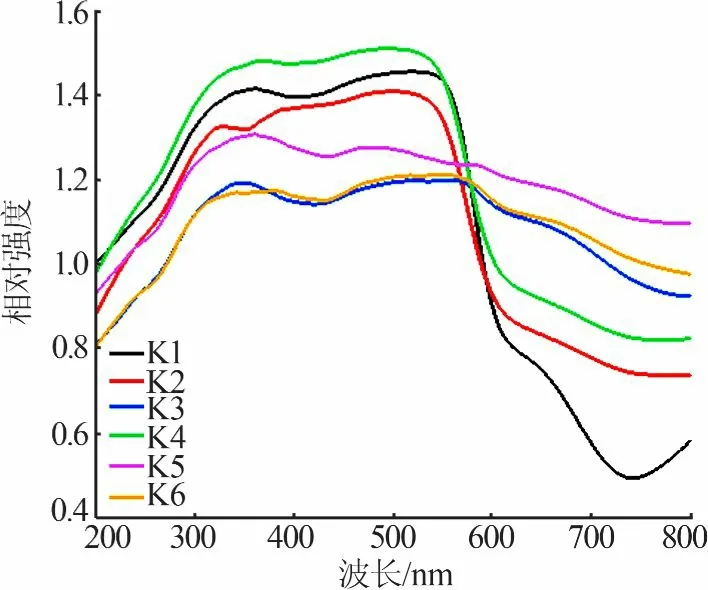
图5 FeCl3和NaOH以不同浓度和不同顺序加料合成α-Fe2O3的UV-Vis图Fig.5 UV-visabsorption spectra ofα-Fe2O3 synthesized in different FeCl3 and NaOH concentration and adding sequence
根据紫外-可见吸收光谱和Tauc方程可得到不同颗粒尺寸α-Fe2O3的禁带宽度。α-Fe2O3是一种n型半导体,其光学带隙可由方程(2)计算:

式中:α为吸收系数;B为相对于材料的常数;Eg为带隙;hv为光能;n为间接带隙取值1/2或直接带隙取值2。样品的(αhv)n—hv曲线见图6。根据曲线切线与横轴的交点可得K1、K2、K3、K4、K5、K6的禁带宽度分别为2.03、2.04、2.00、2.03、1.98、1.88 eV,即随着α-Fe2O3颗粒尺寸的增大吸收带边缘出现明显的红移,并且与报道的本征α-Fe2O3带隙(2.2 eV)[25-26]相比合成的α-Fe2O3光吸收带边缘发生红移。半导体粒子带隙随着晶粒尺寸的增大而减小,这导致光吸收带边缘红移,并且该结果已经在许多半导体纳米粒子系统中观察到[27-28]。根据以上结果,样品K1、K2的带隙略大于其他样品的带隙,这与MANSOUR等[20]的研究结果一致。
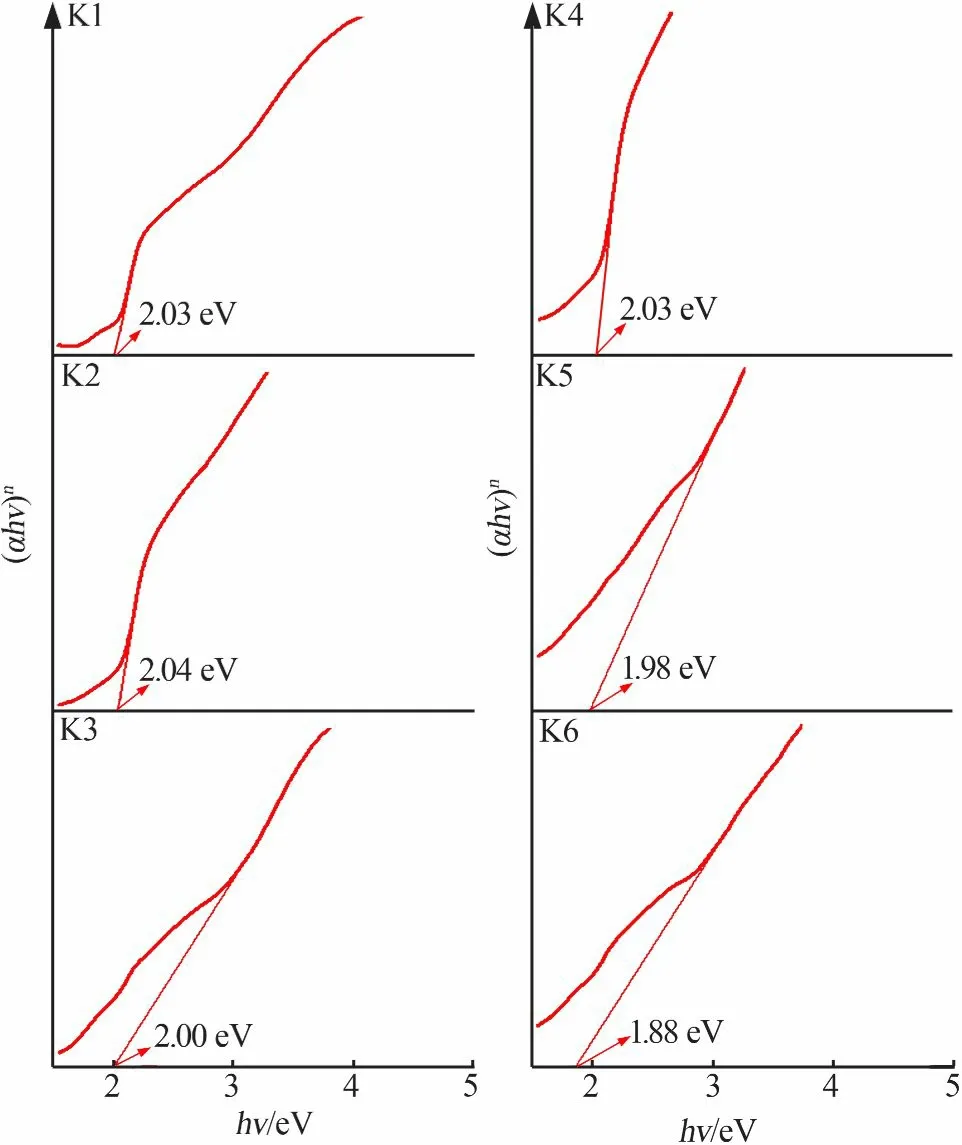
图6 FeCl3和NaOH以不同浓度和不同顺序加料合成α-Fe2O3的(αhv)n-hv曲线Fig.6 (αhv)n-hv curves ofα-Fe2O3 synthesized in different FeCl3 and NaOH concentration and addingsequence
2.4 FT-IR分析
图7为FeCl3和NaOH以不同浓度和不同顺序加料合成α-Fe2O3的FT-IR图。从图7看到,α-Fe2O3在3138、3332cm-1处出现了O—H的伸缩振动吸收峰(表面—OH与H2O形成的氢键导致)[29-30];在1 606 cm-1处出现了H—O—H的变形振动吸收峰;在893 cm-1处出现了Fe—OH的伸缩振动峰;在450、515 cm-1处两个波段的峰可归因于赤铁矿菱形晶格中的铁氧振动。
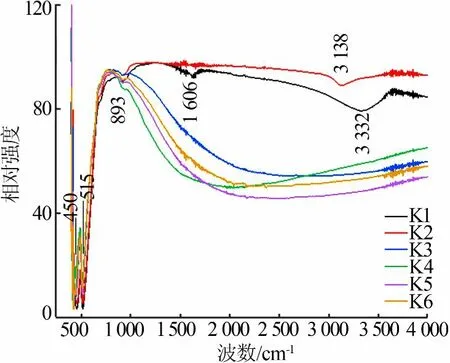
图7 FeCl3和NaOH以不同浓度和不同顺序加料合成α-Fe2O3的FT-IR图Fig.7 FT-IRspectraofα-Fe2O3 synthesized in different FeCl3 and NaOH concentration and addingsequence
2.5 电化学分析
图8a为6个样品作为活性物质组装电池的第一圈电压—容量曲线。从图8a看出,K1、K2、K3、K4、K5、K6的首次充放电比容量分别为657/465、627/405、550/307、601/256、428/239、614/367 mA·h/g。由此说明,α-Fe2O3颗粒尺寸较小时其第一圈的充放电比容量较高。K1、K2的首次平均库伦效率为67.6%,微米级尺寸的K3、K4、K5、K6首次平均库伦效率仅有53.5%。在锂离子电池中,通过α-Fe2O3颗粒的氧化还原反应进行储能,小颗粒可以提供更多的活性位点,即通过粒子之间的表面和界面来储存能量,因此粒径越小的样品容量越大。图8b为电池的第二圈电压—容量曲线。由图8b可知,各个样品的容量与尺寸的关系与第一圈基本一致。
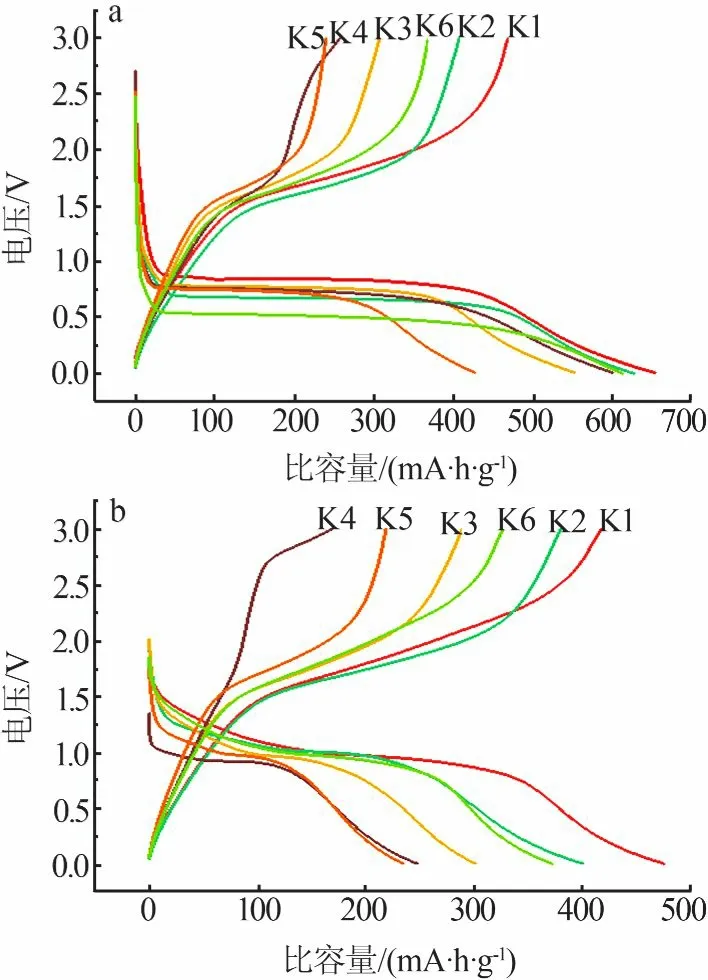
图8 α-Fe2O3的第一圈(a)和第二圈(b)电压—容量曲线Fig.8 Thefirst(a)and second(b)voltage-capacity curvesofα-Fe2O3
图9为以α-Fe2O3作为负极材料在0.1 mV/s扫描速率下第一圈的循环伏安曲线。从图9看出,第一圈时在0.7 V左右出现一个还原峰,说明在这个阶段Fe2O3发生了还原反应,Fe3+转化成Fe0;充电阶段1.8 V处的氧化峰表明Fe0又重新生成Fe2O3。随着颗粒尺寸的增加还原峰向低电势方向移动,氧化峰向高电势方向移动。
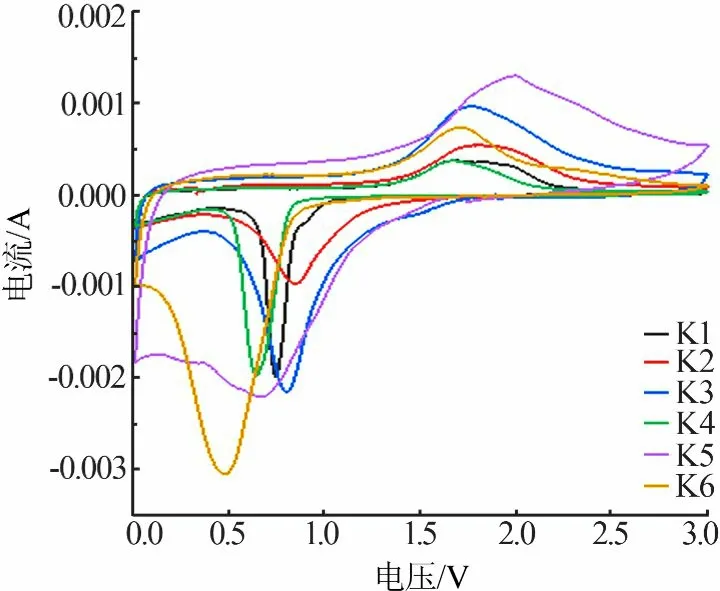
图9 α-Fe2O3的循环伏安曲线Fig.9 Cyclic voltammetry curvesofα-Fe2O3
Fe2O3的简化电化学反应可以表示为:
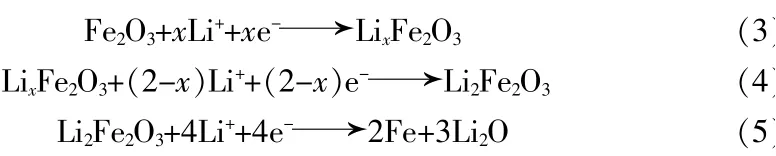
图10为α-Fe2O3的电化学阻抗谱(EIS)图。从图10看出,在低频和高频部分分别出现了一条直线和一个半圆弧,高频半圆的直径与电极的电荷转移电阻成正比。根据EIS分析结果发现,不同尺寸的片状Fe2O3具有不同的阻抗性能,其中K2、K3的电阻更小。

图10 α-Fe2O3的EIS图Fig.10 EISdiagramofα-Fe2O3
3 结论
以NaOH和FeCl3为原料通过调整NaOH溶液的浓度和滴加顺序得到了不同尺寸的片状α-Fe2O3,并且通过该方法可以在较短的时间内制备宏量的具有高热稳定性的片状α-Fe2O3。
1)当加料顺序不变时,增加NaOH溶液浓度制备的片状α-Fe2O3尺寸逐渐增大;当加料顺序改变时,通过R-mixing制备的片状α-Fe2O3尺寸要大于N-mixing制备的α-Fe2O3尺寸。2)α-Fe2O3颗粒尺寸与表观颜色关系密切。将片状α-Fe2O3颗粒尺寸控制在几十纳米时,其表观颜色为红色;当片状α-Fe2O3颗粒尺寸为微米级时,其颜色变为紫红色。通过分析α-Fe2O3颗粒尺寸与带隙的关系,可以发现片状α-Fe2O3颗粒尺寸越小时,其带隙越呈现上升趋势。3)对制备的α-Fe2O3进行了电化学性能测试,探究了电化学储锂性能与颗粒尺寸的关系。结果表明,纳米级颗粒相对于微米级颗粒会提高电池的实际容量。这为探索α-Fe2O3结构与电化学储锂性能之间的相互联系提供了设计依据,为早日实现“双碳”的战略目标打下了基础。

