嵌合抗原受体T细胞治疗复发难治弥漫大B细胞淋巴瘤进展
李 青,邓 琦
(天津市第一中心医院 血液科,天津 300190)
弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma, DLBCL)是成人中最常见的非霍奇金淋巴瘤,在初诊患者中占 35%~40%[1]。目前R-CHOP方案为标准一线治疗方案,治疗后约60%的患者可达完全缓解并实现长生存。但10%~15%的DLBCL患者原发耐药,20%~25%会出现疾病复发[2], 中位总生存仅6个月[3],这部分难治复发DLBCL(R/R DLBCL)患者即使应用二线或多线治疗能够达到疾病缓解甚至进行自体造血干细胞移植,但多数仍会出现疾病再次复发进展,为治疗的难点。嵌合抗原受体T细胞(chimeric antigen receptor T cell, CAR-T)的出现改变了R/R DLBCL的治疗模式,本文就近年CAR-T细胞在R/R DLBCL患者中的治疗进展做一综述。
CAR-T细胞是通过基因修饰的方法在T细胞表面嵌合特定的抗原受体,也就是CAR结构,它能特异性结合肿瘤抗原,引起T细胞的扩增、活化,并释放大量细胞因子[4],突出特点是高度特异性、非MHC限制性及强烈而持久的杀瘤效应。目前大多数CAR由单链可变区结构(single chain variable fragment,scFv)、跨膜区域和胞内信号转导区组成(图1)。一代CAR-T细胞内仅含一个活化结构域,缺乏共刺激信号,因此其在特异性识别肿瘤细胞相关抗原后的杀伤作用十分有限[5],二代CAR-T胞内含有一个活化结构域和一个共刺激区域,比如:CD28或4-1BB[6-7],增强了CAR-T的扩增和杀伤作用,三代CAR-T胞内部分则由活化结构域和多重共刺激区域组成,如:CD27,CD28,4-1BB和OX40等,这些结构域的增加不但能够增加CAR-T细胞特异性识别及结合等能力,更能够显著扩大由胞外区传递的细胞信号,引起下级细胞杀伤作用的级联增大。但因此引起细胞因子过度释放,导致杀伤肿瘤细胞的同时造成正常器官的损害。最新的第四代或更新一代CAR-T技术将细胞因子的胞内段也放入嵌合受体上,能够自分泌细胞因子招募更多的免疫细胞,进一步促进T细胞扩增和细胞因子的释放,从而增强CAR-T的疗效[8]。现阶段获批或临床试验应用比较广泛的是第二代CAR-T。
1 目前获批上市治疗R/R DLBCL的CAR-T细胞产品进展(表1)
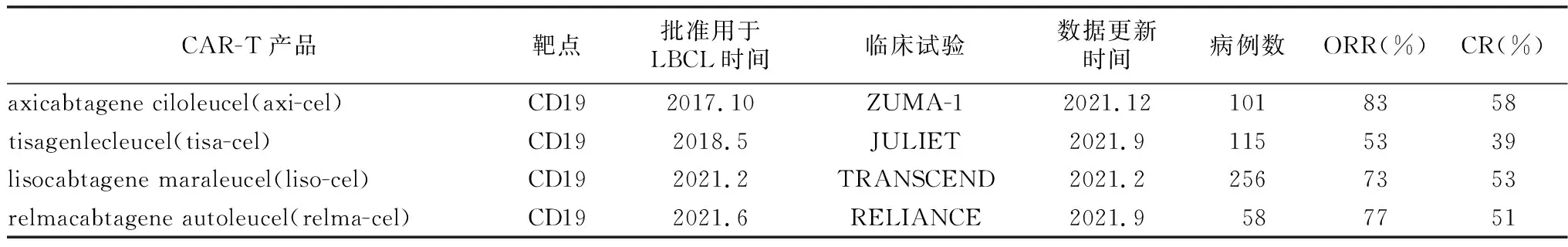
表1 目前上市的CART产品进展概况
1.1axicabtagene ciloleucel(axi-cel) 是包含CD28共刺激结构域的第2代CAR-T细胞,靶向肿瘤细胞的CD19抗原。2017年10月公布ZUMA-1研究结果,axi-cel治疗R/R DLBCL客观反应率(objective response rates,ORR)66%,完全缓解率(complete response rates,CRR)47%,美国食品药品管理局(Food and Drug Administration,FDA)批准axi-cel用于治疗二线及以上全身治疗无效的R/R DLBCL[9-10],2018年6月年欧洲药物管理局(European Medicines Agency EMA)批准上市。近期文献报道了ZUMA-1两年的随访结果并与挽救性化疗进行对比[11],101例R/R DLBCL患者应用axi-cel,中位随访27.1个月, ORR 83%, CRR 58%,2年生存率为54%。亚组分析显示,65岁以上的老年患者ORR和CRR分别为92%和75%,2年总生存(overall survival,OS)率为54%。同时与此前的SCHOLAR-1中挽救化疗的患者进行对比,挽救化疗ORR和CRR分别为34%和12%,2年生存率仅为20%[3]。2021年12月召开的第63届美国血液学年会公布ZUMA-1的4~5年随访数据, 101例患者中位随访51.1个月,4年OS率为44%,1年无事件生存(event-free survival,EFS)率为43%,24个月EFS率为38%,且数据提示在第1年和第2年持续EFS的患者OS更长。不良反应方面:未见新的严重不良事件发生,且无axi-cel相关继发性恶性肿瘤和具有复制能力的逆转录病毒确诊病例[12]。上述随访结果肯定了axi-cel的长期疗效。
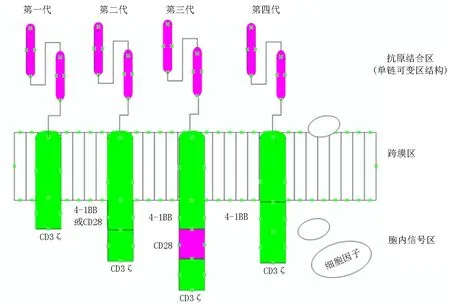
图1 CART结构示意图
1.2tisagenlecleucel(tisa-cel) 为靶向CD19的包含4-1BB共刺激结构域的第2代CAR-T细胞产品,依据JULIET研究结果[13],2018年5月美国FDA 批准tisa-cel用于治疗R/R DLBCL、转化性滤泡性淋巴瘤(TFL)和高级别B细胞淋巴瘤。柳叶刀2021年发布了JULIET研究的II期长期随访结果,115例未进行移植或移植后复发的R/R大B细胞淋巴瘤(R/R LBCL)患者,接受单剂tisa-cel,中位随访40.3个月,ORR为53%,CRR为39%,细胞因子释放综合征(cytokine release syndrome,CRS)发生率为57%,无治疗相关死亡[14]。由于缺乏随机对照研究,有学者将tisa-cel的JULET研究与axi-cel的ZUMA-1研究匹配调整后进行了比较,认为axi-cel有更高的缓解率,但1-2级CRS发生率更高,而3级以上CRS和神经毒性的发生率两者无差别[15]。
1.3lisocabtagene maraleucel(liso-cel) 同样是包含4-1BB共刺激结构域的第2代CAR-T细胞产品,liso-cel与tisa-cel不同之处是由纯化的CD8+和 CD4+T 细胞以 1∶1 组成,根据 TRANSCEND研究结果[16],2021年2月美国FDA批准liso-cel用于治疗R/R LBCL。本研究中269例患者,包含3%继发中枢神经系统受累的患者,ORR和CRR分别为73%和53%,CRS发生率42%。在R/R DLBCL患者中,与挽救化疗比较[17],匹配分析均显示liso-cel组较挽救化疗组具有优势,ORR分别为71%对26%,CRR分别为49%对7%,OS为20.5个月对6个月。在与axi-cel的对比中,两者的治疗有效率相似,但liso-cel的严重不良事件的发生率更低[18]。
1.4relmacabtagene autoleucel(relma-cel;阿基仑赛注射液) 同样为靶向CD19的第2代CAR-T。一项中国复发难治非霍奇金淋巴瘤患者的多中心、开放标签、单臂Ⅱ期研究中(RELIANCE的研究),58 例患者接受了relma-cel治疗,中位年龄为56岁。截至2020年12月31日,ORR为77.6%,CRR为51.7%。中位随访时间为17.9个月,12个月OS率76.8%[19]。2021年6月,中国国家药品监督管理局(NMPA)批准relma-cel用于治疗既往接受二线或以上系统性治疗后R/R DLBCL成人患者(包括DLBCL非特指型、原发纵膈大B细胞淋巴瘤、高级别B细胞淋巴瘤和滤泡淋巴瘤转化的DLBCL)。
2 CAR-T治疗R/R DLBCL临床试验进展
迄今为止上市的CAR-T均靶向CD19抗原,治疗失败或耐药的主要原因一方面是肿瘤的抗原逃逸,多表现为CD19阴性复发,也就是肿瘤细胞表面不表达CD19抗原;另一方面为肿瘤微环境中存在的多种抑制分子及自身免疫抑制机制,可能降低CAR-T扩增及杀伤活性。因此目前研究方向主要涵盖更换抗原位点或改善肿瘤微环境两方面。全球多项临床试验开展新靶点、多靶点的CAR-T以及多种联合治疗方案,以进一步提高疗效、减少疾病复发。
2.1CD19/CD22 CAR-T CD19/CD22 双靶点CAR-T可以克服CD19 CAR-T的抗原逃逸现象,2021年中国学者的一项CD19/CD22双靶点CAR-T治疗复发难治侵袭性B细胞淋巴瘤的研究中[20],16例入组的患者中,ORR为87.5%,CRR为62.5%,2年OS率 77.3%,无进展生存(PFS)率40.2%。4级以上CRS发生率6%。另有关于CD19/CD22 双靶点CAR-T或CD19 CAR-T和CD22 CAR-T序惯输注治疗B细胞淋巴瘤的零星报道[21]。
2.2CD19/CD20 CAR-T 一项关于CD19/CD20串联双特异CAR-T的研究显示,应用4-1BB-CD3ζ LV20.19 CAR T治疗22例患者,82%患者有效,CRR达64%,为CD19弱表达或阴性的R/R DLBCL患者提供了治疗选择[22],我国学者关于优化的串联CD19/CD20 CAR-T治疗B细胞淋巴瘤的试验结果2020年10月发布于BLOOD杂志[23],28例患者ORR和CRR分别为79%和71%,12个月PFS率为64%,CRS发生率为50%,3级以上CRS占14%。针对R/R DLBCL的Ⅱ期试验[24],21例患者ORR和CRR分别为81%和52.4%,3~4级CRS和CAR-T相关性脑病综合征(CRES)发生率为28.5%和9.5%。另一项应用LV20.19 CAR-T治疗B细胞淋巴瘤的试验结果显示22例患者ORR为82%,CRR 64%,3~4级CRS的发生率为5%[22]。
2.3其他新靶点CAR-T CD79b CAR-T、Igβ-CAR T 在B细胞淋巴瘤的基础实验及动物实验中有效[25]。另有我国学者设计的CD70 CAR-T应用于CD19阴性的复发难治B细胞淋巴瘤中,相关临床试验招募中[26]。
2.4CAR-T的联合疗法 CD19 CAR-T 在治疗成人及儿童 B-ALL 中的完全缓解率高达90%[27], 但在ZUMA和JULIET研究中表明,CD19 CAR-T在R/R B细胞淋巴瘤中CRR仅50%左右[9, 28]。因此如何进一步提高CAR-T在R/R DLBCL患者当中的疗效成为研究的热点,除了新靶点、多靶点CAR-T外,近年出现了CAR-T的联合治疗。
“免疫检查点疗法”是通过阻断被癌细胞激活的免疫抑制通路以提高T细胞抗肿瘤免疫应答的治疗方法。程序性死亡分子及其配体(PD-1/PD-L1) 抑制剂是常见的免疫检查点疗法。在肿瘤特异性抗原刺激下,CAR-T细胞PD-1的表达会显著上调,造成其抗肿瘤免疫反应的削弱[29]。Chong等[30]报道了1例R/R DLBCL 予以CAR-T治疗,26天后因疾病进展予以PD-1抑制剂治疗,获得较好临床反应。并且观察到应用PD-1抑制剂后,CD19CAR-T的增殖活性有了大幅度提高。为了探索PD-1/PDL-1阻断剂与CAR-T联合治疗R/R DLBCL的疗效、最佳方案及合适剂量,目前有多项临床试验正在进行(NCT02706405、NCT02926833和NCT03310619)。
已有基础实验及动物实验表明,Bruton’s tyrosinekinase抑制剂(BTK抑制剂)能够增强CAR-T的抗肿瘤疗效[31-32],Fraietta等[33]报道,BTK抑制剂在慢性淋巴细胞白血病患者中能够促进CAR-T的植入及扩增,从而增强疗效, Liu等[34]报道在套细胞淋巴瘤和滤泡淋巴瘤中观察到相似的现象。目前BTK抑制剂联合CAR-T在R/R DLBCL中的疗效尚无报道,相关临床试验招募中((NCT04257578)。
关于CAR-T与放疗的联合包括放疗作为CAR-T输注前的桥接治疗以及作为CAR-T治疗后的挽救治疗两种方式。有学者报道,在R/R DLBCL中,放疗作为axi-cel之前的桥接治疗,ORR 81.8%,重度CRS的发生率为27%[35]。Imber等[36]用放疗作为CAR-T后挽救治疗,14例患者治疗反应率达100%,中位总生存为10个月。目前放疗与CAR-T联合治疗的最佳方案尚无定论。
3 CAR-T成本效益
与成品药物不同,由于CAR-T的制备需要采集患者外周血T细胞,为患者“量身定做”特异性CAR-T,因此时间成本及经济成本高,甚至限制了其临床应用,特别是在发展中国家。有学者对现有产品tisa-cel在R/R DLBCL中的应用进行了成本效益分析[37], 相对于传统化疗来说,虽然CAR-T的治疗费用高,但质量调整生命年(quality-adjusted life year, QALY)增加, 成本效益较挽救化疗具有明显优势。日本学者的研究得出了同样的结论[38]。近年来,关于CAR-T能否产品化的研究一直在进行,“通用型CAR-T”或“Off-the-Shelf”能够让CAR-T的治疗更加经济、方便和快捷,避免了每例患者进行采集-制备的繁琐过程,但免疫排斥和供者CAR-T在患者体内的迅速耗竭一直是研究中的难点[39-40],也是目前国内外研究的热点。
4 CAR-T治疗的不良反应
随着CAR-T技术的逐渐成熟,目前CAR-T治疗的淋巴瘤患者最长随访时间已达5年以上,因此CAR-T治疗的不良反应逐步被认识,处理手段日趋完善。包括CRS、免疫效应细胞相关神经毒性综合征(immune effector cell-associated neurotoxicity,syndrome,ICANS)、脱靶效应以及B细胞功能障碍、感染等。
CRS是CAR-T治疗过程中最常见的不良反应,本质是CAR-T识别靶细胞后自身被激活产生大量炎症因子,引起的全身炎症反应,包括发热、乏力、肌肉酸痛等非特异症状及各个器官系统不同程度的损害。目前已有的分级系统包括最早的Penn标准、常用的LEE标准以及最新的由美国移植与细胞治疗学会(the American Society for Transplantation and Cellular Therapy,ASTCT)定义的分级系统[41-43]。针对JULIET研究中的CRS分析显示,对于同样的患者,Penn分级评价的患者CRS级别较Lee标准和ASTCT标准更高[44],而针对3个分级标准的比较显示目前指南对细胞因子抗体和糖皮质激素的不同建议可能导致过度或延误治疗[45]。
目前ICANS的具体发病机制仍未完全阐明,患者的临床表现有明显异质性,包括头痛、躁狂、昏迷、癫痫、语言障碍、书写障碍等等,ASTCT 提出了 ICANS 共识分级标准[41]。单中心的分析表明,在R/R DLBCL中,ICANS的发生率与患者的CR率和OS无关,同时发现高水平的D0纤维蛋白原提示发生ICANS的风险增加[46]。
CAR-T治疗后由于B细胞缺乏或功能缺陷,感染风险增加,一项研究分析了60例DLBCL患者应用CAR-T治疗1年,细菌、病毒和真菌的累计发生率分别为57.2%, 44.7%, 4%。多因素分析显示主要危险因素为糖皮质激素的应用和感染史[47]。
5 小结和展望
CAR-T治疗开启了细胞免疫靶向治疗的新时代,改变了难治/复发肿瘤的治疗现状,目前CAR-T已经成为经二线治疗无效的R/R DLBCL患者的首选推荐方案,上述进展显示CAR-T较挽救化疗治疗有效率明显提高,能否将CAR-T治疗作为首次复发患者的二线治疗方案,甚至能否作为一线清除微小残留病方案值得进一步探究[48],特别是对于化疗耐药的患者,CAR-T治疗能否代替自体造血干细胞移植,目前已有随机研究正在进行[49]。未来的研究方向包括一方面进一步筛选更加精准的抗原组合靶向淋巴瘤细胞,另一方面针对肿瘤微环境选取更加合适的联合治疗手段。

