血管钙化的影响因素及预测指标
郑丽华, 杜润森, 赵亚恒, 刘 鹏
(1.河北医科大学第一医院 a.血管外科;b. 创伤急救外科,河北 石家庄 050011;2.河北医科大学 研究生院,河北 石家庄 050011)
血管钙化是动脉粥样硬化、糖尿病血管病变、高血压、血管损伤、慢性肾脏病的共同病理特征[1]。血管钙化的特点是血管壁硬度增加,顺应性降低,可导致严重的不良反应,包括收缩期高血压、左心室肥厚、冠状动脉缺血、充血性心力衰竭及可能的斑块破裂、血栓形成和心肌梗死[2-3]。血管钙化不仅是心血管疾病发病率和死亡率增加的重要原因,也是危害中老年人健康的普遍病理现象。血管钙化是动脉粥样硬化的标志,也是心血管事件的独立预测因子。它与全因死亡率密切相关,一直是心血管医学研究的一个重要领域[4-5]。在血管钙化的晚期阶段不能通过药物治疗逆转,而在疾病的早期阶段,当大多数患者仍无症状时,可以通过药物有效干预,但是这些患者通常不会引起医生的注意,因此探索血管钙化的有效预测指标对疾病的早期诊断和干预有重要意义[6]。炎症反应和氧化应激是血管钙化的重要病理过程[7],所以炎症指标可能会成为预测血管钙化的潜在指标,如白蛋白/纤维蛋白原(albumin/fibrinogen, AFR)[8]。本研究回顾性分析血管钙化患者的临床资料,探讨血管钙化的独立危险因素,绘制受试者工作特征(receiver operating characteristic, ROC)曲线分析其预测血管钙化的价值,为血管钙化的预防、诊断提供简单有效的方法。
1 资料与方法
1.1病例选择 本文为回顾性研究,纳入河北医科大学第一医院血管外科2018年8月至2020年7月收治的患者467例,其中血管钙化患者191例(病例组),无血管钙化患者276例(对照组)。入选标准:①年龄≥18 岁,性别不限;②受试者自愿,签订知情同意书;③近3个月内未有糖皮质激素、抗凝、溶栓、免疫抑制剂等相关治疗史。排除标准:①年龄<18岁;②处于妊娠期或哺乳期的患者;③严重心律失常;④恶性肿瘤患者;⑤全身感染等或是患者一般情况较差,研究者认为不适合参加本研究者;⑥临床资料不全者。本研究获得河北医科大学第一医院伦理委员会批准(20200617)。
1.2方法 收集入选患者一般资料及实验室检查,包括:性别、年龄、身高、体重、中性粒细胞占比、淋巴细胞占比、纤维蛋白原、纤维蛋白原降解产物(fibrin degradation products, FDP)、甘油三酯、总胆固醇、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、脂蛋白、谷氨酰基转移酶(γ-glutamyl transpeptadase,GGT)、超敏C反应蛋白(high sensitivity C-reactive protein, hs-CRP)、白蛋白、AFR等。并对入选患者拍摄站立位的侧位腰椎X光片,评估患者腹主动脉有无血管钙化。
1.3统计学方法 应用EmpowerStats(易侕统计)与R软件进行统计学分析。计数资料以[例(%)]表示,组间比较采用χ2检验或Fisher确切概率法。采用单因素和多因素Logistic回归分析血管钙化患者的危险因素和独立危险因素。绘制ROC曲线分析其预测血管钙化的价值。P<0.05为差异有统计学意义。
2 结 果
2.1一般资料及实验室检查 本研究共入选患者467例,病例组191例,对照组276例。两组性别、年龄、身高、体重比较,差异无统计学意义(均P>0.05)。两组中性粒细胞占比、淋巴细胞占比、纤维蛋白原、FDP、HDL-C、LDL-C、白蛋白、脂蛋白、GGT、hs-CRP、AFR、总胆固醇比较,差异有统计学意义(均P<0.05);两组甘油三酯比较,差异无统计学意义(P>0.05),见表1。
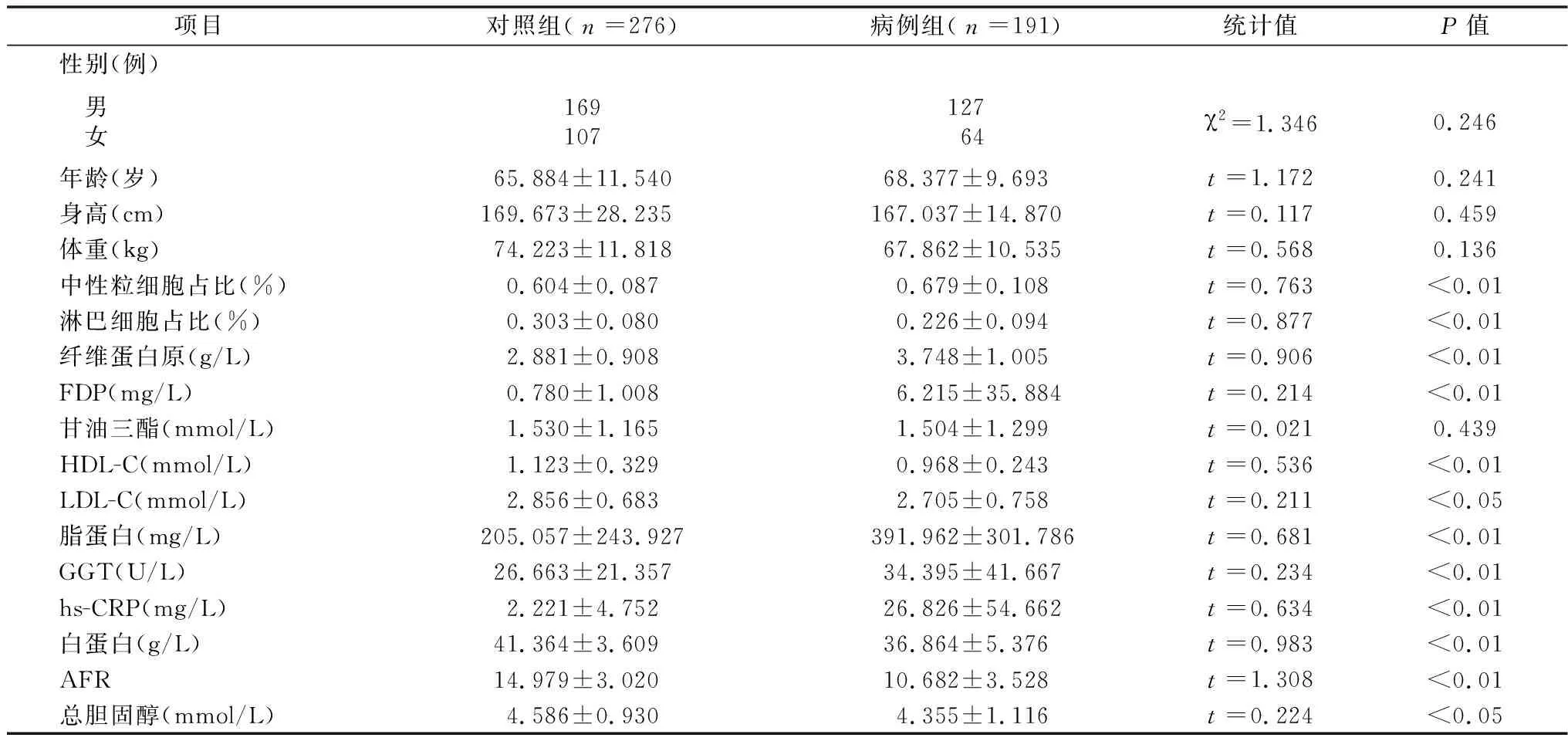
表1 两组一般资料及实验室检查比较
2.2血管钙化的预测因素 将中性粒细胞占比、淋巴细胞占比、纤维蛋白原、FDP、HDL-C、LDL-C、脂蛋白、GGT、hs-CRP、白蛋白、AFR、总胆固醇纳入单因素Logistic回归分析,结果显示,中性粒细胞、淋巴细胞占比、FDP、总胆固醇、HDL-C、LDL-C、脂蛋白、GGT、hs-CRP及AFR是血管钙化的预测因素(均P<0.05)。将中性粒细胞占比、淋巴细胞占比、FDP、总胆固醇、HDL-C、LDL-C、脂蛋白、GGT、hs-CRP及AFR纳入多因素Logistic回归分析,结果显示,FDP、总胆固醇、HDL-C、LDL-C、脂蛋白、AFR是血管钙化的独立预测因素(均P<0.05)。见表2。

表2 血管钙化的单因素Logistic回归分析

表3 血管钙化的多因素Logistic回归分析
2.3预测因素对血管钙化的预测价值 为了进一步检测和比较这些指标对血管钙化的预测价值,绘制ROC曲线。AFR的曲线下面积(area under the curve, AUC)为0.828,FDP的AUC为0.780,脂蛋白的AUC为0.720,HDL-C的AUC为0.679,总胆固醇的AUC为0.570,LDL-C的AUC为0.563,见图1。
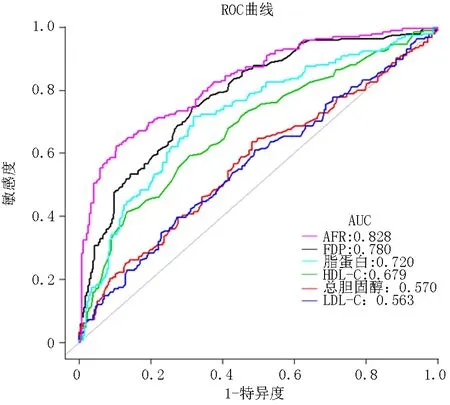
图1 血管钙化独立危险因素的 ROC 曲线分析
3 讨 论
循环系统依靠血管的扩张性和弹性来维持正常的血流动力学、自动调节功能及血管的舒缩。因此,动脉壁中钙的刚性沉积对循环系统具有重要的生物力学影响。血管钙化会增加刚度和脆性,影响血管舒缩功能,增加动脉粥样硬化斑块破裂的风险,从而发生破坏性并发症。在心脏瓣膜钙化时,血流动力学受影响可能很严重,如钙化性主动脉瓣狭窄会阻塞左心室的流出。总之,血管钙化可产生众多不良反应,包括收缩期高血压、左心室肥大、冠状动脉缺血、充血性心力衰竭,从而增加斑块破裂、血栓形成及心肌梗死的发生风险[2, 9]。血管内钙化的发病机制尚不完全清楚,但最近的研究表明可能由于凋亡的血管平滑肌细胞分化成为骨细胞样细胞,产生基质小泡和外泌体,从而启动矿化过程并在血管壁内形成钙化[10-11]。相关研究表明,炎症、囊泡分泌、细胞凋亡中的氧化应激体、斑块、胆固醇水平、放射毒性及脂肪生成等均有助于血管钙化的进展[12]。炎症在血管钙化的发展中起着重要作用,炎症标志物可能是临床实践中评估血管钙化风险的有效工具[13-15]。
本研究通过对467例患者的临床资料进行分析,发现FDP、总胆固醇、脂蛋白是血管钙化的独立危险因素,HDL-C、LDL-C、AFR是血管钙化的独立保护因素。FDP的AUC为0.780,脂蛋白的AUC为0.720,表明FDP、脂蛋白可有效预测血管钙化,AFR的AUC为0.828,说明AFR对血管钙化的预测是强有力的。AFR预测效果要优于FDP、脂蛋白。FDP可以促进内皮细胞、平滑肌细胞和成纤维细胞的增殖及胆固醇沉积,诱导白细胞的黏附和聚集,导致血管内皮损伤,与许多血管疾病有关[16-17]。脂蛋白是一种富含立体脂质和甘油三酯的疏水核心,是由蛋白质、磷脂、胆固醇等组成的球状颗粒。脂蛋白在细胞外脂质的包装、储存、运输和代谢中起着重要作用。研究表明,脂蛋白参与调节血管钙化过程的启动[18]。本研究发现AFR是血管钙化的保护因素,其原因可能为:①白蛋白是一种相对分子质量为69 k的蛋白质,占整个血清成分的一半以上,具有抗炎和抗氧化的特性,是许多心血管疾病的独立预测因子,如冠状动脉疾病、心力衰竭、先天性心脏病、感染性心内膜炎和中风,低白蛋白血症会加重血管钙化[19-20]。②纤维蛋白原是一种糖蛋白,它主要由肝脏中的肝细胞合成,是血浆中的主要凝血蛋白,是血液黏稠度的决定因素,也是血小板聚集的辅因子。血浆纤维蛋白原水平的升高是心血管疾病的独立危险因素[21-22],血管钙化部位炎症时血小板聚集,纤维蛋白原增加。③AFR是一种近年来新提出的炎症指标,可作为反映恶性肿瘤患者炎症状态的潜在生物标志物[8], 可以预测不同癌症的预后[23-25], 还可作为类风湿性关节炎疾病活动的指标[26], 可用于预测心肌梗死患者的再通[27]。AFR的AUC为0.828,也进一步说明AFR具有很好的预测血管钙化的价值。
本研究尚存在不足:①样本量小;②为单中心回顾性研究,仅收录我院血管外科就诊患者,可能存在局限性;③纳入病例未根据病种分类。今后,我们将继续增加样本量,纳入更多指标,进行进一步研究。虽然我们的研究表明AFR对血管钙化有较好的预测能力,但临床上仍需结合影像学检查进一步确定。综上,AFR、FDP、脂蛋白对预测血管钙化是有效的,AFR对血管钙化的预测效果要优于FDP、脂蛋白。本研究结果具有良好的临床实用价值,AFR、FDP、脂蛋白是住院患者的基础检查项目,样本采集简单易行。此外,AFR可反复测量,价格便宜,患者容易接受,有望成为血管钙化新的标记物。

