怀玉山三叶青2个栽培种试管苗对干旱胁迫的生理响应及相关基因的表达
洪森荣 柯维忠 陶月琴 戴云龙 安永盼 符卉卉 阿提克穆•麦麦提 蔡红 陈荣华




摘要:为了探究怀玉山三叶青2个栽培种试管苗对干旱胁迫的生理响应,为其高山大棚有效栽培提供理论依据。以怀玉山三叶青怀玉1号、怀玉2号试管苗为试验材料,进行PEG-6000模拟干旱胁迫处理,通过主成分分析和隶属函数法综合评价怀玉山三叶青2个栽培种试管苗抗旱性的强弱,并通过荧光定量PCR分析干旱胁迫下怀玉山三叶青2个栽培种试管苗相关基因的表达情况。结果表明,随着PEG-6000浓度的增加,怀玉1号、怀玉2号试管苗的株高和生物量整体上呈先稳后降的趋势,可溶性蛋白(SP)、可溶性糖(SS)、游离脯氨酸(Pro)和K+含量以及抗氧化酶[超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)]活性整体上呈先升后降的趋势,而相对电导率(RC)、丙二醛(MDA)含量和Na+含量则呈显著提高的态势,茎、根Ca2+含量无显著变化。根据隶属函数分析结果,怀玉山三叶青2个栽培种试管苗的耐旱性为怀玉2号>怀玉1号;主成分分析结果表明,第1个主成分中较大的指标有POD、CAT活性和Pro含量,第2个主成分中较大的指标有RC、SOD活性和MDA含量,第3个主成分中较大的指标有SS、K+和Ca2+含量;轻度干旱和中度干旱有助于脱落酸、茉莉酸、乙烯、赤霉素、生长素等内源激素含量的提高,也有利于怀玉山三叶青黄酮醇和查尔酮的合成,但不利于怀玉山三叶青烟草花叶病毒的增殖。由研究结果可知,适度干旱胁迫可以提高内源激素和次生代谢物的含量,抑制病毒增殖,促进怀玉山三叶青的生长发育,相关研究结果可为怀玉山三叶青抗旱种源的筛选提供参考依据。
关键词:怀玉山三叶青;栽培种;试管苗;干旱胁迫;生理响应;相关基因表达
中图分类号: Q945.78文献标志码: A
文章编号:1002-1302(2022)04-0117-09
收稿日期:2021-05-22
基金项目:国家自然科学基金(编号:31960079);江西省科技厅重点研发计划一般项目(编号:20192BBGL70050、20202BBG73010);江西省教育厅科学技术研究项目(编号:GJJ201704);上饶市科技局重点研发计划一般项目(编号:2020C002);上饶市科技局平台载体建设项目(编号:2020J001、2019I017)。
作者简介:洪森荣(1974—),男,江西永新人,硕士,教授,研究方向为植物生物技术。E-mail:hongsenrong@163.com。
三叶青(Tetrastigma hemsleyanum Diels et Gilg),别称蛇附子、金线吊葫芦等,为被子植物门双子叶植物纲原始花被亚纲鼠李目葡萄科崖爬藤属草质藤本。三叶青为我国特有的珍稀藥用植物,主要分布在我国长江以南各省份,《中国植物志》中记载,三叶青全草均可入药,以地下块根、果实的药用效果最好,其性平、味微苦,具有清热解毒、祛风化痰、活血止痛等功效,被誉为无毒、无副作用的“植物抗生素”,其经济价值和医药价值较高[1]。位于江西省怀玉山的怀玉山三叶青于2016年3月31日被核准为国家地理标志农产品。目前人们已经从怀玉山三叶青中筛选出2个栽培种(怀玉1号和怀玉2号)用于大棚基质栽培和林下容器栽培,并取得了较好的经济效益。三叶青的药用价值极高,市场需求量大,但其野生资源稀少,因此三叶青的人工种植是大势所趋。研究发现,三叶青对生长环境要求苛刻,生长速度极其缓慢。干旱胁迫是影响植物生长发育最重要的生态因子之一[2]。随着全球气候上升和水资源分配不均,水分缺乏和干旱危害日益严重。研究发现,干旱胁迫会引起植物体内水分亏缺、扰乱植物体内源库流的正常运行,导致植物生长受阻和产量降低[3]。许多研究发现,植物对逆境胁迫的响应涉及分子、生理和表型3个层面,三者密切相关[4]。因此,为了提高三叶青人工驯化栽培水平,探究干旱胁迫对三叶青生长发育的影响具有重要的现实意义。关于干旱胁迫下作物品种生理响应的报道较多。冯慧芳等研究了聚乙二醇(PEG)模拟干旱胁迫环境下火力楠、尾叶桉、枫香、荷木幼苗的生理变化[5];郭瑞等研究了PEG-6000模拟水分胁迫下冬小麦生长、细胞渗透调节物质和叶片荧光特性的变化[6];赵方媛等研究了15 个小黑麦品系苗期的抗旱性[7];许爱云等采用盆栽控制土壤水分的方法研究了土壤自然渐进干旱胁迫下12种草本植物功能性状、光合特性及抗氧化保护酶的变化,并对其抗旱性进行了综合评价[8];由佳辉等以9个葡萄砧木品种的盆栽扦插苗为试验材料,测定了干旱胁迫下抗旱性相关生理指标,并对其抗旱能力进行了综合评价[9]。目前,对三叶青生态因子的研究多集中在温度[10]、光照[11]、生物炭肥[12]、有机肥[13]等方面,关于干旱胁迫对三叶青影响的研究少见报道。本研究以怀玉山三叶青2个栽培种怀玉1号和怀玉2号试管苗为试验材料,进行PEG-6000模拟干旱胁迫处理,通过主成分分析和隶属函数法综合评价怀玉山三叶青2个栽培种试管苗的抗旱性,并通过荧光定量PCR分析干旱胁迫下怀玉山三叶青2个栽培种试管苗相关基因的表达情况,旨在研究怀玉山三叶青2个栽培种在干旱胁迫下的生理响应和基因表达情况,探寻怀玉山三叶青栽植的水分管理节点,为怀玉山三叶青抗旱种源的筛选提供参考依据。
1 材料与方法
1.1 试验材料
本研究采用的材料为怀玉山三叶青2个栽培种怀玉1号和怀玉2号试管苗,由上饶师范学院生命科学学院提供。试验时间为2020年6—9月,试验地点为上饶师范学院生命科学学院。
1.2 试验方法
1.2.1 干旱胁迫培养基的配制和试管苗的干旱胁迫处理 干旱胁迫选用的培养基为MS+1.5 mg/L KT(激动素)+0.3 mg/L NAA(萘乙酸)+30 g/L蔗糖+6 g/L琼脂(pH值为5.8~6.0)。以此培养基为基础,设置6个处理。6个处理的PEG-6000浓度分别设为0、30、60、90、120、150 g/L。将怀玉山三叶青怀玉1号、怀玉2号试管苗接入上述6个处理的固体培养基中,每瓶接种3个试管苗,每个处理接种25瓶。将干旱胁迫处理的怀玉1号、怀玉2号试管苗放入培养室内进行培养。培养条件如下:光照时间 14 h/d,光照度1 000~1 500 lx,温度(25±1) ℃。盐胁迫处理30 d后结束试验,对其进行各项生理指标的测定。
1.2.2 株高和生物量的测定 6个干旱胁迫处理的怀玉1号、怀玉2号试管苗的株高、生物量分别用直尺测量的方法测定,同时参照Green等的方法[14-15]。
1.2.3 生理生化指标的测定 选取6个干旱胁迫处理的怀玉1号、怀玉2号试管苗,用于生理生化指标的测定。可溶性蛋白(soluble protein,SP)含量采用考马斯亮蓝G-250比色法测定[16];游离脯氨酸(proline,Pro)、可溶性糖(soluble sugar,SS)含量分别采用酸性茚三酮比色法、蒽酮比色法测定[17]测定;叶片相对电导率(relative conductivity,RC)的测定参照Chen等的方法[18];超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性以及丙二醛(MDA)含量的测定分别采用愈创木酚法[19]、氮蓝四唑(NBT)比色法[20]、紫外分光光度计法[21]和硫代巴比妥酸(TBA)比色法[17];Na+、K+和Ca2+含量参照海霞等的方法[22]进行测定。
1.2.4 RNA 的提取及荧光定量PCR分析 将6个干旱胁迫处理的怀玉1号、怀玉2号试管苗叶片参照十六烷基三甲基溴化铵(CTAB)法[23]提取总RNA并进行反转录。然后对一些相关基因如TRINITY_DN9862_c2_g1(abscisic acid receptor PYL4)、TRINITY_DN22392_c0_g1(jasmonate ZIM-domain transcriptional repressor)、TRINITY_DN28517_c0_g1(ethylene-responsive transcription factor 1B)、TRINITY_DN2487_c0_g1(gibberellin receptor GID1B)、TRINITY_DN46313_c0_g1(IAA14)、TRINITY_DN30140_c0_g1(flavonol synthase)、TRINITY_DN16981_c0_g3(chalcone synthase)、TRINITY_DN2048_c0_g1(superoxide dismutase)、TRINITY_DN20910_c0_g1(tobamovirus multiplication protein 1)、TRINITY_DN22922_c0_g1(tobamovirus multiplication protein 2A)进行荧光定量 PCR(qRT-PCR)检测(内参基因为GAPDH),所用引物序列见表1。qRT-PCR检测采用20 μL反应体系,PCR反应程序:95 ℃ 10 min;95 ℃ 10 s,60 ℃ 34 s,95 ℃ 15 s,40个循环。使用2-ΔΔCT法进行基因表达水平的计算。
1.3 数据统计分析
以上试验均重复3次。所有数据表示为平均值±标准差,并用SPSS 19.0软件进行统计分析,用单因素方差分析(One-way ANOVA)及多重比较(Duncans)检验以上各项生长、生理生化指标在6个干旱胁迫处理下的差异显著性(P<0.05)。采用SPSS 19.0进行主成分分析。参考赵芳媛等的方法[7]进行计算。
2 结果与分析
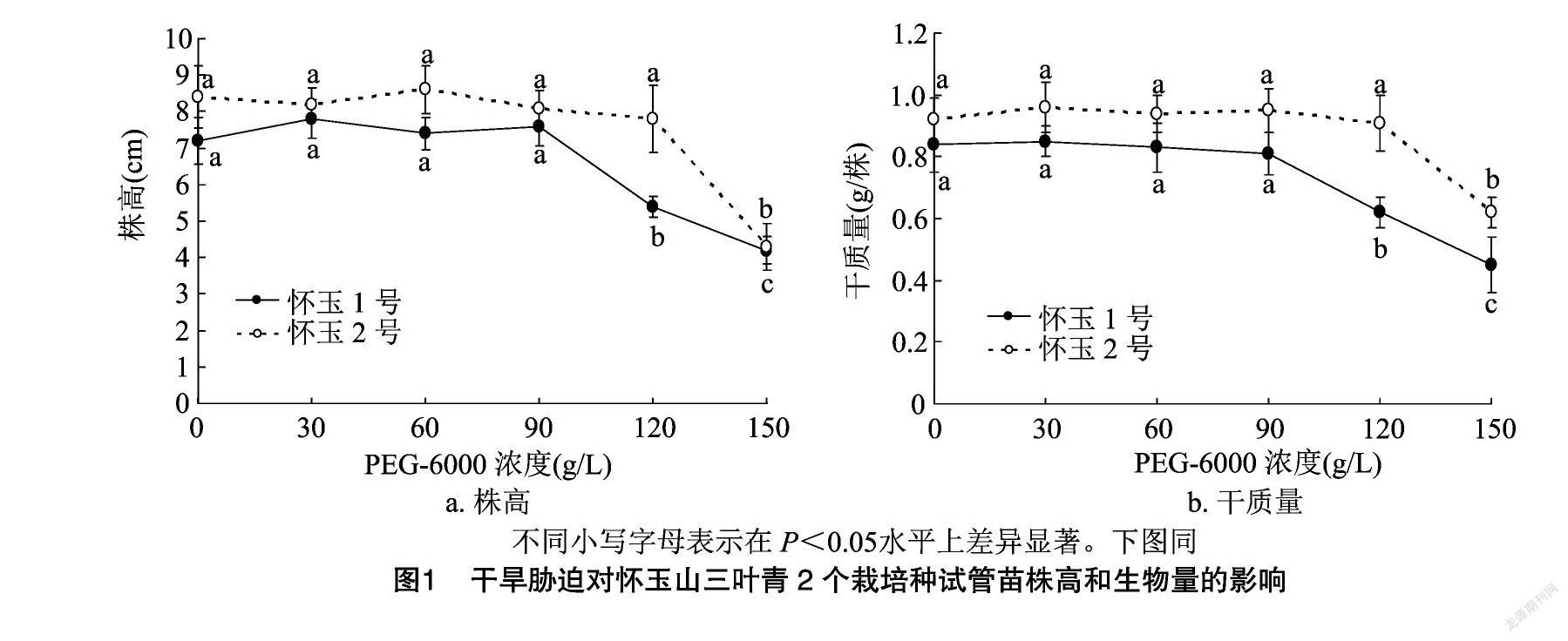
2.1 干旱胁迫对怀玉山三叶青2个栽培种试管苗株高、生物量的影响
从图1可以看出,随着PEG-6000浓度的增加,怀玉1号、怀玉2号试管苗的株高、生物量整体呈先无显著变化后显著下降的趋势;当PEG-6000浓度达到90 g/L时,怀玉1号、怀玉2号试管苗的株高、生物量开始显著下降;当PEG-6000浓度达到120 g/L时,怀玉2号试管苗的株高和试管苗也开始显著下降;当PEG-6000浓度为150 g/L时,怀玉山三叶青怀玉1号、怀玉2号部分试管苗开始变黄、干枯死亡。
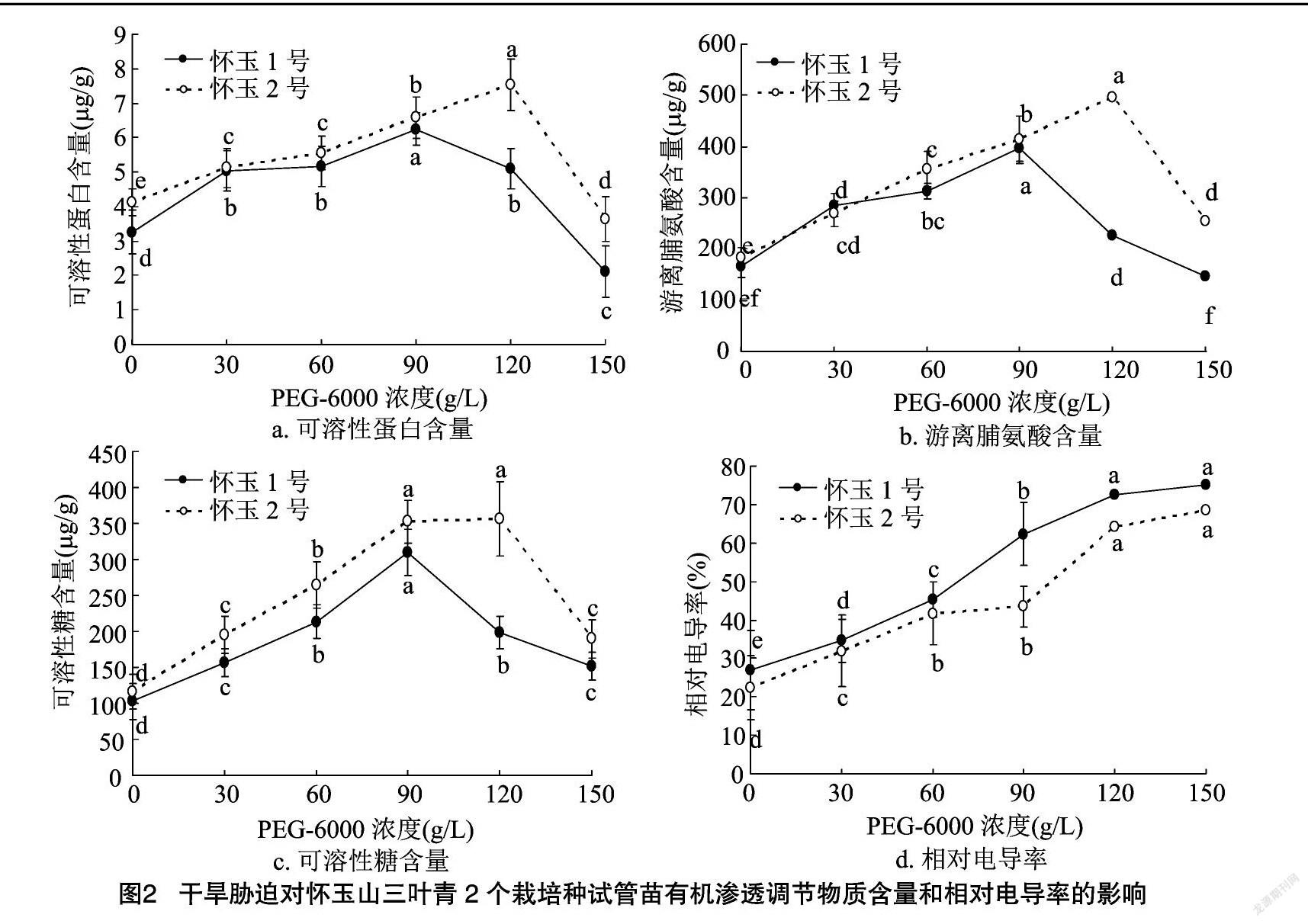
2.2 干旱胁迫对怀玉山三叶青2个栽培种试管苗有机渗透调节物质含量和相对电导率的影响
干旱胁迫对怀玉山三叶青2个栽培种试管苗有机渗透调节物质含量和相对电导率的影响见图2。可以看出,随着PEG-6000浓度的增加,怀玉1号、怀玉2号试管苗的可溶性蛋白、可溶性糖和游离脯氨酸含量整体呈先升后降的趋势,而相对电导率一直呈提高的趋势;当PEG-6000浓度分别为90、120 g/L 时,怀玉1号、怀玉2号试管苗的可溶性蛋白、可溶性糖和游离脯氨酸含量达到最高值。
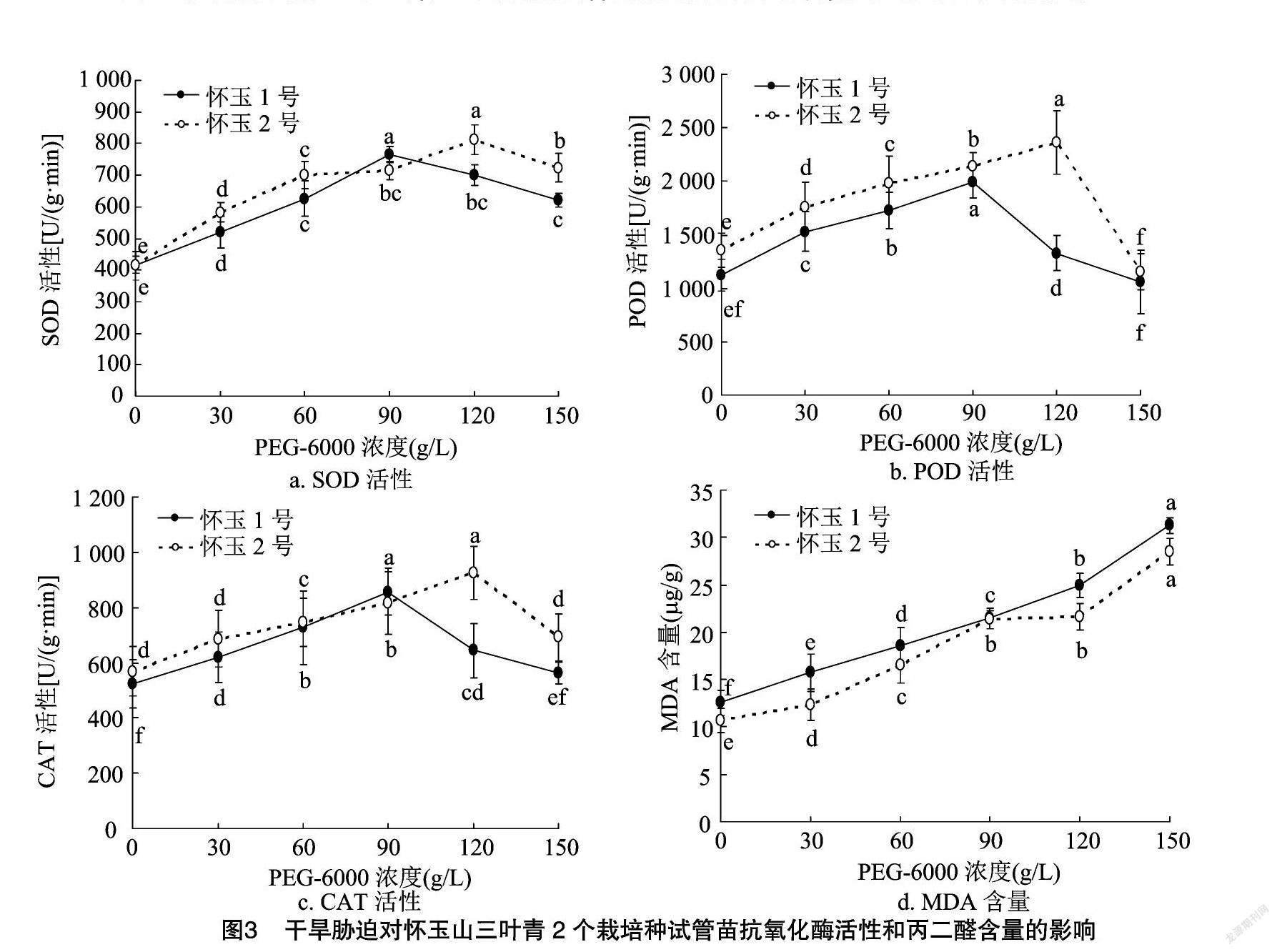
2.3 干旱胁迫对怀玉山三叶青2个栽培种试管苗抗氧化酶活性和丙二醛含量的影响
干旱胁迫对怀玉山三叶青2个栽培种试管苗抗氧化酶活性和丙二醛含量的影响见图3。可以看出,在干旱胁迫下,怀玉山三叶青2个栽培种试管苗抗氧化酶(SOD、POD和CAT)活性呈先升后降的趋势,但两者的MDA含量随着干旱脅迫程度的增加而持续显著提高。
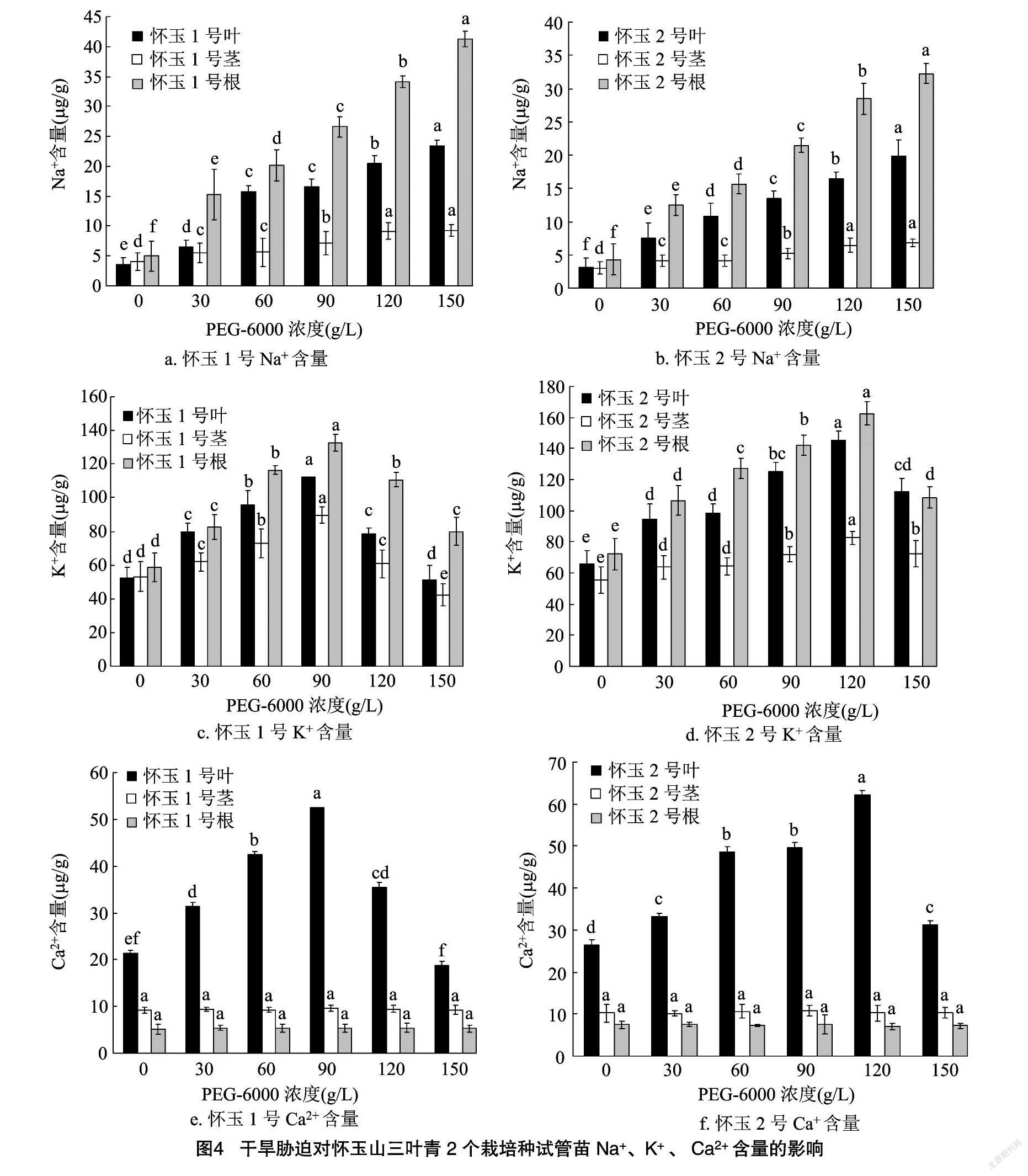
2.4 干旱胁迫对怀玉山三叶青2个栽培种试管苗Na+、K+和Ca2+含量的影响
干旱胁迫对怀玉山三叶青2个栽培种试管苗Na+、K+和Ca2+含量的影响见图4。可以看出,随着干旱胁迫不断加重,怀玉1号、怀玉2号试管苗叶、茎和根内的Na+含量均显著提高;在干旱胁迫下,怀玉山三叶青2个栽培种试管苗叶、茎和根内K+含量呈先升后降的趋势; 在干旱胁迫下, 怀玉山三叶青2个栽培种试管苗叶内Ca2+含量呈先升后降的趋势,但怀玉1号、怀玉2号试管苗茎、根内的Ca2+含量在任何PEG-6000浓度处理下均无显著变化。
2.5 干旱胁迫下怀玉山三叶青2个栽培种试管苗生理生化指标的隶属函数分析
通过干旱胁迫下怀玉山三叶青2个栽培种试管苗的可溶性蛋白含量、可溶性总糖含量、脯氨酸含量、MDA含量、相对电导率、POD活性、SOD活性、CAT活性以及Na+、K+、Ca2+的隶属函数分析,对怀玉山三叶青2个栽培种的耐旱性进行评价。由表2可以看出,怀玉山三叶青2个栽培种试管苗的平均隶属函数值存在差异。因此,根据隶属函数分析可知,怀玉山三叶青2个栽培种试管苗的耐旱性排序为怀玉2号>怀玉1号。
2.6 干旱胁迫下怀玉山三叶青2个栽培种试管苗生理生化指标的主成分分析
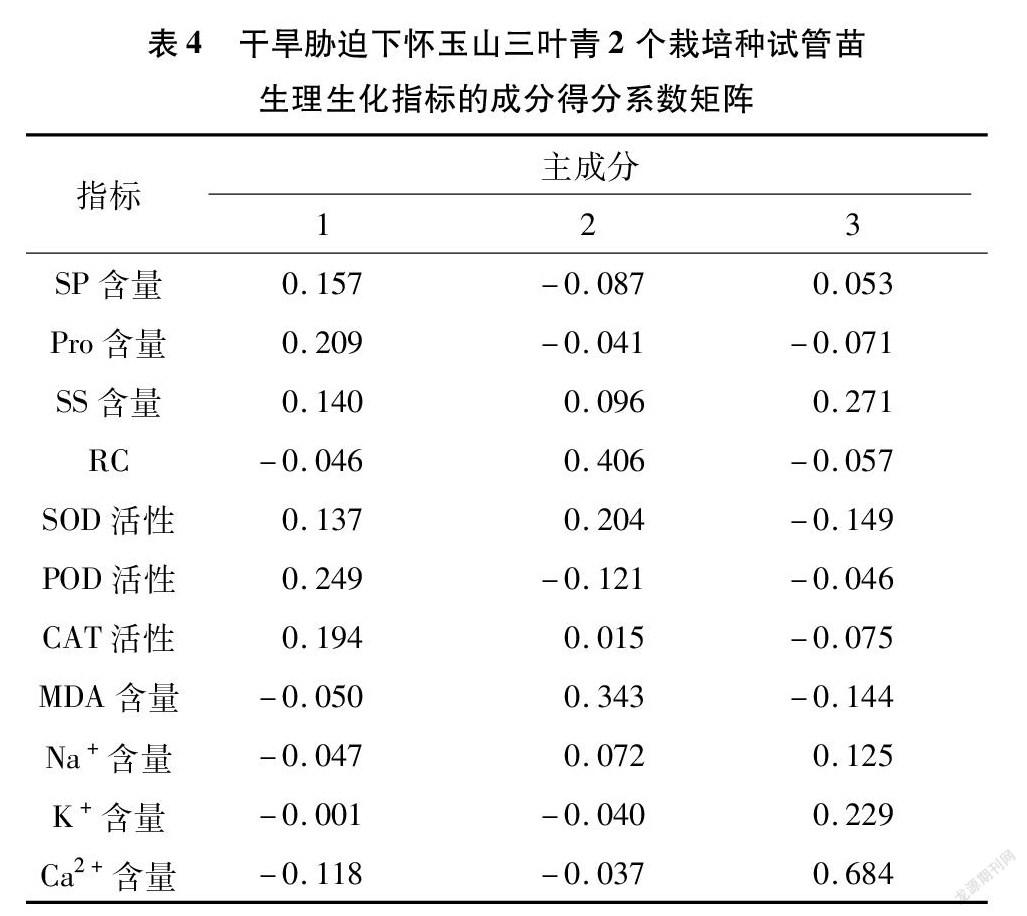
通过SPSS 19.0对各指标的隶属函数值进行标准化处理,并对标准化值进行主成分分析。由表3可以看出, SP含量、 Pro含量、 SS含量、 SOD活性、POD活性、CAT活性、K+含量之间具有一定的相关性。通过SPSS 19.0对干旱胁迫下怀玉山三叶青2个栽培种试管苗生理生化指标的主成分分析。11项生理生化指标成分的得分系数矩阵结果也表明,第1个主成分中较大的指标有POD、CAT活性和Pro含量,说明怀玉山三叶青2个栽培种在干旱胁迫下保持了较高的POD、CAT活性,同时2个栽培种在盐胁迫下产生了较多可以抵御干旱胁迫的脯氨酸,使植株免受干旱胁迫的伤害;第2个主成分中较大的指标有RC、SOD活性和MDA含量,说明怀玉山三叶青2个栽培种在干旱胁迫下具有一定的SOD活性,MDA含量减少,質膜透性较小;第3个主成分中较大的指标有SS、K+和Ca2+含量,说明怀玉山三叶青2个栽培种在干旱胁迫下保持了较高含量的可溶性糖、K+和Ca2+(表4)。
2.7 干旱胁迫对怀玉山三叶青2个栽培种叶片基因表达水平的影响
从图5可以看出,随着干旱胁迫的不断加重,怀玉1号、怀玉2号试管苗abscisic acid receptor PYL4(脱落酸受体PYL4)、jasmonate ZIM-domain transcriptional repressor(茉莉酸ZIM结构域转录抑制因子)、ethylene-responsive transcription factor 1B(乙烯反应性转录因子1B)、gibberellin receptor(赤霉素受体)、IAA 14(吲哚乙酸14)、flavonol synthase(黄酮醇合成酶)、chalcone synthase(查尔酮合成酶)、superoxide dismutase(超氧化物歧化酶)等基因的表达水平均呈先升后降的趋势,而tobamovirus multiplication protein 1(烟草病毒增殖蛋白1)和tobamovirus multiplication protein 2A(烟草病毒增殖蛋白2A)2个基因的表达水平呈不断下降的趋势。本研究结果表明,轻度干旱、中度干旱有助于脱落酸、茉莉酸、乙烯、赤霉素、生长素等内源激素含量的提高,也有利于怀玉山三叶青黄酮醇和查尔酮的合成,但不利于怀玉山三叶青烟草花叶病毒的增殖。
3 讨论
植物在干旱胁迫下会发生生理响应、细胞膜结构和功能受损,活性氧自由基累积,引发膜脂过氧化,产生丙二醛[24],同时积累可溶性蛋白、可溶性糖、游离脯氨酸等有机物质进行渗透调节,以适应干旱胁迫[25]。火力楠、尾叶桉、枫香、荷木幼苗在干旱胁迫下的可溶性糖含量和相对电导率显著增加,脯氨酸含量出现波动[5]。干旱胁迫使15个小黑麦品系叶片的Pro、SS含量显著升高[6],干旱处理使2个玉米品种[26]和9个葡萄砧木品种[9]叶片的质膜透性、脯氨酸含量和可溶性蛋白含量显著升高。在本试验中,干旱胁迫下三叶青2个栽培种试管苗的SP、SS和Pro含量呈先升后降的趋势,RC呈升高的趋势,但在干旱胁迫下,2个棉花品种根系的SP含量显著降低[27]。
在干旱胁迫下,植物会加强酶促防御反应,SOD、POD、CAT可有效清除自由基,降低膜脂过氧化作用,保护细胞膜系统[28]。干旱胁迫使4种阔叶树种幼苗SOD活性、MDA含量呈现先升后降的趋势[2]。干旱胁迫使15个小黑麦品系的MDA含量显著升高[6]。干旱处理使2个玉米品种叶片[26]和2个棉花品种根系[27]的MDA含量及SOD、CAT、POD活性显著升高。干旱胁迫使9个葡萄砧木品种叶片的MDA含量呈上升趋势,SOD活性呈“缓升—快降—快升—快降”的双“S”形趋势,POD活性呈先升再降的趋势[9]。在土壤渐进干旱胁迫下,12种草本植物的SOD活性、CAT活性、MDA含量显著升高[8]。在本试验中,干旱胁迫下怀玉山三叶青2个栽培种试管苗的抗氧化酶活性呈先升后降的趋势,但MDA含量持续升高。
在逆境胁迫下,植物会大量吸收Na+,植物的抗逆性取决于Na+的高效外排[29]。同时,Na+的积累会减少K+、Ca2+的吸收,使离子平衡被破坏,植物的抗逆性也取决于重建体内离子平衡的能力[30]。在干旱胁迫下,巴西旱稻对K+、Ca2+的吸收能力强于日本晴水稻[31]。干旱胁迫对2个木薯品种叶片K+、ABA含量的影响较大,对Ca2+含量的影响较小[32]。在本试验中,干旱胁迫下怀玉山三叶青2个栽培种试管苗叶、茎和根内Na+含量显著提高,K+含量先升后降,Ca2+含量无显著变化。
植物抗旱能力强弱是基因与环境互作调控的结果,单一生理指标无法衡量其抗旱性,需要多指标综合评价[33-34]。隶属函数法是将同一种质材料下的所有指标进行量化比重加权后相加求平均值,以此来客观评价抗旱性强弱[35]。主成分分析法在各指标间内在联系的基础上,将多个且彼此相关的指标转换成个数较少且彼此独立的综合指标,同时根据各自贡献率大小明确各综合指标的相对重要性[36]。主成分分析结果表明,4种阔叶树种幼苗的抗旱能力排序为荷木>火力楠>尾叶桉>枫香[2]。根据隶属函数可将干旱胁迫下15个小黑麦品系分为5种类型(高抗旱型、中抗旱型、中间型、干旱较敏感型和干旱敏感型)[6]。通过主成分分析,9个葡萄砧木品种抗旱能力排序为河岸9号>山河4号>河岸10号>101>山河3号>河岸7号>Ganzia>1613>河岸4号[9]。通过主成分分析与隶属函数值相结合的方法,得到12种草本植物的抗旱能力排序为沙蒿>沙打旺>草木樨>蜀葵>蒙古冰草>碱蓬>白三叶>苜蓿=甘草>沙生冰草>二色补血草>沙米[8]。在本试验中,根据隶属函数分析和比较发现,怀玉山三叶青2个栽培种试管苗的耐旱性排序为怀玉2号>怀玉1号。
研究发现,在干旱胁迫下植物除了发生生理响应外,还会产生一些基因表达的响应。在干旱胁迫下,玉米差异表达转录因子基因主要有bHLH、C2H2、ERF、MYB、NAC和WRKY[37]。在干旱胁迫下,豫杂一号泡桐水通道蛋白、糖转运蛋白、热休克蛋白70和胚胎发育晚期丰富蛋白差异表达量显著,这些基因可能是潜在的干旱胁迫响应基因[38]。干旱胁迫处理后,水稻过氧化氢酶(CATA、CATB、CATC)、过氧化物酶(POX5.1、POX1)、超氧化物歧化酶(plastidic Cu/Zn-SOD、cytosolic Cu/Zn-SOD)、抗坏血酸过氧化物酶(APX)、谷胱甘肽还原酶(GR)基因都呈先上调后下调的趋势[39]。在本试验中,随着干旱胁迫的不断加重,怀玉1号、怀玉2号试管苗abscisic acid receptor PYL4、jasmonate ZIM-domain transcriptional repressor(茉莉酸ZIM結构域转录抑制因子)、ethylene-responsive transcription factor 1B(乙烯反应性转录因子1B)、gibberellin receptor(赤霉素受体)、IAA14(吲哚乙酸14)、flavonol synthase(黄酮醇合成酶)、chalcone synthase(查尔酮合成酶)、superoxide dismutase(超氧化物歧化酶)等基因的表达水平均呈先升后降的趋势,而tobamovirus multiplication protein 1(烟草病毒增殖蛋白1)、tobamovirus multiplication protein 2A(烟草病毒增殖蛋白2A)2个基因的表达水平呈不断下降的趋势。由此可见,轻度干旱和中度干旱有助于脱落酸、茉莉酸、乙烯、赤霉素、生长素等内源激素水平的提高,也有利于怀玉山三叶青黄酮醇和查尔酮的合成,但不利于怀玉山三叶青烟草花叶病毒的增殖。
参考文献:
[1]Chen X,Tao L,Ru Y,et al. Antibacterial mechanism of Tetrastigma hemsleyanum Diels et Gilgs polysaccharides by metabolomics based on HPLC/MS[J]. International Journal of Biological Macromolecules,2019,140:206-215.
[2]Zhang X B,Lei L,Lai J S,et al. Effects of drought stress and water recovery on physiological responses and gene expression in maize seedlings[J]. BMC Plant Biology,2018,18:68.
[3]Hussain M,Farooq S,Hasan W,et al. Drought stress in sunflower:Physiological effects and its management through breeding and agronomic alternatives[J]. Agricultural Water Management,2018,201:152-166.
[4]Kapilan R,Vaziri M,Zwiazek J J. Regulation of aquaporins in plants under stress[J]. Biological Research,2018,51(1):4.
[5]冯慧芳,薛 立,任向荣,等. 4种阔叶幼苗对PEG模拟干旱的生理响应[J]. 生态学报,2011,31(2):371-382.
[6]郭 瑞,郝卫平,龚道枝. PEG-6000模拟水分胁迫对不同抗旱性冬小麦生理生态指标的影响[J]. 作物杂志,2012(5):43-47.
[7]赵方媛,田新会,杜文华. PEG-6000模拟干旱胁迫对15个小黑麦品系苗期生理特性的影响[J]. 干旱地区农业研究,2019,37(5):106-113.
[8]许爱云,曹 兵,谢云. 干旱风沙区煤炭基地12种草本植物对干旱胁迫的生理生态响应及抗旱性评价[J]. 草业学报,2020,29(10):22-34.
[9]由佳辉,高 林,王海鸥,等. 干旱胁迫对 9 个葡萄砧木品种生理指标的影响[J]. 经济林研究,2020,38(3):180-189.
[10]钱丽华,阮松林,戴丹丽,等. 温度对三叶青组培苗SOD、MDA等指标的影响[J]. 浙江农业科学,2010(5):972-974.
[11]杨 华,宋绪忠,陈 磊. 不同遮阴处理的三叶崖爬藤光合作用特性[J]. 林业工程学报,2010,24(5):57-59.
[12]吴志庄,高贵宾,欧建德,等. 生物炭肥对毛竹林下三叶青叶绿素含量、光合与荧光特性的影响[J]. 西北林学院学报,2017,32(5):59-63,103.
[13]周 武,张善华. 不同有机肥对药用植物三叶青化感物质的影响[J]. 丽水学院学报,2017,39(2):66-71.
[14]Green J J,Baddley J A,Cortina J,et al. Root development in the Mediterranean shrub Pistacia lentiscus as affected by nursery treatments[J]. Journal of Arid Environments,2005,61(1):1-12.
[15]Wu G Q,Feng R J,Liang N,et al. Sodium chloride stimulates growth and alleviates sorbitol-induced osmotic stress in sugar beet seedlings[J]. Plant Growth Regulation,2015,75(1):307-316.
[16]李 玲,李娘辉,蒋素梅. 植物生理学模块实验指导[M]. 北京:科学出版社,2008.
[17]李合生. 植物生理生化实验原理与技术[M]. 北京:高等教育出版社,2002.
[18]Chen J X,Wang X F. Guide to plant physiology experiments[M]. 2nd ed. Guangzhou:South China University of Technology Press,2006:64-66.
[19]Lu Y J,Li N Y,Sun J,et al. Exogenous hydrogen peroxide,nitric oxide and calcium mediate root ion fluxes in two non-secretor mangrove species subjected to NaCl stress[J]. Tree Physiology,2013,33(1):81-95.
[20]Giannopolitis C N,Ries S K. Superoxide dismutases:Ⅰ. Occurrence in higher plants[J]. Plant Physiology,1977,59(2):309-314.
[21]Havir E A,McHale N A. Biochemical and developmental characterization of multiple forms of catalase in tobacco leaves[J]. Plant Physiology,1987,84(2):450-455.
[22]海 霞,刘景辉,杨彦明,等. 盐胁迫对燕麦幼苗Na+、K+吸收和离子积累的影响[J]. 麦类作物学报,2019,39(5):613-620.
[23]Chen Q,Yu H W,Wang X R,et al. An alternative cetyltrimethylammonium bromide-based protocol for RNA isolation from blackberry (Rubus L.)[J]. Genetics & Molecular Research,2012,11(2):1773-1782.
[24]时丽冉,刘志华. 干旱胁迫对苣荬菜抗氧化酶和渗透调节物质的影响[J]. 草地学报,2010,18(5):673-677.
[25]Shinozali K,Yamaguchi-Shinozaki K. Gene networks involved in drought stress response and tolerance[J]. Journal of Experimental Botany,2007,58(2):221-227.
[26]李玉华,范春丽,雷志华,等. 两个玉米品种在萌芽期和苗期的干旱耐性比较分析[J]. 西北大学学报(自然科学版),2020,50(5):703-710.
[27]李军宏,王远远,夏 军,等. 两个不同耐旱性棉花品种根系生理特性对干旱的响应[J]. 应用生态学报,2020,31(10):3453-3460.
[28]Zhang J,Kirkham M B. Drought-stress-induced changes in activities of superoxide dismutase,catalase,and peroxidase in wheat species[J]. Plant and Cell Physiology,1993,35(5):785-791.
[29]Farooq M,Wahid A,Kobayashi N,et al. Plant drought stress:effects,mechanisms and management[J]. Agronomy for Sustainable Development,2009,29(1):185-212.
[30]Barber V A,Juday G P,Finney B P. Reduced growth of Alaskan white spruce in the twentieth century from temperature-induced drought stress[J]. Nature,2000,405(6787):668-673.
[31]侯佩臣,王晓冬,王美娟,等. 干旱胁迫下旱稻和水稻对K+和Ca2+的动态吸收研究[J]. 安徽农学通报,2013,19(23):5-7.
[32]杨 子,曾长英,王 斌,等. 干旱胁迫对木薯 K+、Ca2+和ABA的影响[J]. 热带作物学报,2013,34(9):1725-1729.
[33]沈思言,徐艳霞,马春雷,等. 干旱处理对不同品种茶树生理特性影响及抗旱性综合评价[J]. 茶叶科学,2019,39(2):171-180.
[34]邱 爽,何佳琦,李铭杨,等. 大豆GmGolS基因的原核表达及抗旱性分析[J]. 江苏农业科学,2020,48(14):61-65.
[35]李 瑶,隋晓青,郝裕辉,等. 干旱胁迫下新疆7份野生披碱草属种质材料萌发特性与抗旱性评价[J]. 新疆农业科学,2020,57(5):958-966.
[36]石永红,万里强,刘建宁,等. 多年生黑麦草抗旱性主成分及隶属函数分析[J]. 草地学报,2010,18(5):669-672.
[37]张鹏钰,王国瑞,曹丽茹,等. 干旱胁迫和复水处理下玉米差异表达转录因子基因分析[J]. 农业生物技术学报,2020,28(2):211-222.
[38]谢博洋,曹喜兵,张雯宇,等. 干旱胁迫对豫杂一号泡桐基因表达谱的影响[J]. 河南农业大学学报,2019,53(6):876-883.
[39]连 玲,张建福,许惠滨,等. PEG模拟干旱胁迫对水稻抗氧化酶基因表达的影响[J]. 福建農业学报,2019,34(3):255-263.
3865500338245

