3种不同规模化培养模式对湛江等鞭金藻生产力及色素含量的影响
吕 布,杨守国,VASQUEZ Hebert Ely,王爱民,郑 兴,顾志峰
(1 海南大学海洋学院,海南 海口 570228; 2 海南大学南海海洋资源利用国家重点实验室,海南 海口 570228;3 海南省海洋与渔业科学院,海南 海口 571126)
湛江等鞭金藻(Isochrysiszhanjiangensis)是一种重要的水产经济微藻,具有个体小、繁殖快、营养丰富、运动速度适中、不含纤维素细胞壁等特点,易被水生动物幼虫捕捉吞食和消化吸收,常作为海产经济双壳类等动物幼虫的基础饵料[1-3]。
微藻一般分为室内和室外两种养殖方式。室内环境下,主要通过5 L或更小的锥形瓶为培养容器进行培养,主要特点为精细化培养,但培养规模较小,一般作为一级藻种培养的开展模式。室外环境下,主要以容积300 L以上的容器进行培养,如玻璃钢桶、水泥池,主要特点是培养规模大,但精细化程度较低、易污染[4-5]。水产生产活动中所使用的微藻饵料基本是通过室外开放式规模化生产所得,该生产方式一般为一次性生产,易发生污染、倒藻现象,继而影响效益[6]。
室外光生物连续培养器近年来受到微藻生产企业的推崇,其主要特点是可进行连续性高密度培养,不易污染,可规模化生产[7-8]。室外光生物连续培养器具有可高效生产、所获微藻生物质量较高、土地使用面积效率相对较高等特点,使其成为可代替水泥池等占地面积大的微藻传统养殖模式的有效手段之一[9-11]。室外光生物连续培养器作为新型培养模式,相对聚乙烯桶、水泥池等传统模式的相关工作要求较高,如对操作者也具有一定管理技术要求,传统养殖户因对其不了解而不敢轻易接受并进行生产尝试[12]。关于室外光生物连续培养器与目前生产上常用的聚乙烯桶、水泥池等模式之间的生产效率和质量的比较研究报道则更为少见,因此使得新技术在养殖户中的推广工作变得缓慢。
本研究以湛江等鞭金藻为研究对象,比较探究了管道式光生物反应器养殖模式与传统微藻室外规模化养殖模式(聚乙烯桶和水泥池)生产力及生产效果之间的详细差异,以期为微藻生产新模式的推广及技术优化奠定理论基础。
1 材料与方法
1.1 材料
所用湛江等鞭金藻(Isochrysiszhanjiangensis)来源海南大学海洋学院微藻保种室。试验前将藻种进行纯化扩培,取快速生长期的藻液开展室外培养试验。所用培养液为本课题组基于“宁波3#微藻培养液” 而进一步优化所得,具体配方为:化肥尿素 50 mg、NaH2PO410 mg、 FeSO42.5 mg、MnSO40.25 mg、EDTA-2Na 10 mg、VB16× 10-3mg、VB120.5×10-6mg、过滤海水1 L。
试验所用水体为经过沙井过滤、沉淀、漂白水消毒后的自然海水。室外培养过程中的温度、光照强度、湿度、光周期等理化条件为自然条件。
1.2 试验设计
试验在 3 种不同的养殖模式中进行(图1)。聚乙烯桶的工作体积约 1 000 L;传统水泥池工作体积约 3 000 L;管道式光生物反应器工作体积约 2 000 L,其中管道式光生物反应器的供气系统由泵、输气管、调节阀组成。试验充气量基本统一控制为 20 L/min;接种细胞密度约为10.0×104cells/mL。光照为正常自然条件。

图1 试验所用微藻室外规模化培养模式
试验组别接入藻种混匀后,每隔24 h进行取样,进行藻类细胞数目、干重、色素含量、总蛋白含量及可溶性糖含量指标的检测。
1.3 检测指标及方法
(1)藻细胞数目的测定。采用血球计数板法进行测定[13]。
(2)藻细胞干重的测定。预先称重烘干Whatman GF/C过滤膜,将一定体积的藻液在该膜上过滤,经过冲洗除营养盐后,放到105 ℃烘箱中烘干72 h以上后称重,直至前后两次质量差不超过2 mg,然后计算两者的差值代表干重[14]。
(3)藻细胞内生物质的测定。
①叶绿素含量:利用丙酮萃取法提取微藻体内叶绿素,取待测藻液样品 20 mL,通过抽滤于Whatman GF/C膜上,随后用镊子将Whatman GF/C膜取下置于50 mL离心管底部,加入10 mL的90 %丙酮溶液,立即放入4 ℃冰箱中避光保存24 h以上(1~3 d均可),黑暗低温条件下进行萃取。萃取后在4 ℃,4 000 r/min条件下离心10 min,将离心后的提取液上清液小心注入1 cm比色皿,以90 %丙酮溶液作参比,分光光度计(岛津UV-1700)分别测定在波长630、647、664 nm处溶液的吸光度值并记录,减去波长750 nm下测得的吸光度值,得到校正后的E664、E647、E630值。按照以下的方程式计算叶绿素a(Cchla)、叶绿素b(Cchlb)和总叶绿素(Ctch1)的质量浓度[15]。
Cchla=(11.85E664-1.54E647-0.08E630)
×10/V
(1)
Cchlb=(21.03E647-5.43E664-2.66E630)
×10/V
(2)
Ctch1=(20.21E647+8.02E664) ×10/V
(3)
式中:Cchla、Cchlb、Ctch1—叶绿素a、b、总叶绿素的质量浓度,mg/L;E630、E647、E664—吸光度值,nm,V—试验用藻液体积,mL。
②总蛋白质含量:称取 0.1~0.3 g被测样品包于特制锡箔中,并置于自动落样器上。样品在燃烧反应炉 (960 ℃)、通氧量为 170 mL/min条件下充分燃烧 300 s,直至氧剩余量达到 12 %时停止燃烧。燃烧反应炉中的试剂依次为 280 g氧化铜,13 g银丝,15 g铂。燃烧炉中的产物进入 TC 检测器(Rapid N III,Ele-mentar公司)检测[16]。
③可溶性糖含量:取提取液 1 mL于刻度离心管内,加 5 mL蒽酮试剂,拧上盖子,沸水浴10 min之后将离心管冰水浴或用自来水冲洗至室温, 20 min后用紫外分光光度计测 630 nm处的吸光度值,比对标准曲线,计算可溶性糖含量[17]。
1.4 数据处理与统计
(1)数据换算处理:生产力Px和比生长速率(μ)通过下述公式进行计算[18]:
Px= (Xm-Xi)/Tc
(4)
μ= (lnXm-lnXi)/Tc
(5)
式中:Px—生产力,g/(L·d),Xi—初始生物量质量浓度, g/ L,Xm—最大生物量质量浓度,g/L,Tc—与最大生物量质量浓度有关的培养时间,d。
(2)统计分析:试验所得数据均以平均值±标准差(Mean±SD)进行表示。采用Microsoft Excel 2016和DPS 14.5软件进行数据处理和统计分析。采用单因素方差分析法进行差异性显著分析,当P<0.05时认为差异显著。
2 结果
2.1 不同养殖模式下湛江等鞭金藻生产力和比生长速率的差异
管道式光生物反应器培养模式下的湛江等鞭金藻生产力和比生长速率显著优于聚乙烯桶和传统水泥池培养模式(P<0.05,表1)。管道式光生物反应器的生产力和比生长速率最高,分别为0.054 3±0.000 8 g /(L·d)、0.276 7±0.001 0 d-1,其次为传统水泥池模式,分别为0.019 3±0.000 3 g/(L·d)、0.200 7±0.001 2 d-1。而聚乙烯桶模式相对最低,分别为0.016 3±0.000 6 g /(L·d)、0.190 3±0.002 4 d-1。

表1 不同养殖模式下湛江等鞭金藻生产力和比生长速率的差异
2.2 不同养殖模式下湛江等鞭金藻生长密度的差异
不同养殖模式下的湛江等鞭金藻生长整体呈先缓慢增长后快速增长,随后呈稳定状态,最后开始降低的趋势,且管道式光生物反应器模式趋势变化最为明显(图2)。

图2 3种养殖模式对湛江等鞭金藻生长密度的影响
管道式光生物反应器模式在第11 天开始进入快速生长期(1.46±0.04)×106cells/mL,并在第13 天细胞密度达峰值(3.70±0.11)×106cells/mL且开始进入平稳期;传统水泥池和聚乙烯桶模式生长趋势相对平缓,在第13天和第14 天分别达到峰值(1.42±0.01)×106cells/mL、(1.18±0.04)×106cells/mL,但显著低于管道式光生物反应器模式峰值(P< 0.05)。
2.3 不同养殖模式下湛江等鞭金藻叶绿素a、b和总叶绿素含量的差异
不同养殖模式下的湛江等鞭金藻叶绿素a、叶绿素b和总叶绿素质量浓度整体都呈先缓慢增长后快速增长,随后呈稳定状态,最后开始降低的趋势,且管道式光生物反应器模式趋势变化最为明显(图3、4、5)。
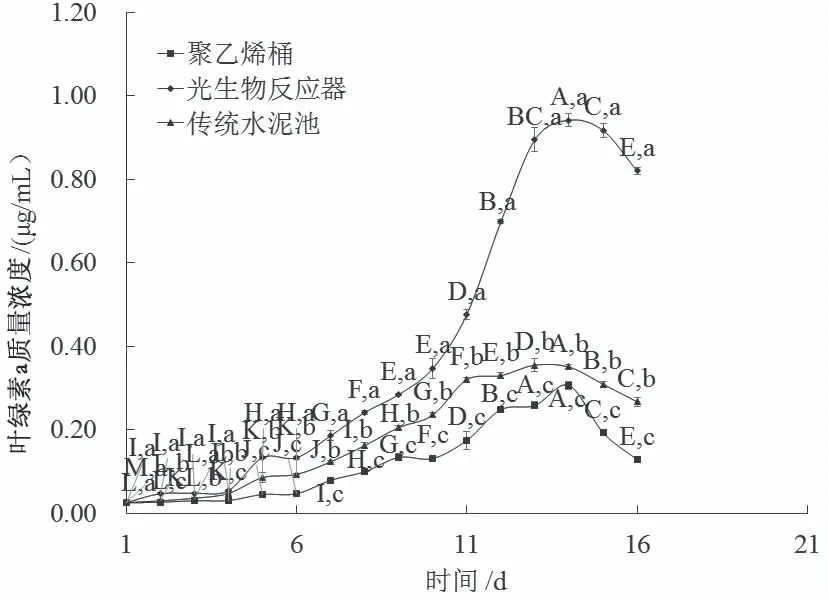
图3 3种养殖模式对湛江等鞭金藻叶绿素a的影响
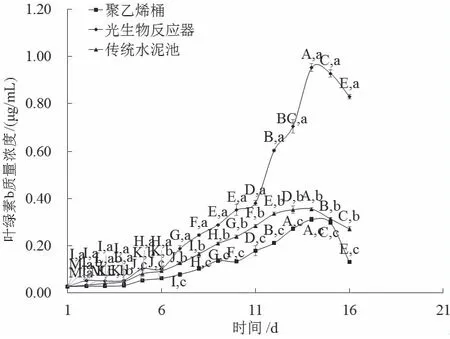
图4 3种养殖模式对湛江等鞭金藻叶绿素b的影响

图5 3种养殖模式对湛江等鞭金藻总叶绿素的影响
管道式光生物反应器模式中叶绿素a、叶绿素b和总叶绿素在第9天开始进入快速增长期(0.28 mg/L、0.29 mg/L、0.58 mg/L),并在第14天叶绿素a、叶绿素b和总叶绿素含量达峰值(0.94 mg/L、0.95 mg/L、1.90 mg/L)且开始进入平稳期;传统水泥池和聚乙烯桶模式叶绿素a、叶绿素b和总叶绿素增长趋势相对平缓,且叶绿素a、叶绿素b和总叶绿素质量浓度的峰值显著低于管道式光生物反应器模式(P< 0.05)。传统水泥池在养殖第13天叶绿素a、叶绿素b和总叶绿素质量浓度分别达峰值0.36 mg/L、0.35 mg/L、0.73 mg/L;聚乙烯桶模式在养殖第14天叶绿素a、叶绿素b和总叶绿素质量浓度分别达峰值0.31 mg/L、0.31 mg/L、0.63 mg/L。
2.4 不同养殖模式下湛江等鞭金藻和胞内有机物含量对比
管道式光生物反应器培养模式下的湛江等鞭金藻有机物质量浓度最佳,其次为传统水泥池模式,且有机物含量之间存在显著性差异(表2,P< 0.05)。管道式光生物反应器的有机物质量浓度最高,最大生物量干重、最高总蛋白质含量和最大可溶性糖含量分别可达0.727 0±0.009 8 g /L、159.125 5±2.169 7 mg/L,42.862 7±0.586 6 mg/L,显著高于传统水泥池模式(0.274 0±0.004 3 g/L、58.021 5±0.952 4 mg/L,15.528 3±0.257 5 mg/L),和聚乙烯桶模式(0.238 5±0.007 4 g /L、50.453 4±1.633 1 mg/L,13.482 3±0.441 5 mg/L)。而管道式光生物反应器,聚乙烯桶和传统水泥池模式的单细胞胞内有机物含量之间没有显著性差异(表3)。
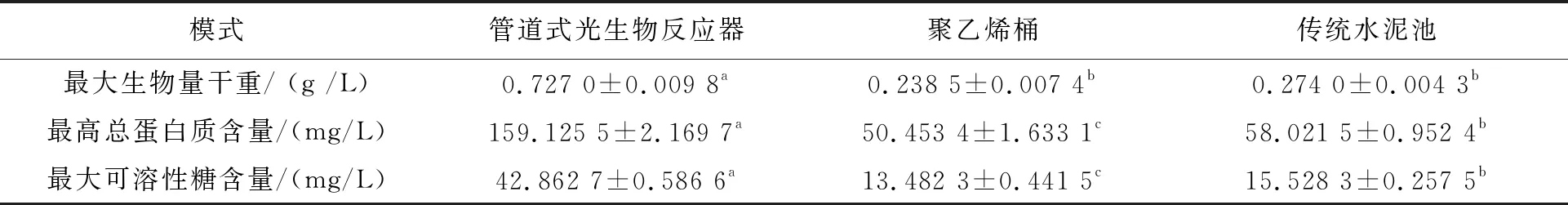
表2 湛江等鞭金藻在聚乙烯桶、管道式光生物反应器和传统水泥池培养下的有机物之间的比较

表3 湛江等鞭金藻在聚乙烯桶、管道式光生物反应器和传统水泥池培养下的单细胞胞内有机物之间的比较
3 讨论
3.1 湛江等鞭金藻3种培养模式比较
微藻培养模式各有利弊,为了取长补短、相互弥补,对各种培养模式不断地优化成为近几年的研究热点。跑道水泥池模式的使用在微藻培养发展过程中实现了扩大和培养的尝试,其优点在于可将投入和运营成本降到最低[19-21]。此外聚乙烯桶模式因其具有体积小、易清理的优点,常在水产养殖场中被应用,是微藻生物饵料扩培的中间模式[22]。管道式光生物反应器是近年来较受水产生产单位欢迎的微藻室外培养的新型模式,其可利用玻璃管道使微藻在生产过程中充分利用太阳光能,使藻细胞的受光面积达到最大,并可降低受其他因素污染藻液的可能性[10,23-24]。本研究表明,管道式光生物反应器是适合户外大规模微藻培养的养殖模式,这与李磊等[10]关于光生物反应器培养微藻的研究结果以及赵新亚等[25]对小球藻和新月菱形藻柱式光生物反应器连续式培养研究结果较为一致。由此可见光生物反应器培养模式与常见的三角瓶一级培养、吊袋二级培养和水泥池三级培养系统相比具有明显的优越性,且具有较高的微藻繁殖效率。
3.2 湛江等鞭金藻3种培养模式对生产力和色素含量影响分析
生产力和比生长速率是评估微藻生产可行性的重要参数之一,本研究表明,管道式光生物反应器生产模式的生产力和比生长速率显著高于聚乙烯桶和传统水泥池模式,即管道式光生物反应器生产模式的生产效果最佳。3种不同培养模式的比较试验是同时在室外开展的,造成生产效果存在差异的主要原因可能在于光照利用的充分与否。随培养时间的推移,藻液单细胞浓度在不断升高,传统水泥池和聚乙烯桶培养模式由于养殖容器深度等问题使得单个藻体细胞所受到光照条件在逐渐减弱,继而限制了其生长,而管道式光生物反应器相对而言即使在养殖后期依然可有效保障藻细胞充足且有效的光照条件[26-28]。与董学卫等[5]关于柱式反应器研究结果相比,管道式光生物反应器的生产力较次于柱式反应器,其原因可能在于培养规模的差异,其所用柱式反应器培养体积较小,更适于室内保种,而本研究所用管道式光生物反应器规模相对较大,更适用于室外培养,同时在和其柱式反应器初始藻密度相差很大的情况下,它们的比生长速率仍然十分接近,可见本研究所用的管道式光生物反应器是具有优势的。
细胞光合速率决定了藻类生长速度,而光合速率又取决于光合色素的含量,因此光合色素含量变化能反映微藻生长发育情况[29]。
本研究发现,利用管道式光生物反应器规模化培养金藻时更利于其叶绿素及胞内有机物的积累。朱永梅等[30]研究中利用不同光合光子强度培养湛江等鞭金藻说明,光照强度在一定的范围内,逐渐升高是有利于微藻生长,本研究所用管道式光生物反应器受光面积更大,单个微藻更容易接受光照,相较于其他两种模式更有利于微藻培养。如果假设培养系统之间的叶绿素数量和质量没有差异,并且所有系统处于相同曲线水平,这原则上表达了管道式光生物反应器系统中湛江等鞭金藻的发育状况更好且应优选用于叶绿素的生产。且在相似的盐度下,本研究中管道式光生物反应器中生产的叶绿素含量和蔺红苹等[1]研究中的叶绿素含量一致。此外,本研究发现试验周期内管道式光生物反应器、聚乙烯桶和传统水泥池的湛江等鞭金藻有机物的质量浓度并不一致,管道式光生物反应器中湛江等鞭金藻总蛋白质含量和可溶性糖含量显著高于聚乙烯桶和传统水泥池培养模式,这可能是由于管道式光生物反应器更利于藻体接受光照所致[5]。与黄振华等[31]使用小型锥形瓶培养的湛江等鞭金藻的蛋白质含量相比,本研究使用的管道式光生物反应器要低于其使用的用于保种的小型锥形瓶,但二者模式相差较大,所以用于规模化生产的管道式光生物反应器的蛋白质含量是具有可比性的。传统的微藻室外规模化培养方式操作烦琐,生产效率低,藻的质量不能得到保障,相关研究结果表明,管道式光生物反应器可有效避免这些问题,更利于微藻规模化培养效率的提高,但需要较精细的技术运营管理。
4 结论
管道式光生物反应器培养模式下的藻细胞生长、繁殖速度快,可快速进入指数生长期,具有藻液细胞浓度大,富含优质生物质的优点,饵料质量可得到强化。管道式光生物反应器为在户外低成本高效开发微藻提供了基础条件。
□

