右旋糖酐发酵液酶解制备右旋糖酐40中氮的控制
问清江, 慕 娟, 孙晓宇, 郑巧霞, 丁 浩
(陕西省微生物研究所,陕西 西安 710043)
右旋糖酐发酵液是肠膜状明串珠菌(Leuconstocmesenteriodes)以蔗糖为主要原料,在其自身的右旋糖酐蔗糖酶(Dextransucrase, EC 2.4.5.1)的作用下,将蔗糖转化为高分子右旋糖酐和果糖的发酵产物[1-2]。右旋糖酐在医药领域的主要用途为代血浆,可以提高血浆胶体渗透压,吸收血管外的水分以补充血容量,从而维护血压扩充血容量的强度。右旋糖酐40是临床医学最常用的右旋糖酐品种之一,具有改善人体血液微循环的作用[3-5]。杂氮是右旋糖酐医用产品的重要指标,培养基中的氮源蛋白胨经肠膜状明串珠菌的代谢,其产物既有蛋白、肽、氨基酸等有机氮,还有无机氮,这些产物是引起不良反应的主要原因之一。因此对右旋糖酐40生产过程中氮含量的控制就是对其抗原性物质异性蛋白含氮杂质的控制,以达到临床用药更加安全有效、降低热源反应和变态反应发生率的目的[6]。传统右旋糖酐40的生产工艺为右旋糖酐发酵液经乙醇沉淀提取粗酐,粗酐经盐酸水解,分离纯化为分子量分布:重均分子量为32 000~42 000、10% 的大分子≤120 000、10%的小分子≥5 000的低分子右旋糖酐,杂氮含量 ≤0.007%[7]。乙醇沉淀提取粗酐,不仅耗费大量乙醇,且高分子的右旋糖酐不容易溶解,只能采用在盐酸的作用下溶解,致使水解反应同步性差,水解产物分子量分布不均而影响产品的质量,最终导致我国右旋糖酐的分子量分布标准与欧洲标准、美国标准、日本标准存在差距[8-9]。右旋糖酐酶(Dextranase,EC 3.2.1.11)能够催化水解右旋糖酐(Dextran)分子中的α-1,6葡萄糖苷键,降解其为小分子的右旋糖酐、异麦芽糖、异麦芽三糖、葡萄糖及少量的多聚糖。酶解反应具有专一性和高效性,可以提高水解效率,改善水解产物的分子量分布,并且反应条件温和,既可避免盐酸对水解设备的特殊要求,又可以降低能耗[10]。右旋糖酐40生产新工艺的探索从发酵液的后处理开始,首先采用吸附过滤方法去除菌体等杂质,然后经陶瓷膜过滤将右旋糖酐与以果糖为主的小分子糖类分离,得到右旋糖酐溶液,用于进一步水解制备右旋糖酐40,从而替代乙醇沉淀提取粗酐工艺;右旋糖酐酶降解高分子右旋糖酐替代盐酸水解制备右旋糖酐40。该右旋糖酐酶水解右旋糖酐发酵处理液方法以蛋白含量为目标确定右旋糖酐发酵液吸附除杂工艺条件,氮含量过程监测进一步控制杂氮,最终使右旋糖酐40产品杂氮含量达标,降低产品不良反应潜在风险,为用药安全提供保证。
1 材料与方法
1.1 材料
1.1.1 菌株 肠膜状明串珠菌(Leuconstocmesenteriodes-1226)由中国药品生物制品检定所提供。
1.1.2 主要试剂与仪器设备 白砂糖(一级,孟连昌裕糖业有限责任公司);右旋糖酐酶(宁夏夏圣实业集团有限公司);考马斯亮蓝G-250(W08D04XL,西安舟鼎国生物技术有限公司)其他试剂为分析纯。分光光度计(752,上海精密科学仪器有限公司);生化培养箱(SPX-150BIII,天津泰斯特);隔水式培养箱(GH-500,北京科伟永兴仪器有限公司);数显恒温磁力搅拌器(85-2,杭州仪表电机有限公司);电热鼓风干燥箱(101,北京科伟永兴仪器有限公司); 高效液相色谱仪(2010A-HT,苏州贝锐仪器科技有限公司);陶瓷复合膜(SJM-FHM-2,合肥世杰膜工程有限公司)。
1.2 方法
1.2.1 右旋糖酐发酵液除杂吸附剂最适作用浓度 取500 mL发酵液的稀释液,加入不同量的活性炭吸附剂,80 ℃搅拌保温30 min,过滤,考马斯亮蓝法检测上清液中的蛋白含量,以发酵液稀释液为对照计算蛋白去除率,以确定吸附剂的最适浓度。
式中:N为蛋白去除率,W1处理前蛋白总量,W2为处理后的蛋白含量。
1.2.2 右旋糖酐发酵液吸附除杂时间 取1 000 mL发酵液的稀释液,加入15 g活性炭吸附剂,80 ℃条件下搅拌保温,分别在15、30、45、60 min时取样200 mL过滤,取上清液检测蛋白含量,以发酵液稀释液为对照计算蛋白去除率,以确定吸附除杂的作用时间。
1.2.3 右旋糖酐发酵液吸附除杂最适温度 取500 mL发酵液的5倍稀释液,加入7.5 g的活性炭吸附剂,在不同的温度条件下搅拌保温45 min,过滤,取上清液检测其中的蛋白含量,以发酵液的稀释液为对照计算蛋白去除率,确定吸附除杂的最适作用温度。
1.2.4 右旋糖酐发酵液吸附除杂最适作用条件 首先以吸附剂用量、时间、温度为因素进行三因素三水平的正交试验,然后通过正交验证试验,最终确定发酵液吸附除杂的最适条件。
1.2.5 考马斯亮蓝法测定蛋白含量[11]取7支试管编号1~7,依次加入100 μg/mL蛋白标准液0.0、0.1、0.2、0.3、0.4、0.5、0.6 mL,以0.15 mol/L NaCl补足1 mL,加入考马斯亮蓝G-250试剂溶液5.0 mL,摇匀,1 h 内以1号为空白对照,在 595 nm 处比色,以A595为纵坐标,标准蛋白含量为横坐标绘制标准曲线,用于测定样品蛋白含量。
1.2.6 杂氮含量标准曲线测定[7]精确量取1.4 mL 含氮量为10 μg/mL 的硫酸铵标准溶液置于消解管中,加入浓硫酸0.5 mL,150~300 ℃ 消解;消解结束放置到室温加入10 mL 蒸馏水,5% 氢氧化钠溶液调节pH至碱性,转入50 mL的比色管,蒸馏水定容至50 mL,加入2.0 mL碱性碘化汞钾试液,摇匀,分光光度计进行不同波长的扫描,确定390 nm为测定波长。配制氮含量为4、9、14、19、24、29、34 μg的硫酸铵溶液,按照上述确定390 nm为测定波长的方法,以A390为纵坐标,氮含量为横坐标绘制标准曲线,用于测定杂氮含量。
1.2.7 分子量与分子量分布[7]取右旋糖酐40样品适量,加流动相(0.71%硫酸钠溶液,内含0.02%叠氮化钠)溶解并稀释制成每 1 mL 约含 10 mg 右旋糖酐40溶液,振摇,室温放置过夜作为供试品溶液。另取 4~5个 已知分子量的右旋糖酐对照品,依法检查(2015版《药典》二部附录VH),样品 10% 大分子部分重均分子量不得大于 120 000,10% 小分子部分重均分子量不得小于 5 000。
2 结果与分析
2.1 右旋糖酐发酵液除杂吸附剂的最适作用浓度
将右旋糖酐发酵液进行5倍体积分数稀释,分别以不同浓度(质量分数,下同)加入吸附剂(活性炭),在80 ℃条件下搅拌保温30 min,过滤收集滤液,检测其蛋白含量,以出发发酵稀释液为对照计算蛋白去除率,结果如图1所示。吸附剂浓度为1.0%~1.5%时,蛋白去除率明显增加,随后不再增加。因此,吸附剂的最适浓度为1.5%。
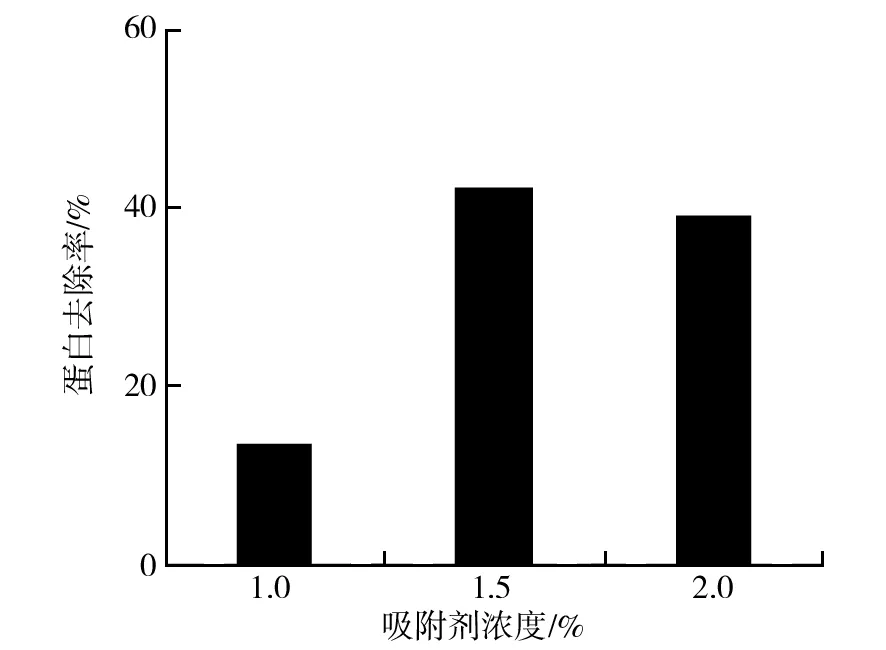
图1 吸附剂浓度对蛋白去除的影响Fig.1 Effect of adsorbent concentration on protein removal
2.2 右旋糖酐发酵液吸附除杂的作用时间
右旋糖酐发酵液稀释液加入1.5% (质量分数)活性炭,80 ℃条件下搅拌保温,不同时间取样过滤, 检测滤液中蛋白含量计算蛋白去除率,结果(图2)表明,15~45 min蛋白去除率处于上升阶段,45 min和60 min的蛋白去除率相当,因此最适吸附除杂时间为45 min。
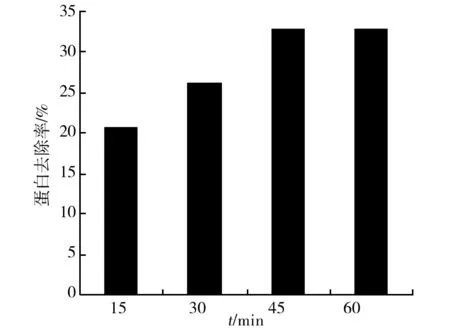
图2 吸附时间对蛋白去除的影响Fig.2 Effect of adsorbent time on protein removal
2.3 右旋糖酐发酵液吸附除杂的作用温度
取500 mL右旋糖酐发酵液稀释液,加入7.5 g的活性炭,以不同的温度搅拌保温45 min,过滤,取样检测上清液中的蛋白含量,以发酵液稀释液为对照计算蛋白去除率,结果见图3,在吸附剂浓度和时间相同的条件下,85 ℃时蛋白去除效果最佳。
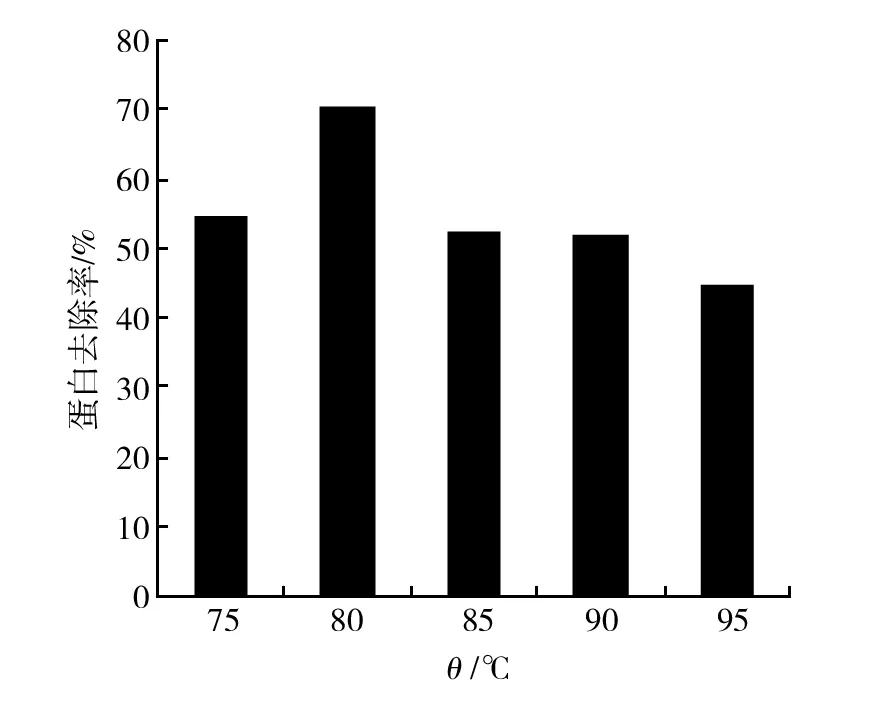
图3 吸附温度对蛋白去除的影响Fig.3 Effect of adsorbent temperature on protein removal
2.4 右旋糖酐发酵液吸附除杂的最适作用条件
在右旋糖酐发酵液吸附除杂条件(吸附剂浓度、时间和温度)单一选择的基础上,按照表1进行吸附剂浓度、时间和温度的三因素三水平的正交试验,结果见表2。从结果级差分析可知,C>B>A ,其中影响最大的是吸附时间,最佳结果为A1B1C3,由于该结果不在表中之列,所以进行验证试验。将表2中试验号1(A1B1C1)、7(A3B1C3)和(A1B1C3)进行比较,结果(表3)表明:A1B1C3蛋白去除率最高,为发酵液吸附除杂的最适作用条件,蛋白去除率44.43%,剩余蛋白在之后的分离纯化工艺过程中进一步被去除。
2.5 右旋糖酐发酵液吸附去除杂氮
将右旋糖酐发酵液进行一定的稀释,按照2.4中最适吸附除杂作用条件进行吸附处理,板框过滤,滤液取样200 mL真空冷冻干燥,干品用于检测(发酵液取样100 mL真空冷冻干燥,干品用于检测对照),其余滤液进一步陶瓷膜过滤。发酵液吸附去除杂氮结果(表4)表明,杂氮的去除率为56.00%~71.60%,吸附除杂后的干品杂氮含量从起始的0.175%~0.257%降至0.072%~0.082%,具有显著的杂氮去除效果;虽然因发酵水平不同而导致的发酵液杂氮含量不同,但是经过吸附处理后,使得杂氮含量可以降低到0.09% 以下。杂氮的去除率(56.00%~71.60%)明显高于蛋白去除率(44.43%),原因在于杂氮的去除中不仅局限于蛋白的去除,还包括其他含氮类物质;考马斯亮蓝法测定蛋白的去除率作为条件实验,方法简便易行,但是会受到检测样品中的澄清度等因素影响,检测数据偏差也导致氮去除率与蛋白去除率的差距。
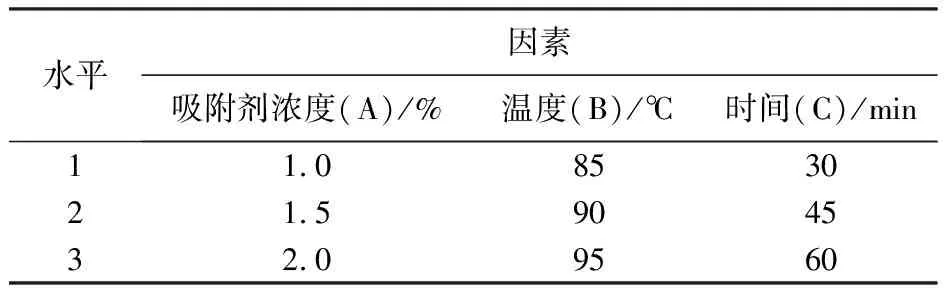
表1 正交试验因素水平
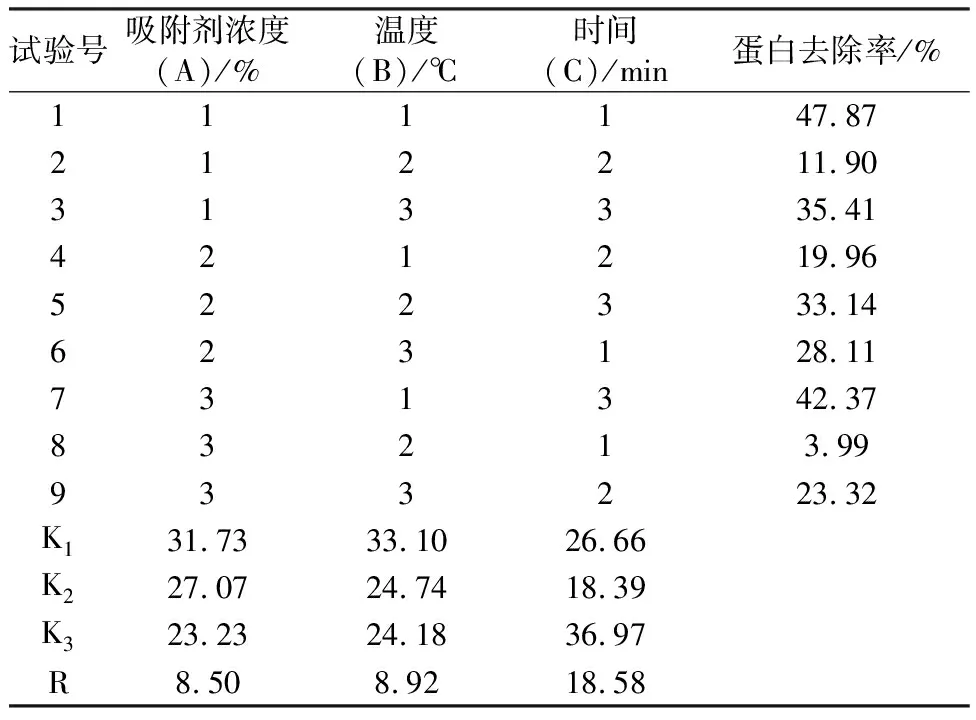
表2 正交试验结果和级差分析
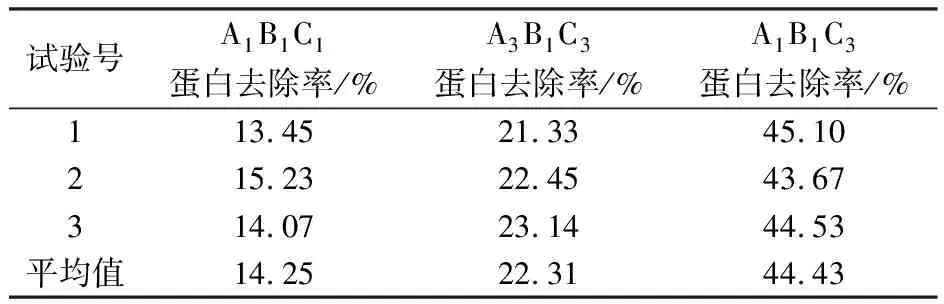
表3 正交试验验证结果
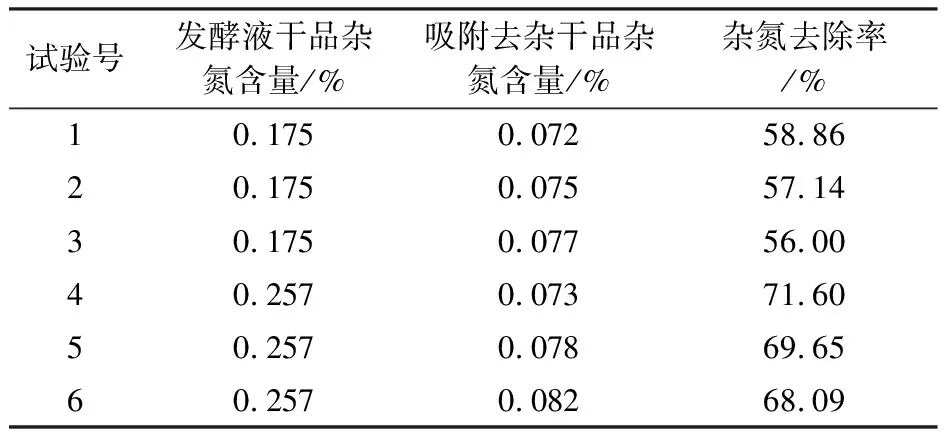
表4 吸附去除杂氮结果
2.6 陶瓷膜过滤去除杂氮
右旋糖酐发酵液经过吸附除杂后的滤液继续进行陶瓷膜过滤,将以果糖为主要代表的小分子糖类与右旋糖酐分离,杂氮等其他小分子杂质同时也被去除,还可以将右旋糖酐稀释液浓缩用于酶解制备右旋糖酐40。在陶瓷膜过滤过程中,需要根据具体料液补加一定量的纯水,以提高滤过除杂效率。收集截留液为右旋糖酐溶液,取样150 mL真空冷冻干燥,干品用于检测。陶瓷膜过滤结果(表5)表明,陶瓷膜过滤杂氮的去除率可达45% 以上,干品杂氮含量低于0.040%;右旋糖酐发酵液经过吸附除杂和陶瓷膜过滤处理后,右旋糖酐溶液的含氮量与传统工艺中乙醇沉淀提取粗酐的杂氮含量(表6)相当,达到了杂氮去除的控制目标,完全可以替代乙醇沉淀提取粗酐工艺。
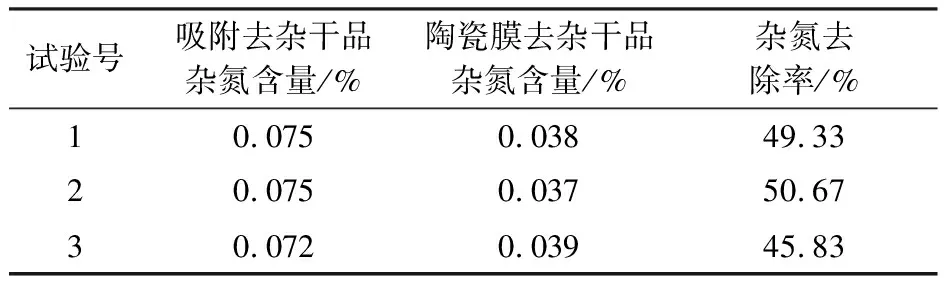
表5 陶瓷膜去除杂氮结果
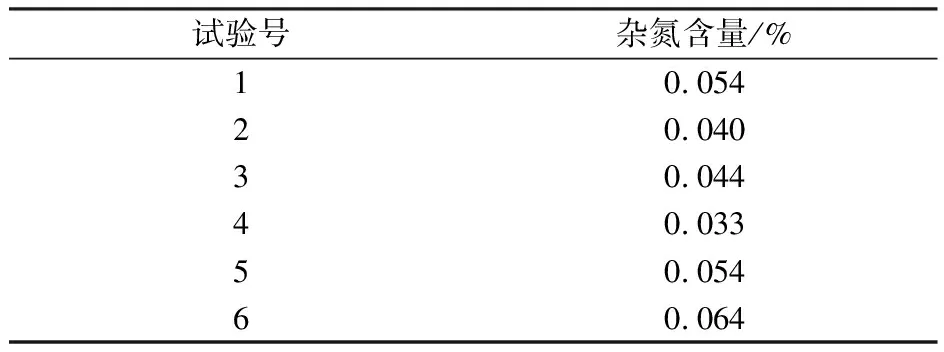
表6 乙醇沉淀提取粗酐的杂氮含量
2.7 酶解制备右旋糖酐40杂氮的去除
右旋糖酐发酵液首先经过以蛋白等大分子为主的吸附除杂工艺处理,然后使用陶瓷膜过滤,去除以果糖为主要代表的小分子杂糖及其他小分子杂质,得到的右旋糖酐发酵液处理液进一步在右旋糖酐酶的作用下水解为一定分子量分布的低分子右旋糖酐溶液,经过乙醇分级沉淀制备右旋糖酐40。在乙醇分级沉淀的工艺过程中杂氮进一步被去除(表7),杂氮的去除率达89% 以上,右旋糖酐40的杂氮含量为0.001%~0.003%,达到《中国药典》≤0.007%的标准。
右旋糖酐发酵液酶解制备右旋糖酐40,在保证其分子量分布达标的前提下,对其杂氮的去除摸索新的工艺路线。右旋糖酐发酵液中杂氮的主要组成部分为肠膜状明串珠菌菌体、右旋糖酐蔗糖酶等蛋白类及小分子代谢产物等,因此发酵液杂氮的去除首先从吸附除杂入手,然后再去除小分子杂氮物质。吸附除杂、陶瓷膜过滤、乙醇分离提取是右旋糖酐发酵液酶解制备右旋糖酐40的关键杂氮去除工艺,结果见表8。吸附去杂氮的去除率57%以上,杂氮含量降至0.090%以下;陶瓷膜过滤去杂氮的去除率45%以上,杂氮含量降至0.040% 以下;乙醇分离沉淀去杂氮的去除率89% 以上,杂氮含量降至0.003% 以下,达到≤0.007% 的国家标准。整个右旋糖酐发酵液酶解制备右旋糖酐40工艺过程杂氮的去除率达到98% 以上。
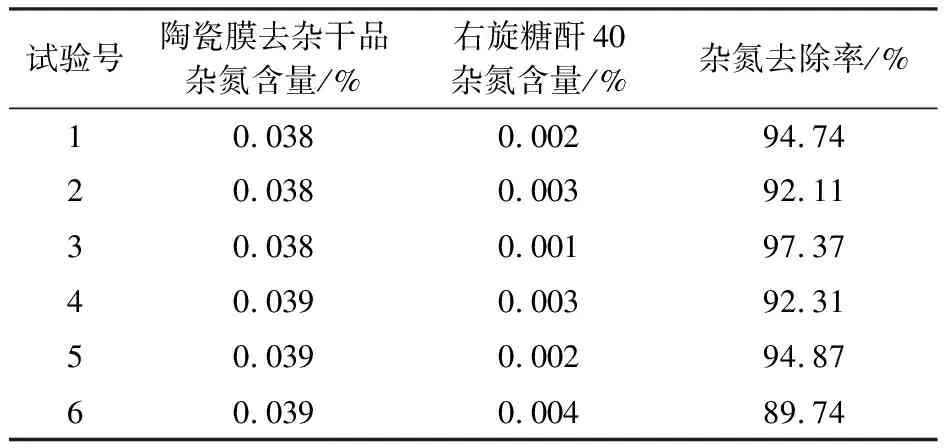
表7 酶解制备右旋糖酐40去除杂氮结果

表8 右旋糖酐发酵液酶解制备右旋糖酐40杂氮控制结果
3 讨 论
传统右旋糖酐40生产工艺过程存在以下缺陷:①乙醇沉淀只能提取大于一定分子量的右旋糖酐,分子量低的部分遗留在残液中,从而导致右旋糖酐40产率低下,还要耗费乙醇;②粗酐因右旋糖酐分子量巨大而难以溶解,只能采用盐酸降解助溶,使得右旋糖酐的降解难以同步而导致降解产物分子量分布不均,产品分子量分布的标准与欧洲及美国等存在差距;③盐酸水解无专一性,温度高能耗大,水解设备材质有特殊要求,盐酸中的氯既影响产品品质,又不利于企业环保。首先通过检测右旋糖酐发酵液蛋白含量,得到最佳吸附条件,然后通过陶瓷膜过滤将右旋糖酐和果糖分离进一步去除杂氮。以上两个工艺过程完全可以替代乙醇沉淀提取粗酐,获得的右旋糖酐发酵液处理液直接用于右旋糖酐酶降解,省去了乙醇的使用和高分子右旋糖酐溶解过程;酶解温度为50 ℃,且右旋糖酐酶具有高效性和专一性,既降低了能耗,又改善了水解液中右旋糖酐分子量的分布,提高了产品品质,降低了企业环保负荷。右旋糖酐酶解液经过乙醇分级沉淀制备右旋糖酐40,杂氮的去除率达到89%以上,杂氮含量降至0.003%以下,达到≤0.007%的国家标准。右旋糖酐发酵液酶解制备右旋糖酐40工艺过程杂氮的控制可以使杂氮去除率达到98%以上,产品杂氮含量达到国家标准,分子量分布有所改善,重均分子量35 000以上,10%小分子>7 000。

