置管7天内启动腹膜透析患者的预后分析
陈艺方 陈秀玲 高 辉 王君如 尹丽娟 周 勤 李 怡 李贵森1, 陈 瑾1,
流行病学调查显示中国成人慢性肾病发病率达10.8%[1]。由于慢性肾脏病起病隐匿、知晓率低,患者往往就诊晚。因此,非计划起始透析占起始透析患者的30%~50%[2],成为全球普遍关注的重要问题。2005年《欧洲最佳血液透析实践指南EBPG指南》[3]和2010年《国际腹膜透析学会ISPD指南》[4]等均建议在置管2周后开始PD,以利于腹膜透析(PD)置管手术伤口愈合及减少早期并发症。不仅限制了PD在终末期肾病中的早期应用及治疗,还延长了患者的住院时间。目前腹膜置管后最佳开始PD时间尚不明确,本研究回顾性分析了早期启动PD患者的并发症及预后情况。
对象和方法
研究对象回顾性分析四川省人民医院PD中心2008-01-01~2016-12-31的新置管PD患者,随访时间为3年。排除标准:(1)无完整病例或随访资料;(2)腹腔镜下PD置管术;(3)置管后未进行PD;(4)肾功能恢复退出PD;(5)置管后开始PD时间>1个月;(6)PD 3个月内转为血液透析或肾移植;(7)PD 3个月内死亡。
方法根据置管后开始PD时间分为三组,P1组(≤7d)、P2组(8~13d)和P3组(≥14d)。所有Tenckhoff导管置入均由3名肾脏科固定医师在局部麻醉下进行开放手术。在腹直肌后壁和腹膜上采用荷包线缝合技术进行导管固定和防止渗漏。启动PD的方案为第1~3天每次透析液注入量1 000 ml,留腹1h,每天3次;第4~6天透析液注入量1 500 ml,留腹3h,每天3次;第7天开始透析液注入量2 000 ml,依据患者情况设置每日透析剂量,开始规律透析。
所有数据从四川省人民医院PD中心数据库收集,收集患者PD置管前最后一次检查结果作为基线数据,并计算年龄校正Charlson合并症指数(aCCI)[5]。基线尿素清除指数(Kt/V)、内生肌酐清除率(Ccr)为患者开始PD治疗1月时检测结果。对患者进行了3年随访,直到任何原因导致退出PD或随访终点时间2019-12-31。患者转归包括:任何原因转血液透析、死亡、肾移植、失随访或转至其他中心。患者死亡日期和死亡原因从医院临床记录中获得。在医院外死亡的患者,通过电话采访家属确定详细的死因。所有个人信息都受到了安全保护,只有调查人员可以获得这些信息。
终点事件及相关定义主要终点是导管技术失败,指透析液流入和(或)透析液流出障碍或因腹膜炎导致的拔管或死亡。次要终点包括与PD相关的并发症事件及死亡。围手术期并发症包括出血(需要输血或外科手术干预的出血)、肠穿孔。感染并发症包括置管术后1月内腹膜炎、随访期间发生的腹膜炎、切口部位感染、隧道出口处感染。腹壁并发症包括疝、胸水、渗漏、鞘膜积液。机械并发症包括导管阻塞、导管移位。导管通畅是指在PD过程中,不需要保守治疗、外科干预情况下,导管保持通畅。
统计学方法采用《SPSS 23.0》统计软件进行数据分析。用Kolmogorov-Smirno检验和直方图进行正态性检验,符合正态分布的计量资料采用均数±标准差表示,组间比较采用单因素方差分析;非正态分布计量资料用中位数(四分位数间距)表示,组间比较采用Kruskal-wallis H检验,两两比较采用Bonferroni法校正;计数资料以例(%)表示,组间比较依据理论频数采用χ2检验和Fisher精确概率法。Kaplan-Meier和多变量COX比例危险生存分析评估患者生存、技术生存,采用Kaplan-Meier法对生存资料进行描述,并采用Log-Rank检验对生存曲线进行组间比较,P<0.05为差异有统计学意义。
结 果
一般情况在研究期间共置入PD导管549例,符合纳入标准的437例,58.0%为男性,平均年龄49.6岁。中位随访时间为18(9,27)月。其中P1组163例、P2组189例、P3组85例。三组患者的基线特征如表1所示,除年龄、血尿素外其余指标无统计学差异。
技术存活率Log-Rank检验分析显示,三组患者1年和3年技术存活率无差异(P=0.066)(图1),分别为95.7%、92.6%、87.1%和 94.5%、89.9%、85.9%。对所有待筛选变量采用单因素COX回归分析(表2),筛选单因素COX回归分析P<0.1的变量,纳入性别(P=0.044)、年龄(P=0.007)、分组(P=0.022)、aCCI(P=0.015)、估算的肾小球滤过率(eGFR)(P=0.010)协变量。导管技术存活率多因素COX回归分析(P=0.003)发现上述5个协变量无统计学差异。同时构建导管阻塞及导管移位COX回归模型,对所有待筛选变量采用单因素COX分析。在导管阻塞COX模型筛选单因素COX回归分析P<0.1的变量(表3),纳入性别(P=0.072)、年龄(P<0.01)、分组(P=0.083)、aCCI(P=0.005)协变量。多因素COX回归分析(P<0.01)提示年龄(HR=0.930, 95%CI 0.891~0.922,P<0.01)为导管阻塞的危险因素。在导管移位COX模型筛选单因素回归分析P<0.1的变量及有临床意义的变量,纳入血红蛋白(P=0.011)、eGFR(P=0.032)及年龄(P=0.333,临床意义)协变量,导管移位多因素COX回归分析,无统计学意义。

图1 三组患者技术存活率P1组:置管后开始腹膜透析时间≤7d;P2组:置管后开始腹膜透析时间8~13d;P3组:置管后开始腹膜透析时间≥14d

表2 导管技术存活率COX分析
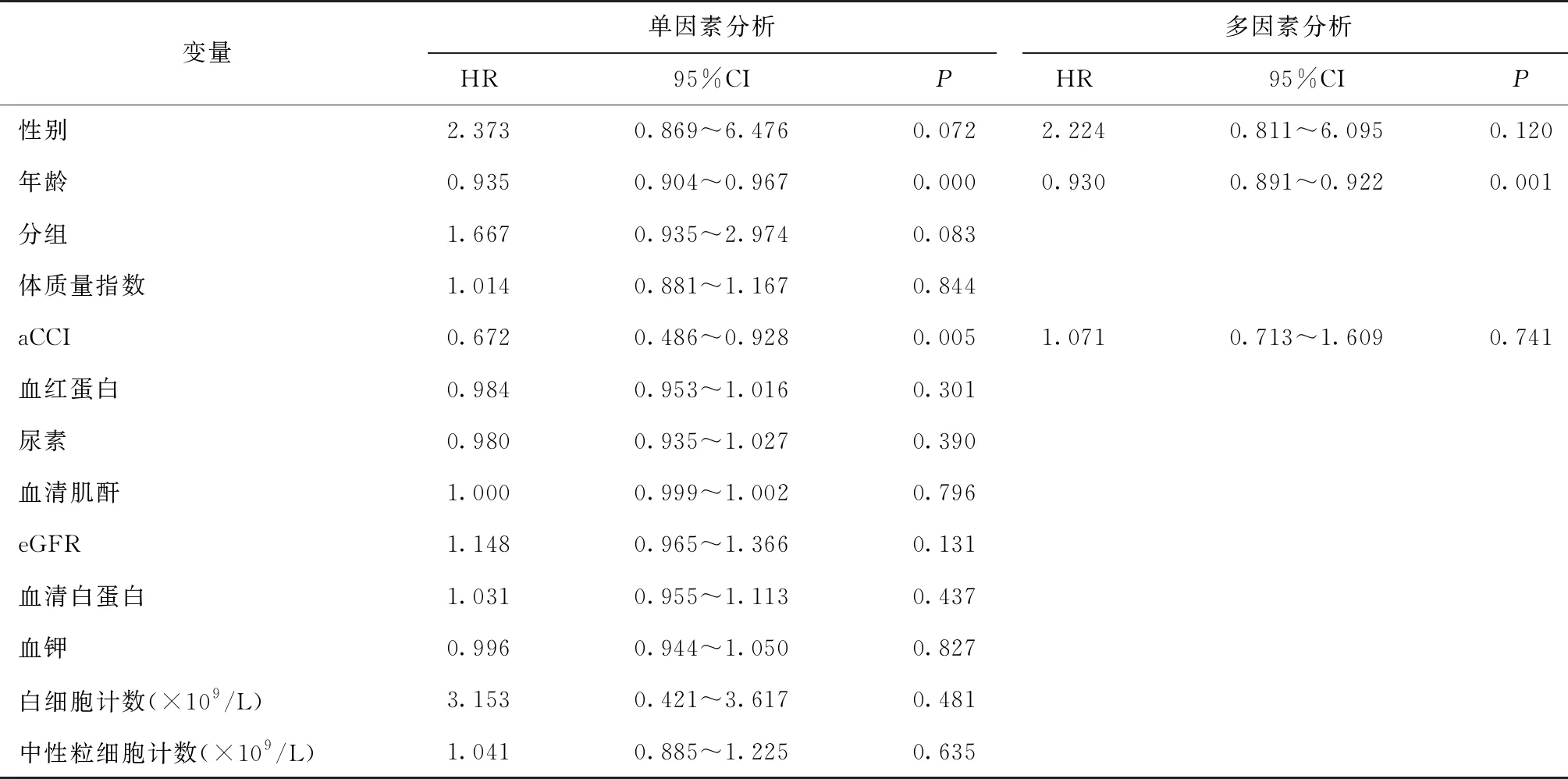
表3 导管阻塞的COX分析
患者生存率和导管通畅率三组患者1年、3年的生存率(P=0.595)分别为90.2%、94.2%、97.6%; 81.0%、82.5%、85.9%(图2A)。三组患者术后1年、3年的导管通畅率(P=0.085)分别95.7%、93.6%、88.2%; 95.7%、92.6%、88.2%(图2B)。

图2 三组患者生存率(A)和导管通畅率(B)P1组:置管后开始腹膜透析时间≤7d;P2组:置管后开始腹膜透析时间8~13d;P3组:置管后开始腹膜透析时间≥14d
功能性导管问题在36个月的随访中,有31例患者出现了功能性导管问题(1例患者同时发生导管移位和导管阻塞)。其中,导管阻塞障碍21例,导管移位11例,8例患者因腹膜炎导致技术失败,三组之间发生率无差异(表4)。
感染和手术并发症三组患者在各种手术和感染并发症的患病率上均无显著差异,三组患者的腹膜炎的患病率亦无显著统计学差异(表4)。
住院时间P1组患者平均住院时间26.0(19.0,32.0)d;P2组平均住院时间28.0(22.0,37.0)d;P3组平均住院时间34.0(24.0,45.0)d。三组患者住院时间差异具有统计学意义(P<0.01),P1组与P2组两两比较、P1组与P3组两两比较、P2组与P3组两两比较均有统计学差异。P1组住院时间最短,可为患者节约了更多时间成本及经济成本。
讨 论
根据置管后开始PD时间,本研究将437例终末期肾病患者,分为P1组(≤7d)、P2组(8~13d)、P3组(≥14d)三组,发现三组患者在技术存活率、感染并发症、围手术期并发症、腹壁并发症、患者生存率结果相似。结果说明7d内启动PD是安全有效的。

表4 腹膜透析相关并发症的比较[n(%)]
文献报道导管故障发生率在2.0%~15.4%[6-10]。既往研究发现早期启动PD可能刺激网膜引起网膜包裹,从而使导管故障发生增加[8,11-12]。此外,年龄可能是导管故障的另一个因素。既往研究报道,年龄较小者更易出现导管故障,这可能与年轻患者的网膜活性高,易发生网膜包裹,从而导致导管功能障碍发生率较高[13]。本研究发现,三组患者中P1组PD启动时间最早,平均年龄最小,但相对技术存活率最高,原因可能为早期启动PD促进肠道运动从而预防导管故障[8,14-16]。
三组患者在感染并发症方面无统计学差异,这与以前的研究一致[1,8]。既往研究表明,计划启动PD组腹膜炎发生率为15.4%[8,17-19]。在本研究中,早期腹膜炎发生率为1.6%,总的腹膜炎的患病率为0.11例/(患者·年),处于较低水平。本中心在插管前30 min常规预防性给予抗生素,由经验丰富的PD医师进行导管置入,以及训练患者和护理人员的专业护理团队可能有助于控制早期腹膜炎的发生。患者肠穿孔、严重出血的发生率非常低,本研究中仅1例患者出现出血,无一例发生肠穿孔,这与既往研究结果相似[13,20]。
既往有研究报道,早期开始透析患者机械并发症发生率高于计划开始的患者[8,21-22],最常见的机械并发症为透析液渗漏,发生率2%~24%[23]。从理论上讲,PD期间腹膜内输注将增加腹膜内压力,增加发生腹壁并发症的风险。本研究结果中有2例(P1组1例,P3组1例)患者早期发生导管渗漏,保守治疗后均未导致技术失败。本中心常规使用较低剂量递增PD的方式,可能有助于减少机械并发症的发生[24]。
本研究表明,三组患者生存率无统计学差异,而aCCI可能是死亡的危险因素。年龄和糖尿病都是PD患者死亡率的危险因素[25-27]。
这项研究的主要优势是样本量大,随访数据完整,但是存在一些不足。首先,这项研究作为一项回顾性研究,可能存在混杂因素导致偏倚。其次,这项研究为单中心的经验,需要多中心、大样本进行验证。
小结:本研究结果表明,7d内启动PD的患者在技术存活率、感染并发症、围手术期并发症、腹壁并发症、患者生存率与术后8~13d及≥14d开始透析的患者无统计学差异。我们建议置管术后7d内启动PD的方案可作为常规透析计划方案。

